Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 495, № 1, стр. 60-65
Новый тип мицелл и концентрация мономеризации фталоцианинов в водных растворах ПАВ
Академик РАН А. И. Русанов 1, 2, *, Т. Г. Мовчан 1, Е. В. Плотникова 1
1 Институт физической химии и электрохимии
им. А.Н. Фрумкина Российской академии наук
Москва, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: airusanov@mail.ru
Поступила в редакцию 21.08.2020
После доработки 13.10.2020
Принята к публикации 21.10.2020
Аннотация
Установлено существование особого типа мицелл поверхностно-активного вещества (ПАВ), которые формируются на солюбилизационном ядре фталоцианина при концентрациях значительно ниже критической концентрации мицеллообразования (ККМ). Это открытие переворачивает традиционные представления коллоидной химии, согласно которым сначала образуются мицеллы ПАВ, а затем в них происходит солюбилизация выше ККМ. В процессе солюбилизации осуществляется мономеризация фталоцианинов (обычно существующих в водном растворе в виде димеров), столь нужная для проявления функциональных свойств их молекул. Настоящее спектрофотометрическое исследование проведено на примере краунзамещенного фталоцианината магния (I) в водном растворе додецилсульфата натрия (II). Установлено, что образуются специфические мицеллы II (их можно назвать протомицеллами) с участием димеров I. На основе экспериментальных данных определена солюбилизационная емкость мицелл, которая, в расчете на одну молекулу I в мицелле, приводит к аномально большому числу агрегации, равному 309. Среди объяснений этого явления – возможность возникновения бимодального распределения мицелл, в котором мицеллы с солюбилизатом сосуществуют с “пустыми” мицеллами, благодаря чему среднее число молекул солюбилизата в мицелле может оказаться меньше единицы.
Фталоцианины имеют широкое прикладное значение, они применяются в молекулярной электронике, химии и медицине [1–10]. В последнее десятилетие вызывает интерес их взаимодействие с коллоидными поверхностно-активными веществами (ПАВ) в водных растворах с образованием мицелл и солюбилизацией в них мономеров фталоцианинов [8–17], поскольку мономеризация фталоцианинов важна для проявления их функциональных (в частности, хромофорных) свойств. Дело в том, что растворимость многих фталоцианинов в воде очень мала, причем считается, что в растворе находятся только ассоциированные формы вещества: димеры и ассоциаты более высоких порядков. Относительно последних сразу уточним: при столь малых концентрациях вероятность их присутствия ничтожна, так что речь должна идти только о димерах. Традиционно считается, что при прибавлении к раствору ПАВ димеры фталоцианинов сохраняются, пока не достигнута критическая концентрация мицеллообразования (ККМ). Выше нее образуются мицеллы ПАВ и начинается солюбилизация фталоцианинов, но только в мономерной форме. Таким образом, при такой точке зрения ККМ ПАВ связывается с мономеризацией фталоцианинов.
В настоящей работе эта точка зрения опровергается и показывается, что образование мицелл нового типа с солюбилизацией фталоцианина может происходить еще до ККМ. Хотя, как и в указанных выше работах, методической базой эксперимента оставалась спектрофотометрия, наши опыты принципиально отличались тем, что проводились в условиях постоянства химического потенциала фталоцианинов (для этого раствор находился в термодинамическом равновесии с твердой фазой, служащей резервуаром вещества). Данное условие позволило определить солюбилизационную емкость мицелл выше ККМ. Кроме того, более детально была изучена домицеллярная область ПАВ в присутствии фталоцианинов. Чтобы не загромождать текст, в данной статье изложение ведется на примере одного фталоцианина – краунзамещенного фталоцианината магния (I), (рис. 1) и одного ПАВ – всем известного додецилсульфата натрия (II) (содержание основного вещества 99.8%, фирма “Acros Organics”). Вода бралась в виде тридистиллята с удельной электропроводностью не выше 4 × 10–4 См м‒1. Измерения велись с помощью однолучевого сканирующего спектрофотометра UNICO (модель UV-2800, США) в диапазоне длин волн 190−900 нм. Характерные длины волн составляли для мономеров I 682 нм и димеров I – 634 нм. Соответственно в процессе калибровки (в системе I–II–вода) были получены значения коэффициентов экстинции ${{\varepsilon }_{1}}$ = 2.62 × 105 М–1 см–1 для мономеров I в растворах II выше ККМ и ${{\varepsilon }_{2}}$ = 4.35 × 104 М–1 см–1 для димеров I в области малых концентраций II в домицеллярной области. При использовании ${{\varepsilon }_{2}}$ нам удалось определить растворимость I в воде как 7.38 мкМ при комнатной температуре.
Обратимся теперь к результатам и рассмотрим сначала домицеллярную область водного раствора I и II. На рис. 2 приведены электронные спектры поглощения при заданных концентрациях I и II (в термодинамике мицеллообразования [18–20] принята нумерация 1 – солюбилизатор, 2 – солюбилизат, так что у нас ${{с}_{1}}$ – концентрация II и ${{с}_{2}}$ – концентрация I). Для наглядности мы разбили рисунок на две части: рис. 2а отвечает преобладанию димеров I (пики при λ = 634 нм), а рис. 2б – его мономеров (пики при λ = 682 нм). Кривая 1 на рис. 2а отвечает насыщенному раствору I в чистой воде (без II), а кривая 2 – концентрации II ${{с}_{1}}$ = 1.7 мМ, что значительно меньше ККМ (около 8 мМ). При этом концентрация I (с2 = = 8.2 мкМ) уже заметно выше растворимости I в чистой воде, и это еще не насыщенный раствор, так что растворимость I в таких условиях будет еще больше. Отсюда мы можем заключить, что прибавление ПАВ к воде повышает растворимость I даже в виде димеров.
Рис. 2.
Электронные спектры поглощения I в домицеллярных водных растворах II: (а) в области преобладания димеров I при с1 = 0 (насыщенный раствор I в отсутствие ПАВ, кривая 1) и с1 = 1.7 мМ, с2 = 8.2 мкМ (кривая 2); (б) в области преобладания мономеров I при с2 = 8.2 мкМ и с1 = 4.3 мМ (кривая 1) или с1 = 5.7 мМ (кривая 2). Длина оптического пути l = 1 см. A – оптическая плотность, λ – длина световой волны.
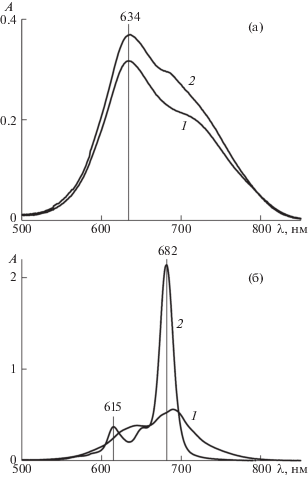
А что же мономеры? В области характерной для них длины волны на кривой 2 (рис. 2а) заметен небольшой излом. Но можно ли связать его с присутствием мономеров, да еще при столь небольшой концентрации ПАВ по сравнению с ККМ? Сомнения развеивает рис. 2б. Уже при с1 = 4.3 мМ (кривая 1) виден приземистый максимум мономеров, который при с1 = 5.7 мМ (кривая 2) взмывает вверх резко выраженным пиком. При этом димеры исчезают. Заметим, что все это происходит при концентрации ПАВ ниже ККМ. Мы можем заключить, что мономеризация I в водном растворе и классическая мицеллизация II – разные, не обязательно связанные друг с другом явления. Если мицеллообразование характеризуется ККМ, то для мономеризации можно ввести понятие концентрации мономеризации – такой концентрации ПАВ, при которой существование мономеров I становится явным. Правда, такое понятие будет еще более условным, чем понятие ККМ. Последнее все-таки соответствует некоторой “взрывной” (при большом числе агрегации) стадии процесса, тогда как переход от димеров к мономерам более постепенный. Среди наших данных за концентрацию мономеризации I можно принять ${{с}_{1}}$ = 1.7 мМ (рис. 2а, кривая 2), но это численное значение, естественно, может уточняться.
Для полной ясности попробуем теперь объяснить все описанное на языке термодинамики растворов. Растворимость I в воде очень мала по той простой причине, что в молекуле I содержится много гидрофобных органических фрагментов, контакт которых с водой термодинамически невыгоден, ибо разрушает структуру воды. Естественная тенденция избегать подобного контакта называется гидрофобным эффектом. Именно он в растворе “припечатывает” одну плоскую молекулу I к другой, чтобы сократить гидрофобный контакт. Казалось бы, этот “пресс” может работать и дальше – тримеры, тетрамеры и т.д. Но нельзя забывать, что все молекулярные структуры раствора имеют динамический характер и для их поддержания требуется определенная концентрация молекул. Предельная концентрация насыщенного раствора I такова, что ее хватает только на поддержание существования димеров. Именно они и составляют главную форму растворенного в чистой воде I.
Очевидно, у каждого димера остается еще много свободной гидрофобной поверхности. Поэтому, как только появляются ионы ПАВ, они начинают ее заполнять (функцию якорей выполняют прижимаемые водой углеводородные хвосты ионов). Если это происходит в насыщенном растворе I, то химический потенциал I закреплен. Статистическая механика дает следующее выражение для химического потенциала компонента i раствора:
где $\mu _{i}^{0}$ – химический потенциал молекулы i в вакууме, wi – работа ее переноса в растворитель, ai – активность компонента i и ${{\Lambda }_{i}}$ – его средняя длина волны де Бройля. При заданной температуре величины $\mu _{i}^{0}$, kT и ${{\Lambda }_{i}}$ играют роль постоянных, и для регулировки химического потенциала можно использовать только wi и ai. Применим формулу (1) к I. После добавления ПАВ к воде уже не чистая вода, а раствор ПАВ играет роль растворителя для I. При этом работа wi существенно уменьшается благодаря гидрофобному эффекту. Тогда, согласно (1), для сохранения значения химического потенциала соединения I, которое было в чистой воде, необходимо, чтобы его активность увеличилась. Активность и концентрация всегда меняются в одном направлении, так что с увеличением активности возрастет и концентрация (растворимость), а если I находится в форме димеров, то возрастет и концентрация димеров. Это и есть солюбилизация, и роль солюбилизатора выполняет ПАВ, но не в мицеллярной, а молекулярной или ионной форме.По мере увеличения концентрации ПАВ его молекулы все чаще сталкиваются с гидрофобной поверхностью димера I, которую, в конце концов, полностью покрывают. При этом образуется структура, полностью аналогичная мицелле ПАВ с солюбилизированным димером I, и ее тоже можно считать мицеллой. Однако судьба таких мицелл недолговечна. Мы знаем, что все они перейдут в другую форму с мономерным солюбилизатом. Такие предварительные и недолговечные формы мицелл можно назвать протомицеллами. Что же происходит при дальнейшем увеличении концентрации ПАВ в растворе? Если ККМ не достигнута, то сокращение гидрофобных контактов углеводородных хвостов молекул ПАВ путем массового образования обычных мицелл еще невозможно. Но есть и другой путь: развалить димеры I на мономеры, увеличив при этом свободную площадь молекул I и предоставив углеводородным хвостам дополнительную посадочную площадь. Но как развалить димеры? Как и все вокруг, димеры представляют собой динамические структуры и имеют среднюю продолжительность жизни. Как только димер разваливается тепловым движением и мономеры какое-то время существуют в растворе индивидуально, молекулы или ионы ПАВ спешат их занять. Однако успех этого дела зависит от концентрации ПАВ. Здесь-то и возникает понятие концентрации мономеризации фталоцианинов. Выше нее постепенно все мицеллы переходят в состояние с солюбилизатом в мономерной форме, причем это может случиться еще до ККМ.
Обратимся теперь к концентрационной области выше ККМ, в которой и ставился наш основной эксперимент. Как уже отмечалось, мы работали с насыщенными растворами в условиях постоянства химического потенциала I. Что касается химического потенциала II, то он является переменным до ККМ, но выше ККМ меняется настолько слабо, что этим часто пренебрегают. А в трехкомпонентной системе (у нас I–II–вода) при постоянстве двух химических потенциалов третий будет также постоянным в силу термодинамических требований. Иными словами, выше ККМ состояние системы становится практически постоянным.
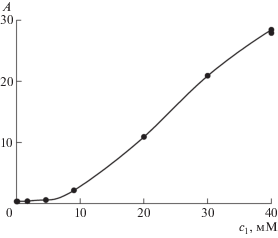
При этом сохраняются все пропорции, и добавление к раствору ПАВ сопровождается растворением соответствующего количества твердой фазы I. Сохраняется и коэффициент экстинкции ε1, при помощи которого можно перейти от экспериментальной зависимости оптической плотности раствора от концентрации II (рис. 3) к концентрации I с2 как функции той же концентрации с1, изображенной точками на рис. 4 (в коллоидной науке график этой функции называется изотермой солюбилизации или солюбилизационной кривой).
Рис. 4.
Солюбилизационная кривая и расположение расчетных точек для зависимости с2 от с1 в системе I–II–вода.
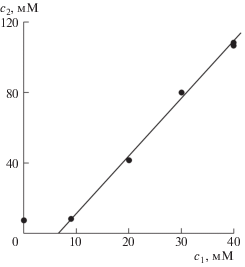
Из рис. 4 видно, что при малых концентрациях солюбилизационная кривая имеет другой наклон, чем при больших. Для них пять последних точек хорошо (с квадратом смешанной корреляции 0.997, при использовании этого критерия единица означает идеальное совпадение) ложатся на прямую линию, для которой компьютер методом наименьших квадратов дает уравнение (обе концентрации в мМ):
Из уравнения (2) следует, что пересечение прямой с осью абсцисс происходит при с1 ≈ 6.5 мМ, и это была бы ККМ соединения II, определенная классическим методом солюбилизации (причем весьма правдоподобная: немного меньше известного значения 8 мМ, а ведь установлено, что солюбилизат всегда понижает значение ККМ ПАВ [21, 22]).
Следуя дальше общепринятой практике, мы должны принять наклон солюбилизационной прямой (т.е. коэффициент при с1 в уравнении (2)) равным солюбилизационной емкости s мицелл II, что является отношением чисел агрегации солюбилизата z и солюбилизатора n:
Отношение двух величин еще не определяет их по отдельности. Но здесь мы заранее знаем, что в каждую мицеллу II входит лишь одна молекула I (в этом суть явления мономеризации). Положив z = 1, из уравнения (3) находим n ≈ 309, что более чем в четыре раза превышает обычное число агрегации для II (n ≈ 65). Из теории мицеллообразования [18–20] известно, что в процессе солюбилизации число агрегации ПАВ несколько возрастает. Но внушительный скачок от 65 к 309 требует пояснений.
В контексте всего сказанного выше можно дать следующее объяснение. Как уже указывалось, образование смешанных мицелл I и II происходит независимо от классических мицелл II. Поэтому фактически распределение агрегатов по размерам имеет два максимума, т.е. является бимодальным: обычные “пустые” мицеллы II сосуществуют с “заполненными” (содержащими мономерный солюбилизат I). Но наш метод рассмотрения подразумевает наличие только одного вида мицелл, а тогда среднее число молекул I в одной мицелле может быть и меньше единицы. При подстановке же в уравнение (3) значений z < 1 можно получать любые разумные средние значения числа агрегации II. Число же 309 приобретает другой смысл – это среднее соотношение чисел молекул II и I в системе.
Приведенные соображения – лишь один из вариантов объяснения наших результатов, и пока существование мицеллы II, содержащей молекулу I, с числом агрегации 309 нельзя считать опровергнутой. В этом плане представляет интерес работа [23], в которой исследовалась солюбилизация мономеров замещенного фталоцианината цинка (структура I с заменой Mg на Zn при R = = SO3H на рис. 1). При использовании в качестве солюбилизатора бромида додецилтриметиламмония (с такой же длиной углеводородной цепи как у II) методом динамического светорассеяния было установлено, что при солюбилизации диаметр мицелл возрастает от 3.12 до 21.04 нм, т.е. примерно в семь раз. Очевидно, для прояснения ситуации, связанной с этими данными, требуются дополнительные исследования.
Список литературы
Owens J.W., Robins M. // Porphyrins Phthalocyanines. 2001. V. 5. P. 460. https://doi.org/10.1002/jpp.340
Senthilarasu S., Velumani S., Sathyamoorthy R., Canizal G., Sebastian P.J., Chavez J.A., Perez R., Subbarayan A., Ascencio J.A. // Appl. Phys. A: Mater. Sci. Process. 2003. V. 77. P. 383. https://doi.org/10.1007/s00339-003-2184-7
Busch T.M., Xing X., Yu G., Yodh A., Wileyto E.P., Wang H.-W., Durduran T., Zhu T.C., Wang K.K.-H. // Photochem. Photobiol. Sci. 2009. V. 8. P. 1683. https://doi.org/10.1039/b9pp00004f
Шапошников Г.П., Кулинич В.П., Майзлиш В.Е. Модифицированные фталоцианины и их структурные аналоги. Под ред. Койфмана О.И., 2-е изд. М.: Красанд, 2012.
Prasath R., Bhavana P. // J. Heterocycl. Chem. 2012. V. 49. P. 1044. https://doi.org/10.1002/jhet.923
Ghazal B., Machacek M., Shalaby M.A., Novakova V., Zimcik P., Makhseed S. // J. Med. Chem. 2017. V. 60. P. 6060. https://doi.org/10.1021/acs.jmedchem.7b00272
Tunçel A., Öztürk I., Ince M., Ocakoglu K., Hoşgör-Limoncu M., Yurt F. // Porphyrins Phthalocyanines. 2019. V. 23. P. 206. https://doi.org/10.1142/S1088424619500238
Гольдшлегер Н.Ф., Черняк А.В., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю. // Журн. общей химии. 2012. Т. 82. С. 856.
Гольдшлегер Н.Ф., Лобач А.С., Гак В.Ю., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю.// Физикохимия поверхности и защита материалов. 2014. Т. 50. С. 496. https://doi.org/10.7868/S0044185614050088
Гольдшлегер Н.Ф., Черняк А.В., Лобач А.С., Калашникова И.П., Баулин В.Е., Цивадзе А.Ю.// Физикохимия поверхности и защита материалов. 2015. Т. 51. С. 160. https://doi.org/10.7868/S0044185615020072
Гольдшлегер Н.Ф., Гак В.Ю., Калашникова И.П., Баулин В.Е., Иванчихина А.В., Смирнов В.А., Ширяев А.А., Цивадзе А.Ю. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4S. С. 3. https://doi.org/10.1134/S0044185618060128
Лобанов А.В., Дмитриева Г.С., Сультимова Н.Б., Левин П.П. // Хим. физика. 2014. Т. 33. С. 15. https://doi.org/10.7868/S0207401X14050082
Гольдшлегер Н.Ф., Гак В.Ю., Лапшина М.А., Баулин В.Е., Ширяев А.А., Цивадзе А.Ю.// Изв. АН. Сер. хим. 2018. № 12. С. 2205.
Мовчан Т.Г., Аверин А.А., Баулин Д.В., Плотнико-ва Е.В., Баулин В.Е., Цивадзе А.Ю. // Коллоид. журн. 2018. Т. 80. С. 528. https://doi.org/10.1134/S0023291218050099
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Аверин А.А., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2018. Т. 80. С. 694. https://doi.org/10.1134/S0023291218060095
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2019. Т. 81. С. 750. https://doi.org/10.1134/S0023291219060120
Мовчан Т.Г., Чернядьев А.Ю., Плотникова Е.В., Цивадзе А.Ю., Баулин В.Е. // Коллоид. журн. 2020. Т. 82. С. 26. https://doi.org/10.31857/S0023291220010085
Русанов А.И. Мицеллообразование в растворах поверхностно-активных веществ. СПб.: Химия, 1992.
Rusanov A.I. Micellization in Surfactant Solutions. Chemistry Reviews, Vol’pin, M.E., Ed.; Vol. 22, Part 1; Reading: Harwood Academic Publishers, 1996. ISBN 90‑5702-297-4.
Русанов А.И., Щёкин А.К. Мицеллообразование в растворах поверхностно-активных веществ, 2-е изд., доп. СПб.: Лань, 2016.
Русанов А.И. // Коллоид. журн. 2020. Т. 82. С. 463. https://doi.org/10.31857/S0023291220040096
Русанов А.И. // Коллоид. журн. 2020. Т. 82. С. 604. https://doi.org/10.31857/S0023291220050134
Jadhao M., Mukherjee S., Joshi R., Kumar H., Ghosh S.K. // RSC Adv. 2016. V. 6. P. 77161. https://doi.org/10.1039/c6ra13151d
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах