Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 495, № 1, стр. 54-59
Особенности стабилизации наночастиц золота хитозаном в растворах угольной кислоты под высоким давлением СО2
К. С. Стамер 1, М. А. Пигалёва 1, *, С. С. Абрамчук 1, 2, М. О. Галлямов 1, 2
1 Московский государственный университет
имени М.В. Ломоносова, физический факультет
Москва, Россия
2 Институт элементоорганических соединений
им. А.Н. Несмеянова Российской академии наук
Москва, Россия
* E-mail: pigaleva@polly.phys.msu.ru
Поступила в редакцию 07.08.2020
После доработки 05.10.2020
Принята к публикации 28.10.2020
Аннотация
В настоящей работе впервые рассмотрена возможность восстановления и стабилизации агломератов из ионов золота в водных кислых растворах хитозана, насыщенных диоксидом углерода под высоким давлением СО2. Для анализа характера взаимодействия компонентов системы использовались УФ-видимая и ИК-спектроскопии. Морфология и размер стабилизируемых хитозаном наночастиц золота определены методом просвечивающей электронной микроскопии. Выявлено, что стабилизация наночастиц золота происходит с участием аминогрупп. Показано, что при достаточно высокой концентрации золота в растворе стабилизируются мелкие сферические наночастицы.
Последнее время наночастицы золота все более активно используются в медицине благодаря их наименьшей цитотоксичности среди наночастиц различных благородных металлов (для наночастиц диаметром больше 2 нм), антимикробной активности, фоточувствительности, большой площади поверхности, способной аккумулировать различные лекарственные средства, способности выступать в качестве катализатора в процессах устранения свободнорадикальных форм кислорода и т.п. [1]. Однако использование достаточно мелких металлических наночастиц осложнено их тенденцией к агрегации в большие кластеры, поэтому при их синтезе необходимо производить их стабилизацию. В качестве стабилизаторов наночастиц могут быть использованы матрицы инертных газов при низких температурах, низкомолекулярные органические вещества, а также полимеры [2]. Метод получения и стабилизации металлических наночастиц полимерами основан на предварительном связывании ионов металла макромолекулой и последующем их восстановлении.
Хитозан – это производное линейного полисахарида, природного широкодоступного полимера хитина, получаемое путем его деацетилирования. Научный интерес использования хитозана обусловлен проявляемыми им антимикробными, ранозаживляющими и гемостатичесими свойствами, а также выраженной биологической активностью, биосовместимостью и нетоксичностью. Хитозан используется в биомедицине в виде растворов, гелей, раневых повязок; в качестве заменителей кожи при лечении поражений и ожогов слизистых оболочек, для тонких покрытий протезов и регенерации костных тканей [3].
Известно, что сорбция металлов полимером хитозаном происходит либо путем электростатического взаимодействия, т.е. ион-ионного взаимодействия отрицательно-заряженных ионов соединений металлов, таких как [PtCl6]2–, [AuCl4]–, и положительно-заряженных аминогрупп хитозана в кислых средах, либо посредством образования донорно-акцепторной связи между положительно-заряженными ионами металлов, такими как Ag+, Pd2+, Cu2+ и т.п., имеющими вакантные орбитали, и атомами азота непротонированных аминогрупп хитозана, имеющими собственные свободные неподеленные пары электронов [4]. Стабилизированные хитозаном наночастицы золота находят свое применение в качестве различных сенсоров [5, 6], катализаторов [7], а также в биомедицине [8]. Хитозан с рКа 6.3–6.5 представляет собой хорошо растворимый в водных кислых средах катионный полиэлектролит, однако при значениях рН среды выше 6 он теряет растворимость [9]. На практике, в силу своей доступности в качестве растворителя для хитозана, чаще всего используется 1%-я уксусная кислота. Так, традиционным методом создания хитозанового композита, содержащего наночастицы золота, является смешивание раствора хитозана в 1%-й уксусной кислоте с раствором тетрахлороаурата (III) водорода и последующее восстановление стабилизированных ионов золота с помощью специальных восстанавливающих агентов при дополнительной температурной обработке. Стоит отметить, что имеются также единичные работы, указывающие на то, что хитозан сам способен к восстановлению в растворе ионов золота до металлических наночастиц [10]. Однако в частных случаях остатки уксусной кислоты в изделиях медицинского назначения способны стимулировать аллергическую реакцию организма [11]. Это ограничивает применение в медицине растворов хитозана в подобных традиционных кислотах.
Для решения вышеуказанной проблемы в качестве растворителя для хитозана может быть использована двухфазная система H2O/CO2 под высоким давлением, а именно, полярная водная среда, до некоторой степени насыщенная растворенными в ней неполярными молекулами диоксида углерода, формирующими раствор угольной кислоты. Известно, что молекулы диоксида углерода растворяются в воде [12] с образованием угольной кислоты, которая параллельно диссоциирует на протоны и карбонат-анионы [13]. При высоком давлении в сотни атмосфер рН водной фазы такой бифазной системы снижается до значений меньше 3, делая ее пригодной для растворения хитозана. Это безвредная среда при нормальных условиях, обладающая под давлением дополнительными бактерицидными свойствами. Действительно, стерилизующая способность подобных растворов угольной кислоты связана с присутствием в данной среде CO2 под высоким давлением в сочетании с понижением кислотности среды: растворенные в воде молекулы СО2 при высоком давлении проникают в диспергированные в водной фазе бактерии и вирусы и инактивируют их посредством ряда ранее описанных в литературе механизмов [14]. При этом материал, формируемый в такой системе, не загрязняется никакими следами растворителей, ведь СО2 спонтанно покидает готовый продукт, оставляя материал в воде, которая абсолютно безвредна для тканей человеческого организма.
В данной работе впервые рассмотрены особенности стабилизации и восстановления агломератов из ионов золота хитозаном, растворенным в экологичной, самонейтрализующейся и безвредной среде: в водных кислых растворах хитозана, насыщенных диоксидом углерода под высоким давлением СО2. Под самонейтрализацией следует понимать способность угольной кислоты спонтанно распадаться на СО2 и воду при сбросе повышенного давления, что избавляет от необходимости дополнительно нейтрализовывать кислый раствор.
В исследованиях использовался хитозановый порошок производства Sigma-Aldrich (каталожный номер 448877, молекулярная масса Mв = = 1300 кг/моль, степень деацетилирования СД = = 73% [15]), СО2 высокой чистоты (99.995%, Московский газоперерабатывающий завод, Россия), специально очищенная непосредственно перед каждым экспериментом на установке Millipore Milli-Q (США) вода, раствор 0.38M тетрахлоро-аурата (III) водорода (Sigma-Aldrich).
В реактор высокого давления объемом 10 мл помещали порошок хитозана (50 мг), свежеприготовленную очищенную воду (5 мл) и магнитный перемешивающий элемент. Реактор герметично закрывали, через вентиль в него закачивали диоксид углерода под давлением 300 атм. При таком способе насыщения воды СО2 параллельно происходит формирование и диссоциация молекул угольной кислоты с достижением рН порядка 3, что позволяет использовать данную среду в качестве растворителя хитозана [13]. Растворение хитозана происходило в реакторе, помещенном на неделю на магнитную мешалку, в течение недели при комнатной температуре. Затем реактор декомпрессировали, получая на выходе визуально однородный по всему объему раствор с концентрацией хитозана 10 г л–1. Для изучения взаимодействия частиц золота с раствором хитозана в последний при нормальном атмосферном давлении, непосредственно сразу после вскрытия реактора и сброса давления в 300 атм, добавляли 100 или 200 мкл раствора HAuCl4 для достижения мольного соотношения хитозан : Au = 1 : 1 или 1 : 2 соответственно.
В данной работе для выявления природы взаимодействия между звеньями хитозана и наночастицами золота (мольное отношение HAuCl4 : хитозан = 1 : 1) на установке Thermo Nicolet FTIR NEXUS (США) была проведена ИК-спектроскопия чистого хитозана и композитов, полученных в водных кислых растворах хитозана, насыщенных диоксидом углерода и затем высушенных в пленку на воздухе при температуре 30°С. Как можно видеть из рис. 1, характеристическая линия колебаний группы ${\text{NH}}_{3}^{ + }$ (1531 см–1) [16] в композите претерпевает красное смещение и заметный рост интенсивности, что может быть связано с взаимодействием некоторых протонированных аминогрупп ${\text{NH}}_{3}^{ + }$ с анионами [AuCl4]– посредством ион-ионного взаимодействия (рис. 2а), а наличие красного смещения характеристических линий, соответствующих Амиду I и группе NH2 (1642 см–1 и 1570 см–1 соответственно), может указывать на последующую диссоциацию [AuCl4]– и формирование координационного комплекса “нейтральная NH2 группа хитозана–Au(III)” [17] (рис. 2а). Значительный рост интенсивности пика валентных колебаний C=O (1727 см–1) после взаимодействия водных кислых растворов хитозана, насыщенных диоксидом углерода, с раствором тетрахлороаурата (III) водорода может свидетельствовать о формировании карбоксильных и альдегидных групп в сочетании с возможной частичной деполимеризацией хитозана в кислой среде, где золото катализирует этот процесс, а также последующей окислительно-восстановительной реакции, ведущей к восстановлению золота Au(III) до металла Au(0) (рис. 2б). Также из анализа данных ИК-спектроскопии можно сделать вывод о наличии взаимодействия хитозана и наночастиц золота преимущественно с участием аминогруппы полимера.
Рис. 1.
(а) ИК-спектры поглощения пленок из растворов исходного хитозана и хитозана с HAuCl4, полученных в водных кислых растворах хитозана, насыщенных диоксидом углерода под высоким давлением СО2, (б) таблица характеристических пиков образцов.
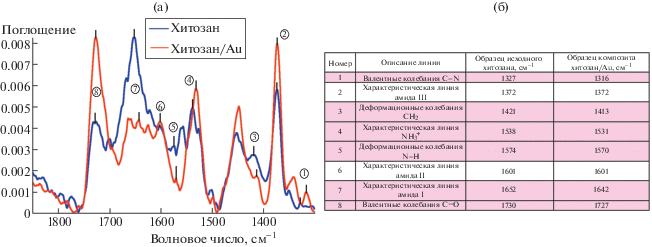
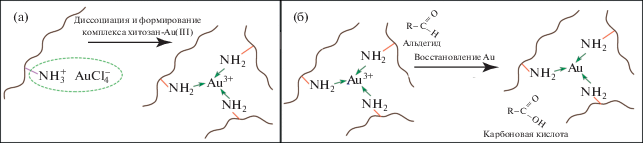
Рис. 2.
Схематическое изображение предполагаемого процесса стабилизации (а) и восстановления (б) агломератов из ионов золота хитозаном. Альдегид и карбоновая кислота изображены для большей наглядности процесса.
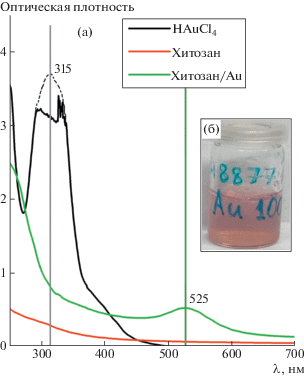
На установке Spectronic UNICAM UV1/UV/Vis (США) были получены УФ-спектры растворов кислоты НAuCl4, водных кислых растворов хитозана, предварительно насыщенных диоксидом углерода под давлением СО2 в 300 атм, при нормальном давлении и смеси из этих двух растворов c мольным соотношением НAuCl4 : хитозан = 2 : 1 (рис. 3а). Исчезновение характеристического пика иона [AuCl4]– при 315 нм, который присутствовал в исходном растворе тетрахлороаурата (III) водорода, указывает на его трансформацию в комплекс хитозан–Au3+ [10] (рис. 2а). Появление пика поверхностного плазмонного резонанса при длине волны 525 нм [18], который проявляется в растворах хитозана с НAuCl4 спустя неделю экспозиции, может указывать на образование частиц коллоидного золота. Симметричность этого пика указывает на то, что синтезированные наночастицы имеют сферическую форму, а его положение – на небольшой размер частиц. О стабилизации и частичном восстановлении агломератов из ионов золота, связанных с макромолекулами хитозана координационными связями с аминогруппами, также свидетельствует изменение цвета раствора с прозрачного на розовый (рис. 3б). Аналогичное изменение цвета реакционной смеси с появлением характеристического пика поверхностного плазмонного резонанса на 522 нм наблюдалось в системе (хитозан, растворенный в уксусной кислоте) + (раствор НAuCl4) с последующим нагревом смеси до 70°С [19]. Этот эффект может быть связан с коллективными колебаниями свободных электронов, присутствующих в восстановленных наночастицах Au. Таким образом, на основании данных УФ-спектроскопии можно сделать вывод о взаимодействии ионов золота с раствором хитозана и способности хитозана с течением времени восстанавливать связанные ионы золота до металлических наночастиц. При этом после восстановления металлические наночастицы золота могут агрегировать, чтобы минимизировать свою поверхностную энергию.
Рис. 3.
(а) УФ-спектры поглощения образцов исходного хитозана, коллоидного раствора хитозан/Au, полученных в водных кислых растворах хитозана, насыщенных диоксидом углерода, и раствора HAuCl4, (б) фотография раствора хитозана с наночастицами золота спустя неделю экспозиции.
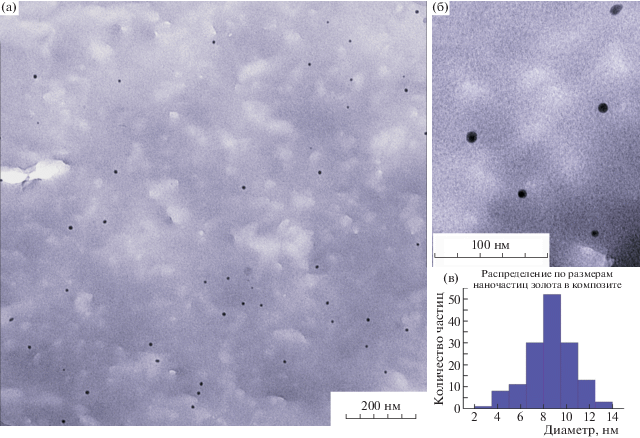
Для визуализации морфологии и определения размеров наночастиц золота в полученных композитах использовали ПЭМ (рис. 4). Из пленки, образовавшейся после высыхания на воздухе раствора хитозана со стабилизированными наночастицами золота (мольное отношение HAuCl4 : : хитозан = 2 : 1), были сделаны тонкие срезы с помощью ультрамикротома Ultracut (Reichert-Jung, Австрия) с алмазным ножом ultra 35° (DiaTOME, Швейцария). Срезы переносили с поверхности ножа сухим методом на углеродную пленку-подложку модели S160 (Plano GmbH, Германия), зафиксированную на медной сетке. Микрофотографии ПЭМ были получены на микроскопе LEO 912 AB OMEGA (LEO/Carl Zeiss, Германия) с ускоряющим напряжением в 100 кВ. В ходе исследования были зарегистрированы наночастицы небольших размеров (диаметром примерно 8.6 нм) преимущественно сферической формы. Такой размер наночастиц существенно ниже размера наночастиц золота, стабилизированных хитозаном в кислых растворах, традиционно приготовленных при нормальном атмосферном давлении (например, диаметр наночастиц золота в работе [19] – около 80 нм, в работе [20] – 50–70 нм, в работе [21] – 17 нм). Из приведенной гистограммы (рис. 4в) можно сделать вывод о некоторой полидисперсности распределения частиц по размерам, что можно объяснить достаточно высокой концентрацией золота в растворе [22].
Рис. 4.
Микрофотографии ПЭМ срезов тонких пленок композита Au/хитозан (а), область среза с большим увеличением (б); гистограмма распределения размеров наночастиц золота в композите (в).
В настоящей работе впервые было установлено, что в водных кислых растворах хитозана, насыщенных диоксидом углерода, возможно восстанавливать и стабилизировать наночастицы золота. Методом ИК-спектроскопии было показано, что –N–H-группа макромолекул хитозана участвует в координации ионов Au. Непосредственно на формирование частиц коллоидного золота указывает зарегистрированный с помощью УФ-спектроскопии пик поверхностного плазмонного резонанса на длине волны 525 нм. Методом ПЭМ обнаружено формирование сферических наночастиц золота со средним размером около 8.6 нм.
Список литературы
Elahi N., Kamali M., Baghersad M. // Talanta. 2018. V. 184. P. 537–556. https://doi.org/10.1016/j.talanta.2018.02.088
Помогайло А.Д., Розенберг А.С., Уфлянд И.Е. Наночастицы металлов в полимерах. Глава 3. Макромолекулы как стабилизаторы ультрадисперсного состояния / М.: Химия, 2000. С. 269–319.
Dash M., Chiellini F., Ottenbrite R.M., Chiellini E. // Prog. Polym. Sci. 2011. V. 3. № 8. P. 981–1014. https://doi.org/10.1016/j.progpolymsci.2011.02.001
Guibal E. // Sep. Purif. Technol. 2004. V. 38. P. 43–74. https://doi.org/10.1016/j.seppur.2003.10.004
Fu F., Yang B., Hu X., Tang H., Zhang Y., Xu X., Zhang Y., Touhid S., Liu X., Zhu Y., Zhou J., Yao J. // Chem. Eng. J. 2020. V. 392. P. 123693. https://doi.org/10.1016/j.cej.2019.123693
Surya S., Khatoon S., Lahcen A., Nguyen A., Dzantiev B.B., Tarannum N., Salama K. // RSC Adv. 2020. V. 10. P. 12823.https://doi.org/10.1039/D0RA01838D
Fu Y., Qin L., Huang D., Zeng G., Lai C., Li B., He J., Yi H., Zhang M., Cheng M., Wen X. // Appl. Catal., B. 2019. V. 255. P. 117740. https://doi.org/10.1016/j.apcatb.2019.05.042
Chen X., Zhao X., Wang G. // Carbohydr. Polym. 2020. V. 244. P. 116311. https://doi.org/10.1016/j.carbpol.2020.116311
Rinaudo M. // Progr. Polym. Sci. 2006. V. 31 № 7. P. 603–632. https://doi.org/10.1016/j.progpolymsci.2006.06.001
Pestov A., Nazirov A., Modin E., Mironenko A., Brat-skaya S. Carbohydr. Polym. 2015. V. 117. P. 70–77. https://doi.org/10.1016/j.carbpol.2014.09.030
Wuethrich B. Allergology. 2011. V. 34. № 8. P. 427–436. https://doi.org/10.5414/ALP34427
Spycher N. // Geochim. Cosmochim. Acta. 2003. V. 67. 3015–3031. https://doi.org/10.1016/S0016-7037(03)00273-4
Pigaleva M.A., Elmanovich I.V., Kononevich Y.N., Gallyamov M.O., Muzafarov A.M. // RSC Adv. 2015. V. 5. P. 103573–103608. https://doi.org/10.1039/C5RA18469J
Garcia-Gonzalez L., Geeraer A.H., Spilimbergo S., Elst K., Van Ginneken L., Debevere J., Van Impe J.F., Devlieghere F. // Int. J. Food Microbiol. 2007. V. 117. № 1. P. 1–28. https://doi.org/10.1016/j.ijfoodmicro.2007.02.018
Pigaleva M.A., Portnov I.V., Rudov A.A., Blagodatskikh I.V., Grigoriev T.E., Gallyamov M.O., Potemkin I.I. Macromolecules. 2014. V. 47. № 16. P. 5749–5758. https://doi.org/10.1021/ma501169c
Lawrie G., Keen I., Drew B., Chandler-Temple A., Rintoul L., Fredericks P., Grøndahl L. // Biomacromolecules. 2007. V. 8. P. 2533–2541. https://doi.org/10.1021/bm070014y
Nivethaa E.A.K., Dhanavel S., Narayanan V., Arul Vasu C., Stephen A. RSC Adv. 2015. V. 5. P. 1024–1032. https://doi.org/10.1039/C4RA11615A
Zhang T., Wang W., Zhang D., Zhang X., Ma Y., Zhou Y., Qi L. // Adv. Funct. Mater. 2010. V. 20. P. 1152–1160. https://doi.org/10.1002/adfm.200902104
Kalaivani R., Maruthupandy M., Muneeswaran T., Manoj Singh, Sureshkumar S., Anand M., Ramakriti-nan C.M., Quero F., Kumaraguru A.K. // Int. J. Biol. Macromol. 2020. V. 146. P. 560–568. https://doi.org/10.1016/j.ijbiomac.2020.01.037
Nezhad-Mokhtari P., Akrami-Hasan-Kohal M., Ghorbani M. // Int. J. Biol. Macromol. 2020. V. 154. P. 198–205. https://doi.org/10.1016/j.ijbiomac.2020.03.112
Tokumasu A., Inose T., Yamauchi N., Nakashima K., Tokunaga M., Kato C., Hatoyama K., Kamei T., Gonda K., Kobayashi Y. // Colloid. Polym. Sci. 2019. V. 297. P. 1143–1148. https://doi.org/10.1007/s00396-019-04524-3
Esumi K., Takei N., Yoshimura T. // Colloids Surf., B. 2003. V. 32. P. 117–123. https://doi.org/10.1016/S0927-7765(03)00151-6
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


