Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 497, № 1, стр. 22-28
Электрофлотационное извлечение смеси гидроксидов Cu, Ni, Zn из водно-аммиачных щелочных растворов
Академик РАН В. П. Мешалкин 1, 2, В. А. Колесников 1, *, А. В. Перфильева 1, Аунг Пьяе 1, А. В. Колесников 1
1 Российский химико-технологический университет имени Д.И. Менделеева
125047 Москва, Россия
2 Институт общей и неорганической химии
Российской академии наук имени Н.С. Курнакова
119071 Москва, Россия
* E-mail: artkoles@list.ru
Поступила в редакцию 19.12.2020
После доработки 12.02.2021
Принята к публикации 03.03.2021
Аннотация
Исследован процесс электрофлотационного извлечения смеси гидроксидов меди, цинка и никеля из водно-аммиачных щелочных растворов. Показано, что анионный ПАВ – мыла талловых масел из древесины хвойных пород – оказывает положительное влияние на эффективность процесса электрофлотационного извлечения смеси гидроксидов: сокращение времени процесса в 4–5 раз, расширение области рН и формирование более устойчивого пенного продукта. Предложена схема формирования заряда поверхности, адсорбции ПАВ и лиганда на дисперсной фазе гидроксидов металлов и их влияния на электрофлотационный процесс.
ВВЕДЕНИЕ
В современном гальванохимическом производстве для получения металлических покрытий требуемого качества и заданных характеристик широко применяются комплексные электролиты, в состав которых входят различные лиганды: аммиак, цианид, тартрат-ион, амины и др., – в первую очередь в процессах меднения, цинкования и никелирования, и получения сплавов Zn–Ni, Cu–Ni, Cu–Zn [1, 2]. В сточных водах, содержащих металлы-комплексообразователи Cu2+ Zn2+ и Ni2+ и различные неорганические лиганды, гидроксидные осадки при рН 8–10, особенно при высоких концентрациях лиганда, не формируются, что снижает эффективность различных способов извлечения дисперсной фазы [3, 4].
Известны различные способы отделения дисперсной фазы – осаждение, фильтрация, флотация и электрофлотация [5–7]. В последние годы в России [8–10] и за рубежом [11–24] широкое распространение для очистки сточных вод сложного состава, в первую очередь для извлечения взвешенных веществ и гидрофильных осадков частиц малого размера (10–50 мкм), получил метод электрофлотации.
Используя константы устойчивости комплексов металл–лиганд (Me–L) для различных концентраций металлов и лигандов, можно определить области формирования осадков, их концентрацию и условия выделения из сточных вод. При этом в присутствии лигандов образующиеся осадки, как правило, мелкодисперсны, размер частиц при низких концентрациях (менее 100 мг л–1) не превышает 10 мкм.
Проведенные исследования процесса электрофлотационного (ЭФ) извлечения ионов цветных металлов из сульфатно-хлоридных щелочных растворов показали, что эффективность процесса снижается в присутствии аммиака. Возможность формирования осадков гидроксидов металлов, гидроксокомплексов, а также аммиачных комплексов Cu, Zn и Ni связано с определением условий для эффективной очистки сточной воды [7]. Ионы никеля в растворе аммиака в области рH 9–10 образуют более слабые комплексы, чем ионы меди и цинка, которые при увеличении значения рН разрушаются, и ионы никеля переходят в гидроксокомплексы или формируют осадки гидроксида.
Целью данной работы было исследование процесса электрофлотационного извлечения смеси ионов меди, никеля и цинка в виде гидроксидных осадков из водно-аммиачных щелочных растворов в условиях комплексообразования. Были поставлены следующие задачи:
– исследовать влияние ПАВ различной природы на ЭФ извлечение дисперсной фазы осадков гидроксидов Cu, Zn и Ni;
– установить зависимость степени извлечения смеси гидроксидов Cu, Zn и Ni в водных растворах нейтрального электролита Na2SO4 и в присутствии лиганда NH3 от рН раствора, размера частиц и электрокинетического потенциала (ξ-потенциал) дисперсной фазы.
МЕТОДИКА ИССЛЕДОВАНИЙ
Экспериментальные исследования электрофлотационных процессов проводили по методикам [7–10].
Эффективность электрофлотационного процесса оценивали по значению степени извлечения α (%):
(1)
$\alpha = \frac{{{{С}_{{{\text{исх}}}}} - {{С}_{{{\text{ост}}}}}}}{{{{С}_{{{\text{исх}}}}}}} \times 100\% ,$Физико-химические характеристики частиц дисперсной фазы исследовали при помощи лазерного анализатора частиц Analysette NanoTec/MikroTec/XT (Германия) и лазерного анализатора характеристик частиц субмикронного и нано-диапазона Malvern Zetasizer Nano (Великобритания); погрешность измерений ±0.5%.
Объектами исследования были водные растворы смеси ионов меди, цинка и никеля состава:
– система А (с нейтральным электролитом): H2O–ΣMe(OH)2 –Na2SO4, где Ме = Cu2+, Zn2+, Ni2+,
– система Б (с лигандом): H2O–ΣMe(OH)2 –NH3, где Ме = Cu2+, Zn2+, Ni2+.
Система А: с(Cu2+) = 30 мг л–1, с(Zn2+) = 30 мг л–1, с(Ni2+) = 30 мг л–1, с(Na2SO4) = 1 г л–1.
Система Б: с(Cu2+) = 30 мг л–1, с(Zn2+) = 30 мг л–1, с(Ni2+) = 30 мг л–1, с(NH4OH) = 500 мг л–1.
Условия проведения электрофлотационного процесса: время извлечения τ = 20 мин, плотность тока Jv = 0.4 А л–1.
В работе использовали промышленные ПАВ, широко применяемые при флотации Al2O3. Анионный ПАВ – мыла талловых масел древесины хвойных пород (МТМх) и катионный ПАВ – ацетат первичных аминов (ФЛОН-1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что в процессе напорной флотации эффективно извлекается гидрофобный осадок, а при электрофлотации извлекается дисперсная фаза с гидрофобно-гидрофильными свойствами, например, гидроксиды металлов [6, 7].
Однако, при избытке лиганда, например, аммиака, образуются устойчивые растворимые комплексы металлов, формирующие коллоидно-устойчивые системы с размером частиц менее 1 мкм. Для извлечения таких объектов флотационные методы не подходят, так как флотокомплекс дисперсная фаза–пузырьки H2 и O2 не формируется.
Согласно [25] прочность аммиачных комплексов снижается в ряду: Cu2+ > Zn2+ > Ni2+. Для гидроксокомплексов наиболее прочные комплексы характерны для ионов Zn2+, в этом случае прочность изменяется в ряду Zn2+ > Cu2+ > Ni2+. Мы установили, что формирование наиболее труднорастворимых осадков для Cu(OH)2 начинается при pH 8–8.5, для Zn(OH)2 при pH 9–9.5 и для Ni(OH)2 при pH 10–10.5. В водной среде растворимость гидроксида никеля выше, чем гидроксида меди. Таким образом, при наличии в исходном растворе смеси ионов металлов Cu2+, Zn2+, Ni2+ в зависимости от значения pH образуются осадки разного состава, часть ионов металлов остается в растворе, и, возможно, образуются растворимые комплексы. В водном растворе Na2SO4 при pH 8 после фильтрования было определено, что дисперсная фаза содержала 98% Cu2+, 63% Zn2+, 39% Ni2+ от исходного количества каждого из металлов; при pH 9 содержание металлов в дисперсной фазе увеличилось: Cu2+ – 99%, Zn2+ – 98%, Ni2+ – 93% (табл. 1). В щелочных растворах при pH 10 процентное содержание каждого металла в осадке достигало 99% от исходного, а концентрация свободных ионов, определяемая произведением растворимости, находилась на уровне 0.1–1.0 мг л–1. При pH 11 процентное содержание Zn в дисперсной фазе снизилось до 96%, что связано с повышением растворимости Zn(OH)2 и формированием ионов ZnO$_{2}^{{2 - }}$.
Таблица 1.
Влияние pH раствора и природы электролита на степень извлечения α дисперсной фазы смеси гидроксидов Cu, Zn, Ni
| pH | Me | Система А | Система Б | ||
|---|---|---|---|---|---|
| αэф, % (ЭФ) | αmax, % (ЭФ + Ф) | αэф, % (ЭФ) | αmax, % (ЭФ + Ф) | ||
| 8 | Cu | 90 | 98 | 71 | 86 |
| Ni | 31 | 39 | 52 | 59 | |
| Zn | 52 | 63 | 42 | 48 | |
| 9 | Cu | 99 | 99 | 88 | 98 |
| Ni | 86 | 93 | 78 | 93 | |
| Zn | 98 | 99 | 85 | 98 | |
| 10 | Cu | 96 | 99 | 93 | 99 |
| Ni | 95 | 99 | 95 | 99 | |
| Zn | 91 | 98 | 96 | 99 | |
| 11 | Cu | 85 | 99 | 97 | 99 |
| Ni | 78 | 99 | 99 | 99 | |
| Zn | 79 | 96 | 99 | 99 | |
В отличие от водных растворов Na2SO4, в водно-аммиачных растворах количество дисперсной фазы гидроксидов Cu, Zn, Ni, как и ожидалось, понижено (табл. 1). Содержание меди в дисперсной фазе при pH 8 составило 86%, цинка – 48%, никеля – 39% от исходного содержания каждого металла. Остальная часть металлов оставалась в растворе в виде ионов и аммиачных комплексов: ([Cu(NH3)n]2+ + Cu2+), ([Zn(NH3)n]2+ + Zn2+), ([Ni(NH3)n]2+ + Ni2+). При pH 10–11 присутствие аммиака в растворе практически не влияло – 98–99% каждого из металлов находилось в дисперсной фазе.
Возможны случаи, когда метод электрофлотации не эффективен (т.е. степень извлечения достаточно низкая или равна нулю), несмотря на наличие в системе дисперсной фазы, которую можно отделить обычным фильтрованием.
Экспериментальные данные ЭФ процесса извлечения смеси гидроксидов Cu, Zn, Ni из щелочного аммиачного раствора (система Б) в сравнении с водным раствором сульфата натрия (система А) представлены в табл. 1. Для определения максимально возможной степени извлечения дисперсной фазы после электрофлотации дополнительно проведена фильтрация (Ф) растворов.
В сульфатном растворе при pH 8–9 электрофлотационное извлечение протекает неэффективно. Установлено, что степень извлечения сравнительно невысокая: после процесса ЭФ в системе остается еще до 8% дисперсной фазы, которая была отделена фильтрованием. При рН 10 степень извлечения достигает максимальных значений 98–99%. При рН 11 эффективность ЭФ процесса снижается (αэф = 78–85%), дополнительное фильтрование повышает степень извлечения αmax до 96–99%. При этом степень извлечения цинка ниже, чем меди и никеля, что связано с бóльшей растворимостью Zn(OH)2 и формированием ионов ZnO$_{2}^{{2 - }}$.
В отличие от сульфатных растворов в аммиачном растворе высокие значения αэф наблюдаются только при pH 11, достигая 97–99%.
Ранее было установлено, что ПАВ различной природы положительно влияют на ЭФ процесс извлечения гидроксидов металлов [7]. В водно-аммиачном растворе при pH 8–9 значение степени извлечения не превышало 85%. При добавлении в раствор анионного ПАВ МТМх степень извлечения существенно возрастала. Рост степени извлечения наблюдался во всем исследованном диапазоне pH 8–11, величины αэф достигали 97–99% (табл. 2). Указанный факт связан с гидрофобизацией поверхности дисперсной фазы смеси гидроксидов Cu, Zn, Ni. Катионный ПАВ (ФЛОН-1), напротив, не оказал положительного влияния, снижая степень извлечения в слабощелочной области рН на 3–5%.
Таблица 2.
Влияние pH и природы ПАВ на степень электрофлотационного извлечения дисперсной фазы смеси гидроксидов Cu, Zn, Ni из водно-аммиачных растворов (система Б)
| pH | Me | αэф, % | ||
|---|---|---|---|---|
| Система Б | Система Б + МТМх | Система Б + ФЛОН-1 | ||
| 8 | Cu | 71 | 96 | 89 |
| Ni | 52 | 89 | 40 | |
| Zn | 42 | 97 | 60 | |
| 9 | Cu | 88 | 96 | 92 |
| Ni | 78 | 98 | 58 | |
| Zn | 85 | 98 | 54 | |
| 10 | Cu | 93 | 97 | 92 |
| Ni | 95 | 99 | 90 | |
| Zn | 91 | 97 | 92 | |
| 11 | Cu | 97 | 97 | 93 |
| Ni | 99 | 98 | 93 | |
| Zn | 99 | 98 | 98 | |
Важными для анализа причин роста и снижения степени извлечения дисперсной фазы гидроксидов являются физико-химические характеристики: средний размер частиц, величина и знак ξ-потенциала, определенные в работе для реальных систем. Экспериментальные данные, полученные для системы А без ПАВ и с добавлением анионного и катионного ПАВ при различных значениях рН, представлены в табл. 3.
Таблица 3.
Влияние pH раствора, природы ПАВ на величину ξ-потенциала и средний размер частиц смеси гидроксидов Cu, Ni и Zn в водном растворе Na2SO4
| pH | Система А | Система А + ФЛОН-1 | Система А + МТМх | |||
|---|---|---|---|---|---|---|
| d, мкм | ξ, мВ | d, мкм | ξ, мВ | d, мкм | ξ, мВ | |
| 8 | 17 | –16 | 18 | –9 | 13 | –4 |
| 9 | 31 | –14 | 21 | –8 | 16 | –7 |
| 10 | 40 | –10 | 28 | –6 | 25 | –9 |
| 11 | 32 | –9 | 40 | –3 | 34 | –12 |
Установлено, что с увеличением pH растет средний размер частиц смеси гидроксидов металлов в растворе. Причем при pH 8 в дисперсной фазе в основном преобладает гидроксид меди; при pH 9 смесь в основном состоит из Cu(OH)2 и Zn(OH)2; при pH 10 смесь содержит Cu(OH)2, Zn(OH)2, Ni(OH)2.
Несмотря на то что оксид цинка обладает хорошей флотационной активностью и высоким отрицательным значением ξ-потенциала, при рН 11 его растворимость увеличивается, поэтому степень извлечения снижается. Высокие отрицательные значения ξ-потенциала дисперсной фазы при pH 8–9 в растворе Na2SO4 связаны со специфической адсорбцией ионов SO$_{4}^{{2 - }}$. В растворах NaNO3, NaCl при pH 8–9 величина ξ-потенциала близка к нулю, что соответствует изоэлектрической точке гидроксидов.
При введении в раствор катионного ПАВ ФЛОН-1 значение ξ-потенциала повысилось. При этом размер частиц при pH 8–10 не изменялся. При pH 11 за счет адсорбции катионного ПАВ на отрицательно заряженной поверхности осадка гидроксида размер частиц дисперсной фазы увеличивался. Анионный ПАВ не оказывал влияния на размер частиц дисперсной фазы, снижая заряд поверхности от –4…–7 мВ без ПАВ до ‒16…–14 мВ при pH 8–9, что связано с вытеснением анионным ПАВ абсорбированных ионов SO$_{4}^{{2 - }}$ c поверхности.
Для системы Б при pH 8–10 следует обратить особое внимание на небольшие размеры частиц дисперсной фазы: 5–10 мкм (табл. 4). Величина ξ-потенциала отрицательна и составила –5…–8 мВ. Это является причиной снижения степени извлечения в электрофлотационном процессе. При pH 11 в водном растворе происходит частичное разрушение аммиачного комплекса и формирование гидроксокомплекса, о чем свидетельствуют рост отрицательных значений ξ-потенциала и увеличение размера частиц до 10 мкм. Это в совокупности обеспечило высокую эффективность электрофлотационного процесса, величина αэф достигла 99%. Присутствие катионного ПАВ ФЛОН-1 не оказывало влияния на величину и знак ξ-потенциала, но привело к увеличению размера частиц в 2 раза. Введение анионного ПАВ МТМх способствовало образованию более крупных частиц (12–18 мкм) при pH 8–10 и до 34 мкм при pH 11. То есть использование ПАВ положительно влияло на процесс электрофлотационного извлечения дисперсной фазы.
Таблица 4.
Влияние pH раствора, природы ПАВ на величину ξ-потенциала и средний размер частиц смеси гидроксидов Cu, Ni и Zn в водном растворе NH4OH (система Б)
| pH | Система Б | Система Б + ФЛОН-1 | Система Б + МТМх | |||
|---|---|---|---|---|---|---|
| d, мкм | ξ, мВ | d, мкм | ξ, мВ | D , мкм | ξ, мВ | |
| 8 | 5 | –8 | 11 | –4 | 12 | –1 |
| 9 | 5 | –6 | 13 | –5 | 18 | –3 |
| 10 | 5 | –5 | 13 | –6 | 18 | –6 |
| 11 | 10 | –8 | 18 | –9 | 34 | –8 |
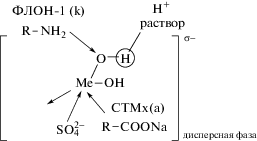
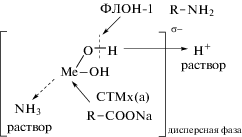
На рис. 1–3 схематично представлено формирование заряда поверхности σ для гидроксидов металлов: в водном растворе электролитов NaNO3 и NaCl (рис. 1); в электролите, где наблюдается специфическая адсорбция ионов SO$_{4}^{{2 - }}$ (рис. 2); в аммиачном растворе в присутствии лиганда NH3 для комплексообразователей – ионов Cu2+, Zn2+, Ni2+ (рис. 3).
Рис. 1.
Механизм формирования заряда поверхности гидроксида в инактивном электролите (концентрация NaCl и NaNO3 1 г л–1).
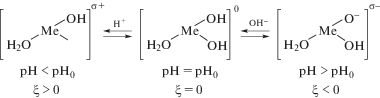
Рис. 2.
Механизм формирования заряда поверхности гидроксида в присутствии специфически адсорбирующихся ионов SO42– (концентрация Na2SO4 1 г л–1).
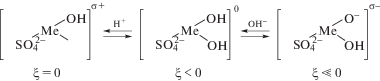
Рис. 3.
Механизм формирования заряда поверхности гидроксида в присутствии лиганда (концентрация NН4OH 1 г л–1).
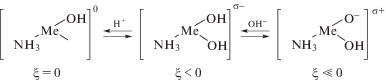
Исследования показали, что заряд дисперсной фазы (ξ-потенциал) имеет отрицательные значения в растворах Na2SO4 и NH4OH. В этом случае молекулы воды вытесняются с поверхности оксидов за счет адсорбции NH3 или ионов SO$_{4}^{{2 - }}$.
Катионные ПАВ на гидроксидах металлов адсорбируются по кислородным группам, тогда как анионные ПАВ – по ионам металла, вытесняя молекулы воды. Адсорбция ПАВ гидрофобизирует поверхность и приводит к росту степени электрофлотационного извлечения. Схематично адсорбционный процесс представлен на рис. 4 для водного раствора на основе сульфата натрия и на рис. 5 для щелочного аммиачного раствора. Предложенные механизмы позволяют оценить влияние ПАВ на электрофлотационный процесс извлечения дисперсной фазы.
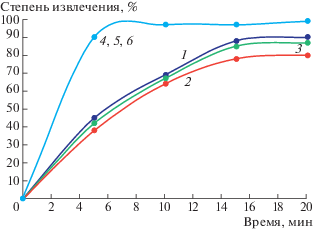
ПАВ оказывает положительное влияние не только на степень извлечения, но и на скорость процесса. На рис. 6 представлены данные по кинетике ЭФ процесса извлечения смеси гидроксидов металлов Cu, Zn, Ni из водно-аммиачного раствора. В присутствии ПАВ степень извлечения достигала 96% в течение 5 мин обработки. Пенный продукт (смесь гидроксидов) устойчив и не разрушался во времени, что связано, в первую очередь, с гидрофобизацией их поверхности. В пользу влияния поверхностных характеристик свидетельствует тот факт, что эффекты проявляются при низких концентрациях ПАВ (5 мг л–1 на 100 мг л–1 гидроксидного осадка). Степень извлечения возрастала в том числе за счет увеличения размера частиц примерно в 3 раза и гидрофобизации поверхности.
ЗАКЛЮЧЕНИЕ
Показано, что дисперсная фаза смеси гидроксидов Cu, Zn, Ni в водно-аммиачном щелочном растворе может быть извлечена с высокими значениями степени извлечения при pH 8–10 в присутствии промышленного анионного ПАВ МТМх. Эффективность влияния анионного ПАВ на степень извлечения связана с увеличением размера флотируемых частиц и гидрофобизацией поверхности дисперсной фазы cмеси гидроксидов Cu, Zn, Ni. Найдены оптимальные условия (pH 10, объемная плотность тока Jv = 0.4 А л–1, время флотации не более 20 мин), при которых величина αэф достигает 98–99%, пенный продукт устойчив и не разрушается в процессе электролиза при выделении газов H2 и O2.
Установлено, что ПАВ, использованные в работе, за счет адсорбции на гидроксидных осадках и пузырьках электролитических газов при их минимальных концентрациях (5 мг л–1 на 100 мг л–1 дисперсной фазы) практически не обнаруживаются в растворе после электрофлотации (остаточная концентрация не превышала 0.1 мг л–1).
Список литературы
Виноградов С.С. Экологически безопасное гальваническое производство. 2-е изд. М.: Глобус, 2002. ISBN 5-89021-016-05
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. № 1. С. 51–53. https://doi.org/10.6060/tcct.20165901.5296
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. Румянцева К.Е. // Изв. вузов. Химия и хим. технология. 2014. Т. 57. № 8. С. 47–51.
Shekhanov R.F., Gridchin S.N., Balmasov A.V. // Russ. J. Electrochem. 2018. V. 54. № 4. P. 355–362. https://doi.org/10.1134/S1023193518040079
Колесников В.А., Меньшутина Н.В., Десятов А.В. Оборудование, технологии и проектирование систем очистки сточных вод / М.: ДеЛи плюс, 2016.
Ksenofontov B.S. // Santechnika magazine (Water supply pipes fittings). 2020. № 2. P. 46–51.
Kolesnikov V.A., II’in V.I., Brodskiy V.A., Kolesnikov V.A. // Theor. Found. Chem. Eng. 2017. V. 51. № 4. P. 361–375. https://doi.org/10.1134/S0040579517040200
Kolesnikov A., Milyutina A., Desyatov A., Kolesnikov V. // Sep. Purif. Technol. 2019. V. 209. P. 73–78. https://doi.org/10.1016/j.seppur.2018.07.014
Колесников А.В., Мешалкин В.П., Давыдкова Т.В., Колесников В.А. // ДАН. Химия, науки о материалах. 2020. Т. 494. № 1. С. 55–61. https://doi.org/10.31857/S2686953520050076
Мешалкин В.П., Колесников А.В., Савельев Д.С., Колесников В.А., Белозерский А.Ю., Меньшова И.И., Маслянникова Д.В., Сычева О.В. // ДАН. 2019. Т. 486. № 6. С. 680–684. https://doi.org/10.31857/S0869-56524866680-684
Garcia-Segura S., Eiband M.M. S.G., de Melo J.V., Martínez-Huitle C.A., Martínez-Huitle C.A. // J. Electroanal. Chem. 2017. V. 801. P. 267–299. https://doi.org/10.1016/j.jelechem.2017.07.047
Paulista L.O., Presumido P.H., Theodoro J.D.P., Pinheiro A.L.N. // Environ. Sci. Pollution Res. 2018. V. 25. P. 19790–19800. https://doi.org/ 2184-yhttps://doi.org/10.1007/s11356-018
A. Daniel Villalobos-Lara A.D., Pérez T., Uribe A.R., Alfaro-Ayala J.F., de Jesús Ramírez-Minguela J., Minchaca-Mojica J.I. // J. Electroanal. Chem. 2020. V. 858. 113807. https://doi.org/10.1016/j.jelechem.2019.113807
Aoudj S., Khelifa A., Drouiche N. // Chemosphere. 2016. V. 180. P. 379–387. https://doi.org/10.1080/19443994.2015.1095120
Kolesnikov V.A., Brodsky V.A., Perfil’eva A.V., Kolesni-kov A.V. // Pure Appl. Chem. 2017. V. 89. № 10. P. 1535–1541. https://doi.org/10.1515/pac-2016-1113
Merzouk B., Madani K., Sekki A. // Desalination. 2010. V. 250. № 2. P. 573–577. https://doi.org/10.1016/j.desal.2009.09.026
Balla W., Essadki A.H., Gourich B., Dassaa A., Chenik H., Azzi M. // J. Hazard. Mater. 2010. V. 184. № 1–3. P. 710–716. https://doi.org/10.1016/j.jhazmat.2010.08.097
Mirshafiee A., Rezaee A., Mamoory R. S. // J. Cleaner Prod. 2018. V. 198. P. 71–79. https://doi.org/10.1016/j.jclepro.2018.06.201
Tchamango S.R., Darchen A. // J. Environ. Chem. Eng. 2018. V. 6 (4). P. 4546–4554. https://doi.org/10.1016/j.jece.2018.06.044
Gamage N.P., Chellam S. // Environ. Sci. and Technol. 2014. V. 48. № 2. P. 1148–1157. https://doi.org/10.1021/es405080g
Ghernaout D., Naceur M.W., Ghernaout B. // Desalination and Water Treatment. 2011. № 28 (1–3). P. 287–320. https://doi.org/10.5004/dwt.2011.1493
Kyzas G., Matis K. // Processes. 2018. V. 6 (8). № 116. P. 1–16. https://doi.org/10.3390/pr6080116
Peleka E.N., Gallios G.P., Matis K.A. // J. Chem. Technol. Biotechnol. 2018. V. 93. P. 615–623. https://doi.org/10.1002/jctb.5486
Sillanpää M., Shestakova M. Electrochemical Water Treatment Methods: Fundamentals, Methods and Full Scale Applications. Butterworth-Heinemann, 2017. 1–310 p.
Лурье Ю.Ю. Справочник по аналитической химии. 5-е изд. М.: Химия, 1979. 480 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах