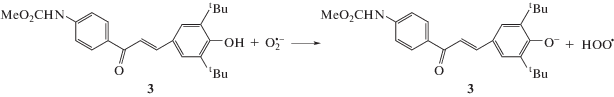Доклады Российской академии наук. Химия, науки о материалах , 2021, T. 500, № 1, стр. 13-17
Активность гидроксипроизводных халконов в отношении супероксид анион-радикала
М. А. Половинкина 1, В. П. Осипова 1, *, А. Д. Осипова 2, Н. Т. Берберова 2, А. В. Великородов 3, академик РАН Г. Г. Матишов 1
1 Федеральный исследовательский центр
Южный научный центр Российской академии наук
344006 Ростов-на-Дону, Россия
2 Астраханский государственный технический университет
414056 Астрахань, Россия
3 Астраханский государственный университет
414056 Астрахань, Россия
* E-mail: osipova_vp@mail.ru
Поступила в редакцию 29.05.2021
После доработки 23.08.2021
Принята к публикации 26.08.2021
Аннотация
Проведено исследование поглощающей активности новых гидроксипроизводных халконов в отношении супероксид анион-радикала (${\text{O}}_{2}^{{\centerdot \, - }}$), генерированного электрохимически, в ферментативной системе ксантин/ксантиноксидаза при восстановлении нитросинего тетразолия, а также в процессе неферментативного хиноидного окисления адреналина в щелочной среде. Впервые установлена антирадикальная активность новых гидроксипроизводных халконов в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$. Взаимодействие с электрохимически генерированным ${\text{O}}_{2}^{{\centerdot \, - }}$ и высокая антирадикальная активность в условиях аутоокисления адреналина в щелочной среде установлены для халкона, содержащего 2,6-ди-трет-бутилфенольный фрагмент. Наибольшую поглощающую активность в ферментативной системе ксантин/ксантиноксидаза и СОД-протекторную активность проявил халкон с двумя неэкранированными ОН-группами. Ингибирующая активность гидроксипроизводных халконов в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$ согласуется с результатами прогноза in silico и свидетельствует об их способности снижать вероятность развития окислительного стресса. Установлена корреляция между способностью исследованных халконов утилизировать супероксид анион-радикал и ингибирующей активностью в модельных системах пероксидного окисления олеиновой кислоты и липидов печени тиляпии.
Несбалансированные биохимические нарушения, возникающие в биологических системах, приводят к образованию активных форм кислорода (АФК), которые провоцируют развитие многих патологических состояний [1]. Одной из активных форм кислорода в живых организмах является супероксид анион-радикал (надпероксид-анион, ${\text{O}}_{2}^{{\centerdot \, - }}$), образующийся в процессе одноэлектронного восстановления O2 [2]. Роль ${\text{O}}_{2}^{{\centerdot \, - }}$ в организме двойственна: в нормальных условиях он участвует в клеточной активности контролируемым образом, в избытке же он способен повреждать биологические молекулы, в том числе нуклеиновые кислоты, липиды, белки, вызывая острые и хронические нарушения метаболических путей [3].
Существует естественная эндогенная защитная антиоксидантная система, например: супероксиддисмутаза (СОД), супероксидредуктаза, – которая эффективно удаляет ${\text{O}}_{2}^{{\centerdot \, - }}$ и другие АФК. При сбое обмена веществ или под воздействием внешних факторов эндогенная клеточная защита не справляется с последствиями окислительного стресса [4]. Природные и синтетически полученные соединения, которые могут быстро утилизировать ${\text{O}}_{2}^{{\centerdot \, - }}$, являются перспективными антиоксидантами, поскольку могут снижать токсическое действие АФК за счет обрыва свободно-радикальных процессов, что является важным при профилактике и лечении патологических состояний.
С целью снижения риска проявления нежелательных побочных эффектов предпочтение отдается соединениям, которые встречаются в продуктах растительного происхождения, например, флавоноидам, и обладают широким спектром биологической активности, в том числе антиоксидантными свойствами [5, 6]. В то же время многие антиоксиданты природного происхождения, флавоноиды в том числе, имеют ряд недостатков, таких как малая растворимость, недостаточная биодоступность при пероральном приеме, низкая системная абсорбция, высокая скорость их выведения из организма, а также образование токсичных метаболитов [7, 8]. Кроме того, ранее было установлено, что флавоноиды могут проявлять прооксидантные свойства при применении их в высоких концентрациях [9]. Все вышеперечисленное ограничивает применение антиоксидантов растительного происхождения в терапевтических целях и способствует созданию новых высокоэффективных и безопасных фармакологически активных соединений, содержащих различные биомиметические редокс-активные и фармакофорные группы, различающиеся по механизму антиоксидантного действия.
Ранее были синтезированы новые гидроксипроизводные халконов 1–3 (рис. 1), для которых с высокой вероятностью была предсказана in silico способность выступать в качестве антиоксидантов, ловушек свободных радикалов, кислорода и оксида азота [10].
Рис. 1.
Структурные формулы соединений: 1 – 3-[(E)-3-(2,4-дигидроксифенил)-2-пропеноил]-2H-хромен-2-он, 2 – 3-[(E)-3-(4-гидроксифенил)-2-пропеноил]-2H-хромен-2-он, 3 – метил-N-(4-{(E)-3-[3,5-ди(трет-бутил)-4-гидроксифенил]-2-пропеноил}фенил)карбамат.

В работе исследована поглощающая активность данных халконов 1–3 в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$, генерированного электрохимически, в ферментативной системе ксантин/ксантиноксидаза, а также в процессе неферментативного хиноидного окисления адреналина в щелочной среде.
Антиоксидантное действие потенциальных ингибиторов окислительных процессов во многом обусловлено активностью по отношению к различным видам АФК. Супероксид анион-радикал ${\text{O}}_{2}^{{\centerdot \, - }}$ образуется в процессе одноэлектронного восстановления кислорода, поэтому для исследования возможности взаимодействия потенциальных антиоксидантов с данной АФК удобно применять электрохимические методы исследования. Преимуществами электрохимического метода являются высокая чувствительность, скорость и воспроизводимость показателей, но прежде всего отсутствие побочных продуктов, так как апротонный растворитель способствует стабилизации радикала и препятствует дисмутации ${\text{O}}_{2}^{{\centerdot \, - }}$, что обеспечивает гораздо более точное измерение способности улавливания активных радикалов [11].
Электровосстановление кислорода на Pt-электроде в ацетонитриле приводит к образованию ${\text{O}}_{2}^{{\centerdot \, - }}$, фиксируемого на циклической вольтамперограмме (ЦВА) (CH3CN, Pt, 0.1 М nBu4NClO4, C = = 5 мМ, Ag/AgCl, ${v}$ = 0.2 В с–1) [12]. В присутствии гидроксипроизводных халконов 1 и 2 не отмечено изменений на ЦВА, что свидетельствует об отсутствии их активности в отношении электрохимически генерированного ${\text{O}}_{2}^{{\centerdot \, - }}$, несмотря на наличие в структурах систем переноса атомов водорода и электронов – ОН-групп.
Взаимодействие соединения 3 с ${\text{O}}_{2}^{{\centerdot \, - }}$ приводит к исчезновению обратимости стадии восстановления O2 (рис. 2).
Рис. 2.
ЦВА восстановления ${\text{O}}_{2}^{{\centerdot \, - }}$ без (кривая 1) и в присутствии соединения 3 (кривая 2) (CH3CN, Pt, 0.1 М nBu4NClO4, C = 5 мM, Ag/AgCl, ${v}$ = 0.2 В с–1).
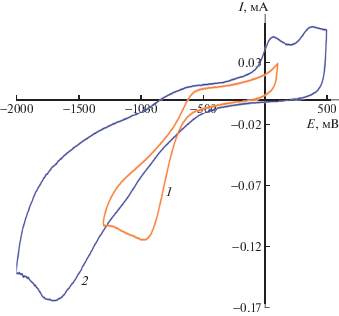
Уменьшение высоты анодного пика окисления супероксид анион-радикала и увеличение высоты катодного пика указывают на необратимое взаимодействие соединения 3 с ${\text{O}}_{2}^{{\centerdot \, - }}$. На обратной ветви ЦВА появляется новый анодный пик при потенциале +0.05 В, что, предположительно, объясняется образованием соответствующего фенолят-аниона при отрыве ${\text{O}}_{2}^{{\centerdot \, - }}$ атома водорода от OH-группы халкона 3, как показано на схеме 1.
Полученные результаты свидетельствуют об активности соединения 3 в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$, генерированного электрохимически, что объясняется наличием пространственно-затрудненного фенольного фрагмента, способствующего образованию стабильного интермедиата.
Изучена ингибирующая активность соединений 1–3 в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$, генерированного в ферментативной системе ксантин/ксантиноксидаза при восстановлении нитросинего тетразолия (НСТ-тест) до формазана синего цвета, с максимальным поглощением при 560 нм. Количество восстановленного нитросинего тетразолия прямо пропорционально количеству ${\text{O}}_{2}^{{\centerdot \, - }}$, продуцируемого в модельной системе, поэтому снижение концентрации восстановленного формазана свидетельствует об антирадикальной активности соединения.
Установлена незначительная ингибирующая активность халконов 1–3 в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$, образующегося в ферментативной системе. Высокая способность утилизировать ${\text{O}}_{2}^{{\centerdot \, - }}$в НСТ-тесте выявлена для соединения 1 (41.3 ± 0.09% ингибирования), отличительной особенностью которого является наличие двух гидроксильных групп, в отличие от соединений 2 и 3, активность которых составила 28.4 ± 0.04 и 29.5 ± 0.06% соответственно (рис. 3).
Рис. 3.
Поглощающая активность соединений 1–3 в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$, генерированного в ферментативной системе ксантин/ксантиноксидаза, в процессе хиноидного окисления адреналина в щелочной среде в присутствии гомогената печени русского осетра (СОД-протекторная активность) и без биопрепарата (аутоокисление адреналина). Представлены средние значения, полученные в независимых опытах при 5 параллельных измерениях в каждом эксперименте, относительно контроля; отличия от контрольной экспериментальной группы p < 0.05.

Учитывая то, что в данной модельной системе, в зависимости от pH среды, возможно автоокисление флавоноидов, а также то, что образующийся формазан плохо растворим в воде [13], полученные показатели не дают правильного представления о способности исследуемых соединений утилизировать ${\text{O}}_{2}^{{\centerdot \, - }}$. Поэтому в работе исследована активность гидроксипроизводных халконов в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$, полученного в модельной системе аутоокисления адреналина в щелочной среде (рН 10.65) до адренохрома, регистрируемого при λ = 347 нм [14]. Особенностью этого метода является то, что продуктами хиноидного окисления адреналина являются не только ${\text{O}}_{2}^{{\centerdot \, - }}$, но и радикалы карбонат-бикарбонатных анионов и CO2, следовательно, в целом можно судить об антирадикальной активности халконов. Кроме того, модельная система хиноидного окисления адреналина позволяет оценить способность биопрепаратов (супернатант гомогената печени русского осетра) ингибировать генерацию ${\text{O}}_{2}^{{\centerdot \, - }}$, т.е. определить протекторную активность соединений в отношении супероксиддисмутазы (СОД).
В условиях аутоокисления адреналина все халконы ингибируют образование ${\text{O}}_{2}^{{\centerdot \, - }}$, соединения 1 и 3 – на 33.9 и 38.8% соответственно. Наименьшей активностью в неферментативной системе обладает соединение 2 (13.0% ингибирования), что, возможно, объясняется наличием одной неэкранированной ОН-группы в структуре халкона. Добавление супернатанта гомогената печени русского осетра в щелочной бикарбонатный буфер приводит к снижению скорости аутоокисления адреналина, что свидетельствует об утилизации ${\text{O}}_{2}^{{\centerdot \, - }}$ цитозольной СОД. Наибольшая СОД-протекторная активность биопрепарата установлена для производного халкона 1 (76.4 ± 0.01% ингибирования), соединения 2 и 3 ингибируют процесс образования адренохрома на 38.6 ± 0.01 и 49.9 ± 0.03% соответственно.
Полученные результаты по способности гидроксипроизводных халконов 1–3 утилизировать супероксид анион-радикал коррелируют с данными о наибольшем ингибирующем действии халкона 1 в модельной системе неферментативного пероксидного окисления олеиновой кислоты и соединения 3 в модельной системе длительно протекающего процесса окисления липидов печени тиляпии [10].
Таким образом, в опытах in vitro показано, что производные халконов 1–3 проявляют свойства первичных антиоксидантов, антирадикальные свойства которых объясняются возможностью выступать донорами электронов и/или атомов водорода. Поглощающая активность соединений в отношении ${\text{O}}_{2}^{{\centerdot \, - }}$, генерированного в различных модельных системах, согласуется с данными прогноза in silico [10]. Наибольшая ингибирующая активность в ферментативной системе ксантин/ксантиноксидаза и СОД-протекторная активность выявлена для халкона 1, в структуре которого содержатся две неэкранированные ОН-группы. Взаимодействие с электрохимически генерированным ${\text{O}}_{2}^{{\centerdot \, - }}$ установлено только для халкона 3, который демонстрирует высокую антирадикальную активность и в условиях аутоокисления адреналина в щелочной среде, что объясняется присутствием 2,6-ди-трет-бутилфенольного фрагмента, способствующего образованию стабильного ароксильного радикала. Учитывая, что соединения 1–3 хорошо растворимы в этаноле и ДМСО, а также то, что для них in silico спрогнозирована низкая потенциальная токсичность (4 класс), дальнейшие экспериментальные исследования по изучению биологической активности и острой токсичности данных халконов in vivo позволят выявить эффективные и безопасные фармакологически активные соединения.
Список литературы
Lambeth J.D. // Free Radic. Biol. Med. 2007. V. 43. P. 332–347. https://doi.org/10.1016/j.freeradbiomed.2007.03.027
Zabik N.L., Anwar S., Ziu I., Martic-Milne S. // Electrochim. Acta. 2019. V. 296. № 10. P. 174–180. https://doi.org/10.1016/j.electacta.2018.11.051
Phaniendra A., Jestadi D.B., Periyasamy L. // Indian J. Clin. Biochem. 2015. V. 30. № 1. P. 11–26. https://doi.org/10.1007/s12291-014-0446-0
Hayyan M., Hashim M.A., Al Nashef I.M. // Chem. Rev. 2016. V. 116. № 5. P. 3029–3085. https://doi.org/10.1021/acs.chemrev.5b00407
Adelusi T.I., Akinbolaji G.R., Yin X., Ayinde K.S., Olaoba O.T. // Eur. J. Pharmacol. 2021. V. 891. № 15. P. 173695. https://doi.org/10.1016/j.ejphar.2020.173695
Janković T., Turković N., Kotur-Stevuljević J., Vujić Z., Ivković B. // Chem.-Biol. Interactions. 2020. V. 324. P. 109084. https://doi.org/10.1016/j.cbi.2020.109084
Zengin G., Aktumsek A., Guler G.O., Cakmak Y.S., Yildiztugay E. // Rec. Nat. Prod. 2011. V. 5. P. 123–132.
Zhao Zh., Cui X., Ma X., Wang Z. // Acta Biochim. Biophys. Sin. 2020. V. 52. № 11. P. 1265–1273. https://doi.org/10.1093/abbs/gmaa124
Procházková D., Boušová I., Wilhelmová N. // Fitoterapia. 2011. V. 82. № 4. P. 513–523. https://doi.org/10.1093/abbs/gmaa124
Osipova V.P., Polovinkina M.A., Telekova L.R., Velikorodov A.V., Stepkina N.N., Berberova N.T. // Russ. Chem. Bull. International Edition. 2020. V. 69. № 3. P. 504–509. https://doi.org/10.1007/s11172-020-2790-y
Magalhães L.M., Segundo M.A., Reis S., Lima J. // Anal. Chim. Acta. 2008. V. 613. № 1. P. 1–19. https://doi.org/10.1016/j.aca.2008.02.047
Osipova V., Polovinkina M., Osipova A., Gracheva Yu., Okhlobystin A. // Turk. J. Chem. 2019. V. 43. P. 1336–1349. https://doi.org/10.3906/kim-1904-40
Zagrean-Tuza C., Dorneanu S., Mot A.C. // Free Radical Biol. Med. 2020. V. 146. P. 189–197. https://doi.org/10.1016/j.freeradbiomed.2019.11.006
Polovinkina M.A., Kolyada M.N., Osipova V.P., Berberova N.T., Chukicheva I.Y., Shumova O.A., Kutchin A.V. // Dokl. Chem. 2019. V. 484. № 5. P. 568–571. https://doi.org/10.31857/S0869-56524845568-571
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах