Доклады Российской академии наук. Химия, науки о материалах , 2022, T. 505, № 1, стр. 25-29
Синтез полифункциональных олигоэфирдиолов на основе аллилглицидилового эфира
Т. В. Гриневич 1, *, М. Л. Придатченко 2, Д. Б. Виноградов 3, П. В. Булатов 3, академик РАН А. А. Берлин 1
1 Федеральное государственное бюджетное
учреждение науки Федеральный исследовательский центр химической физики им. Н.Н. Семенова
Российской академии наук
119991 Москва, Россия
2 Институт энергетических проблем химической физики им. В.Л. Тальрозе Федерального исследовательского центра химической физики им. Н.Н. Семенова Российской академии наук
119334 Москва, Россия
3 Федеральное государственное бюджетное
учреждение науки Институт органической химии
им. Н.Д. Зеленского Российской академии наук
119991 Москва, Россия
* E-mail: grin@chph.ras.ru
Поступила в редакцию 27.04.2022
После доработки 28.06.2022
Принята к публикации 07.07.2022
- EDN: BJYLOF
- DOI: 10.31857/S268695352260012X
Аннотация
Исследована реакция бромирования олигоэфирдиола аллилглицидилового эфира, проведенная по двум методикам. Показано, что в результате одной методики наряду с полностью бромированным олигоэфирдиолом образуются молекулы моноола и молекулы, не содержащие ОН-группы. Предположено, что их формирование проходит по реакции циклодегидробромирования за счет отщепления одной или двух молекул бромоводорода от олигоэфирдиола с образованием в них диоксановых и диоксипановых циклических фрагментов. Определены условия полного бромирования олигодиола с сохранением функциональности по ОН-группам.
ВВЕДЕНИЕ
Настоящее исследование посвящено получению олигоэфирдиолов с функциональными группами в полимерной цепи. Данный класс соединений может рассматриваться в качестве полифункциональных сшивающих агентов, соединений для формирования концевых групп, а также для проведения реакций полимераналогичного превращения по функциональным группам полимерной цепи с целью создания материалов с новым комплексом свойств.
Целью работы являлась разработка метода получения олигоэфирдиолов с повышенным содержанием функциональных групп.
В качестве объекта исследований выбрана реакция катионной полимеризации аллилглицидилового эфира (АГЭ) на каталитической системе BF3–Н2О. Ранее в работе [1] было показано, что в этих условиях реакция полимеризации идет с образованием олигодиолов с полидисперсностью, не превышающей 1.1; олигодиолы со временем переходят из вязкотекучего состояния в твердое. Из анализа ИК-спектров свежеполученного олигоэфирдиола АГЭ и образующейся после его отверждения пленки следовало, что процесс самопроизвольного отверждения связан, видимо, с образованием трехмерной полимерной сетки за счет межмолекулярного взаимодействия по двойной связи, сигналы от которой в ИК-спектре пленки практически отсутствуют.
Чтобы не допустить процесса сшивки, необходимо было либо вводить ингибитор, либо переводить двойную связь по реакции полимераналогичного превращения в иной вид функциональных групп, например, по реакции бромирования. Важно отметить, что бромирование, наряду с предотвращением самопроизвольной сшивки олигоэфира, должно приводить к удвоению реакционных групп в боковой цепи олигоэфира.
МЕТОДИКИ ЭКСПЕРИМЕНТА
Реакцию бромирования проводили по двум методикам (А, Б). Согласно методике А в раствор 7.61 г (65.2 экв. ммоль) олигоэфирдиола АГЭ (MМ = 819) в 60 мл хлористого метилена при 0–5°С и перемешивании постепенно прикапывали раствор 4.3 мл (13.34 г, 83.5 ммоль) брома в 70 мл хлористого метилена так, чтобы температура реакционной смеси не поднималась выше 5°C. Полученный раствор перемешивали при 5°C в течение 2 ч, после чего оставляли реакционную смесь при комнатной температуре на 3 сут. После выдержки раствор промывали 4 × 25 мл 10%-м водным раствором Na2CO3 и далее 2 × 20 мл воды. Затем хлористый метилен отгоняли в вакууме. Получили 15.8 г вязкой светло-оранжевой жидкости –олиго-(2,3-дибромпропилглицидилового) эфира. Выход: 91.4%. Найдено %: C, 26.84; H, 3.90. Вычислено для C42.12H71.20Br13.04O15.04, %: C, 27.20; H, 3.86.
Времена выдержки реакции бромирования были определены ранее в ходе систематических исследований [2] в области синтеза функционализированных олигомеров при исследовании схожей реакции бромирования по двойной связи в олигоэфире сополимера аллилглицидилового эфира и эпихлоргидрина.
Во втором случае (методика Б) реакционную массу раствором соды не промывали, а проводили прямую отгонку растворителя. В раствор 6.88 г (59 экв. ммоль) олигоэфирдиола АГЭ (MМ = 856) в 60 мл дихлорэтана при перемешивании постепенно прикапывали раствор 3.9 мл (12.10 г, 75.73 ммоль) брома в 63 мл дихлорэтана так, чтобы температура реакционной смеси не поднималась выше 21°C. Полученный раствор перемешивали при 21°C в течение 2 ч, после чего оставляли реакционную смесь при комнатной температуре на 3 сут. После выдержки дихлорэтан отгоняли под вакуумом. Получили 16.13 г вязкой светло-оранжевой жидкости – олиго-(2,3-дибромпропилглицидилового) эфира. В этом случае выход продукта составил примерно 99%. Найдено, %: C, 25.96; H, 3.64; Br, 58.21. Вычислено для C44.04H75.40Br14.68O15.68, %: C, 26.08; H, 3.73; Br, 57.82.
Состав продуктов реакции определяли при помощи метода масс-спектрометрии. Данный метод в настоящее время широко используется в медико-биологических работах [3–5] и практически не применяется в работах, связанных с синтезом полимеров. Измерения проводили на приборе “AmaZon SL” (Bruker Daltonics, Германия) в положительной моде. Ионизацию проводили методом электрораспыления при падении потенциала от 4000 до 500 В. Температура осушающего газа (азот) составляла 160°С. Для накопления ионов параметр ICC (Ion Charge Control), отвечающий за максимальное число ионных зарядов в ловушке, устанавливали равным 100 000 усл. ед. Полимер растворяли в ацетонитриле (J.T. Baker, США), степень очистки – HPLC grade, с добавлением 0.1%-го раствора муравьиной кислоты (“Fluka Analytical”, Германия), степень очистки – 98%.
Исследования 1H ЯМР проводили в растворе ДМСО-d6 на спектрометре Bruker AVANCE AM300 (300.13 МГц): внутренний стандарт для ядер 1Н – квинтет остаточных протонов дейтерированного растворителя с химическим сдвигом 2.505 м. д.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
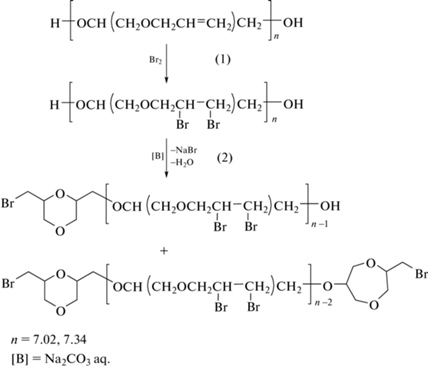
Как было отмечено ранее, для предотвращения самопроизвольной сшивки олигоэфиров по двойной связи проводилась функционализация последних реакцией бромирования полимераналогичного превращения (схема 1, реакция (1)).
На рис. 1 представлены масс-спектры олигодиола АГЭ (ММ ~ 800, полидисперсность 1.06), бромированного по методике А (методика синтеза и анализ олигодиола приведены в работе [1]). На масс-спектре было выделено и отнесено несколько серий пиков: (1) пики полностью бромированного олигодиола с атомом Na (ММ звена 274, C6O2H10Br2), m/z: 1136.7, 1410.6, 1679.5, 1955.4 (z = 1+) и (2) пики полностью бромированного олигодиола с атомом K, m/z: 435.9, 576.8, 713.7, 850.7, 988.7 (z = 2+); (3) пики с недостатком одного атома Br с атомом Na, m/z: 1328.7, 1599.6, 1873.5 (z = 1+) и (4) пики без одного атома Br с атомом K, m/z: 535.8, 673.8, 809.7 (z = 2+); (5) пики с недостатком двух атомов брома m/z: 476.9, 613.8, 750.8, 887.7, 1023.7 (z = 2+).
Рис. 1.
Масс-спектр бромированного олигоэфирдиола аллилглицидилового эфира с ММ ~ 800: (а) с зарядом (z) 2, (б) с зарядом (z) 1.

Полученные результаты можно было бы отнести к неполному бромированию олигоэфирдиола АГЭ по методике А. Однако проведенные нами исследования олигоэфиров до и после бромирования методом 1H ЯМР-спектроскопии указывали на исчерпывающее присоединение брома по двойной связи (рис. 2).
Рис. 2.
Спектры 1Н ЯМР олиго-(аллилглицидилового) эфира (a) и олиго-(2,3-дибромпропилглицидиловых) эфиров (б, в) в ДМСО-d6. (a) 3.36–3.77 (м, 5H (OCH2CH(O)CH2O)), 3.94 (д, J 5.0 Гц, 2H, OCH2CH=CH2), 5.13 (д, J 10.4 Гц, 1H, цис-HCH=CH–), 5.25 (д, J 17.2 Гц, 1H, транс‑HCH=CH–), 5.78–5.96 (м, 1H, OCH2CH=CH2). (б) Бромирование по методике А: 3.35–3.94 (м, 12H, CH2OCH2 (диоксановый/диоксипановый фрагмент), CH2Br (диоксановый/диоксипановый фрагмент), CH2O, CH2Br, OCH, OH), 4.53 (м, 1H, CHBr), 4.79 (ушир. м, 2H, BrCH2CHOCHCH2O (диоксановый/диоксипановый фрагмент)). (в) Бромирование по методике Б: 3.33–3.94 (м, 6H, CH2O, CH2Br, OCH, OH), 4.52 (м, 1H, CHBr).

Так, из данных, представленных на рис. 2, видно, что в бромированных олигомерах (рис. 2б,в) отсутствуют сигналы протонов при атомах углерода с кратной связью: двух дублетов в цис- и транс-положениях при 5.13 и 5.25 м. д. соответственно, и мультиплета от протонов группы HC= при 5.86 м. д. При этом появляется четкий мультиплет в области 4.53 м. д., характерный для группы HC–Br. Учитывая тот факт, что в случае бромированного олигомера (методика А) в ходе выделения продукта реакционную массу обрабатывали водным раствором соды, можно предположить, что за счет отщепления бромоводорода от макромолекул диола, имела место реакция циклодегидробромирования по терминальным атомам брома и гидроксильным группам, которая могла приводить к образованию по концам макромолекул диоксановых и диоксипановых циклических фрагментов (схема, реакция (2)). Примеры подобной реакции достаточно подробно описаны в литературе [6, 7].
Возможный альтернативный механизм дегидробромирования за счет элиминирования некоторых терминальных атомов брома с протонами от прилежащих к ним в β-положении углеродов исключался в виду отсутствия сигналов двух синглетов в области 5.6–5.7 м. д., принадлежащих цис- и транс- протонам образующейся в этом случае группы –(Br)C=CH2 (подробно данный пример рассмотрен в работе [7]). В то же время в пользу предположения о возможном циклообразовании говорит наличие небольшого уширенного пика в области 4.79 м. д., который можно было бы отнести к обоим CH–O-фрагментам образовавшихся циклов. В случае образования терминальных циклических фрагментов общее расчетное соотношение интенсивностей сигналов отдельно стоящих пиков при 4.79 м. д. (CH–O), 4.53 м. д. (HCBr) и 3.35–3.94 м. д. (CH2OCH2), должно быть соответственно 1 / 3/ 31. Экспериментально полученное соотношение интенсивностей сигналов пиков близко к расчетному значению и равно 1 / 3.3 / 37.4.
Данная реакция циклодегидробромирования предположительно протекает в основном с участием вторичного гидроксила (с образованием диоксанового фрагмента), доля которого в полимере растет по мере протекания реакции полимеризации [8].
Напротив, в случае бромированного олигомера по методике Б, где проводили прямую отгонку растворителя без обработки реакционной массы оснóвными агентами, пик при 4.79 м. д. отсутствует. В дополнение к результатам ЯМР-исследований полученные данные элементного анализа олигомера, бромированного по методике Б, также вполне определенно подтверждают исчерпывающее присоединение брома по кратным связям и отсутствие отщепления HBr от олигомера. Согласно данным элементного анализа получены следующие значения содержания элементов (%): Br, 58.21; H, 3.64; C, 25.96, близкими к их расчетным значениям (%): 57.82, 3.73, 26.08 соответственно. Об этом же свидетельствуют и данные по значениям выхода бромированного продукта: в первом случае это – 91.4%, что может быть связано с отщеплением HBr, а во втором – 99%.
Таким образом, можно констатировать, что в случае отсутствия обработки бромированного олигомера оснóвными реагентами процесс дегидробромирования не идет и синтез завершается на стадии реакции (1) (схема 1).
ВЫВОДЫ
Определены условия полного бромирования олигодиола аллилглицидилового эфира с сохранением функциональности по ОН-группам.
Получены олигоэфирдиолы с существенным ростом функциональных групп внутри молекулы за счет замены одной реакционной аллильной группы в боковой цепи олигомера на два реакционно-активных атома брома.
Показано, что в случае обработки бромированного олигоэфирдиола оснóвными реагентами в продукте идентифицируются молекулы моно-ола и молекулы, не содержащие ОН-групп. Предположено, что их образование происходит по реакции дегидробромирования за счет отщепления одной или двух молекул бромоводорода от олигоэфирдиола с образованием в них диоксановых и диоксипановых циклических фрагментов.
Список литературы
Гриневич Т.В., Придатченко М.Л., Щеголихин А.Н. // Хим. физика. 2021. Т. 40. № 12. С. 72–75. https://doi.org/10.31857/S0207401X21120050
Гриневич Т.В., Соловьянов А.А., Виноградов Д.Б., Булатов П.В., Тартаковский В.А., Берлин А.А. // Боеприпасы и спецхимия. 2020. № 2. С. 5–9.
Nusinow D.P., Szpyt J., Ghandi M., Rose C.M., McDo-nald E.R., Kalocsay M., Jane-Valbuena J., Gelfand E., Schweppe D.K., Jedrychowski M., Golji J., Porter D.A., Rejtar T., Wang Y.K., Kryukov G.V., Stegmeier F., Erickson B.K., Garraway L.A., Levi A., Sellers W.R., Gy-gil S.P. // Cell. 2020. V. 180. № 2. P. 387–402. https://doi.org/10.1016/j.cell.2019.12.023
Lundberg E., Borner G.H.H. // Nat. Rev. Mol. Cell Biol. 2019. V. 20. № 5. P. 285–302. https://doi.org/10.1038/s41580-018-0094-y
Gingras A.C., Abe K.T., Raught B. // Cur.Opin. Chem. Biol. 2019. V. 48. P. 44–54. https://doi.org/10.1016/j.cbpa.2018.10.017
Цивунин В.С., Зарипова В.Г., Бикулова В.Ж., Зыкова В.В., Капустина И.В. // Ж. орг. химии. 1983. Т. 19. № 3. С. 660–661.
Булатов П.В., Ермаков А.С., Тартаковский В.А. // Изв. АН. Сер. хим.1999. № 12. С. 2324–2326.
Гриневич Т.В., Коровина Г.В., Таганов Н.Г., Соловьянов А.А. // Доклады АН. 1998. Т. 362. № 3. С. 353–356.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах