Доклады Российской академии наук. Химия, науки о материалах , 2022, T. 505, № 1, стр. 104-110
Катализаторы низкотемпературного окисления СО на основе платины, CеO2 и углеродных нанотрубок
Л. С. Кибис 1, А. Н. Коробова 1, А. В. Задесенец 2, А. В. Романенко 1, Т. Ю. Кардаш 1, О. А. Стонкус 1, С. В. Коренев 2, О. Ю. Подъячева 1, Е. М. Славинская 1, А. И. Боронин 1, *
1 Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова
Сибирского отделения Российской академии наук”
630090 Новосибирск, Россия
2 Федеральное государственное бюджетное
учреждение науки Институт неорганической химии
им. А.В. Николаева Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
* E-mail: boronin@catalysis.ru
Поступила в редакцию 22.06.2022
После доработки 05.08.2022
Принята к публикации 19.08.2022
- EDN: ZDTMZB
- DOI: 10.31857/S2686953522700108
Аннотация
В работе были изучены нанокомпозитные катализаторы на основе высокодисперсных частиц платины и оксида церия, закрепленных на поверхности углеродных нанотрубок. Композиты были получены с использованием комплексов (Ме4N)2[Pt2(μ-OH)2(NO3)8] в качестве предшественника платины. Подобный метод синтеза способствовал закреплению наночастиц, кластеров и одиночных атомов/ионов платины на поверхности как оксида церия, так и углеродного материала. Исследование каталитической активности образцов показало, что высокодисперсные металлические формы платины, стабилизированные непосредственно на поверхности углеродных нанотрубок, способствуют эффективному окислению СО при его низких концентрациях в реакционной смеси при комнатной температуре, в том числе в присутствии паров воды. Для протекания реакции низкотемпературного окисления СО при более высоких концентрациях оксида углерода в реакционной смеси необходимо формирование новых активных центров за счет взаимодействия ионов платины с частицами оксида церия.
ВВЕДЕНИЕ
Системы на основе Pt/CeO2 известны своей высокой активностью в различных окислительных реакциях, имеющих большое практическое значение [1–3]. Дискуссии о наиболее активных состояниях платины, ответственных за протекание каталитических реакций, в первую очередь в области низких температур, продолжаются до сих пор [4]. С точки зрения оптимального использования дорогостоящего благородного металла наиболее важны системы с минимальным содержанием активного компонента (АК). В этом отношении катализаторы, содержащие изолированные атомы/ионы платины, представляют первостепенный интерес. Однако во многих работах показано, что металлические [5, 6] или окисленные кластеры и наночастицы платины [7, 8] могут быть более активными в реакциях окисления, чем одиночные изолированные центры. С практической точки зрения также остается актуальным вопрос о том, какое влияние оказывает присутствие паров воды в реакционной смеси на каталитические свойства системы и механизм протекания реакций окисления [9, 10]. Таким образом, для установления природы активности катализаторов Pt–CeO2 в реакциях окисления необходимо дальнейшее проведение фундаментальных исследований на модельных системах, содержащих активный компонент в высокодисперсном состоянии.
Известно, что за счет наличия поверхностных групп и дефектов наноструктурированные углеродные материалы могут выступать как носители, стабилизирующие дисперсные формы активных компонентов [11–13]. Ранее при исследовании Pd–CeO2 композиций, нанесенных на многостенные углеродные нанотрубки (Pd–CeO2 / МУНТ), нами было показано, что даже при высокой загрузке активного компонента размер частиц палладия и оксида церия, закрепленных на углеродном носителе, не превышает 2–3 нм [14]. Этот результат дает основания полагать, что при переходе к платина-содержащей системе также может быть достигнута высокая дисперсность АК.
В данной работе были синтезированы Pt-CeO2 / МУНТ-композиты, и исследована их активность в реакции низкотемпературного (ниже 100°С) окисления СО, в том числе в присутствии паров воды в реакционной смеси. Результаты были сопоставлены с образцами сравнения: Pt / МУНТ, не содержащим оксид церия; и Pt / CeO2, не содержащим углеродные наноматериалы. Применение комплекса физико-химических методов исследования позволило определить структуры, ответственные за каталитическую активность образцов в области низких температур, а также за окисление СО во влажной атмосфере.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез МУНТ и катализаторов. МУНТ получали разложением этилена в проточном реакторе на катализаторе состава 62 вес. % Fe–8 вес. % Ni–30 вес. % Al2O3 при 700°С. Катализатор роста удаляли обработкой полученных МУНТ в азотной кислоте. Детали методики синтеза МУНТ приведены в работе [15].
Для получения Pt–CeО2 / МУНТ- и Pt / МУНТ-композитов использовали биядерный нитратный комплекс состава (Me4N)2[Pt2(µ-OH)2(NO3)8], полученный из H2PtCl6 · nH2O по методике, приведенной в работах Д.Б. Васильченко и соавт. [16, 17]. Для приготовления Pt–CeО2 / МУНТ катализатора (6 вес. % Pt, 20 вес. % СеО2) навески (Me4N)2[Pt2(µ-OH)2(NO3)8] и (NH4)2[Ce(NO3)6] растворяли в ацетоне с последующим добавлением в полученный раствор МУНТ. Взвесь обрабатывали в ультразвуковой бане и оставляли на 12 ч в плотно закрытой емкости. Растворитель удаляли упариванием до исчезновения видимых следов жидкости, а затем в сушильном шкафу при 55°С. Сухой остаток нагревали в атмосфере гелия до 350°С со скоростью 2°С мин–1 и выдерживали при этой температуре 30 мин. Образец Pt / МУНТ (6 вес. % Pt) готовили аналогичным образом. Далее образцы обозначены как Pt–Ce–C и Pt–C соответственно. Удельная площадь поверхности образцов (SБЭТ) составила 165 и 152 м2 г‑1 соответственно.
Образец сравнения Pt / CeO2 (5 вес. % Pt, обозначен как Pt–Ce) получали пропиткой по влагоемкости свежеприготовленного оксида церия водным раствором Pt(NO3)4. Итоговый образец Pt–Ce прокаливали на воздухе при 450°С в течение 4 ч. Оксид церия готовили осаждением раствора Ce(NO3)3 водным раствором аммиака с последующими сушкой и прокаливанием при 450°С в течение 4 ч. Для образца Pt–Ce удельная площадь поверхности составила SБЭТ = 122 м2 г–1.
Исследование катализаторов физико-химическими методами. Дифрактограммы получены на дифрактометре STOE STADI MP (Германия) с использованием MoKα1-излучения (λ = 0.70926 Å) и детектора DECTRIS MYTHEN. Для формирования первичного пучка применялся изогнутый Ge (111) монохроматор. Сканирование проводилось в интервале углов 2θ = 5–40°.
Данные рентгеновской фотоэлектронной спектроскопии (РФЭС) получены на спектрометре ES300 (KRATOS Analytical, Великобритания) с использованием рентгеновского излучения MgKα (hν = 1253.6 эВ). В качестве внутреннего стандарта для калибровки энергетической шкалы спектров использовалась линия углерода C1s с энергией связи 284.4 эВ, характерной для углерода в составе МУНТ.
Исследование методом просвечивающей электронной микроскопии (ПЭМ) выполнено на микроскопе Thermo Fisher Scientific Themis Z (Нидерланды) с двухкорректорной системой регуляции астигматизма при ускоряющем напряжении 200 кВ. Локальный элементный анализ был выполнен с помощью метода энергодисперсионной рентгеновской спектроскопии с использованием детектора Super-X EDX (Thermo Fisher Scientific). Темнопольные фотографии получены при помощи сканирующего трансмиссионного электронного микроскопа (СПЭМ, англ. Scanning Transmission Electron Microscope, STEM) с использованием HAADF (High-Angle Annular Dark-Field) детектора.
Изучение каталитической активности. Исследование проводили на установке с проточным реактором с анализом состава газовой смеси квадрупольным масс-спектрометром RGA 200 (SRS). Эксперименты проводили в режиме температурно-программируемой реакции СО + О2 (ТПР-СО+О2) в ходе линейного нагрева со скоростью 10°С мин–1. Исходная смесь, содержащая 0.2 об. % СО, 1 об. % О2, 0.5 об. % Ne, гелий – баланс, подавалась в реактор, предварительно охлажденный до –40°С, со скоростью 1000 см3 мин–1. Эксперименты ТПР-СО+О2 включали три цикла нагрева образцов до 350°С с промежуточным охлаждением в реакционной смеси. В настоящей статье приведены данные ТПР-СО+О2, полученные в ходе третьего нагрева. Навески образцов составляли по 0.1 г, а размер гранул катализаторов – 0.25–0.5 мм (Pt–Ce) и 0.1–0.14 мм (Pt–Ce–С и Pt–C). Эксперименты в изотермическом режиме проводили при температуре 20°С; состав исходной реакционной смеси: 100 м. д. CO, 5 об. % О2, 0.5 об. % Ne, 0 или 2.8 об. % H2O (что соответствовало 100% влажности при 20°С) и скорости реакционной смеси 100 см3 мин–1. Скорость реакции рассчитывали по формуле:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Зависимости конверсии СО от температуры для образцов Pt–Ce–C, Pt–C и Pt–Ce приведены на рис. 1а.
Рис. 1.
(а) Зависимости конверсии СО от температуры при проведении экспериментов в режиме ТПР-СО+О2 для катализаторов Pt–Ce–C, Pt–C и Pt–Ce; (б) рассчитанные зависимости скоростей реакции от температуры в Аррениусовских координатах.

Образец Pt–Ce–C демонстрирует активность в реакции окисления СО в области температур ниже 100°С. Температура 50% конверсии СО (Т50) составляет 110°С. Образец Pt–Ce также демонстрирует конверсию СО уже при температурах выше 30°С. Для образца Pt–C кривая конверсии СО смещается в область более высоких температур, а Т50 возрастает до 140°С. Для более детального сопоставления активности катализаторов были рассчитаны скорости реакции при температурах 40 и 75°С, а также энергии активации реакции (Еа) (рис. 1б). Полученные данные приведены в табл. 1. Скорость реакции увеличивается в ряду Pt–C → Pt–Ce–C → Pt–Ce при обеих температурах.
Таблица 1.
Значение скоростей реакции W при 40 и 75°C, а также величины энергии активации для образцов Pt–Ce–C, Pt–C, Pt–Ce
| Образец | W, ммоль CO/моль Pt × с | Ea, ккал моль–1 | |
|---|---|---|---|
| 40°C | 75°C | ||
| Pt–C | 0.4 | 2.1 | 9.4 ± 0.5 |
| Pt–Ce–C | 1.1 | 5.3 | 9.9 ± 0.5 |
| Pt–Ce | 3.9 | 9.3 | 5.4 ± 0.5 |
Дифрактограммы изученных образцов приведены на рис. 2а.
Рис. 2.
(а) Дифрактограммы для образцов МУНТ, Pt–C, Pt–Ce–C и Pt–Ce. Рефлексы, соответствующие фазе CeO2, обозначены (*); (б) рентгеновские фотоэлектронные спектры Pt4f для катализаторов Pt–C, Pt–Ce–C и Pt–Ce. Спектры приведены после нормирования на интегральную интенсивность спектра Ce3d.
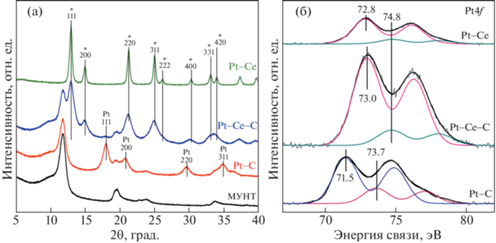
Дифрактограмма катализатора Pt–C, помимо рефлексов, соответствующих рассеянию от углеродного носителя, содержит дополнительные широкие рефлексы металлической платины (ICDD PDF-2 #00-004-0802) (рис. 2а). Для образца Pt–Ce–C наблюдаются рефлексы фаз МУНТ и CeO2 (ICDD PDF-2 #00-034-0394). Также на дифрактограмме образца Pt–Ce–C можно отметить наличие широкого малоинтенсивного максимума на месте рефлекса 111 металлической платины, что может свидетельствовать о присутствии небольшого количества этой фазы в образце. На дифрактограмме образца Pt–Ce присутствуют только пики, относящиеся к фазе диоксида церия.
Для оценки размеров областей когерентного рассеяния (ОКР) и параметра микроискажений фаз CeO2 и Pt было проведено полнопрофильное моделирование методом Ритвельда (табл. 2). Можно видеть, что использование МУНТ в качестве носителя приводит к формированию дисперсных частиц платины и оксида церия с размером ОКР порядка 2–3 нм и высоким параметром микронапряжений, свидетельствующим о высокой дефектности образующихся частиц.
Таблица 2.
Размер ОКР (D) и микронапряжения (Δd/d, d – межплоскостное расстояние) фаз CeO2 и Pt для катализаторов. В скобках приведено среднее квадратичное отклонение полученного значения
| Образец | CeO2 | Pt | ||
|---|---|---|---|---|
| D, нм | Δd/d | D, нм | Δd/d | |
| Pt–C | – | – | 2.8(2) | 0.19(3) |
| Pt–Ce–C | 3.2(1) | 0.22(3) | ≈2 | – |
| Pt–Ce | 12(1) | 0.093(2) | – | – |
Зарядовое состояние платины на поверхности катализаторов изучено методом рентгеновской фотоэлектронной спектроскопии. Спектр Pt4 f-образца Pt–C (см. рис. 2б) содержит основной дублет с энергией связи Есв(Pt4 f7/2) = 71.5 эВ, относящийся к дисперсным металлическим частицам платины [18]. В спектре также присутствует дублет с Есв(Pt4 f7/2) = 73.8 эВ, соответствующий окисленным формам платины Pt4+ [19, 20]. Для образца Pt–Ce–C наблюдается состояние с Есв(Pt4 f7/2) = = 73.0 эВ, которое может быть отнесено к одиночным ионным формам Pt2+, стабилизированным на поверхности СеО2 в плоско-квадратном окружении [21]. Дублет с Есв(Pt4 f7/2) = 74.8 эВ соответствует состоянию платины Pt4+ [22]. Спектр Pt4 f образца Pt–Ce также указывает на два состояния платины с Есв(Pt4 f7/2) 72.8 и 74.8 эВ, соответствующие формам Pt2+ и Pt4+. Ранее аналогичные состояния платины были зарегистрированы при изучении катализаторов Pt / CeO2, полученных с использованием (Me4N)2[Pt2(µ-OH)2(NO3)8] в качестве предшественника платины [17]. Таким образом, данные метода РФЭС показывают, что в случае образцов Pt–Ce–C и Pt–Ce платина находится в окисленном состоянии вследствие взаимодействия платины с оксидом церия. В образце Pt–C основным является металлическое состояние платины, однако определенная доля окисленных форм Pt4+ (~25%) также присутствует. Более низкая интенсивность линии Pt4f для образца Pt–C относительно Pt–Ce–C связана с формированием более крупных металлических частиц платины.
По данным ПЭМ использование углеродных материалов в качестве носителя способствует стабилизации платины и оксида церия в высокодисперсном состоянии. На поверхности МУНТ наблюдаются как одиночные наночастицы, так и небольшие агломераты наночастиц размером не более 30 нм (рис. 3а,б).
Рис. 3.
Катализатор Pt–Cе–C: (а) ПЭМ-снимок; (б) ПЭМВР-снимок и EDX-картирование отмеченного прямоугольником участка; (в) HAADF-STEM-снимок. Желтые стрелки указывают на наночастицы платины; желтыми кругами обведены единичные атомы платины в структуре CeO2; красными кругами – единичные атомы Pt и Ce; зеленая стрелка указывает на наночастицу СеО2 размером до 4 нм.

Анализ межплоскостных расстояний, а также данные EDX-картирования, указывают на то, что агломераты включают в себя наночастицы CeO2 размером 2–10 нм и наночастицы металлической платины размером 1–4 нм. Единичные наночастицы, локализующиеся на поверхности МУНТ и не входящие в состав агломератов, имеют меньший размер. Одиночные наночастицы CeO2 имеют размер не более 4 нм, но число таких частиц невелико (одна из таких частиц отмечена зеленой стрелкой на рис. 3б). Бóльшая часть одиночных наночастиц на поверхности МУНТ имеет размер 1–2 нм. EDX-анализ показал присутствие платины в их составе, а межплоскостные расстояния соответствуют металлической платине. Поскольку данные РФЭС показывают наличие только окисленных форм платины, нельзя исключить, что формирование металлических частиц Pt происходит под воздействием электронного пучка [8].
Исследование катализатора в режиме HAADF-STEM позволило установить присутствие на поверхности МУНТ одиночных атомов и субнаноразмерных скоплений атомов (рис. 3в). Вследствие неоднородности контраста углеродного материала затруднительно однозначно определить, к какому элементу (Pt или Ce) относятся наблюдаемые одиночные атомы. Вероятнее всего, на поверхности МУНТ присутствуют оба типа атомов. Также на данном снимке виден агломерат наночастиц Pt и CeO2. Неоднородность изображения периодической решетки CeO2 свидетельствует о присутствии атомов платины (яркие точки, обведенные желтыми кругами на рис. 3в) в структуре частиц СеО2.
Таким образом, данные ПЭМ подтверждают формирование высокодисперсных форм активных компонентов (наночастиц, кластеров и одиночных атомов/ионов) при их закреплении на поверхности МУНТ. При этом для образца Pt–Ce–C стабилизация дисперсных форм платины происходит как на поверхности МУНТ, так и на оксиде церия.
На рис. 4 показаны зависимости конверсии СО от времени при проведении стационарных каталитических экспериментов в смесях СО + О2 и СО + О2 + Н2О при температуре 20°С.
Рис. 4.
Конверсия СО в изотермическом режиме при температуре 20°С в присутствии и в отсутствие воды в реакционной смеси для катализаторов (а) Pt–Ce–C, (б) Pt–C, (в) Pt–Ce. Время “0 мин” соответствует моменту времени подачи реакционной смеси в реактор.

Все образцы демонстрировали высокую активность и хорошую стабильность каталитических характеристик в сухой смеси с сохранением конверсии СО на уровне выше 70%. При проведении реакции окисления СО во влажной атмосфере каталитические свойства образцов значительно отличались. Так, для образцов на основе МУНТ (Pt–C и Pt–Ce–C) добавление паров воды в реакционную смесь практически не оказывало влияния на величину конверсии СО. Однако активность “безуглеродного” образца Pt–Ce в присутствии паров воды резко снижалась: падение конверсии СО практически до нуля происходило в течение первых 25 мин эксперимента.
Отсутствие активности катализатора Pt–Ce и высокая активность катализатора Pt–C в присутствии паров воды позволяют заключить, что устойчивость образца Pt–Ce–C во влажной реакционной смеси обусловлена теми формами платины, которые локализованы не на частицах оксида церия, а стабилизированы непосредственно на носителе – МУНТ.
Наблюдаемые отличия в каталитической активности образцов различного состава могут быть связаны с влиянием СеО2 на состояние платины. Высокодисперсные частицы платины, стабилизированные на поверхности МУНТ, находятся, в основном, в металлическом состоянии; а в присутствии оксида церия платина переходит в ионное состояние за счет сильного контактного взаимодействия с СеО2 (см. рис. 2б). Отличия в природе активных центров катализаторов Pt–C и Pt–Ce приводят к реализации разных механизмов реакции окисления СО. Для катализаторов, содержащих ионные состояния платины, характерен механизм Марса–ван Кревелена [23]. Решеточный кислород СеО2 способствует эффективному реокислению (регенерации) высокодисперсных ионных форм платины, обеспечивая высокие значения каталитических характеристик образцов (см. рис. 1). Однако в присутствии паров воды, как видно из данных на рис. 4, ионные состояния платины не обеспечивают стабильное функционирование катализатора. На металлических частицах платины, наиболее вероятно, реализуется механизм Лэнгмюра–Хиншельвуда [24], подразумевающий активацию обоих реагентов на поверхности Pt0. Поскольку теплота и скорость адсорбции СО на металлических частицах выше, чем кислорода О2, то при низких температурах происходит так называемое “отравление” поверхности молекулами СО, для преодоления которого необходимо повышение температуры или относительной концентрации кислорода в реакционной смеси [24]. По-видимому, вследствие подобного “отравления” поверхности конверсия СО для катализатора Pt–C наблюдалась при более высоких температурах в сравнении с образцами Pt–Ce–C и Pt–Ce (рис. 1а). Однако, при повышении относительной концентрации кислорода в реакционной смеси, а также с увеличением времени контакта в 10 раз, происходило значительное увеличение конверсии СО при низких температурах (рис. 4б). Введение в реакционную смесь паров воды практически не влияло на изменение скорости химической реакции. Фактически это означает, что адсорбция Н2О не ингибирует адсорбцию СО и О2, по-видимому, вследствие низкой теплоты адсорбции Н2О на высокодисперсных металлических частицах платины.
ЗАКЛЮЧЕНИЕ
В работе показано, что использование многостенных углеродных нанотрубок в качестве носителя способствует закреплению активных компонентов – платины и оксида церия в высокодисперсном состоянии. Центрами стабилизации частиц платины могут выступать как оксид церия, так и углеродные нанотрубки. Активность образцов Pt–CeO2 / МУНТ и Pt / МУНТ была изучена в реакции окисления СО в сухой смеси и в присутствии паров воды, а также была сопоставлена с образцом сравнения – Pt / CеО2.
Наличие взаимодействия платина–оксид церия приводит к стабилизации ионных состояний платины, демонстрирующих активность в реакции окисления СО в области температур ниже 100°С при высоких концентрациях СО. Однако активность катализатора Pt / CeO2 резко снижается при добавлении паров воды в реакционную смесь. Высокодисперсные металлические частицы платины, стабилизированные на углеродном носителе, в свою очередь, позволяют осуществлять превращение небольших количеств моно- оксида углерода в присутствии паров воды при комнатной температуре практически со 100% эффективностью. Таким образом, композиты Pt–CeO2 / МУНТ, содержащие как ионные, так и высокодисперсные металлические формы платины, позволяют обеспечить как низкотемпературную активность в реакции окисления СО, так и ее сохранение в присутствии паров воды.
Список литературы
Liu K., Wang A., Zhang T. // ACS Catal. 2012. V. 2. № 6. P. 1165–1178. https://doi.org/10.1021/cs200418w
Pierre D., Deng W., Flytzani-Stephanopoulos M. // Top. Catal. 2007. V. 46. P. 363–373. https://doi.org/10.1007/s11244-007-9013-8
Rood S., Eslava S., Manigrasso A., Bannister S. // Proc. Inst. Mech. Eng. Part D: J. Automob. Eng. 2020. V. 234. № 4. P. 936–949. https://doi.org/10.1177/0954407019859822
Borges L.R., da Silva A.G.M., Braga A.H., Rossi L.M., Suller Garcia M.A., Vidinha P. // ChemCatChem. 2021. V. 13. № 5. P. 1340–1354. https://doi.org/10.1002/cctc.202001621
Gatla S., Aubert D., Agostini G., Mathon O., Pascarelli S., Lunkenbein T., Willinger M.G., Kaper H. // ACS Catal. 2016. V. 6. № 9. P. 6151–6155. https://doi.org/10.1021/acscatal.6b00677
Gänzler A.M., Casapu M., Vernoux P., Loridant S., Cadete Santos Aires F.J., Epicier T., Betz B., Hoyer R., Grunwaldt J.-D. // Angew. Chem. In. Ed. 2017. V. 56. № 42. P. 13078–13082. https://doi.org/10.1002/anie.201707842
Wang H., Liu J.-X., Allard L.F., Lee S., Liu J., Li H., Wang J., Wang J., Oh S.H., Li W., Flytzani-Stephanopoulos M., Shen M., Goldsmith B.R., Yang M. // Nat. Commun. 2019. V. 10. Article 3808. https://doi.org/10.1038/s41467-019-11856-9
Boronin A.I., Slavinskaya E.M., Figueroba A., Stadnichenko A.I., Kardash T.Yu., Stonkus O.A., Fedorova E.A., Muravev V.V., Svetlichnyi V.A., Bruix A., Neyman K.M. // Appl. Catal., B. 2021. V.286. P. 119931. https://doi.org/10.1016/j.apcatb.2021.119931
Meunier F.C., Cardenas L., Kaper H., Šmíd B., Vorokhta M., Grosjean R., Aubert D., Dembélé K., Lunkenbein T. // Angew. Chem., In. Ed. 2021. V. 60. № 7. P. 3799–3805. https://doi.org/10.1002/anie.202013223
Ning X., Li Y., Dong B., Wang H., Yu H., Peng F., Yang Y. // J. Catal. 2017. V. 348. P. 100–109. https://doi.org/10.1016/j.jcat.2017.02.011
Kochubey D.I., Chesnokov V.V., Malykhin S.E. // Carbon. 2012. V. 50. № 8. P. 2782–2787. https://doi.org/10.1016/j.carbon.2012.02.040
Melchionna M., Marchesan S., Prato M., Fornasiero P. // Catal. Sci. Technol. 2015. V. 5. № 8. P. 3859–3875. https://doi.org/10.1039/c5cy00651a
Bulushev D.A., Zacharska M., Lisitsyn A.S., Podyache-va O.Yu., Hage F.S., Ramasse Q.M., Bangert U., Bulusheva L.G. // ACS Catal. 2016. V. 6. № 6. P. 3442–3451. https://doi.org/10.1021/acscatal.6b00476
Kibis L.S., Korobova A.N., Fedorova E.A., Kardash T.Yu., Zadesenets A.V., Korenev S.V., Stonkus O.A., Slavin-skaya E.M., Podyacheva O.Yu., Boronin A.I. // J. Struct. Chem. 2022. V. 63. № 3. P. 407–422. https://doi.org/10.1134/S0022476622030076
Podyacheva O.Yu., Suboch A.N., Yashnik S.A., Salni-kov A.V., Cherepanova S.V., Kibis L.S., Simenyuk G.Y., Romanenko A.I., Ismagilov Z.R. // J. Struct. Chem. 2021. V. 62. № 5. P. 771–781. https://doi.org/10.1134/S0022476621050139
Vasilchenko D., Tkachev S., Baidina I., Korenev S. // Inorg. Chem. 2013. V. 52. № 18. P. 10532–10541. https://doi.org/10.1021/ic401499j
Vasilchenko D., Topchiyan P., Berdyugin S., Filatov E., Tkachev S., Baidina I., Komarov V., Slavinskaya E., Stadnichenko A., Gerasimov E. // Inorg. Chem. 2019. V. 58. № 9. P. 6075–6087. https://doi.org/10.1021/acs.inorgchem.9b00370
Mason M.G. // Phys. Rev. B. 1983. V. 27. № 2. P. 748–762. https://doi.org/10.1103/PhysRevB.27.748
Tian Z.Q., Jiang S.P., Liang Y.M., Shen P.K. // J. Phys. Chem. B. 2006. V. 110. № 11. P. 5343–5350. https://doi.org/10.1021/jp056401o
Ono L.K., Yuan B., Heinrich H., Roldan Cuenya B. // J. Phys. Chem. C. 2010. V. 114. № 50. P. 22119–22133. https://doi.org/10.1021/jp1086703
Vorokhta M., Khalakhan I., Matolínová I., Nováková J., Haviar S., Lančok J., Novotný M., Yoshikawa H., Matolín V. // Appl. Surf. Sci. 2017. V. 396. P. 278–283. https://doi.org/10.1016/j.apsusc.2016.10.119
Matolín V., Matolínová I., Václavů M., Khalakhan I., Vorokhta M., Fiala R., Piš I., Sofer Z., Poltierová-Vejpravová J., Mori T., Potin V., Yoshikawa H., Ueda S., Kobayashi K. // Langmuir. 2010. V. 26. № 15. P. 12824–12831. https://doi.org/10.1021/la100399t
Nie L., Mei D., Xiong H., Peng B., Ren Z., Hernan-dez X.I.P., DeLaRiva A., Wang M., Engelhard M.H., Kovarik L., Datye A.K., Wang Y. // Science. 2017. V. 358. № 6369. P. 1419–1423. https://doi.org/10.1126/science.aao2109
van Spronsen M.A., Frenken J.W.M., Groot I.M.N. // Chem. Soc. Rev. 2017. V. 46. № 14. P. 4347–4374. https://doi.org/10.1039/C7CS00045F
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


