Доклады Российской академии наук. Науки о Земле, 2020, T. 490, № 1, стр. 55-60
Карбонатный биологический насос в норвежском и баренцевом морях: механизмы регуляции
Л. А. Паутова 1, В. А. Силкин 2, М. Д. Кравчишина 1, *, А. Л. Чульцова 3, академик РАН А. П. Лисицын 1
1 Институт океанологии им. П.П. Ширшова Российской Академии наук
Москва, Россия
2 Институт океанологии им. П.П. Ширшова
Российской Академии наук
Южное отделение, Геленджик, Россия
3 Институт океанологии им. П.П. Ширшова
Российской Академии наук
Северо-Западное отделение, Архангельск, Россия
* E-mail: kravchishina@ocean.ru
Поступила в редакцию 30.04.2019
После доработки 25.06.2019
Принята к публикации 20.07.2019
Аннотация
Проведены исследования фитопланктонного звена карбонатного насоса в Норвежском и Баренцевом морях в июле–августе 2017 г. Уникальная группа фитопланктона – кокколитофориды, является важным поставщиком кальцита в донные осадки. В изученных морях кокколитофориды были представлены двумя видами: Emiliania huxleyi и Coccolithus pelagicus. Массовое развитие C. pelagicus в Баренцевом море зафиксировано авторами впервые. Оценен вклад этих видов в продукцию кальцита и выявлены основные факторы среды, определяющие максимальный уровень их развития. Полученные данные дают возможность предсказывать распространение этих видов и, как следствие, выявлять особенности функционирования карбонатного насоса.
Одним из механизмов, регулирующих концентрацию углекислого газа в атмосфере, является биологический карбонатный насос – утилизация растворенного неорганического углерода и его отложение в форме кальцита в донных осадках: ${\text{C}}{{{\text{a}}}^{{2 + }}} + 2{\text{HCO}}_{3}^{ - }$ $ \rightleftarrows $ ${\text{CaC}}{{{\text{O}}}_{3}}{\kern 1pt} \downarrow + \;{{{\text{H}}}_{2}}{\text{O}} + {\text{C}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow $. Около половины всего кальцита в океане производится группой морского фитопланктона – кокколитофоридами, клетки которых образуют кальцитные оболочки [4]. Массовым видом, формирующим цветения в пелагиали океана, является Emiliania huxleyi – главный поставщик кальцита в донные осадки [8]. Исследования последних лет [5] показали, что и другой вид – Coccolithus pelagicus, может образовывать массовые скопления в высокоширотной Северной Атлантике. Благодаря более крупным размерам клеток содержание кальцита в оболочке C. pelagicus в 30–40 раз выше, чем в оболочке E. huxleyi. Поэтому роль C. pelagicus в карбонатном насосе может быть сравнима или даже превосходить роль E. huxleyi. Предполагается, что кроме условий освещенности, основным регулятором численности этих видов является температура воды (T). У холодолюбивого вида C. pelagicus интенсивный рост начинается при T на ~2°C ниже по сравнению с E. huxleyi [10].
Регулярные спутниковые наблюдения свидетельствуют о ежегодных летних цветениях E. huxleyi в юго-западной части Баренцева моря с конца июня до начала сентября [1, 7]. Массовое развитие C. pelagicus в Баренцевом море мы зафиксировали впервые в августе 2017 г. Представлялось важным оценить вклад этих видов в продукцию кальцита и выявить основные факторы среды, определяющие максимальный уровень их развития. Впервые в качестве возможного механизма регуляции роста E. huxleyi и C. pelagicus рассматривается концентрация основных элементов минерального питания: азот (Nмин), фосфор (Pмин), кремний (Si).
Исследования выполнялись в 68-м рейсе НИС “Академик Мстислав Келдыш” летом 2017 г. в Норвежском море (19–23 июля) и в Баренцевом море (23 июля – 18 августа). Отбор проб проводили зондирующим комплексом SBE 9p с CTD-зондом SBE 9+ (рис. 1). Изучены 134 пробы фитопланктона на 38 станциях из верхнего слоя (0–50 м) воды в пределах фотической зоны. Фиксатор – формалин с конечной концентрацией 0.5–1%. Определение видов и подсчет клеток проводили на световом микроскопе “Эргавал” (Карл Цейс) в водном препарате при увеличении 16 × 20 и 16 × 40. Средний диаметр клетки C. pelagicus считали равным 14 мкм, E. huxleyi для норвежской популяции – 5 мкм и для баренцевоморской – 7 мкм. За уровень цветения E. huxleyi принимали численность 106 кл/л. Номенклатура дана по [14, 15]. Содержание кальцита в клетках рассчитывали по [5]. Концентрации растворенных Si, Pмин и Nмин определяли по стандартным методикам (~500 проб, 67 станций) [2]. Для анализа данных применяли t-критерий Стьюдента (t-test) для уровня значимости 5%.
Рис. 1.
Положение станций отбора проб фитопланктона и вклад видов E. huxleyi и C. pelagicus в производство кальцита (циклограммы) в Норвежском и Баренцевом морях в июле–августе 2017 г. Стрелками показаны основные направления течений. 1 – доля видов кокколитофорид, %: E. huxleyi показана черным цветом, C. pelagicus – белым цветом; 2 – теплая атлантическая вода; 3 – холодная арктическая вода; 4 – теплое прибрежное Норвежское течение. Для построения карты использована батиметрия GEBCO.
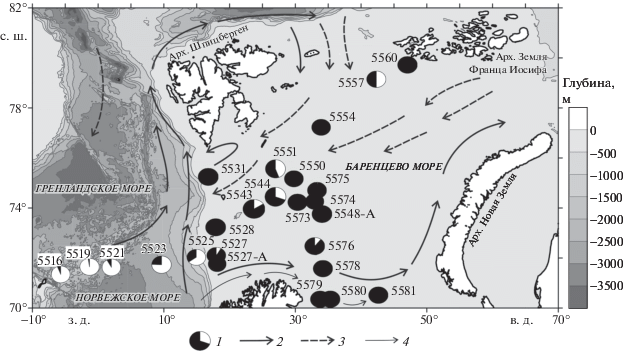
Фитопланктон изученных морей, по нашим данным, находился на поздних стадиях летней сукцессии с доминированием кокколитофориды E. huxleyi, что типично для современных планктонных фитоценов субарктических морей [1, 7]. Этот вид был абсолютным доминантом в Баренцевом море (табл. 1). Численность C. pelagicus по сравнению с E. huxleyi была не высока, но благодаря крупным размерам клеток его вклад в биомассу кокколитофорид в Норвежском море превышал 90%.
Таблица 1.
Численность E. huxleyi и C. pelagicus и содержание кальцита в зависимости от факторов среды в Баренцевом (Б) и Норвежском (Н) морях в июле–августе 2017 г.
| Номер станции | Море | Дата/время GMT | Координаты, град. | Горизонт, м | Численность, кл/л | Nмин, мМ | Pмин, мМ | N:P | T, °С | S, епс | Кальцит, ×10–3 моль CaCO3/м3 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Широта | Долгота | |||||||||||
| Emiliania huxleyi | ||||||||||||
| 5576 | Б | 14.08/06:10 | 72.4642 | 32.0020 | 5 | 6.6 × 106 | 0.81 | 0.12 | 6.75 | 9.31 | 34.5 | 1.98 |
| 5577 | Б | 14.08/11:15 | 72.2065 | 33.0162 | 5 | 4.1 × 106 | 1.22 | 0.04 | 30.5 | 9.31 | 34.6 | 1.23 |
| 5578 | Б | 14.08/17:10 | 71.5678 | 34.0003 | 5 | 3.2 × 106 | 1.35 | 0.05 | 2.70 | 9.92 | 34.2 | 0.95 |
| 5579 | Б | 15.08/04:15 | 70.2235 | 33.0062 | 5 | 3.3 × 106 | 0.84 | 0.04 | 21.0 | 10.68 | 33.9 | 0.98 |
| 5580 | Б | 16.08/12:30 | 70.2148 | 35.0027 | 10 | 5.3 × 106 | 0.65 | 0.09 | 7.22 | 9.78 | 34.4 | 1.58 |
| 5581 | Б | 16.08/07:30 | 70.5080 | 42.0157 | 22 | 2.4 × 106 | 1.28 | 0.13 | 9.85 | 5.96 | 34.7 | 0.49 |
| 5548-А | Б | 12.08/21:00 | 73.8940 | 33.0110 | 20 | 1.6 × 106 | 0.82 | 0.07 | 11.71 | 7.43 | 35.0 | 0.47 |
| 5548 | Б | 01.08/05:30 | 73.9163 | 33.0073 | 5 | 1.2 × 106 | 0.78 | 0.08 | 10.0 | 7.55 | 34.99 | 0.35 |
| 5544 | Б | 31.07/00:45 | 74.4370 | 26.0088 | 5 | 1.8 × 106 | 0.56 | 0.03 | 18.7 | 7.32 | 35.02 | 0.55 |
| 5550 | Б | 02.08/08:50 | 75.1582 | 29.0077 | 5 | 1.2 × 106 | 0.92 | 0.07 | 13.14 | 7.14 | 35.0 | 0.35 |
| 5516 | Н | 19.07/15:00 | 71.2993 | –5.0028 | 19 | 0.1 × 106 | 4.07 | 0.19 | 21.4 | 6.99 | 35.0 | 0.04 |
| Coccolithus pelagicus | ||||||||||||
| 5516 | Н | 19.07/15:00 | 71.2993 | –5.0028 | 19 | 3.8 × 104 | 4.07 | 0.19 | 21.4 | 6.99 | 35.0 | 0.45 |
| 5521 | Н | 20.07/22:40 | 71.4787 | 2.0127 | 35 | 1.0 × 104 | 3.30 | 0.23 | 14.3 | 8.06 | 35.07 | 0.16 |
| 5519 | Н | 20.07/13:00 | 71.4627 | –1.0022 | 23 | 2.4 × 103 | 6.94 | 0.31 | 22.4 | 5.92 | 35.02 | 0.04 |
| 5525 | Н | 23.07/11:00 | 72.0040 | 14.0040 | 25 | 1.9 × 104 | 1.52 | 0.06 | 25.3 | 8.5 | 35.0 | 0.32 |
| 5576 | Б | 14.08/06:10 | 72.4642 | 32.0020 | 33 | 1.4 × 104 | 10.79 | 0.51 | 21.2 | 5.5 | 34.8 | 0.24 |
| 5544 | Б | 31.07/00:45 | 74.4370 | 26.0088 | 35 | 1.4 × 104 | 2.45 | 0.18 | 13.6 | 5.8 | 35.07 | 0.24 |
Наибольшая численность E. huxleyi, соответствующая уровню цветения, наблюдалась в поверхностном слое воды юго-западной части Баренцева моря: до 6.62 × 106 кл/л на ст. 5576. Напротив, максимальная концентрация клеток C. pelagicus отмечена в Норвежском море в области Арктического фронта (3.8 × 104 кл/л, ст. 5516, горизонт 19 м). Средняя глубина залегания максимума численности C. pelagicus составила 21.9 м, а E. huxleyi – не превышала 10.1 м (t-test, p < 0.007), табл. 2. Установлены существенные различия факторов среды (соленость и температура воды, биогенные элементы), благоприятствующих развитию этих видов.
Таблица 2.
Средние значения солености, температуры, глубины залегания максимума численности C. pelagicus (C. p.) и E. huxleyi (E. h.), концентрации растворенных Si, Nмин и Pмин в Норвежском и Баренцевом морях в июле–августе 2017 г.
| Параметр | S, епс | T, °C | h, м | Si | Pмин | Nмин | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| мМ | ||||||||||||
| Вид | C. p. | E. h. | C. p. | E. h. | C. p. | E. h. | C. p. | E. h. | C. p. | E. h. | C. p. | E. h. |
| n | 13 | 15 | 13 | 15 | 13 | 15 | 13 | 15 | 13 | 15 | 13 | 15 |
| Среднее | 35.00 | 34.66 | 6.8 | 8.4 | 21.9 | 10.1 | 0.40 | 0.65 | 0.20 | 0.08 | 3.25 | 1.01 |
| t-test | 0.001 | 0.012 | 0.04 | 0.16 | 0.004 | 0.015 | ||||||
Соленость воды (S). Наибольшая численность C. pelagicus наблюдалась при S = 35.0–35.07 епс (табл. 1), характерной для Северо-Атлантического течения. Данный вид не отмечался в составе планктонных фитоценов Баренцева моря, оказавшихся под влиянием распресненных вод прибрежной ветви Норвежского течения. C. pelagicus может служить индикатором поступления воды Северо-Атлантического течения в Норвежское и Баренцево моря [11]. Массовое развитие E. huxleyi (до 3.3 × 106 кл/л) отмечалось в более широком диапазоне S (33.90–35.06 епс). Цветение наблюдалось при S = 33.90–35.02 епс, а максимальная численность при S = 34.5 епс, характерной для Норвежского течения. Средние значения S на участках цветения E. huxleyi и массового развития C. pelagicus достоверно отличались (t-test, p < 0.001).
Температура воды (T). В тех случаях, когда оба вида достигали максимальной численности, значимым фактором была T. Так, при цветении E. huxleyi средняя T поверхностного слоя составила 8.4°С; в слое массового развития C. pelagicus – 6.8°С и эти различия достоверны (t-test, p < 0,012). Однако, согласно [3], оптимальная T для роста C. pelagicus близка к 8°С, т. е., температурные оптимумы развития E. huxleyi и C. pelagicus перекрываются. Нами выявлены акватории (станции 5519, 5521, 5528, 5573), где при оптимальной T = = 8.3–10.5°С не наблюдалось цветения E. huxleyi. Здесь концентрации Nмин 0.40–1.80 и Pмин 0.10–0.18 мМ были выше, чем в ареалах цветения этого вида (0.06–0.26 и 0.04–0.12 мМ соответственно). Максимальная численность E. huxleyi достигалась, наоборот, при минимальной численности или отсутствии другого кальцификатора – C. pelagicus (рис. 1). Помимо T, механизмом регуляции численности E. huxleyi и C. pelagicus являлась концентрация Si, Nмин и Рмин.
Биогенные элементы. Цветение E. huxleyi наблюдалось в верхнем 20-метровом слое воды при низких концентрациях Nмин (1.01 ± 0.16 мМ) и Pмин (0.08 ± 0.02 мМ), табл. 2. Абсолютный максимум численности вида (6.6 × 106 кл/л) отмечался при низких концентрациях Nмин и Pмин (N : P = = 6.75), табл. 1. Для C. pelagicus характерно наличие глубинного максимума (до 3.80 × 104 кл/л) в слое 19–35 м при более высоких концентрациях Nмин (3.25 ± 2.0 мМ) и Pмин (0.20 ± 0.09 мМ). Так, при максимальной численности этого вида концентрации Nмин и Pмин были выше в 5 и 1.6 раза соответственно (N : P = 21.4). Анализ средних концентраций Nмин и Pмин подтвердил, что различия в условиях роста этих видов статистически достоверны (табл. 2).
Другим условием достижения максимальной численности для обоих видов была низкая концентрация Si в слое фотосинтеза, исключавшая конкуренцию со стороны диатомовых водорослей [9]. Повышение концентрации Si (до 0.8–1.6 мМ) при высоких концентрациях Nмин (1.56–6.97 мМ) и Pмин (0.1–0.4 мМ) приводило к массовому развитию диатомей и возвращению фитоцена на ранние стадии сукцессии (станции 5528, 5543, 5573, слой 5–20 м). При этом численность кокколитофорид не превышала 2.4 × 103 кл/л для C. pelagicus и 2.0 × 105 кл/л для E. huxleyi. Наши данные согласуются с представлениями о Si как важнейшем регуляторе в системе “диатомовые водоросли – кокколитофориды” [6]. Однако при низких концентрациях Nмин и Pмин эта закономерность нарушается [12, 13]. Так, в Чёрном море в период цветения E. huxleyi (май–июнь 2002–2017 гг.) концентрация Si в верхнем слое воды была высокой (>5 мМ) и не могла лимитировать рост диатомей. Условием цветения E. huxleyi была низкая концентрация Nмин, что лимитировало рост диатомовых водорослей; повышение концентрации Pмин привело к максимальному уровню цветения E. huxleyi.
В Баренцевом море в июле–августе 2016–2017 гг. нами установлены схожие закономерности. Цветение E. huxleyi, зарегистрированное в 2016 г. в юго-восточной части моря (до 12 × 106 кл/л), было большей интенсивности, чем в 2017 г. (табл. 1, 3). Концентрация Pмин в поверхностном слое воды в 2016 г. была достоверно выше, чем в 2017 г. (0.12 и 0.08 мМ, соответственно, t-test p < 0.001); концентрация Nмин, наоборот, ниже (0.36 и 1.01 мМ, соответственно, t-test p < 0.000001). Отношение N : P в 2016 г. было в 2 раза ниже, чем в 2017 г. При этом средние концентрации Si в эти годы были схожими (t-test p < 0.13). В Норвежском море максимальный вклад C. pelagicus в продукцию кальцита был на порядок выше, чем вклад E. huxleyi. Максимальное количество кальцита, произведенного C. pelagicus в Баренцевом море, в 2 раза ниже, чем в Норвежским море (табл. 1, рис. 1).
Таблица 3.
Температура воды, концентрация элементов минерального питания, максимальная численность E. huxleyi и содержание кальцита в Баренцевом море 07 июля 2016 г.
| Станция | Время GMT | Координаты, град. | Горизонт, м | T, °C | Si | Nмин | Pмин | N:P | Численность, 106 кл/л | Кальцит, ×10–3 моль СаСО3/м3 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| широта | долгота | мМ | |||||||||
| 6531 | 06:58 | 70.8483 | 38.9653 | 0 | 11.4 | 0.72 | 0.38 | 0.12 | 3.24 | 12.0 | 3.60 |
| 6533 | 10:20 | 70.8852 | 38.4893 | 5 | 11.4 | 0.52 | 0.35 | 0.10 | 3.49 | 8.0 | 2.40 |
| 6534 | 14:31 | 70.5033 | 38.4940 | 0 | 11.7 | 0.46 | 0.29 | 0.10 | 2.86 | 9.3 | 2.79 |
| 6534 | 14:31 | 70.5033 | 38.4940 | 10 | 11.2 | 0.52 | 0.26 | 0.09 | 2.84 | 9.5 | 2.85 |
Таким образом, основным продуцентом кальцита в Баренцевом море являлась E. huxleyi. Поскольку содержание кальцита прямо пропорционально численности клеток вида-кальцификатора, то в Баренцевом море основным регулятором эффективности карбонатного насоса является концентрация Pмин. Кальцификация может контролироваться развитием C. pelagicus, как в Норвежском море, только при условии увеличения концентраций Nмин и Pмин в сочетании с низкой концентрацией Si. Следовательно, основной вклад в работу сезонного (июнь–сентябрь) карбонатного насоса вносит C. pelagicus в Норвежском море и E. huxleyi в Баренцевом море.
Впервые установлено, что основным механизмом регуляции фитопланктонного звена карбонатного насоса в Норвежском и Баренцевом морях являются концентрации биогенных элементов: прежде всего, Nмин, Pмин и их соотношение (N : P), которые определяют численность видов-кальцификаторов. Высокая концентрация Nмин и Pмин и высокая величина N : P (превышающая соотношение Редфилда) необходимы для максимального развития C. pelagicus. Низкая концентрация Nмин и низкая величина N : P способствуют активному росту E. huxleyi.
Список литературы
Буренков В.И., Копелевич О.В., Ратькова Т.Н., Шеберстов С.В. // Океанология. 2011. Т. 51. № 5. С. 818–826.
Руководство по химическому анализу морских вод. РД 52.10.243–92 / Под ред. С.Г. Орадовского. С.-Пб.: Гидрометеоиздат, 1993. 315 с.
Baumann K., Andruleit H., Samtleben C. // Deep Sea Res. Part II. V. 47. 2000. P. 1743–1772.
Broecker W., Clark E. // Paleoceanography. V. 24. 2009. PA3205.
Daniels C. J., Poulton A. J., Sheward R. M. // Biogeosciences. V. 11. 2014. P. 6915–6925.
Egge J.K., Aksnes D.L. // Marine Ecol. Prog. Series. V. 83. 1992. P. 281–289.
Giraudeau J., Hulot V., Hanquiez V., et al. // J. Mar. Syst. V. 158. 2016. P. 93–105.
Iglesias-Rodrigez M.D., Brown C.W., Doney S.C., et al. // Global. Biogem. Cycle. V. 16. 2002. P. 1–20.
Krause J.W., Brzezinski M.A., Villareal T.A., Wilson C. // Limnol. and Oceanogr. V. 57. 2012. P. 1084–1098.
Neukermans G., Oziel L., Babin M. // Global Change Biol. V. 24(6). 2018. P. 2545–2553.
Oziel L., Neukermans G., Ardyna M., et al. // J. Geophys. Res. Oceans. V. 122(6). 2017. P. 5121–5139.
Silkin V.A., Pautova L.A., Giordano M., et al. // Mar. Poll. Bull. V. 138. 2019. 274–284.
Silkin V.A., Pautova L.A., Pakhomova S.V., et al. // J. Exper. Mar. Biol. and Ecol. V. 461. 2014. P. 267–274.
Tomas C.R. (Ed.) Identifying marine phytoplankton. San-Diego: Acad. Press, 1997. 858 p.
World Register of Marine Species (http://www.marinespecies.org).
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле


