Доклады Российской академии наук. Науки о Земле, 2020, T. 494, № 1, стр. 29-32
Стероидные гормоны растений – уникальные компоненты девонских нефтей Беларуси
Иностранный член РАН Р. Г. Гарецкий 1, Я. Г. Грибик 1, Р. П. Литвиновская 2, А. Л. Савчук 2, М. А. Мардосевич 2, В. А. Хрипач 2, *
1 Институт природопользования Национальной академии наук Беларуси
Минск, Республика Беларусь
2 Институт биоорганической химии Национальной академии наук Беларуси
Минск, Республика Беларусь
* E-mail: khripach@iboch.by
Поступила в редакцию 19.05.2020
После доработки 20.05.2020
Принята к публикации 25.06.2020
Аннотация
Приводятся данные по изучению содержания стероидных гормонов растений (брассиностероидов) в образцах нефти ряда месторождений Беларуси. Содержание стероидных гормонов растений в образцах нефти измерялось методом иммуноферментного анализа. В составе ископаемого сырья впервые обнаружены брассиностероиды ряда брассинолида, 24-эпибрассинолида и 28-гомобрассинолида. Количество содержащихся в нефти брассиностероидов варьирует в пределах от 0.87 до 8.82 нг/г, что сопоставимо с содержанием их в растительных объектах.
Исследования нефтяных составляющих и вызываемые ими эффекты показали, что небольшие количества нефти, попадая в почву, не только не вредят растениям, но могут даже стимулировать их рост [1]. В ходе изучения способности почвы к самовосстановлению при загрязнении ее нефтью было найдено, что добавка нефти до 0,06% для клоповника безлепестного (Lepidium ruderale L.) и 0.16% для полыни чернобыльника (Artemisia vulgaris L.) оказывает стимулирующий эффект на рост растений [2]. Наиболее изученными составляющими нефти являются в настоящее время нефтяные кислоты (алифатические, нафтеновые, ароматические) и их производные [3]. В середине прошлого века было запатентовано ростовое вещество (40%-ный водный раствор натриевых солей нефтяных кислот, выделенных из керосинов и дизельных топлив) [4]. Было показано, что нефтяное ростовое вещество оказывает заметное положительное влияние на рост, развитие и приживаемость сеянцев древесных пород и других растений [5].
Современные методы идентификации органических соединений позволяют более точно определять составляющие нефтяных образцов, которые присутствуют в очень низких концентрациях, но способны проявлять высокую физиологическую активность, в том числе фиторостостимулирующую. К последним относятся брассиностероиды (БС) – гормоны растений, присущие всему растительному миру [6, 7]. Если принять во внимание, что в составе горных пород, вмещающих нефть, содержатся растительные остатки, то можно предположить, что нефть также может содержать свойственные растительным организмам гормоны стероидной структуры.
Настоящее исследование посвящено проверке этой гипотезы с помощью аналитического метода, разработанного нами ранее специально для этой группы растительных гормонов [8, 9]. В результате нам удалось найти и измерить содержание указанных гормонов во всех изученных образцах нефти и это, насколько нам известно, является первым случаем обнаружения подобных сложных биологически значимых молекул в составе ископаемого сырья.
Исследовано 6 проб нефти из 5 месторождений, расположенных в единственном в Беларуси Припятском нефтеносном бассейне. В геологическом плане Припятский нефтеносный бассейн представляет собой палеорифтовую структуру, сформировавшуюся на герцинском этапе геологического развития региона в абсолютном временном периоде 375–350 млн лет тому назад. Установленные залежи нефти находятся в породах осадочного чехла мощностью до 6.0–6.5 км, представленного преимущественно девонскими отложениями палеозойской эры, в разрезе которых выделяются подсолевой (терригенный и карбонатный), нижнесоленосный, межсолевой, верхнесоленосный и надсолевой комплексы. Залежи нефти, из которых отобраны и проанализированы пробы, расположены в Северной части Припятского прогиба в Светлогорском и Калинковичском районах Гомельской области (рис. 1). Анализируемые пробы нефти распределяются следующим образом по разрезу – снизу-вверх. Из подсолевого карбонатного комплекса проанализировано три пробы Зуевского (семилукский и саргаевский горизонты) и Ново-Сосновского (семилукский горизонт) месторождений (табл. 1).
Рис. 1.
Схема размещения исследуемых нефтяных месторождений Беларуси. Обозначения месторождений: 1 – Зуевское, 2 – Ново-Сосновское, 3 – Морозовское, 4 – Давыдовское, 5 – Ново-Кореневское.
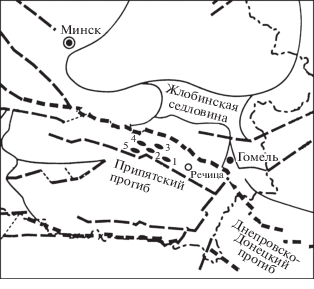
Таблица 1.
Характеристика нефти и вмещающих пород Припятского прогиба
| №№ п/п | Месторождение, скважина | Глубина, м | Горизонт | Вмещающие породы | Пластовые | Плотность нефти, г/см3 | |
|---|---|---|---|---|---|---|---|
| Давление, МПа | Темпе-ратура, °С | ||||||
| 1 | Зуевское, 603 | 3564–3590 | семилукский | Доломит серый мелкокристаллический, пористый с выпотами нефти | 40.8 | 75 | 0.8384 |
| 2 | Зуевское, 603 | 3599–3606 | саргаевский | Доломит темно-серый тонкокристаллический, пористый с выпотами нефти | 41.4 | 79 | 0.8437 |
| 3 | Ново-Кореневское, 12 | 2725–2733 | задонский | Доломит темно-серый тонкокристаллический, трещиноватый | 30.6 | 52 | 0.8665 |
| 4 | Ново-Сосновское, 48 | 3254–3271 | семилукский | Доломит серый, кристаллический, массивный, кавернозный | 39.0 | 71 | 0.8039 |
| 5 | Давыдовское, 83 | 2648–2670 | задонский | Известняк серый, слабоглинистый, доломитизированный | 27.5 | 58 | 0.857 |
| 6 | Морозовское, 1 | 2760–2766 | боричевский | Известняк массивный, ангидрит серый чешуйчатый | 28.5 | 61 | 0.8398 |
Нефть межсолевой залежи (задонский горизонт) изучена по двум пробам на Давыдовском и Ново-Кореневском месторождениях, а верхнесоленосного комплекса по одной пробе (боричевский горизонт) из Морозовского месторождения. Следует отметить, что все проанализированные пробы представляют залежи, приуроченные к карбонатным породам, которые представлены преимущественно доломитами, известняками, мергелями с пластами ангидрита, солей. Большая часть емкостного пространства, содержащего пластовые флюиды (нефть, пластовые воды рассольного типа), сформирована как органогенные постройки преимущественно биостромного типа, породообразующими элементами емкостного пространства которых являлись сине-зеленые водоросли (строматолиты), кораллы, брахиоподы, моллюски, криноидеи [10].
В качестве метода исследования образцов применяли иммуноферментный анализ, при этом поиск вели в наиболее распространенных группах фитогормональных стероидов – ряда 24-эпибрассинолида, брассинолида и 28-гомобрассинолида. Образец нефти (3 мл) порционно распределяли между циклогексаном (9 мл) и 80%-ным водным метанолом (3 × 6 мл). Объединенную водно-метанольную фракцию упаривали до водного остатка. Далее водный остаток порционно распределяли между этилацетатом (9 мл) и 0.25 М Na2HPO4 (3 мл × 3). Органическую фракцию промывали дистиллированной водой до нейтрального рН и упаривали досуха. Полученный остаток растворяли в небольшом количестве буферного раствора (2 мл). Буферный экстракт центрифугировали на приборе Eppedorf®MiniSpinPlus (13 375 об/мин) в течение 5 мин, супернатант разводили в 10 раз. Количественное определение содержания стероидных гормонов растений в образцах нефти проводили с помощью разработанного нами двухстадийного иммуноферментного метода анализа [9] с использованием тест-систем по определению брассиностероидов ряда 24-эпибрассинолида, брассинолида и 28-гомобрассинолида.
Калибровочные пробы готовили методом серийных разведений исходного спиртового раствора с известной концентрацией (10–4 моль/л) брассиностероида буферным раствором. Концентрация стероида в калибровочных пробах составляла 0, 0.01, 0.1 и 1.0 нмоль/л. Раствор ферментативного конъюгата брассиностероид-пероксидаза хрена готовили также на буферном растворе. Концентрацию конъюгата подбирали с таким расчетом, чтобы оптическая плотность в лунке, содержащей калибровочную пробу с “нулевым” содержанием стероида, составляла не менее 2.0 опт. ед.
В полистирольные лунки планшета с иммобилизованными антителами вносили по 150 мкл калибровочных проб и анализируемых образцов в дубликатах. Концентрация стероида в калибровочных пробах составляла 0; 0.01; 0.1; 1 нмоль/л. Планшет инкубировали при 37°С в течение 2 ч, после чего содержимое лунок удаляли и промывали их промывочным раствором (4 × 150 мкл). Затем во все промытые лунки добавляли по 150 мкл раствора конъюгата соответствующего брассиностероида с ПХ и инкубировали 5 мин при 37°C. Затем удаляли содержимое, промывали, как описано выше, добавляли по 150 мкл хромоген-субстратной смеси и инкубировали при 37°C в течение 20–25 мин. Останавливали реакцию добавлением во все лунки по 50 мкл раствора стоп-реагента (5%-ного раствора H2SO4). Оптическую плотность раствора во всех лунках измеряли на фотометре универсальном Ф300ТП (РУПП “Витязь”, Беларусь) при длине волны 450 нм. Методом интерполяции по калибровочному графику рассчитывали концентрацию БС (нмоль/л) в анализируемой пробе. Полученные данные приведены в табл. 2.
Таблица 2.
Содержание брассиностероидов в образцах нефти (нг/г)
| № | Образцы нефти | БС ряда 24-эпи-брассинолида | БС ряда брассинолида | БС ряда 28-гомо-брассинолида |
|---|---|---|---|---|
| 1 | Зуевское месторождение, скв. № 603, 3564–3590 м | 0.575 ± 0.052 | 0.164 ± 0.015 | 0.139 ± 0.018 |
| 2 | Зуевское месторождение, скв. № 603, 3599–3606 м | 0.935 ± 0.072 | 0.218 ± 0.024 | 0.119 ± 0.011 |
| 3 | Ново-Кореневское месторождение | 0.738 ± 0.024 | 0.222 ± 0.004 | 0.228 ± 0.015 |
| 4 | Ново-Сосновское месторождение | 0.555 ± 0.057 | 0.406 ± 0.096 | 0.165 ± 0.012 |
| 5 | Давыдовское месторождение | 2.67 ± 0.32 | 0.280 ± 0.039 | 0.295 ± 0.005 |
| 6 | Морозовское месторождение | 8.07 ± 1.37 | 0.335 ± 0.005 | 0.359 ± 0.029 |
На основании полученных данных можно сделать вывод, что все изученные образцы нефти содержат стероидные гормоны растений основных известных в настоящее время групп – брассинолида, 24-эпибрассинолида и 28-гомобрассинолида. При этом наиболее распространенными являются фитогормоны ряда 24-эпибрассинолида (максимальное содержание их отмечено в нефти верхнесоленосного комплекса Морозовского месторождения – 8.07 нг/г). Суммарное количество содержащихся в нефти брассиностероидов варьирует в пределах от 0.87 до 8.82 нг/г. На состав брассиностероидов слабо влияют месторасположение в разрезе и глубина залегания горизонта. Однако количественное содержание брассиностероидов сопоставимо с таковым в растительных объектах [11–14], в том числе в лекарственных травах [15]. Очевидно, это можно объяснить высокой устойчивостью изучаемых объектов к трансформациям под воздействием геологических факторов, участвующих в процессах формирования горных пород и залежей полезных ископаемых.
Список литературы
Русанова Г.В. Деградация криогенных почв в районах нефтегазоразведочных работ // Почвоведение. 2000. № 2. С. 252–261.
Лифшиц С.Х., Кершенгольц Б.М., Чалая О.Н. и др. Изучение способности модельной системы “мерзлотная почва Якутии — растения» к восстановлению при загрязнении нефтью // Химия в интересах устойчивого развития. 2008. № 5. С. 537–545.
Иванова Л.В., Кошелев В.Н., Соколова Н.А. и др. Нефтяные кислоты и их производные. получение и применение // Труды Российского государственного университета нефти и газа. 2013. № 1. С. 68–80.
А.с. № 447910 (СССР). МКИ С О7 С 61/00. Способ получения нефтяного ростового вещества. Подано 25.10.72. Опубликовано 30.04.86. Бюл. № 16. Приоритет 1972.
Гусейнов Д.М. Применение новых видов удобрений. Москва: Сельхозиздат, 1961.
Brassinosteroids: Chemistry. Bioactivity // Horace G.C., Yokota T., Adam G. (editors). Application. Washington: ACS; 1991.
Nolan T.M., Vukašinović N., Liu D., Russinova E., Yin Y. Brassinosteroids: Multidimensional Regulators of Plant Growth, Development, and Stress Responses // The Plant Cell. 2000. V. 32. P. 236–318.
Khripach V.A., Zhabinskii V.N., Litvinovskaya R.P. Immunoassays of Brassinosteroids // In Hayat S., Ahmad A. (editors). Brassinosteroids: A Class of Plant Hormones. Dordrecht: Springer Science & Business Media; 2011. P. 375–392.
Pradko A.G., Litvinovskaya R.P., Sauchuk A.L., et al. A New ELISA for Quantification of Brassinosteroids in Plants //Steroids. 2015. V. 97. P. 78–86.
Махнач А.С., Москвич В.А., Кручек С.А., Урьев И.И. Органогенные постройки девона Белоруссии. Минск: Наука и техника; 1984. 236 с.
Kanwar M., Bajguz A., Zhou J., et al. Analysis of Brassinosteroids in Plants // J. Plant Growth Regul. 2017. V. 36. P. 1002–1030. https://doi.org/10.1007/s00344-017-9732-4
Bajguz A., Tretyn A. The chemical characteristic and distribution of brassinosteroids in plants // Phytochemistry. 2003. Vol. 62(7). P. 1027–1046. https://doi.org/10.1016/s0031-9422(02)00656-8
Ding J., Mao L.J., Wang S.T., et al. Determination of Endogenous Brassinosteroids in Plant Tissues Using Solid-phase Extraction with Double Layered Cartridge Followed by High-performance Liquid Chromatography-tandem Mass spectrometry // Phytochem. Anal. 2013. V. 24. P. 386–394.
Swaczynova J., Novák O., Hauserová E., et al. New Techniques for the Estimation of Naturally Occurring Brassinosteroids // J. Plant Growth Regul. 2007 V. 26. P. 1–14 https://doi.org/10.1007/s00344-006-0045-2
Литвиновская Р.П., Савчук А.Л., Томанова М.А. и др. Содержание стероидных фитогормонов в некоторых лекарственных сборах // Химия природных соединений. 2019. Т. 55. № 5. С. 847–848.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле


