Доклады Российской академии наук. Науки о Земле, 2021, T. 498, № 2, стр. 146-151
Экспериментальные исследования растворимости фенакита в щелочно-гранитоидных расплавах
Б. Б. Дамдинов 1, *, Н. И. Сук 2, А. Р. Котельников 2, Л. Б. Дамдинова 1, В. Б. Хубанов 1
1 Геологический институт Сибирского отделения Российской академии наук
Улан-Удэ, Россия
2 Институт экспериментальной минералогии Российской академии наук
Черноголовка, Россия
* E-mail: damdinov@mail.ru
Поступила в редакцию 05.02.2021
После доработки 18.02.2021
Принята к публикации 20.02.2021
Аннотация
Растворимость фенакита (Be2SiO4) в алюмосиликатных расплавах различной щелочности экспериментально исследована при Т = 1000°С и Р = 1 кбар в сухих условиях и в присутствии 10 мас. % H2O. Эксперименты проводились на установке высокого газового давления. Продолжительность экспериментов составила 5 дней. Исходным материалом служило наплавленное стекло гранитного состава разной агпаитности (1–1.5), а также природный фенакит. Состав образцов после экспериментов определялся методом электронно-зондового рентгеноспектрального анализа, содержание бериллия – методом лазерной абляции. Было обнаружено, что растворимость фенакита зависит от состава алюмосиликатного расплава, увеличиваясь с увеличением агпаитности ((Na + K)/Al). Концентрации BeO в “сухих” расплавах варьируют в пределах 0.67–1.3 мас. %, в присутствии водного флюида – 1.58–2.28 мас. %. Полученные экспериментальные данные свидетельствуют в пользу концентрирования бериллия в остаточных щелочных водосодержащих расплавах. При этом содержания бериллия в этих остаточных расплавах могут быть достаточно высокими, позволяющими сформировать крупные месторождения бериллия за счет его экстракции флюидами из сравнительно небольших по объему магматических тел.
ВВЕДЕНИЕ
Бериллий входит в число стратегических металлов (таких как Nb, Ta, Mo, W, Sn и др.), необходимых для промышленности высоких технологий (ядерная энергетика, металлургия, машиностроение). Геохимически бериллий связан с гранитами, в частности с разностями литий-фтористых гранитов, щелочных гранитов и пегматитов [1]. Главными источниками бериллия являются пегматитовые и гидротермальные месторождения, где около половины мировых запасов приходится на пегматитовые месторождения [2]. Среди гидротермальных месторождений главными по запасам являются месторождения, связанные с бертрандит-флюорит-фенакитовыми (Ермаковское, Россия), бертрандит-аргиллизитовыми (Спер-Маунтин, США), берилл-слюдяными (Малышевское, Россия) и редкометально-флюоритовыми (Вознесенское, Россия) метасоматитами [2, 3, 4].
Кларк бериллия в земной коре, по А.П. Виноградову (1962), равен 3.8 ppm, в кислых изверженных породах – 5.5 ppm, средних – 1.8 ppm, основных – 0.4 ppm, осадочных – 3 ppm. Согласно исследованиям А.А. Беуса и Ю.П. Дикова [1], средние содержания бериллия в кислых породах составляют 5 ppm, в щелочных – 6 ppm. По современным данным, кларк бериллия в верхней коре оценивается всего в 3 ppm, в примитивной мантии – 60 ppb [5]. В гранитах средние содержания бериллия достигают 130–160 ppm, хотя в большинстве случаев варьируют в пределах 3–28 ppm [6]. В рудах промышленных месторождений среднее содержание Be варьирует от 700 до 7200 ppm (0.2–2 мас. % BeO).
Почти все месторождения бериллия генетически связаны с гранитоидным магматизмом, являясь продуктами деятельности летучих компонентов, отщепляющихся от гранитной магмы. На месторождения, связанные с кислыми породами, приходится 98% учтенных запасов бериллия. Следовательно, концентрирование этого элемента обусловлено в первую очередь процессами, происходящими в ходе эволюции материнских гранитоидных расплавов. Однако сведения о содержаниях бериллия в исходных гранитоидных расплавах практически отсутствуют. Экспериментальные данные по растворимости бериллия в гранитных расплавах также крайне немногочисленны. Известны лишь единичные работы, посвященные исследованиям растворимости бериллия в гранитоидных расплавах и в гидротермальных растворах, опубликованные во второй половине XX века [1, 7, 8, 9].
Считается, что крупнейшее в России Ермаковское фтор-бериллиевое месторождение сформировано за счет интрузии субщелочных гранитов [10]. Следовательно, повышенная щелочность могла оказывать влияние на концентрацию бериллия в первичном расплаве. Однако экспериментальные данные по влиянию щелочности на растворимость бериллия ранее отсутствовали. Это послужило основанием для исследования растворимости фенакита (Be2SiO4) в гранитных расплавах с различными значениями коэффициентов агпаитности (Кagp = (Na + K)/Al).
МЕТОДИКА ЭКСПЕРИМЕНТА
Растворимость фенакита в алюмосиликатных расплавах различного состава экспериментально изучалась при Т = 1000°С и Р = 1 кбар в сухих условиях и в присутствии 10 мас. % воды. Эксперименты проводились на установке высокого газового давления. Исходным материалом служили предварительно наплавленные стекла гранитного состава, отвечающие составу гранита Ермаковского месторождения [11], но с различной агпаитностью (1, 1.2, 1.5), а также природный фенакит из радиально-лучистых кристаллов Ермаковского месторождения. Опыты проводились в заваренных платиновых ампулах диаметром 3 мм, куда помещалась навеска (70 мг гранитного стекла + 14 мг фенакита) и при необходимости заливалась вода (7 мкл). Продолжительность опытов составляла 5 сут, затем осуществлялась изобарическая закалка. Условия проведения опытов представлены в табл. 1.
Таблица 1.
Условия опытов по изучению растворимости фенакита в модельных гранитных расплавах при Т = 1000°С; Р = 1 кбар
| № оп. | Навеска | H2O, мкл |
|---|---|---|
| 7286 | 70 мг гранит1) (Kagp =1)2) + 14 мг фенакит3) | 7 |
| 7287 | 70 мг гранит (Kagp = 1.2) +14мг фенакит | 7 |
| 7288 | 70 мг гранит (Kagp = 1.5) + 14 мг фенакит | 7 |
| 7289 | 70 мг гранит (Kagp = 1) + 14 мг фенакит | – |
| 7290 | 70 мг гранит (Kagp = 1.2) + 14 мг фенакит | – |
| 7291 | 70 мг гранит (Kagp = 1.5) + 14 мг фенакит | – |
Составы полученных образцов определялись на сканирующем электронном микроскопе Tescan Vega II XMU (Чехия), оснащенном энергодисперсионным (INCAx-sight) и кристалл-дифракционным (INCA wave) рентгеновскими спектрометрами (Англия, Оксфорд). Использовалась программа качественного и количественного анализа INCA Energy 450. Условия анализа при использовании только энергодисперсионного спектрометра были следующие: ускоряющее напряжение 20 кВ, ток поглощенных электронов на Co 0.3 нА, время анализа в точке 70 с. Точность определения при использовании энергодисперсионного спектрометра составляет 0.2 мас. % элемента.
Содержания бериллия определяли методом лазерной абляции на масс-спектрометре высокого разрешения Element XR (Thermo Fisher Scientific), соединенным с приставкой для лазерного прибора UP-213 с длиной волны излучения 213 нм (New Wave Research) в ЦКП “Аналитический центр минералого-геохимических и изотопных исследований Геологического института СО РАН”, г. Улан-Удэ. В качестве внешнего стандарта использовался эталон стекла NIST-610, контрольным образцом служил эталон стекла NIST-612. Стратегия анализа представляла собой измерение внешнего и контрольного стандарта через каждые пять измерений образца. Расчет проводился с помощью программы Glitter [12] с введением содержания оксида кремния в качестве внутреннего стандарта, оцененного методом EMA. Относительные погрешности измерения концентраций Be составляли менее 10%, Na – менее 15%, Al – менее 7%, K – менее 10%, Ca – менее 8%.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ И ОБСУЖДЕНИЕ
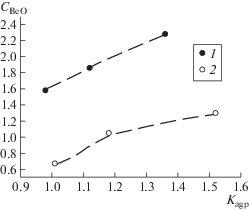
В результате экспериментов получено гомогенное стекло с кристаллами фенакита (рис. 1). Состав стекла определялся преимущественно вблизи кристаллов и представлен в табл. 2. Содержания BeO по всему образцу практически не менялись, что может свидетельствовать о достижении равновесия в ходе опытов. Установлено, что растворимость фенакита зависит от состава алюмосиликатного расплава (рис. 2), возрастая с увеличением его агпаитности ((Na + K)/Al). При этом коэффициент агпаитности в водосодержащих системах немного уменьшается по сравнению с исходным значением, что можно объяснить частичным растворением щелочей во флюиде. Полученные данные показывают, что растворимость фенакита в стекле в присутствии водного флюида выше, чем в сухих условиях. На основании полученных данных рассчитаны линейные зависимости растворимости фенакита от коэффициента агпаитности (Kagp):
где sx – среднеквадратичное отклонение, Ex – погрешность оценки CBeO.Рис. 1.
Кристаллы фенакита (темно-серые) в алюмосиликатном стекле: а – эксперимент в присутствии воды (обр. 7286); б – эксперимент в безводных условиях (обр. 7289). Белые точки показывают места анализов стекла методом LA-ICP-MS.

Таблица 2.
Составы экспериментальных стекол, полученных при Т = 1000°С и Р = 1 кбар (составы приведены к 100 мас. %)
| В присутствии Н2О | Сухие условия | |||||
|---|---|---|---|---|---|---|
| № обр. | 7286 | 7287 | 7288 | 7289 | 7290 | 7291 |
| SiO2 | 72.32 | 71.31 | 71.17 | 71.91 | 70.63 | 69.80 |
| Al2O3 | 14.75 | 13.80 | 12.96 | 15.31 | 14.88 | 13.23 |
| Na2O | 5.50 | 5.68 | 6.48 | 5.96 | 6.91 | 7.72 |
| K2O | 5.06 | 5.63 | 6.50 | 5.23 | 5.74 | 6.84 |
| CaO | 0.47 | 1.52 | 0.42 | 0.57 | 0.36 | 0.62 |
| FeO | 0.32 | 0.20 | 0.18 | 0.35 | 0.42 | 0.48 |
| BeO | 1.58 | 1.86 | 2.28 | 0.67 | 1.05 | 1.30 |
| Сумма | 100.00 | 100.00 | 99.99 | 100.00 | 99.99 | 99.99 |
| Kagp | 0.98 | 1.12 | 1.36 | 1.01 | 1.18 | 1.52 |
Рис. 2.
Зависимость содержания BeO (мас. %) от агпаитности алюмосиликатного расплава (Na + K)/Al. 1 – эксперименты, проведенные в присутствии водного флюида, 2 – эксперименты, проведенные в сухих условиях.
В ранее проведенных экспериментальных исследованиях растворимости было установлено, что растворимость бериллия в силикатном расплаве возрастает с повышением температуры (в интервале 650–850°С) и снижением глиноземистости – значений индекса ASI (Al2O3/(Na2O + + K2O + CaO)) [7]. В то же время наши экспериментальные данные хорошо согласуются с данными цитируемой работы [7], экстраполированными на 1000°С, для значений агпаитности гранитного расплава ~1. При экстраполяции данных [7] для Kagp = 0.90 ± 0.01 (водонасыщенные условия) на основе линейного уравнения:
По нашим данным, зависимость CBeO(мас. %) от агпаитности в водонасыщенных условиях описывается линейным уравнением:
Для температуры 1000°C и Kagp = 0.90 получаем значение CBeO(мас. %) = 1.443 ± 0.02, что хорошо согласуется со значением, полученным по данным [7] (1.396 ± 0.03 мас. %). Эти значения при sx = 0.04 статистически значимо не различаются.
Заметим, что влияние щелочности гранитоидов на растворимость бериллия ранее не оценивалось, хотя известно, что многие гидротермальные месторождения бериллия ассоциируют со щелочными или субщелочными гранитоидами и их вулканическими аналогами [2, 4]. Наши экспериментальные исследования показали, что растворимость фенакита в гранитоидном расплаве имеет прямую положительную зависимость от щелочности – с увеличением коэффициента агпаитности (отношения щелочей к алюминию) его растворимость возрастает. Это наблюдается как в сухих условиях, где содержания BeO возрастают от 0.67 до 1.3 мас. %, так и в присутствии водного флюида (BeO – от 1.58 до 2.28 мас. %). Как видно из представленных данных (табл. 2, рис. 2), в водосодержащем расплаве растворимость BeO существенно выше, чем в сухом.
Согласно исследованиям [4, 9] перенос бериллия в составе флюида осуществляется преимущественно во фторидной форме. Очевидно, что добавка F в исходное стекло (гранитный расплав), скорее всего, позволила бы получить еще большую растворимость бериллия. Тем не менее полученные результаты согласуются с данными о более высокой продуктивности на бериллий более водонасыщенных гранитоидов [10]. Практически прямая зависимость растворимости бериллия от щелочности расплава позволяет считать, что щелочные граниты наиболее продуктивны на бериллиевое оруденение. Это можно наблюдать на примере гидротермальных месторождений бериллия, в частности, крупнейшее в России Ермаковское F–Be месторождение генетически связано с интрузией щелочных гранитов [2, 10, 11, 13, 14].
Ранее, на примере экспериментальных данных по растворимости берилла и фенакита, было показано, что содержание Be в силикатном гранитоидном расплаве достигает более 4000 ppm, причем эта величина сильно зависит от температурных условий, в меньшей степени, от содержания глинозема [7]. Наши исследования показали значительно более высокие содержания, достигающие 2.28 мас. % BeO в силикатном стекле. Эти данные показывают, что первичный расплав может содержать достаточно высокие концентрации бериллия, на уровне первых мас. %, что выше содержания Be в самом богатом гидротермальном месторождении – Ермаковском фтор-бериллиевом. В то же время содержания бериллия в природных гранитоидах могут достигать 160 ppm только в наиболее обогащенных разностях, кларк же этого элемента в гранитах составляет от 3 до 28 ppm [6]. Такое различие между возможной растворимостью (первые мас. %) и реальным уровнем содержаний бериллия в гранитоидах (не более 160 ppm) можно объяснить тем, что в ходе кристаллизации расплава бериллий, как типичный некогерентный элемент, должен уходить во флюидную фазу. Однако ранее проведенные экспериментальные исследования распределения Be в системе вода–гранитный расплав показали значение KD = 0.81 [8]. Следовательно, бериллий имеет большее сродство с расплавом, чем с флюидной фазой. В то же время известно, что концентрирование бериллия в природных месторождениях всегда происходит с участием флюида как в пегматитовых объектах, образующихся из остаточных расплавов, обогащенных флюидной фазой, так и на гидротермальных месторождениях, флюидно-метасоматический генезис которых очевиден.
Экспериментальные исследования [9] показали, что бериллий в гидротермальных условиях мигрирует преимущественно в составе фтор-содержащих комплексных соединений. Следовательно, наличие фтора во флюиде является главным условием экстракции бериллия во флюидную фазу и значение коэффициента распределения флюид-расплав в этом случае будет значительно увеличиваться. Экспериментальные исследования в системе NaF–H2O показали, что фторидные растворы являются растворами второго (P–Q) типа, одной из особенностей которых является наличие двух областей фазовой несмесимости [15]. При высоких P-T параметрах, характерных для условий начала кристаллизации гранитоидного расплава, фторидный водно-солевой флюид распадается на две несмесимые фазы – концентрированный натрий-фторидный рассол и слабоконцентрированный NaF-содержащий водный флюид. Существование таких несмесимых флюидных фаз доказано исследованиями расплавных и флюидных включений в рудогенерирующих гранитоидах Оротского и Ермаковского бериллиевых месторождений [10]. Согласно цитируемой работе, общая концентрация солевых компонентов, представленных преимущественно фтор-содержащими сульфатно-хлоридными фазами, в рассолах достигает 70–75 мас. %. Фаза концентрированного рассола максимально экстрагирует некогерентные элементы, в том числе бериллий, из гранитоидного расплава, часть элементов может выноситься из расплава в составе слабоконцентрированного флюида. В результате природные гранитоиды содержат бериллий в своем составе в концентрациях намного меньших, чем его возможная максимальная растворимость в первичном расплаве. Отсюда можно сделать вывод, что содержания бериллия в щелочно-гранитоидных расплавах могут быть достаточно высокими, позволяющими сформировать крупные месторождения бериллия за счет его экстракции из сравнительно небольших по объему магматических тел.
Полученные экспериментальные данные свидетельствуют в пользу концентрирования бериллия в остаточных щелочных водосодержащих расплавах. Эти расплавы образуются при активной роли гетерогенных фторсодержащих флюидов во флюидно-магматических системах при эволюции гранитных расплавов. Признаки участия гетерогенного флюида в процессе рудообразования ранее были установлены при исследовании расплавных и флюидных включений на Оротском и Ермаковском бериллиевых месторождениях [10].
ВЫВОДЫ
1. Экспериментально установлено, что концентрации бериллия в гранитоидном расплаве возрастают с ростом щелочности. Содержания BeO в силикатном стекле в интервале значений коэффициента агпаитности 1.01–1.52, в сухих условиях повышаются от 0.67 до 1.3 мас. %. В присутствии водного флюида, в интервале агпаитности 0.98–1.36, содержания BeO варьируют в пределах 1.58–2.28 мас. %.
2. Показано, что бериллий характеризуется высокой растворимостью в гранитных расплавах, где содержания BeO могут превышать 2 мас. %, что соответствует его концентрациям в богатых месторождениях.
3. Высокая растворимость бериллия в гранитоидном расплаве позволяет сделать вывод о том, что крупные месторождения бериллия могут формироваться за счет сравнительно небольших по объему магматических тел.
4. Полученные экспериментальные данные свидетельствуют в пользу модели концентрирования бериллия в остаточных щелочных водосодержащих расплавах, образующихся во флюидно-магматических системах в ходе эволюции гранитных расплавов.
Список литературы
Беус А.А., Диков Ю.П. Геохимия бериллия в процессах эндогенного минералообразования (на основе гидротермального эксперимента). М.: Недра, 1967. 160 с.
Куприянова И.И., Шпанов Е.П. Бериллиевые месторождения России. М.: ГЕОС, 2011. 353 с.
Генетические типы гидротермальных месторождений бериллия // Под ред. А.И. Гинзбурга, М.: Недра, 1975, 248 с.
Barton M.D., Young S. Non-pegmatitic deposits of Beryllium: Mineralogy, geology, phase equilibria and origin // Reviews in Mineralogy and Geochemistry. 2002. V. 50. № 1. P. 591–692.
Grew E.S. Mineralogy, petrology and geochemistry of Beryllium: An introduction and list of Beryllium minerals // Reviews in Mineralogy and Geochemistry. 2002. V. 50. № 1. P. 1–76.
London D., Evensen J. M. Beryllium in Silicic magmas and origin of beryl-bearing pegmatites // Reviews in Mineralogy and Geochemistry. 2002. V. 50. № 1. P. 445–486.
Evensen J.M., London D., Wendlandt R.F. Solubility and stability of beryl in granitic melts // American mineralogist. 1999. V. 84. P. 733–745.
London D., Hervig R.L., Morgan G.B. Melt-vapor solubilities and elements; partitioning in peraluminous granite-pegmatite systems: experimental results with Macusani glass at 200 MPa // Contributions to Mineralogy and Petrology. 1988. V. 99. P. 360–373.
Wood S.A. Theoretical prediction of speciation and solubility of beryllium in hydrothermal solutions to 300°C at saturated vapor pressure: Application to bertrandite/phenakite deposits // Ore Geology Reviews. 1992. V. 7. P. 249–278.
Рейф Ф.Г. Щелочные граниты и бериллиевое (фенакит-бертрандитовое) оруденение на примере Оротского и Ермаковского месторождений // Геохимия. 2008. № 3. С. 243–263.
Лыхин Д.А., Ярмолюк В.В. Западно-Забайкальская бериллиевая провинция: месторождения, рудоносный магматизм, источники вещества. М.: ИГЕМ РАН, ГЕОС, 2015. 256 с.
Griffin W.L., Powell W.J., Pearson N.J., O’Reilly S.Y. In: Laser Ablation ICP-MS in the Earth Sciences. Ed. P.J. Sylvester. Mineralogical association of Canada short course series. 2008. V. 40. P. 204–207.
Дамдинова Л.Б., Дамдинов Б.Б., Брянский Н.В. Процессы формирования флюорит-лейкофан-мелинофан-эвдидимитовых руд Ермаковского F–Be месторождения (Западное Забайкалье) // Геология и геофизика. 2018. № 8. С. 1271–1291.
Дамдинова Л.Б., Рейф Ф.Г. Особенности формирования разнотипной прожилковой бериллиевой минерализации на Ермаковском F–Bе месторождении (Западное Забайкалье) // Геология и геофизика, 2004. Т. 45. № 8. С. 979–991.
Котельникова З.А., Котельников А.Р. Na–F-содержащие флюиды: экспериментальное изучение при 500–800°С и Р=2000 бар методом синтетических флюидных включений в кварце // Геохимия, 2008. № 1. С. 54–68.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле




