Доклады Российской академии наук. Науки о Земле, 2021, T. 499, № 1, стр. 71-76
Пелагическая экосистема котловины Нансена в условиях изменчивости притока атлантической воды: механизм формирования диатомового цветения в прикромочной зоне
Л. А. Паутова 1, В. А. Силкин 1, *, М. Д. Кравчишина 1, **, В. Г. Якубенко 1, Е. А. Кудрявцева 1, А. А. Клювиткин 1, академик РАН Л. И. Лобковский 1
1 Институт океанологии им. П.П. Ширшова
Российской академии наук
Москва, Россия
* E-mail: vsilkin@mail.ru
** E-mail: kravchishina@ocean.ru
Поступила в редакцию 04.03.2021
После доработки 16.03.2021
Принята к публикации 13.05.2021
Аннотация
В ходе судовых наблюдений получены уникальные данные об аномально высоком уровне биомассы фитопланктона (30 г м–3) в прикромочной зоне глубоководного района высокой Арктики (котловина Нансена, 83° с.ш.) в летний период 2020 г. Изменения в видовом составе и увеличение количественных показателей планктонных фитоценов определялись сложной гидрологической структурой, формирующейся в результате взаимодействия теплой атлантической и холодной арктической водных масс, и подтверждали важную роль Северо-Атлантического течения в европейском секторе Арктического бассейна. Впервые установлена достоверная связь между уровнем продуктивности фитопланктона и глубиной залегания галоклина – индикатора подъема богатых биогенными элементами (прежде всего азотом) атлантических вод. Впервые показано, что видом, формирующим прикромочное цветение в высокой Арктике, может быть крупноклеточная криопелагическая центрическая диатомовая водоросль Porosira glacialis (= Podosira hormoides var. glacialis).
Потепление в атлантическом секторе Арктики и резкое сокращение площади ледяных полей связывают с усилением Северо-Атлантического течения [1, 2], одна из ветвей которого проходит через котловину Нансена, а другая, широко разветвляясь в южной части Баренцева моря, переносит атлантические воды к восточным его границам к северу и югу от архипелага Новая Земля. В Баренцевом море следствием такого усиления, помимо таяния льдов, являются отмечающиеся в последние 20 лет ежегодные летние цветения атлантического вида – кокколитофориды Emiliania huxleyi численностью от 1.5 × 106 до 12 × 106 кл л–1 [3]. Цветения происходят исключительно в водах атлантического генезиса к югу от Полярного фронта в наиболее теплых водах Норвежского (Нордкапского) течения. В литературе последних 20 лет усиление поступления Атлантической воды (АВ) в Северном Ледовитом океане принято называть “атлантификацией”, включая в это понятие массовое развитие (“цветение”) бореальных видов, привносимых в арктический регион течениями из Северной Атлантики [4, 5].
Сведений о воздействии АВ на пелагические экосистемы котловины Нансена и, в частности, на первичное продуцирующее звено экосистемы, крайне мало. Известно, что в стрежне Атлантического Пограничного течения (АПТ), проходящего вдоль материкового склона на восток, в достаточно большом количестве (до 5.0 × 105 кл л–1) может развиваться кокколитофорида E. huxleyi [6]. Это резко контрастирует с фитоценами шельфовых вод вокруг архипелага Шпицберген, не подверженных влиянию этого течения. Здесь структура лидирующих комплексов фитопланктона определяется холодноводными арктическими видами [6–8]. То же самое относится и к северной части Баренцева моря, где в летних фитоценах доминируют арктические виды [9]. Исключения составляют глубоководные желоба: в частности, в желобе Франц-Виктория в летний период 2017 г. подповерхностные максимумы численности и биомассы фитопланктона формировались бореально-арктической диатомеей Eucampia groenlandica [10].
Исследования, проведенные в прикромочной зоне в котловине Нансена (83° с.ш., глубина 3000 м) в августе 2012 г. на разрезе от восточного побережья Шпицбергена в открытое море [8], показали, что в планктонном фитоцене при низких показателях численности и биомассы сообщества доминировали представители “ледовой флоры” – холодноводные арктические пеннатные диатомеи из родов Fragilariopsis, Nitzschia и Navicula.
Исследования гидрофизической структуры, выполненные в котловине Нансена позднее с 2013 по 2017 г., позволили выявить продвижение зоны влияния АВ на гидрологический и ледовый режимы вдоль траектории распространения этой воды, при этом в 2017 г. наблюдался аномальный сдвиг границы многолетних льдов к северо-востоку [2, 11]. В этот же период, но в южной ветви Северо-Атлантического (Норвежского) течения, входящего в юго-западную часть Баренцева моря, зафиксирован аномально высокий (9.0 × 106 кл л–1) уровень цветения кокколитофорид [3, 12]. На восточной границе моря в проливе Карские ворота примерно в это же время впервые отмечено массовое развитие другого атлантического вида – золотистой водоросли Phaeocystis pouchetii [13]. В летний период 2016 г. у северной оконечности архипелага Новая Земля в желобе Святой Анны фиксировался высокий уровень численности бореального фитопланктона и, в том числе, кокколитофорид [14], заносимых сюда, по-видимому, активизировавшимся Колгуевским течением. Судя по результатам других исследований, усиление развития бореальной флоры (до 1.6 × 105 кл л–1, Chaetoceros compressus) в южной части желоба Святой Анны происходило и ранее в 2007 и 2011 г. [15, 16].
В то же время для котловины Нансена какие-либо сведения об отклике фитопланктона на усиление притока АВ отсутствуют. Цель настоящей работы – с помощью сравнительного анализа структуры планктонных фитоценов котловины Нансена и прилежащего баренцевоморского шельфа, находящегося под непосредственным воздействием АПТ, выяснить механизмы формирования необычайно высокой интенсивности цветения в прикромочной зоне высокой Арктики.
Работа выполнена в 80-м рейсе НИС “Академик Мстислав Келдыш” 16–19 августа 2020 г. [17]. Исследование структуры фитопланктона как регулятора глобального углеродного цикла было составной частью работ по изучению потоков взвеси в морях Европейской Арктики, находящихся под влиянием климатических изменений. Пробы воды от поверхности до глубины 3000 м были собраны с помощью океанографического комплекса SBE на 7 станциях в котловине Нансена (82–83° с.ш.) и на сопредельном шельфе Баренцева моря (80–81° с.ш.) (рис. 1, табл. 1). Проанализировано 80 фитопланктонных проб. При камеральной обработке проб применяли стандартные методы, принятые в ИО РАН. В качестве фиксатора использовали формалин до конечной концентрации в пробе 0.5–1%. Определение видов и подсчет числа клеток проводили на световом микроскопе “Эргавал” (“Карл Цейс”) в водном препарате при увеличении 16 × 20 и 16 × 40. Учитывались представители всех систематических и размерных групп, кроме водорослей пикопланктона с линейными размерами <2 мкм.
Рис. 1.
Картосхема станций отбора проб фитопланктона (1) в августе 2020 г. Положение границы морского ледяного покрова (2) дано по [http://www.aari.ru/ odata/_d0015.php].
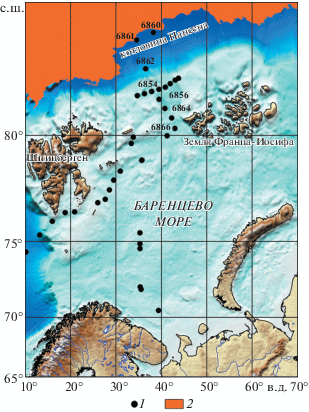
Таблица 1.
Местоположение станций, дата и время отбора проб
| Станция | Широта, с.ш. | Долгота, в.д. | Дата | Время, GMT | Глубина, м | Район исследования |
|---|---|---|---|---|---|---|
| 6854 | 81°33.22′ | 37°51.95′ | 16.08.20 | 12:32 | 426 | Баренцево море |
| 6856 | 81°41.51′ | 40°52.77′ | 16.08.20 | 14:55 | 409 | |
| 6860 | 83°16.00′ | 38°14.89′ | 17.08.20 | 07:10 | 3703 | Котловина Нансена |
| 6861 | 83°04.19′ | 34°34.61′ | 18.08.20 | 06:05 | 3670 | |
| 6862 | 82°15.62′ | 36°32.66′ | 18.08.20 | 14:30 | 2162 | |
| 6864 | 80°59.02′ | 40°46.02′ | 19.08.20 | 08:21 | 593 | Баренцево море |
| 6866 | 80°16.09′ | 42°58.39′ | 19.08.20 | 17:01 | 403 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В аномально теплый для Арктики летний период 2020 г. в котловине Нансена граница ледяных полей фиксировалась у 83° с.ш. (рис. 1, табл. 2). Подробное (от поверхности до 3000 м) исследование видовой и количественной структуры планктонных фитоценов в прикромочной зоне (станции 6860 и 6861, табл. 1) позволило установить наличие мощного цветения в верхнем распресненном слое воды на ст. 6860, сформированного крупноклеточной криопелагической центрической диатомовой водорослью Porosira glacialis (= Podosira hormoides var. glacialis Grunow, 1884) (3.5 × 105 кл л–1, 29.9 г м–3, 99% от общей сырой биомассы фитопланктона, 13 мг м–3 хлорофилла “а”, 64.1 мгС м–3 сутки–1 первичная продукция). Данная водоросль относится к представителям так называемой “ледовой флоры”, часть жизненного цикла которых ассоциирована с нижней поверхностью однолетнего льда.
Таблица 2.
Максимальные показатели общей биомассы фитопланктона (Bmax) на станциях наблюдения и соответствующие показатели температуры, солености и концентрации основных биогенных элементов
| Станция | Bmax, мг м–3 | Bmax, мгС м–3 | Глубина залегания Bmax, м | Темпера-тура, °C | Соленость, епс | Si, мкМ | ${\text{P}}{\kern 1pt} - {\kern 1pt} {\text{PO}}_{4}^{{3 - }}$, мкМ | ${\text{N}}{\kern 1pt} - {\kern 1pt} {\text{NO}}_{3}^{ - }$, мкМ | Доминирующий вид, % доминирования |
|---|---|---|---|---|---|---|---|---|---|
| 6854 | 71.59 | 3.22 | 38 | –1.37 | 34.23 | 1.15 | 0.49 | 3.83 | Eucampia groenlandica + + Thalassiosira spp., 61% |
| 6856 | 109.73 | 3.19 | 50 | –1.27 | 34.24 | 0.94 | 0.42 | 5.14 | Porosira glacialis, 99% |
| 6860* | 29 855 | 799 | 10 | –1.35 | 33.18 | 0.16 | 0.36 | 0.18 | Porosira glacialis, 99% |
| 6861* | 30.60 | 1.00 | 3 | –1.41 | 31.30 | – | – | – | Porosira glacialis, 93% |
| 6862 | 166.6 | 7.05 | 30 | –1.64 | 34.02 | 0.42 | 0.29 | 1.05 | E. groenlandica + + Thalassiosira spp., 85% Chrysophyta, 80% |
| 556.6 | 25.74 | 38 | –1.68 | 34.05 | – | – | – | ||
| 6864 | 37.4 | 3.29 | 0 | 3.30 | 33.00 | 0.36 | 0.07 | аналит. “0” | Gymnodinium spp.+ + Gyrodinium spp., 76% |
| 6866 | 4.63 | 0.32 | 20 | 3.67 | 33.69 | 0.47 | 0.13 | аналит. “0” | Gymnodinium spp. + + Protoperidinium breve + + Prorocentrum minimum, 53% |
Клетки данной водоросли концентрировались в узком слое на 5–10-метровой глубине в верхней части остроградиентного галоклина при температуре – 1.36°C и солености 33.4 епс. Фитоцен находился на ранней стадии оседания вследствие практически полного потребления биогенных элементов в поверхностном 5-метровом слое талой воды (табл. 2). Цветению сопутствовало незначительное развитие других холодноводных диатомовых водорослей из родов Thalassiosira, Lauderia, Chaetoceros, Nitzschia, Pseudonitzschia и динофлагеллят из родов Gymnodinium, Gyrodi-nium, Protoperidinium и Prorocentrum. Практически все водоросли концентрировались в верхнем 40-метровом слое воды в пределах фотической зоны. В афотической зоне, начиная с глубины 50 м и вплоть до глубины 3000 м, в сообществе присутствовали преимущественно споры Thalasiossira gravida и Porosira glacialis, а также пустые створки Thalasiossira spp. Подобное распределение в афотическом слое было характерно для всех глубоководных станций. Следует особо отметить присутствие в ядре АВ на ст. 6862 диатомеи P. glacialis (3.0 × 102 кл л–1).
Планктонные фитоцены станций 6860 и 6862 (последняя располагалась на свале глубин в зоне основного потока АПТ), демонстрировали высокую степень сходства (>50% общих видов). В составе этих фитоценов присутствовал вид-индикатор АВ – кокколитофорида E. huxleyi. Повсеместно встречались представители атлантического океанического комплекса из родов Rhizosolenia (R. hebetata f. semispina, R. hebetata f. hebetata, R. styliformis, R. setigera) и Chaetoceros (C. borealis, C. atlanticus, C. danicus) [18]. На ст. 6860 регистрировались высокозалегающие нутриклин (3.82 мкМ азота нитратного, горизонт 20 м, табл. 2) и остроградиентный галоклин (горизонт 5–10 м), отделяющий тонкий поверхностный слой талой воды от нижележащих арктических вод, а также ядро теплых АВ (температура от 1.22 до 2.53°С, соленость выше 34.8 епс) на горизонтах 100–200 м. Все изложенные факты являются убедительным свидетельством присутствия вод АПТ в котловине Нансена и их подъема к поверхности. Так, центрическая диатомея R. hebetata f. semispina – летняя массовая форма бореальной Атлантики – фиксировалась на ст. 6860 даже в слое 5–10 м. Это объясняется тем, что глубина залегания галоклина в прикромочной зоне варьировала в течение суток и могла подниматься до горизонта 5 м (рис. 2).
Рис. 2.
Глубина залегания галоклина в котловине Нансена по данным CTD-зондирований 17–18 августа 2020 г.: ст. 6860 (1, 2) и ст. 6861 (3, 4).
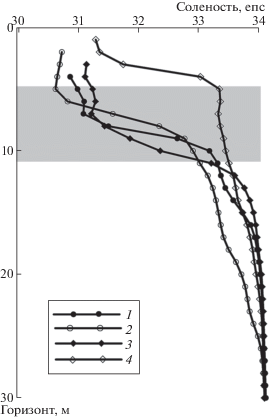
Напротив, на ст. 6861, также располагавшейся у ледяной кромки, при показателях температуры и солености более низких, чем на ст. 6860 (табл. 2), но при доминировании того же вида (P. glacialis) цветения не наблюдалось. Численность и биомасса сообщества были низкими, биомасса не превышала 30.6 мг м–3 (1 мг м–3 хлорофилла “а”) и была максимальной на горизонте 3 м при температуре –1.43°С и солености 31.3 епс (табл. 2). Причиной столь существенных различий могло быть менее выраженное влияние АПТ. Остроградиентный галоклин здесь располагался ниже (14–20 м), а нутриклин – на 34 м (табл. 2). О слабом воздействии АПТ на структуру фитоцена ст. 6861 может также свидетельствовать низкая (<20%) степень сходства видовой структуры станций 6861 и 6862: нахождение видов атлантического океанического комплекса (Rhizosolenia spp., Chaetoce-ros spp.) на большей глубине (34–90 м), а индикаторного вида (кокколитофорида Coccolithus pelagicus) лишь в ядре АПТ (горизонт 185 м) на ст. 6861. Тем не менее высокая физиологическая активность клеток в поверхностном слое воды ст. 6861 (первичная продукция 30.3 мгС м–3 сутки–1, горизонт 1 м) могла быть потенциалом для развития цветения при усилении воздействия АПТ. В августе 2012 г. [8] “цветение” в прикромочной зоне этого района отсутствовало. В фитоцене доминировали холодноводные арктические виды, преимущественно из рода Fragilariopsis. Ядро АВ располагалось намного глубже, чем в 2020 г. – на глубине 600 м, что могло быть причиной наблюдающихся различий в структуре планктонных фитоценов разных лет.
Сравнительный анализ структуры фитопланктона в изученном нами районе свидетельствует о том, что на северном шельфе Баренцева моря (станции 6854, 6856, 6864, 6866) и в районе свала глубин (ст. 6862) наблюдались более поздние стадии фитопланктонной сукцессии, обусловленные стратификацией водной толщи вследствие летнего прогрева поверхностного слоя. Истощение запасов биогенных элементов в верхнем продуцирующем слое является причиной прекращения диатомового цветения с последующим его оседанием в нижележащие слои. Так, на шельфовых станциях 6854 и 6856, а также на ст. 6862, фиксировались подповерхностные максимумы численности и биомассы диатомовых водорослей из родов Eucampia и Thalassiosira и золотистой водоросли Phaeocystis pouchetii, располагавшиеся в нижней части фотической зоны и ассоциированные с нутриклином (табл. 2). Наличие таких максимумов является характерной особенностью летних фитоценов северного Шпицбергенского шельфа, находящегося под воздействием АПТ [8].
Вблизи архипелага Земля Франца Иосифа (станции 6864 и 6866) развитие фитопланктона лимитировалось низкими концентрациями биогенных элементов, прежде всего, нулевыми концентрациями азота нитратного, потребленных в процессе весеннего цветения диатомовых (табл. 2). В сообществе доминировали миксо- и гетеротрофные динофлагелляты из родов Gymnodinium и Gyrodimium. На ст. 6864, где ядро АПТ было хорошо выражено, индикаторами АВ выступали кокколитофорида E. huxleyi (3.2 × 103 кл л–1, слой 0–20 м) и тепловодная крупноклеточная динофлагеллята Ceratium horridum, встреченная на глубине 20 м на границе полярной поверхностной и арктической промежуточной водных масс [8]. Крайне низкие, по сравнению с остальными станциями, количественные показатели фитопланктона зафиксированы на ст. 6866 (до 4.6 мг м–3, горизонт 20 м), где присутствие ядра АВ с соленостью 34.8 епс было наименее выраженным: самая высокая температура для слоя 100–200 м отмечена на горизонте 111 м (–0.02°C, табл. 2).
Таким образом, результаты исследований, проведенных в летний период 2020 г., свидетельствуют о кардинальной перестройке планктонных фитоценов прикромочной зоны, произошедшей в составе доминант при резком увеличении численности нового доминирующего вида – бореально-арктической P. glacialis до уровня цветения. Этот вид пришел на смену холодноводным арктическим видам “ледовой флоры” из родов Fragilariopsis, Nitzchia и Navicula, доминировавшим в планктонных фитоценах прикромочной зоны этого участка котловины Нансена в августе 2012 г. [8]. Обращает на себя внимание тот факт, что беспрецедентно высокий уровень биомассы сообщества (30 г м–3) достигался за счет массового развития одного вида (P. glacialis), широко распространенного в Северной Атлантике и в тех районах бореальной зоны, для которых характерно наличие сезонного ледяного покрова. Имея в виду факт обнаружения данного вида в ядре атлантических вод АПТ на ст. 6862, можно предположить его транспортировку водами этого течения в высокую Арктику.
Обнаруженный нами феномен массового развития P. glacialis в котловине Нансена по своей природе является весенним цветением, которое развивается у кромки ледяных полей в период ледотаяния и обычно наблюдается в высокой Арктике в июле–августе. В столь высоких широтах (83○ с.ш.) явление весеннего цветения наблюдается впервые in situ. Ранее повышенная продуктивность в прикромочной зоне регистрировалась только по спутниковым данным [19]. Цветение инициировалось активным воздействием вод АПТ. Влияние этих вод прослеживалось вплоть до поверхности моря, вследствие чего формировался высокозалегающий остроградиентный галоклин, отделявший талые воды от нижележащих слоев. Отсутствие цветения на ст. 6861, также располагавшейся в прикромочной зоне, можно объяснить слабым влиянием АПТ.
Воздействие АПТ в августе 2020 г. прослеживалось на фитоценах как шельфовых станций, так и над свалом глубин. В отсутствие ледяного покрова подповерхностные максимумы численности и биомассы формировались в слое 30–50 м, прежде всего, за счет диатомеи Eucampia groenlandica – вида, формирующего весенние цветения в субполярной Северной Атлантике и Арктике в условиях открытой воды. Районы, где влияние АПТ было минимальным (ст. 6866), фиксировался самый низкий для летнего периода уровень количественного развития фитопланктона (4.6 мг м–3).
ВЫВОДЫ
Получены первые натурные данные о мощном цветении диатомовых водорослей с биомассой 30 г м–3 в прикромочной зоне (83° с.ш.) котловины Нансена, обусловленном активным воздействием атлантической воды.
Впервые для высокой Арктики показано, что видом, формирующим прикромочное цветение, может быть криопелагическая крупноклеточная центрическая диатомовая водоросль Porosira glacialis. При высоком уровне численности (3.6 × 105 кл л–1) вклад этой водоросли в общую биомассу достигал 99%.
Установлено, что основным механизмом запуска цветения было формирование высокозалегающего остроградиентного галоклина, отделяющего талые воды от нижележащих вод, и являющегося следствием подъема атлантической воды к поверхности.
Список литературы
Polyakov I.V., Pnyushkov A.V., Alkire M.B., et al. Greater Role for Atlantic Inflows on Sea-ice Loss in the Eurasian Basin of the Arctic Ocean // Science. 2017. V. 536. P. 285–291.
Иванов В.В., Репина И.А. Влияние сезонной изменчивости температуры атлантической воды на ледяной покров Северного Ледовитого океана // Известия РАН. Физика атмосферы и океана. 2018. Т. 54. № 1. С. 73–82.
Oziel L., Baudena A., Ardyna M., et al. Faster Atlantic Currents Drive Poleward Expansion of Temperate Phytoplankton in the Arctic Ocean // Nature Communications. 2020. 11:1705. https://doi.org/10.1038/s41467-020-15485-5
Søreide J.E., Leu E., Berge J., et al. Timing in Blooms, Algal Food Quality and Calanus glacialis Reproduction and Growth in a Changing Arctic // Global Change Biology. 2010. V. 16. P. 3154–3163.
Neukermans G., Oziel L., Babin M. Increased Intrusion of Warming Atlantic Water Leads to a Rapid Expansion of Temperate Phytoplankton in the Arctic // Global Change Biology. 2018. V. 24(6). P. 1–9.
Giraudeau J., Hulot V., Hanquiez V., et al. A Survey of the Summer Coccolithophore Community in the Western Barents Sea // Journal of Marine Systems. 2016. V. 158. P. 93–105.
Owrid G., Socal G., Civitarese G., et al. Spatial Variability of Phytoplankton, Nutrients and New Production Estimates in the Waters around Svalbard // Polar Research. 2000. 19 (2). P. 155–171.
Hop H., Assmy P., Wold A., et al. Pelagic Ecosystem Characteristics Across the Atlantic Water Boundary Current from Rijpfjorden, Svalbard, to the Arctic Ocean During Summer (2010–2014) // Frontiers in Marine Science. 2019. 6:181. https://doi.org/10.3389/fmars.2019.00181
Макаревич П.Р., Олейник А.А. Фитопланктон Баренцева моря в весенний период: состав и структура в районе ледовой кромки // Труды Кольского научного центра РАН. 2017. Т. 8. № 2–4. С. 50–58.
Паутова Л.А. Фитопланктон Баренцева моря // Система Баренцева моря / Отв. ред. А.П. Лисицын. М: Научный мир, 2021. С. 317–330.
Аксенов П.В., Иванов В.В. “Атлантификация” как вероятная причина сокращения площади морского льда в бассейне Нансена в зимний сезон // Проблемы Арктики и Антарктики. 2018. Т. 64. № 1(115). С. 42–54.
Silkin V., Pautova L., Giordano M., et al. Interannual Variability of Emiliania huxleyi Blooms in the Barents Sea: In situ Data 2014–2018 // Marine Pollution Bulletin. 2020. V. 158. 111392. https://doi.org/10.1016/j.marpolbul.2020.111392
Сажин А.Ф., Мошаров С.А., Романова Н.Д. и др. Планктонное сообщество Карского моря ранней весной // Океанология. 2017. Т. 57. № 1. С. 246–248.
Сергеева В.М., Суханова И.Н., Флинт М.В. и др. Фитопланктон желоба Святой Анны: влияние абиотических факторов // Океанология. 2020. Т. 60. № 4. С. 528–544.
Суханова И.Н., Флинт М.В., Дружкова Е.И. и др. Фитопланктон северо-западной части Карского моря // Океанология. 2015. Т. 55. № 4. С. 605–619.
Сергеева В.М., Суханова И.Н., Дружкова Е.И. и др. Структура и распределение фитопланктона в глубоководных районах северной части Карского моря // Океанология. 2016. Т. 56. № 1. С. 113–119.
Клювиткин А.А., Политова Н.В., Новигатский А.Н., Кравчишина М.Д. Исследования Европейской Арктики в 80-м рейсе научно-исследовательского судна “Академик Мстислав Келдыш”// Океанология. 2021. Т. 61. № 1. С. 156–158.
Paasche E. Phytoplankton Distribution in the Norwegian Sea in June, 1954, related to Hydrography and Compared with Primary Production data // Report on Norwegian Fishery and Marine Investigations. 1960. V. XII. No. 11. P. 1–77.
Perrette M., Yool A., Quartly G.D., Popova E.E. Near-ubiquity of Ice-edge Blooms in the Arctic // Biogeosciences. 2011. V. 8. P. 515–524.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле


