Доклады Российской академии наук. Науки о Земле, 2022, T. 502, № 1, стр. 16-21
Оценка роли карбонат-бикарбонатных флюидов в транспорте и осаждении РЗЭ в процессе рудообразования (термодинамическое моделирование)
Г. П. Широносова 1, *, И. Р. Прокопьев 1, 2
1 Институт геологии и минералогии им. В.С. Соболева Сибирского отделения Российской академии наук
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: shiron@igm.nsc.ru
Поступила в редакцию 12.08.2021
После доработки 01.10.2021
Принята к публикации 06.10.2021
- EDN: DYUQYS
- DOI: 10.31857/S2686739722010078
Аннотация
Выполнены термодинамические расчеты по воздействию на монацит + кальцит карбонат-бикарбонатных охлаждающихся от 500 до 100°С флюидов с одновременным понижением давления от 2000 до 125 бар. Показано, что карбонат-бикарбонатные комплексы РЗЭ приобретают значение только при пониженных температурах. При этом общая концентрация лантаноидов во флюиде оказывается довольно низкой. Это свидетельствует о том, что в присутствии даже незначительных количеств фтора и кальция в гидротермальной системе карбонат-бикарбонатные флюиды не приводят к выносу РЗЭ, а способствуют их накоплению в виде осаждающихся фторокарбонатов. Таким образом, впервые для широкого ряда ТР-параметров и всего ряда лантаноидов проведена оценка роли карбонат-бикарбонатных гидротермальных флюидов в транспорте и отложении редкоземельных элементов.
Авторы обзора по карбонатитовым месторождениям редкоземельных элементов (РЗЭ) [1] приходят к выводу, что обогащение, миграция и осаждение РЗЭ в основном происходят во флюидах, богатых CO2, при средних и высоких температурах, хотя предпосылкой для обеспечения достаточного количества РЗЭ на ранней стадии эволюции флюидов является жидкостная несмесимость между карбонатитовыми расплавами и гидротермальными флюидами. Широкое распространение CO2 [2, 3] и бикарбонатных флюидов (вплоть до образования дочерних включений нахколита NaHCO3 [4] и троны Na2CO3 NaHCO3 H2O [5] на карбонатитовых месторождениях заставляют обратить внимание на роль карбонат-бикарбонатных комплексов в транспорте редкоземельных элементов (РЗЭ) при формировании их месторождений.
Экспериментально были изучены карбонат-бикарбонатные комплексы Y + РЗЭ только для нормальных условий в основополагающих работах [6, 7]. Для повышенных температур их устойчивость была предсказана методом экстраполяции [8]. В настоящей работе эти данные используются для оценки роли карбонат-бикарбонатных комплексов в транспорте и отложении РЗЭ при формировании их месторождений. С этой целью проведены термодинамические расчеты по составу равновесных минеральных ассоциаций и сосуществующих флюидов при воздействии на монацит + + кальцит слабокислого и близнейтрального щелочного флюидов, охлаждающихся от 500 до 100°С при одновременно снижающемся давлении от 2000 до 125 бар. Из твердых фаз в исходный состав системы вводилось 5.37 × 10–3 моль модельного монацита, содержащего РЗЭ в соотношении (моли соответствующих фосфатов): La – 1.3 × 10–3, Ce – 2.4 × 10–3, Pr – 2.7 × 10–4, Nd – 8.3 × 10–4, Sm – 1.17 × 10–4, Eu – 4.7 × 10–6, Gd – 9 × 10–5, Tb – 9.17 × × 10–6, Dy – 3.8 × 10–5, Ho – 5.2 × 10–8, Er – 9.5 × × 10–6, Yb – 2.7 × 10–6, Lu – 2 × 10–7, Y – 2.4 × 10–4 и 0.001 моль СаСО3. В качестве возможных равновесных твердых фаз РЗЭ-содержащие минералы в расчетах рассматриваются как идеальные твердые растворы: монацит (LnPO4, где Ln – La, Ce, Pr, Nd, Sm, Eu, Gd); РЗЭ-флюорит (CaF2 – (Ln, Y)F3) и РЗЭ-фторапатит (Ca5(PO4)3F – (Ln, Y)3(PO4)3), где Ln весь ряд от La до Lu, а также ксенотим (Y, Ln)PO4, где Ln – Tb, Dy, Er, Yb, Lu. Из-за отсутствия данных по конечным миналам во фторокарбонатах РЗЭ бастнезит и паризит приняты как минералы постоян-ного состава Ce0.5La0.25Nd0.2Pr0.05CO3F и CaCe0.95La0.6Nd0.35Pr0.1(CO3)3F2 соответственно [9]. Термодинамические данные для фосфатов РЗЭ заимствованы из [10]. Расчеты проведены для слабокислых и близнейтральных – слабощелочных флюидов с применением программного комплекса HCh [11] в комплексе с базой термодинамических данных UNITHERM, дополненной недостающими термодинамическими данными из работы [10]. Данные для кальцита, флюорита и фторапатита заимствованы из [12], для базовых ионов и комплексных частиц макросистемы – из термодинамической базы данных SUPCRT [13], а для HCl взяты из публикации [14].
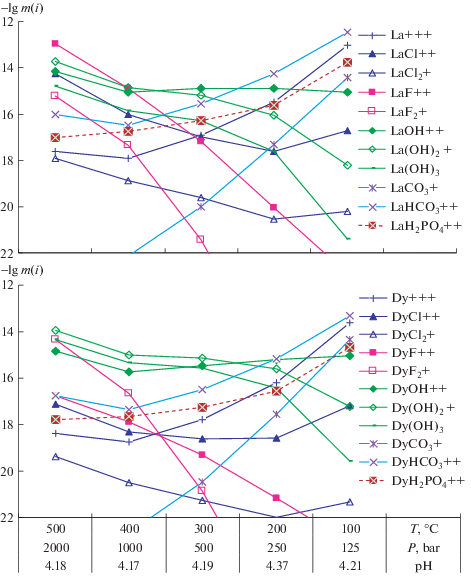
В случае слабокислого флюида в исходный состав его входило 4mH2CO3 + E-4mHCl + 3E-3mHF + mKOH (здесь и далее m означает моль/кг H2O), KOH вводился для создания определенного рН примерно равным 4.2 (см. подписи к оси абсцисс на рис. 1). Соотношение равновесных твердых фаз после воздействия на монацит + кальцит слабокислого карбонатного раствора в условиях охлаждающегося гидротермального флюида приведено на рис. 1.
Рис. 1.
Соотношение твердых фаз в результате взаимодействия ассоциации монацит + кальцит с охлаждающимся слабокислым карбонатным флюидом. Исходный состав системы: 0.001mCaCO3 + 5E–3m monazite + 4mH2CO3 + E–4mHCl + 3E–3mHF + mKOH.
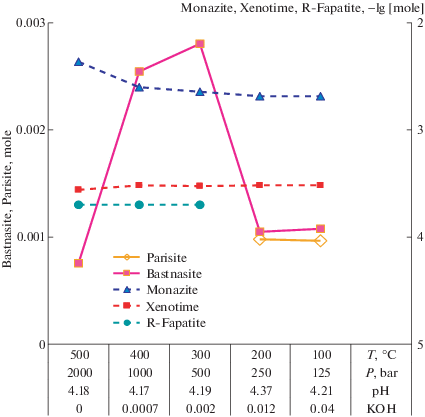
Во всем температурном интервале новообразованными оказываются бастнезит (привязан к левой оси ординат, количество приведено в молях) и ксенотим (правая ось ординат, где его количество приведено в логарифмических единицах).
В интервале 500–300°С образуется редкоземельный фторапатит (R-ftorapatite – правая ось ординат), который с понижением температуры замещается паризитом (левая ось ординат). Ввиду низкого содержания фтора во флюиде и исходно малого количества введенного кальция предусмотренная возможность образования редкоземельного флюорита не реализуется. За оба эти компонента идет конкуренция между редкоземельным фторапатитом и паризитом. Количество монацита исходно взято с избытком, поэтому он остается не израсходованным и присутствует в равновесной ассоциации во всем интервале исследованных параметров флюида. Оговоримся, что низкие концентрации хлорид- и фторид-ионов во флюиде приняты во избежание превалирования их РЗЭ-комплексов и подавления образования карбонат-бикарбонатных комплексов РЗЭ.
На рис. 2 в качестве примера показано распределение представителя легких лантана и тяжелых РЗЭ – диспрозия по их формам в слабокислом флюиде. Хорошо видно, что в случае La, несмотря на принятую низкую концентрацию HF при 500°С, первый его фторокомплекс LaF+2 оказывается ведущим, при 400°С к нему присоединяется второй гидроксокомплекс La(OH)$_{2}^{ + }$, а к 300°С они оба уступают место первому гидроксокомплексу LaOH+2. Только при 200–100°С на первое место выходит бикарбонатный комплекс лантана LaHCO$_{3}^{{ + 2}}$. Обратим внимание на то, что в целом общая концентрация лантана максимальная при 500 и 100°С не превышает 10–12 молей, при средних температурах опускаясь до 10–15 молей. Что касается диспрозия, то в высокотемпературной области вплоть до 300°С на первое место выходит второй гидроксокомплекс Ln(OH)$_{2}^{ + }$, а на втором месте оказывается второй фторокомплекс DyF$_{2}^{ + }$, но только при 500°С. Бикарбонатный комплекс диспрозия DyHCO$_{3}^{{ + 2}}$ также как и для лантана становится преобладающим только при 200–100°С. Аналогичная картина наблюдается и для остальных РЗЭ с той лишь разницей, что и при 100°С с возрастанием номера лантаноида наблюдается общее понижение их концентрации до 10–14–10–15 моля, несмотря на то, что при 100°С к бикарбонатным их комплексам присоединяется частица Ln+3. Таким образом, в слабокислых условиях карбонатные растворы несут низкие концентрации РЗЭ и не способствуют их выносу в процессе рудообразования благодаря осаждению их фторокарбонатных минералов бастнезита и паризита.
При расчетах в близнейтральных–слабощелочных условиях в исходный состав раствора введено 4mNaHCO3 + 3.8mHCl + 5E-3mHF + mKOH, количество щелочи менялось для создания определенного рН примерно равным 7.3 (показано в подписях к оси абсцисс рис. 3). На рис. 3 приведено соотношение равновесных твердых фаз в варианте слабощелочного флюида, воздействовавшего также на исходную ассоциацию монацита с кальцитом. Сплошными линиями показано количество молей новообразованных бастнезита и паризита (левая ось ординат). Пунктирными линиями обозначены логарифмы количеств (lg [моль], правая ось ординат) остаточного монацита и новообразованных ксенотима и фторапатита.
Рис. 3.
Соотношение твердых фаз после взаимодействия ассоциации монацит + кальцит с охлаждающимся слабощелочным раствором бикарбоната натрия. Исходный состав системы: 0.001mCaCO3 + 5E–3m monazite + 4mNaHCO3 + + 3.8mHCl + 5E–3mHF + mKOH.
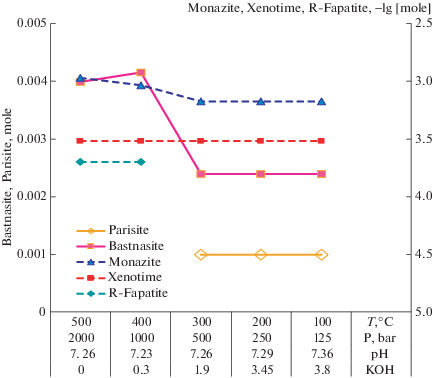
В целом равновесная ассоциация остается аналогичной наблюдавшейся при воздействии слабокислого флюида. По-прежнему во всем исследованном интервале параметров наблюдаются образование бастнезита и ксенотима и конкуренция за кальций и фтор между редкоземельным фтор-апатитом и паризитом. РЗЭ-фторапатит оказывается устойчивым в высокотемпературной области, а при понижении температуры уступает место фторокарбонату – паризиту. Отличие заключается лишь в том, что в слабощелочных условиях область устойчивости РЗЭ-фторапатита сокращается до 500–400°С, а паризит появляется на 100°С раньше в интервале 300–100°С.
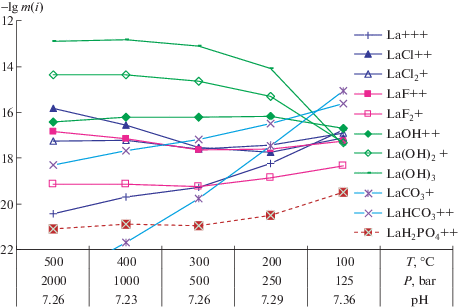
На рис. 4 для примера показано распределение лантана по формам в равновесном флюиде. Как и следовало ожидать, в слабощелочных условиях в широкой области параметров системы (от 500 до 200°С) ведущими оказываются третий и второй гидроксокомплексы La(OH)$_{3}^{0}$ > La(OH)$_{2}^{ + }$. Отметим, что четвертый гидроксокомплекс La(OH)$_{4}^{ - }$ нами исключен из числа возможных, так как при экспериментальном исследовании устойчивости гидроксокомплексов РЗЭ в работе [15] этот комплекс не обнаружен. К 100°C концентрация гидроксокомплексов значительно понижается, и на первое место выходит сначала карбонатный комплекс LaCO$_{3}^{ + }$ и следом за ним идет бикарбонатный комплекс LaHCO$_{3}^{{ + 2}}$. Для остальных лантаноидов с возрастанием их номера начиная с самария всю область температур от 500 до 200°С занимают все три гидроксокомплекса в порядке La(OH)$_{3}^{0}$ > > La(OH)$_{2}^{ + }$ > La(OH)+2. Следует отметить, что если в слабокислых условиях ведущим был бикарбонатный комплекс и концентрация его при 100°С приближалась к 10–12 моль, то при тех же 100°С, где карбонат-бикарбонатные комплексы преобладают, общая концентрация их достигает лишь 10–15 моль. Это, по-видимому, обусловлено повышенным образованием паризита в близнейтральных условиях (максимально возможным из-за ограничения по кальцию – 0.001 моль). Увеличение при расчетах исходной концентрации NaHCO3 до 6 молей приводит при 100°С к образованию в равновесной ассоциации нахколита, в соответствии с данными работы [16], но это не сопровождается повышением концентрации карбонат-бикарбонатных комплексов РЗЭ.
Рис. 4.
Распределение по формам лантана в слабощелочном–близнейтральном флюиде бикарбоната натрия (см. рис. 3).
Таким образом, проведенное исследование воздействия на монацит в ассоциации с кальцитом карбонат-бикарбонатных флюидов в широком диапазоне ТР-параметров показало, что карбонат-бикарбонатные комплексы РЗЭ приобретают значение только при пониженных температурах. При этом общая концентрация лантаноидов во флюиде оказывается довольно низкой. Это свидетельствует о том, что в присутствии даже незначительных количеств фтора и кальция в гидротермальной системе карбонат-бикарбонатные флюиды не приводят к выносу РЗЭ, а способствуют их накоплению в виде осаждающихся фторокарбонатов, в нашем случае – бастнезита и паризита. Следует особо отметить тот факт, что наши оценки роли карбонат-бикарбонатных флюидов являются приблизительными из-за не учета возможной гетерогенности карбонатных флюидов в области повышенных ТР-параметров, а также из-за отсутствия экспериментальных данных по определению констант устойчивости карбонатных комплексов РЗЭ. Для уточнения сделанных выводов требуется настоятельная необходимость их определения особенно в области повышенных температур.
Список литературы
Wang Zhen-Yu, Fan Hong-Rui, Zhou L., Yang Kui-Feng, She H.-Dong. Carbonatite-Related REE Deposits: An Overview // Minerals. 2020. 10. 965. https://doi.org/10.3390/min10110965
Chen J., Yang R.-D., Du L.-J., Gao J.-B., Zheng L.-L., Huang Z.-L. Multistage Fluid Sources and Evolution of Qinglong Sb-(Au) Deposit in Northern Margin of Youjiang Basin, SW China: REE Geochemistry and Sr-H-O Isotopes of Ore-related Jasperoid, Quartz and Fluorite // Ore Geology Reviews. 2020. V. 127. 103851.
Yuan H.-X., Ni P., Chen H., Lv Z.-Ch., Yu X.-F., Bao T., Wang G.-G., Hu R.-H., Du J.-W. Geology, Fluid Inclusion and H-O-S-Pb Isotope Constraint on the Genesis of the Changxing Gold Deposit, Fujian, South China // Ore Geology Reviews. V. 129. 103887.
Vasyukova O.V., Williams-Jones A.E. Direct Measurement of Metal Concentrations in Fluid Inclusions, a Tale of Hydrothermal Alteration and REE Ore Formation from Strange Lake, Canada // ChGeol. 2018. V. 483. P. 385–396.
Prokopyev I.R., Doroshkevich A.G., Zhumadilova D.V., Starikova A.E., Nugumanova Ya.N., Vladykin N.V. Petrogenesis of Zr–Nb (REE) Carbonatites from the Arbarastakh Complex (Aldan Shield, Russia): Mineralogy and Inclusion Data // Ore Geology Reviews. 2021. V. 131. 104042.
Liu X.W., Byrne R.H. Comprehensive Investigation of Yttrium and Rare Earth Element Complexation by Carbonate Ions Using ICP Mass Spectrometry // J. Solution Chem. 1998. V. 27. P. 803–815.
Luo Y.R., Byrne R.H. Carbonate Complexation of Yttrium and the Rare Earth Elements in Natural Waters // Geochim. Cosmochim. Acta. 2004. V. 68. P. 691–699.
Haas J., Shock E.L., Sassani D. Rare Earth Elements in Hydrothermal Systems: Estimates of Standard Partial Molal Thermodynamic Properties of Aqueous Complexes of the Rare Earth Elements at High Temperature and Pressure // Geochimica et Cosmochimica Acta. 1995. V. 59. P. 4329–4350.
Gysi A.P., Williams-Jones A.E. The Thermodynamic Properties of Bastnasite-(Ce) and Parisite-(Ce) // Chemical Geology. 2015. V. 21. P. 87–101.
Migdisov A., Williams-Jones A.E., Brugger J., Caporuscio F.A. Hydrothermal Transport, Deposition, and Fractionation of the REE: Experimental Data and Thermodynamic Calculations // Chemical Geology. 2016. V. 439. P. 13–42.
Shvarov Yu.V. HCh: New Potentialities for the Thermodynamic Simulation of Geochemical Systems Offered by Windows // Geochemistry International. 2008. V. 46. № 8. P. 834–839.
Robie R.A., Hemingway B.S. Thermodynamic Properties of Minerals and Related Substances at 298.15 K and 1 Bar (105 Pascals) Pressure and at Higher Temperatures // U.S.Geological Survey Bulletin. 1995. V. 2131. P. 461.
Johnson J.W., Oelkers E.H., Helgeson H.C. SUPCRT92: A Software Package for Calculating the Standard Molal Thermodynamic Properties of Minerals, Gases, Aqueous Species, and Reactions from 1 to 5000 Bar and 0 to 1000°C // Computer Geoscientist. 1992. V. 18. P. 899–947.
Tagirov B.R., Zotov A., Akinfiev N. Experimental Study of Dissociation of HCl from 350 to 500°C and from 500 to 2500 Bars: Thermodynamic Properties of HCl°(aq) // Geochimica et Cosmochimica Acta. 1997. V. 61. P. 4267–4280.
Stepanchikova S.A., Biteikina R.P., Shironosova G.P., Kolonin G.R. An Experimental Study of Hydroxo Complex Formation in Basic and Near-neutral Solutions of Rare-earth Elements and Yttrium at 25°C // Russian Geology and Geophysics. 2014. V. 55. P. 941–944.
Широносова Г.П., Борисенко А.С., Колонин Г.Р. Термодинамическая оценка условий устойчивости нахколита // Труды Всероссийского ежегодного семинара по экспериментальной минералогии, петрологии и геохимии. Москва. 2015. С. 167–170.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле