Доклады Российской академии наук. Науки о Земле, 2022, T. 504, № 2, стр. 205-212
Кристаллохимический фактор выбора матриц РЗЭ-актинидов
Член-корреспондент РАН С. В. Юдинцев 1, 2, *, М. С. Никольский 1, О. И. Стефановская 2, Б. С. Никонов 1
1 Институт геологии рудных месторождений, петрографии, минералогии и геохимии
Российской академии наук
Москва, Россия
2 Институт физической химии и электрохимии
им. А.Н. Фрумкина Российской академии наук
Москва, Россия
* E-mail: yudintsevsv@gmail.com
Поступила в редакцию 01.03.2022
После доработки 09.03.2022
Принята к публикации 10.03.2022
- EDN: PFFSTM
- DOI: 10.31857/S2686739722060159
Аннотация
Титанаты легких редких земель (РЗЭ): РЗЭ2TiO5, РЗЭ2Ti2O7 и РЗЭ4Ti9O24 – потенциальные матрицы для иммобилизации РЗЭ-актинидной фракции высокоактивных отходов переработки облученного ядерного топлива. Проанализированы данные о вхождении примесных элементов (цирконий, уран, кальций) в эти фазы. В них проявлен ограниченный изоморфизм в отношении данных элементов, в том числе согласно реакции: 2РЗЭ3+ = Сa2+ + U4+, обычной для природных минералов и их синтетических аналогов. Рассмотрены причины низкой растворимости примесей в структурах титанатов РЗЭ. Проанализирована роль кристаллохимического фактора при выборе оптимальных типов матриц для иммобилизации РЗЭ-актинидной фракции.
В России реализуется стратегия двухкомпонентной ядерной энергетики с реакторами на медленных и быстрых нейтронах с переработкой отработавшего ядерного топлива [1]. В результате образуются радиоактивные отходы, в том числе высокого уровня активности (ВАО). Ключевая задача повышения безопасности ядерной энергетики – это разработка способов обращения с долгоживущими трансурановыми актинидами, которые представлены Pu и малыми актинидами – Np, Am и Cm. Малые актиниды могут быть выделены из ВАО в виде РЗЭ-МА-фракции (МА = = Am, Cm) и включены в емкие фазы с низкой растворимостью в воде для захоронения [2]. В составе РЗЭ-МА-фракции доминируют крупные лантаниды (La, Ce, Pr, Nd, Sm), на Am и Cm приходится до 10 мас. % [3]. Перспективными матрицами для фракции РЗЭ-актинидов служат титанаты и цирконаты РЗЭ [1, 2, 4]. При их изучении много внимания уделялось оксидам со структурой пирохлора и флюорита [2, 4, 5], меньше данных имеется о свойствах титанатов РЗЭ, в основном они касаются влияния типа РЗЭ на структуру фаз состава РЗЭ2TiO5 и РЗЭ2Ti2O7 и изучения их поведения при ионном облучении [6, 7].
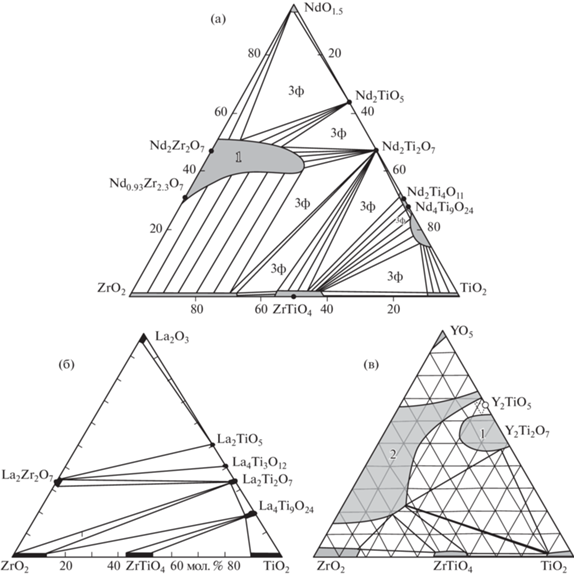
Аналог Am3+ и Cm3+ – это Nd3+, поэтому наибольший интерес при поиске матриц РЗЭ-МА-фракции вызывают соединения неодима. В системе Nd2O3–TiO2–ZrO2 имеются (рис. 1а) фазы [8]: Nd2(Ti,Zr)2O7 со структурой пирохлора (далее кратко LnTZ), TiO2 (T, рутил), ZrTiO4 (ZT, шриланкит) и тетрагональный ZrO2 (Zt). Титанаты Nd представлены: Nd2TiO5 (LnT), Nd2Ti2O7 (LnT2), Nd2Ti4O11 (LnT4), Nd4Ti9O24 (Ln2T9). Исследовались и другие титанатные и цирконатные системы с РЗЭ: La2O3–TiO2–ZrO2 [9], Y2O3–TiO2–ZrO2 [10], Nd2O3–TiO2 [11]. В работе [11] доказана идентичность Nd2Ti4O11 и Nd4Ti9O24 и найдена фаза Nd2Ti3O9 (LnT3).
В системе La2О3–TiО2–ZrО2 имеются (рис. 1б) фазы: La2TiO5 (LnT), La4Ti3O12 (Ln2T3), La2Ti2O7 (LnT2), La4Ti9О24 (Ln2T9), La2Zr2О7 (LnZ2), ZrTiО4 (ZT), ZrO2 (Z), TiO2 (T). Системы с Nd2O3 и La2О3 близки по набору фаз, однако ассоциации фаз в них различны, в основном из-за намного меньшей области La‒Zr-пирохлора (LnZ2). Характерная черта титанатов Nd (La) – слабые вариации состава, отношения Ti : РЗЭ в них близки к значениям в формулах, что отражено в узких полях фаз на диаграммах. При 1350°С в LnT2, Ln2T3 и LnT входит менее 2 мол. % ZrО2 [9], содержание ZrО2 в Ln2T9 выше и равно 4 мол. % (табл. 1). Пирохлор La2Zr2О7 (LnZ2) содержит до 35 мол. % La2O3 и 69 мол. % ZrO2 при идеальных значениях 33 и 67 мол. %. Изоморфизм La3+ в ZrO2 и ZrTiО4 ограничен 1 мол. % La2О3. Высокие содержания (12–14 мол. %) наблюдаются для ZrO2 в (Ti,Zr)O2 и TiO2 в (Zr,Ti)O2, в широких пределах, от 1.4 до 0.9, меняется отношение Zr : Ti в ZrTiO4. Замена крупных РЗЭ3+ (La, Nd) на Y3+ ведет к переме- нам в строении диаграммы (рис. 1в). Структура Y2Ti2O7 становится кубической (как у пирохлора) и появляется большое поле (Zr,Y)O2–x с флюоритовой структурой. Остаются оксиды TiO2, ZrО2 и ZrTiО4, имеется Y2TiO5 с кубической структурой (пр. группа $Fm\bar {3}m$), тогда как фазы Nd2TiO5 и La2TiO5 обладают ромбической симметрией (пространственная группа Pnma).
Таблица 1.
Составы фаз (мол. %) в системе La2O3–TiO2–ZrO2, данные работы [9]
| Фаза и ее обозначение | La2O3 | TiO2 | ZrO2 |
|---|---|---|---|
| La2Ti2O7, LnT2 | 32.3 ± 0.3 | 66.2 ± 0.2 | 1.5 ± 0.3 |
| 31.7 ± 0.9 | 67.2 ± 1.0 | 1.1 + 0.2 | |
| La4Ti9O24, Ln2T9 | 17.7 ± 1.0 | 81.1 ± 1.1 | 2.2 + 0.3 |
| 16.7 ± 0.5 | 78.9 ± 0.6 | 4.4 ± 0.2 | |
| ZrTiO4, ZT | < п. о. | 53.1 ± 0.4 | 46.9 ± 0.3 |
| < п. о. | 41.6 ± 0.3 | 58.4 ± 0.3 | |
| ZrO2, Zt | < п. о. | 13.5 ± 0.6 | 86.5 ± 0.7 |
| TiO2, T | < п. о. | 88.6 ± 0.5 | 11.4 ± 0.3 |
Изменение радиуса РЗЭ3+ в системах РЗЭ2О3–TiO2 и РЗЭ2О3–ZrO2 сопровождается полиморфными превращениями. Соединения РЗЭ2Ti2O7 и РЗЭ2Zr2O7 кристаллизуются в трех структурных типах – флюорита, пирохлора и перовскитоподобного моноклинного титаната [3, 5–7]. Области стабильности пирохлора отвечают значениям отношений ионных радиусов (по Шеннону) РЗЭ и Ti (Zr) от 1.46 до 1.78, за ее пределами образуются анионно-дефицитная структура флюорита у цирконатов РЗЭ и слоистая перовскитоподобная структура для титанатов РЗЭ. Структурой пирохлора обладают титанаты средних и тяжелых РЗЭ (Ln2Ti2O7, Ln = Sm–Yb, Y) и цирконаты средних и легких РЗЭ (Ln2Zr2O7, Ln = La–Gd). Фазы РЗЭ2TiO5 с РЗЭ от La до Sm обладают ромбической структурой, от Er до Lu и для Sc – кубической, от Eu до Ho и у Y они имеют гексагональную структуру [7]. Сохранение структуры при вариациях состава – важная характеристика матриц. Если при синтезе целевой фазы образуются соединения с большей растворимостью в воде, это может вызвать ухудшение изоляционных свойств. Нами [12–16] получены данные о содержании примесей (Ca, Zr, U) в титанатах РЗЭ. Образцы готовили спеканием (ХПС), плавлением индукционным нагревом в “холодном” тигле (ИПХТ) или в электропечах (ЭП), результаты суммированы в табл. 2–4 и на рис. 2. Изучен ряд новых образцов, содержащих U (NTС-1, NTС-2, NTU-4, NTZ-1, NTZ-2, NTZ-3).
Таблица 2.
Состав, условия получения образцов и слагающие их фазы по данным РФА
| Образец | Состав (валовая формула) образца | Условия синтеза | Основные фазы |
|---|---|---|---|
| LT2 | La0.5Nd1.4Sm0.1Ti2O7 | ХПС: 1400°С, 4 ч | LnT2, Ln2T9 |
| 3б | Ln1.8Ca0.1U0.1Ti2O7 | ИПХТ: 1600°С, 1 ч | LnT2, UT2, О |
| 4 | Ln3.6Ca0.2U0.2Ti9O24 | То же | Ln2T9, UT2, О |
| МПМ–2 | 0.5 Ln4Zr0.5Ti8.5O24 + 0.5 TiO2 | То же | Ln2T9, T |
| NTС-1 | 0.5 (Ca0.5NdU0.5)ZrTiO7 + 0.5 Nd2TiO5 | ЭП: 1500°С, 1 ч | LnZT, О |
| NTС-2 | (Ca0.25Nd1.5U0.25)(Zr0.5Ti1.5)O7 | То же | LnZT, О |
| NTU-4 | 0.95 Nd2TiO5 + 0.05 UO2 | То же | LnT2, Ln2T9, О |
| NTZ-1 | 0.4Nd2TiZrO7 + 0.4Nd2TiO5 + 0.2UO2 | То же | LnZT, LnT2, О |
| NTZ-2 | 0.4Nd2TiZrO7 + 0.4Nd2Ti2O7 + 0.2 UO2 | То же | LnT2, O |
| NTZ-3 | 0.4Nd2TiZrO7 + 0.3Nd4Ti9O24 + 0.3 UO2 | То же | UT, Ln2T9, T |
Таблица 3.
Составы фаз образцов “3б” и “4”, содержащих уран и смесь редких земель
| Оксид, мас. % | Образец “3б” | Образец “4” | ||||
|---|---|---|---|---|---|---|
| LnT2 | UT2 | (Ln,U)O2 – x | Ln2T9 | UT2 | (Ln,U)O2 – x | |
| CaO | 1.2 | < п. о. | < п. о. | 0.7 | < п. о. | 0.6 |
| TiO2 | 34.2 | 45.9 | < п. о. | 52.8 | 44.5 | 0.9 |
| La2O3 | 8.7 | 2.4 | < п. о. | 5.9 | 2.1 | 3.1 |
| Ce2O3 | 18.3 | 14.3 | 16.8 | 12.2 | 10.9 | 18.7 |
| Pr2O3 | 7.2 | 2.0 | 3.2 | 4.8 | 1.9 | 2.9 |
| Nd2O3 | 24.7 | 8.6 | 12.6 | 17.2 | 8.4 | 11.4 |
| Sm2O3 | 4.7 | 2.1 | 4.5 | 3.4 | 2.1 | 2.9 |
| Eu2O3 | < п. о. | < п. о. | < п. о. | 0.8 | 0.7 | 1.0 |
| Gd2O3 | 1.0 | < п. о. | 1.2 | 0.9 | 1.0 | 1.5 |
| UO2 | < п. о. | 24.7 | 61.7 | 1.3 | 28.4 | 57.0 |
Таблица 4.
Составы (мас. %) фаз в образцах с ураном, сумма приведена к 100 маc. %
| Образец | Фаза | CaO | TiO2 | ZrO2 | Nd2O3 | UO2 |
|---|---|---|---|---|---|---|
| NTC-1 | Пирохлор | 2.5 (0.17)* | 28.4 (0.38) | 11.0 (0.48) | 50.0 (0.48) | 8.1 (0.58) |
| (Nd,Zr,U)O2 – x | < п. о. | < п. о. | 4.1 | 26.5 | 69.4 | |
| NTC-2 | Пирохлор | 2.1 | 25.6 | 11.7 | 49.3 | 11.3 |
| (Nd,Zr,U)O2 – x | < п. о. | < п. о. | 4.6 | 18.8 | 76.6 | |
| NTU-4 | Nd2TiO5 | < п. о. | 19.3 | < п. о. | 80.7 | < п. о. |
| Nd2Ti2O7 | < п. о. | 32.1 | < п. о. | 67.9 | < п. о. | |
| (Nd,U)O2 – x | < п. о. | 1.3 | 61.6 | < п. о. | 37.1 | |
| NTZ-1 | Пирохлор | Нет | 12.5 | 21.8 | 54.9 | 9.7 |
| Nd2Ti2O7 | Нет | 32.1 | < п. о. | 65.5 | 1.2 | |
| (Nd,Zr,U)O2 – x | Нет | < п. о. | 6.5 | 38.9 | 54.6 | |
| NTZ-2 | Nd2Ti2O7 | Нет | 32.3 | 0.7 | 66.3 | 0.7 |
| (Nd,Zr,U)O2 – x | Нет | 1.2 | 9.5 | 21.8 | 67.5 | |
| (U,Nd)TiO6 | Нет | 41.9 | 3.4 | 18.9 | 35.8 | |
| NTZ-3 | (Ti,Zr)O2 | Нет | 94.7 | 5.3 | < п. о. | < п. о. |
| Nd4Ti9O24 | Нет | 49.5 | 1.9 | 46.4 | 2.2 |
Рис. 2.
СЭМ-изображения образцов: (а) LT2 (1 – LnT2, 2 – Ln2T9); (б) 3б (1 – LnT2; 2 – UT2, браннерит; 3 – (Ln,U)O2 – x; 4 – титано-силикат РЗЭ); (в) 4 (1 – Ln2T9; 2 – UT2, браннерит; 3 – (Ln,U)O2–x; 4 – титано-силикат РЗЭ); (г); МПМ-2 (1 – T, рутил, 2 – Ln2T9), (д) NTC-2 (1 – пирохлор, 2 – (Ln,U)O2 – x); (е) NTU-4 (1 – LnT2, 2 – Ln2T9, 3 – (Ln,U)O2 – x). Черное – поры. Метка равна 50 (а, г–е), 20 (б) или 10 (в) микрон. Составы фаз сведены в табл. 3 и 4.

При анализе данных можно отметить широкие вариации составов фаз в отношении трехвалентных РЗЭ (табл. 3). Это связано с тем, что титанаты лантанидов (Ln3+ = La, Ce, Nd) одинаковой стехиометрии (LnT, LnT2, Ln2T9) изоструктурны. Однако, в отличие от других соединений РЗЭ (пирохлора, цирконолита, монацита, браннерита и др.), титанаты обладают низкой растворимостью в отношении четырехвалентных (U, Zr) и двухвалентных (Ca) элементов.
Концентрация ZrO2 в фазе Ln2T9 (обр. МПМ-2) составляет 2.0 мас. %, в рутиле она возрастает до 8.5 мас. %. Содержание урана в 1.3 мас. % отмечено для Ln2T9 (табл. 3), в LnT и LnT2 оно ниже предела обнаружения, равного 0.3–0.5 мас. % (табл. 3–4). Самые высокие содержания урана и циркония (10 мас. % и более) наблюдаются в пирохлоре (табл. 4). Эти особенности состава данных фаз обусловлены их кристаллохимическими характеристиками.
Титанаты и цирконаты РЗЭ кристаллизуются в нескольких структурных типах. В большинстве случаев атомы Ti и Zr окружены шестью атомами кислорода в виде октаэдра. Для крупных РЗЭ (La–Sm) доминируют координационные числа (к.ч.) VII (одношапочная тригональная призма, усеченный куб), VIII (куб, искаженный куб, двухшапочная антипризма) или IX (трехшапочная тригональная призма). С уменьшением радиуса РЗЭ3+ растет роль к.ч., равного VI. Описание структуры фаз с Nd3+ приведено в табл. 5 и на рис. 3.
Таблица 5.
Кристаллографические характеристики фаз неодима в системе Nd2O3–TiO2–ZrO2
| Формула | Простр. группа | Структурный тип | Форма полиэдра неодим – кислород, в скобках – координационное число Nd3+ | Ссылка |
|---|---|---|---|---|
| Nd2Zr2O7 | $Fd\bar {3}m$ | Ca2Nb2O7 | искаженный куб (VIII) | [5, 17] |
| Nd2TiO5 | Pnma | La2TiO5 | одношапочная тригональная призма (VII) | [18] |
| Nd2Ti2O7 | P1211 | La2Ti2O7 | искаженная одно- (VII) – двух- (VIII) – трехшапочная (IX) тригональная призма | [17] |
| Nd4Ti9O24 | Fddd | Nd4Ti9O24 | искаженная двухшапочная антипризма (VIII) – куб (VIII) – октаэдр (VI) | [19] |
Рис. 3.
Структуры фаз стехиометрии Nd2Zr2O7 (а), Nd2Ti2O7 (б), Nd2TiO5 (в) и Nd4Ti9O24 (г). Зеленым цветом показаны полиэдры Ti и Zr, коричневым – полиэдры Nd.
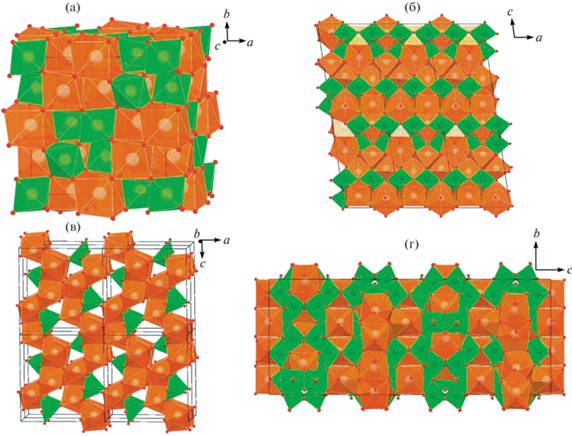
Фаза Nd2Zr2O7 имеет кубическую симметрию (рис. 3а), пространственная группа $Fd\bar {3}m$. В элементарной ячейке восемь формульных единиц, полиэдр Nd – скаленоэдр (искаженный куб), содержит 8 атомов О – шесть равноудаленных и еще два на большем расстоянии. Катионы Zr окружают 6 атомов О, находящихся в вершинах тригональной антипризмы (искаженного октаэдра). Структуру пирохлора можно описать через взаимопроникающие каркасы из октаэдров ВО6 и А2Х. Эта структура производна от решетки оксидов флюоритового типа AO2 (пр. гр. $Fm\bar {3}m$).
Структура Nd2Ti2O7 производна от структуры перовскита (рис. 3б): октаэдры TiO6, соединяясь вершинами, формируют в направлениях а и b пластины толщиной в 4 октаэдра (около 12 Å), между которыми расположены одношапочные тригональные призмы NdO7. Трехшапочные тригональные призмы полиэдров NdO9 выполняют полости октаэдрических блоков. Двухшапочные призмы NdO8 находятся внутри и между октаэдрическими блоками.
Структура Nd2TiO5 (рис. 3в) состоит из трехмерной сетки связанных ребрами семивершинников LnO7 и цепочек квадратных пирамид TiO5, соединенных вершинами в направлении [010]. Наиболее сложная структура характерна для Nd4Ti9O24: она состоит из титан-кислородного каркаса, в полостях которого расположены полиэдры Nd (рис. 3г). Атомы Nd занимают 3 позиции: полиэдр Nd(1) – искаженная квадратная антипризма, Nd(2) – октаэдр, Nd(3) – искаженная квадратная призма. Полиэдры Nd(1)O8, объединяясь по ребрам и вершинам, формируют слои, параллельные плоскости (110). Полиэдры Nd(3) связываются ребрами со слоями Nd(1) с образованием слоев толщиной около 17.5 Å, в каналах которых расположены изолированные октаэдры Nd(2).
Координационные полиэдры ионов Zr4+ и Ti4+ меньшего размера во всех фазах имеют форму октаэдра (к.ч. = VI), кроме Nd2TiO5, где к.ч. Ti4+ = V, а сам полиэдр имеет форму квадратной пирамиды. Именно этим объясняется разный изоморфизм элементов в этих фазах – широкое поле твердого раствора со структурой пирохлора и узкие поля составов фаз с близкими к их номинальной стехиометрии соотношениями элементов в остальных случаях. Низкой “растворимости” примесей (Ca, Zr, U) отвечают нечетные к.ч. неодима (VII и IX) в полиэдрах Nd–O, часть атомов Nd в структуре Nd4Ti9O24 имеет к.ч. = VIII. Вероятно, с этим и связано повышенное содержание U и Zr в данной фазе по сравнению с Nd2Ti2O7 или Nd2TiO5.
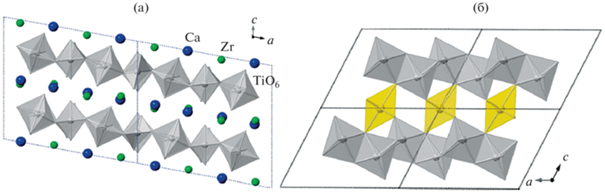
Узкие поля титанатов Lа3+ и Nd3+ (рис. 1а, 1б) контрастируют с большими вариациями составов пирохлора, цирконолита, браннерита, также рассматриваемых в качестве матриц РЗЭ-актинидной фракции. Для цирконатного и титан-цирконатного пирохлора характерна большая емкость структуры в отношении актинидов в степенях окисления, отличных от трех [3–5, 20]. В позиции Zr пирохлора Nd2Zr2O7 входит до 20 ат. % U, от 10 до 20 ат. % U и Th входит в позиции Nd. Широкие области составов цирконолита и браннерита обусловлены особенностями их структуры [3, 4]. Цирконолит CaZrTi2O7 (рис. 4а) обладает моноклинной симметрией (C2/m), к.ч. Ca и Zr равны VIII и VII соответственно. Катионы РЗЭ и актинидов могут замещать Ca, Zr и Ti по трем механизмам. Первый из них гетеровалентный: Ca2+ + + Zr4+ → 2M$_{1}^{{3 + }}$ (M1 = лантаниды, Ln и актиниды, An). При высоких концентрациях катионов M1 эта структура трансформируется в пирохлор, (M1)2Ti2O7. Второй вариант гетеровалентного изоморфизма: Ca2+ + Ti4+ → M$_{1}^{{3 + }}$ + M$_{2}^{{3 + }}$ (M1 = Ln и An = Pu, Am, Cm; M2 = Al, Fe). Кроме того, возможно изовалентное замещение Zr4+ на катионы M$_{3}^{{4 + }}$ (M3 = Ce, An). В цирконолите актиниды (U, Np, Pu) входят в позиции Ca и Zr в количестве до ~0.3 атома в формуле, при полной замене циркония на актиниды образуется пирохлор CaAn4+Ti2O7. Браннерит кристаллизуется в моноклинной симметрии (пр. гр. C2/m), катионы U и Ti находятся в центре октаэдров. Слои из связанных вершинами и ребрами октаэдров TiO6 параллельны плоскости (001), их скрепляют колонны октаэдров UO6, вытянутые вдоль оси b (рис. 4б). Крупные позиции занимают ионы (Се, Th, U, Np, Pu)4+ или катионы более высокого заряда (Np5+, U5+/U6+) с одновременным вхождением в структуру Са2+ и РЗЭ3+ для его компенсации, например, по гетеровалентным обменам типа: Ca2+ + U6+ → 2U4+ или РЗЭ3+ + U5+ → 2U4+.
Рис. 4.
Кристаллические структуры цирконолита CaZrTi2O7 (а): серые – слои октаэдров Ti, атомы Ca и Zr (синие и зеленые) и браннерита UTi2O6 (б): октаэдры U, желтое, образуют колонны параллельно оси b; и октаэдры Ti, серое, формирующие слои вдоль плоскости (001) и имеющие общие вершины с колоннами из соединенных вершинами урановых октаэдров).
ВЫВОДЫ
На примере фаз Nd, аналога актинидов (Am, Cm), рассмотрены вариации состава и кристаллохимия возможных матриц РЗЭ–МА в системе Nd2O3 –TiO2 –ZrO2. В ней имеются, по уменьшению полей стабильности на диаграмме (рис. 1а), фазы: Nd2(Zr,Ti)2O7, Nd4Ti9O24, ZrTiO4, (Zr,Ti)O2, (Ti,Zr)O2, Nd2Ti2O7, Nd2TiO5. Потенциальными матрицами для фракции РЗЭ-МА служат: РЗЭ2(Zr,Ti)2О7–х со структурой пирохлора, Nd4Ti9O24, Nd2Ti2O7 (перовскит), Nd2TiO5. Максимальная область устойчивости – у пирохлора Nd2(Ti,Zr)2O7, в который входит 10 мас. % и более U и Zr. В титанатах Nd “растворимость” Ca, Zr и U мала: от 2–3 мас. % в Nd4Ti9O24, до ниже предела обнаружения (0.3–0.5 мас. %) в Nd2TiO5 и Nd2Ti2O7. При повышенном содержании примесей в дополнение к титанатам РЗЭ в матрицах образуются оксид U и РЗЭ, титанат U (браннерит), титанат Ca и Zr (цирконолит). Два последних соединения обладают высокой устойчивостью в растворах и их появление не приведет к ухудшению изоляционных характеристик матриц в отношении РЗЭ-МА. В системах РЗЭ2О3–TiO2 и РЗЭ2О3–ZrO2 со снижением радиуса РЗЭ3+ структура соединений РЗЭ2Ti2O7 изменяется с моноклинной перовскитоподобной на кубическую пирохлоровую: граница полиморфного превращения проходит между Nd и Sm. Фазы РЗЭ2Zr2О7 кристаллизуются в двух родственных структурных типах – пирохлора и флюорита. Первая образуется при большом различии радиусов РЗЭ3+ и Zr4+ (RРЗЭ: RZr > 1.46). С уменьшением разницы в размерах ионов структура пирохлора трансформируется в дефицитную по анионам структуру флюорита (РЗЭ, Zr)4O7. Граница проходит по Gd3+ – цирконаты более легких и крупных РЗЭ группы Се кристаллизуются в пирохлоровом структурном типе, а тяжелые и меньшие по размеру РЗЭ группы Y обладают структурой типа флюорита. Для соединений РЗЭ2TiO5 ситуация более сложная: фазы РЗЭ от La до Sm имеют ромбическую симметрию, от Er до Lu и у Sc – кубическую, а фазы РЗЭ от Eu до Ho и Y – гексагональные.
Знание кристаллохимических особенностей фаз РЗЭ позволяет управлять фазовым составом получаемых матриц. Примеси (Zr, Fe, остаточные количества Pu, U) могут либо находиться в РЗЭ-МА-фракции, либо специально вводиться (СаО, Fe2O3, Al2O3) в шихту перед синтезом матрицы. В результате, наряду с титанатами РЗЭ-МА, можно получить фазы со структурой пирохлора, браннерита, цирконолита, наличие которых не ухудшает свойства матрицы в силу их высокой коррозионной устойчивости в воде.
Список литературы
Юдинцев С.В. Изоляция фракционированных отходов ядерной энергетики // Радиохимия. 2021. Т. 63. № 5. С. 403–430.
Стефановский С.В., Юдинцев С.В. Титанаты, цирконаты, алюминаты и ферриты – матрицы для иммобилизации актинидов // Успехи химии. 2016. Т. 85. № 9. С. 962–994.
Spent Nuclear Fuel Reprocessing Flowsheet. Paris: OECD NEA, 2012. 120 p.
Lumpkin G.R. Ceramic Host Phases for Nuclear Waste Remediation // In: Experimental and Theoretical Approaches to Actinide Chemistry. J.K. Gibson, W.A. de Jong (Eds.). John Wiley & Sons Ltd. 2018. Ch. 7. P. 333–377.
Ewing R.C., Weber W.J., Lian J. Nuclear Waste Disposal – Pyrochlore (A2B2O7): Nuclear Waste Form for the Immobilization of Plutonium and “Minor” Actinides // Journal of Applied Physics. 2004. V. 95. № 11. P. 5949–5971.
Smith K.L., Blackford M.G., Lumpkin G.R., Zaluzec N.J. Radiation Tolerance of A2B2O7 Compounds at the Cubic–monoclinic Boundary // Microscopy and Microanalysis. 2006. V. 12. S. 2. P. 1094–1095.
Aughterson R.D., Lumpkin G.R., Ionescu M., de los Re-yes M., Gault B., Whittle K.R., Smith K.L., Cairney J.M. Ion-irradiation Resistance of the Orthorhombic Ln2TiO5 (Ln = La, Pr, Nd, Sm, Eu, Gd, Tb and Dy) Series // Journal of Nuclear Materials 2015. V. 467. P. 683–691.
Shoup S.S., Bamberger C.E., Tyree J.L., Anovitz L. Lanthanide-containing Zirconotitanate Solid Solutions // Journal of Solid-State Chemistry. 1996. V. 127. P. 231–239.
Skapin S.D., Kolar D., Suvorov D. Phase Equilibria and Solid Solution Relationships in the La2O3 – TiO2 – ZrO2 System // Solid State Sciences. 1999. V. 1. P. 245–255.
Schaedler T.A., Fabrichnaya O., Levi C.G. Phase Equilibria in the TiO2 – YO1.5 – ZrO2 System // J. Eur. Ceram. Soc. 2008. V. 28. P. 2509–2520.
Gong W., Zhang R. Phase Relationship in the TiO2 – Nd2O3 Pseudo-binary System // J. Alloys and Compd. 2013. V. 548. P. 216–221.
Юдинцев С.В. Титанаты лантанидов – потенциальные матрицы для иммобилизации актинидных отходов // ДАН. 2015. Т. 460. № 4. С. 453–458.
Юдинцев С.В., Стефановский С.В., Каленова М.Ю., Никонов Б.С., Никольский М.С., Кощеев А.М., Щепин А.С. Матрицы для иммобилизации отходов редкоземельно-актинидной фракции, полученные методом индукционного плавления в холодном тигле // Радиохимия. 2015. Т. 57. Вып. 3. С. 272–282.
Юдинцев С.В., Стефановский С.В., Стефановская О.И., Никонов Б.С., Никольский М.С. Межфазовое распределение урана в матрицах для иммобилизации актинид-редкоземельной фракции высокорадиоактивных отходов // Радиохимия. 2015. Т. 57. Вып. 6. С. 547–555.
Юдинцев С.В., Лившиц Т.С., Джанг Дж., Юинг Р.Ч. Поведение редкоземельных пирохлоров и перовскитов при ионном облучении // ДАН. 2015. Т. 461. № 1. С. 75–81.
Юдинцев С.В., Никольский М.С., Никонов Б.С., Мальковский В.И. Матрицы для изоляции актинидных отходов в глубоком скважинном хранилище // Доклады РАН. Науки о Земле. 2018. Т. 480. № 2. С. 217–222.
Harvey E.J., Whittle K.R., Lumpkin G.R., Smith R.I., Redfern S.A.T. Solid Solubilities of (La,Nd,)2(Zr,Ti)2O7 Phases Deduced by Neutron Diffraction // Journal of Solid State Chemistry. 2005. V. 178. № 3. P. 800–810.
Mueller-Buschbaum H., Scheunemann K. Zurkenntnis von Nd2TiO5 // J. Inorg. Nucl. Chem. 1973. V. 35. № 4. P. 1091–1098.
Hübner N., Gruehn R. Nd4Ti9O24: Präparation und Struktur // Z. Anorg. Allg. Chem. 1992. V. 616. № 10. P. 86–94.
Sun J., Zhou J., Hu Z., Chan T.-S., Liu R., Yu H., Zhang L., Wang J.-Q. Controllable Sites and High-capacity Immobilization of Uranium in Nd2Zr2O7 Pyrochlore // J. Synchrotron Rad. 2022. V. 29. P. 37–44.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле