Доклады Российской академии наук. Науки о Земле, 2022, T. 505, № 1, стр. 30-37
Экспериментальное исследование растворимости природных танталита и пирохлора, оксидов тантала и ниобия в гидротермальных фторидно-хлоридных растворах
Н. П. Котова 1, *, В. С. Коржинская 1, член-корреспондент РАН Ю. Б. Шаповалов 1
1 Институт экспериментальной минералогии Российской академии наук
Черноголовка, Россия
* E-mail: kotova@iem.ac.ru
Поступила в редакцию 25.03.2022
После доработки 05.04.2022
Принята к публикации 05.04.2022
- EDN: VDJBTT
- DOI: 10.31857/S2686739722070106
Аннотация
Экспериментально изучены концентрационная и температурная зависимости растворимости танталита, пирохлора и оксидов тантала и ниобия во фторидно-хлоридных водных растворах (mHF + + mHCl) при 300–550°С, 100 МПа (буфер Со–СоО). Исходную концентрацию HF варьировали в пределах от 0.01 m до 2 m, а концентрация HCl оставалась постоянной и составляла 0.5 m. Проведен сравнительный анализ равновесных содержаний Nb и Ta при растворении оксидов тантала, ниобия и природных минералов танталита и пирохлора во фторидных, хлоридных и смешанных (mHF + + mHCl) растворах.
ВВЕДЕНИЕ
Разработка научно обоснованных критериев прогноза и поиска месторождений экономически важных металлов требует более четких представлений об условиях их образования, формах переноса рудных элементов, их поведении в различных физико-химических средах. Общеизвестно, что одними из перспективных объектов на тантал-ниобиевое оруденение являются редкометальные граниты. Первоосновой исследования генезиса редкометальных месторождений, несомненно, являются геологические данные (минералогические, структурные, геофизические и др.) конкретного месторождения. За прошедшие годы исследователями накоплен огромный материал по их геологическому строению, петрологии, геохимии, минералогии, геодинамическому положению и вопросам генезиса. Однако, несмотря на большие достижения геологов в области изучения рудоносных гранитов и связанных с ними грейзеновых, альбититовых и других генетических типов редкометальных месторождений, многие принципиальные вопросы их генезиса до сих пор остаются неясными.
Наиболее общепринятыми являются генетические представления В.И. Коваленко [5], состоящие в том, что редкометальные литий-фтористые граниты, вмещающие танталовые руды, образуются в результате кристаллизационного фракционирования обычной гранитной магмы в специфических условиях, обеспечивающих постадийное накопление в остаточном гранитном расплаве F, Li, Ta, Nb и других редких металлов. Однако для моделирования физико-химических условий образования грейзеновых и альбититовых месторождений W, Mo, Sn, Ta, Nb и Li, связанных со стандартными известково-щелочными, в том числе и литий-фтористыми гранитами, необходимо учитывать еще и роль гидротермально-метасоматических процессов [2, 15]. В работах [3, 4, 6, 7] была показана определяющая роль метасоматических процессов в генезисе гранитов, а также в распределении акцессорных минералов редких металлов. Роль этих процессов в образовании месторождений Ta и Nb – это один из наиболее актуальных вопросов современной геохимии.
В этой связи экспериментальные исследования растворимости рудных минералов при контролируемых физико-химических параметрах, необходимые для создания надежных баз экспериментальных данных, используемых для определения преобладающих форм переноса рудных элементов, оценки их термодинамических свойств и последующем построении количественных моделей фракционирования рудных элементов в природной среде, определения условий формирования крупных и промышленно-значимых редкометальных месторождений, связанных с гранитами различной щелочности, в том числе, и с Li–F гранитами, и обоснованности существующих генетических гипотез их происхождения, приобретают первостепенное значение.
В настоящее время имеющиеся на мировом уровне данные по растворимости минералов Ta и Nb при T–P–X–f(O2)-условиях, отвечающих магматическим и гидротермальным процессам минерало- и рудообразования, явно недостаточны для определения роли гидротермально-метасоматических процессов в генезисе редкометальных месторождений. Поэтому оценка предельных концентраций рудных элементов в гидротермальных растворах в широкой области Т–Р–X-параметров, необходимых для построения количественной модели процесса рудообразования, является актуальной проблемой рудогенеза.
МЕТОДИКА И ТЕХНИКА ЭКСПЕРИМЕНТА
Данная работа связана с многолетними комплексными экспериментальными исследованиями процессов концентрирования, форм переноса и отложения рудных компонентов (Ta, Nb, W, U и др.) [8, 13, 14, 16]. Главным методом исследований был выбран метод растворимости рудных минералов, в основе которого лежит анализ поведения содержания рудного элемента (компонента, минерала) в зависимости от валовой концентрации растворителя. Все эксперименты были проведены на гидротермальных установках высокого давления (предельные параметры: 600°С, 200 МПа). Окислительно-восстановительные условия в опытах задавали буферной парой Со–СоО. Для более быстрого достижения равновесия в опытах использовались легко проницаемые для водорода платиновые пробирки. Изучение растворимости оксида ниобия, аналога природного минерала ниобоксида, и оксида тантала, аналога природного минерала тантита, проводили с использованием предварительно очищенных гидротермальной перекристаллизацией в 0.1 М растворе HF при 550°С, 100 МПа химических реактивов – оксида тантала (β-Ta2O5) марки “ч” и оксида ниобия (β-Nb2O5) марки “осч”, Для изучения растворимости пирохлора (Ca, Na)2(Nb, Ta)2O6(O,OH,F) и танталита ((Mn,Fe)(Ta,Nb)2O6 брали природные монокристаллы пирохлора – из кор выветривания карбонатитового месторождения Татарка (состав по микрозондовым определениям: Na2O–7.61%; CaO–14.28%; Nb2O5–71.61%; F–5.18%; TiO2–0.83%; Ta2O5 ≤ 1% вес.), и танталита – из кварц-амазонит-слюдистых пегматоидов Этыкинского танталового месторождения, имеющие следующий состав по данным анализа на электронном микрозонде CamScan MV2300 (“VEGA” TS 5130MM): Nb2O5 58.99%, Ta2O5 17.70%, MnO 13.51%, FeO 4.42%, TiO2 2.59%, SnO2 1.54%, WO3 1.24% (среднее из семи анализов). В экспериментах использовали вырезанные из них фрагменты величиной около 2–3 мм и весом 0.1–0.05 г, которые предварительно обрабатывали 0.1 М раствором HF, промывали водой и сушили. Фторидно-хлоридные растворы готовили из соответствующих реактивов HF и HCl марки “осч” на основе бидистиллированной воды. Концентрации исходных растворов HF варьировали в пределах от 0.01 m до 2 m, а концентрация HCl оставалась постоянной и составляла 0.5 m. Следует отметить, что выбранный диапазон концентраций HF отвечает реальному диапазону концентраций фторидов в природных постмагматических флюидах на месторождениях, связанных с гранитами. По данным А.М. Аксюка [1], полученным на основе экспериментально разработанного слюдяного геофториметра, на переходном магматическо-гидротермальном этапе эволюции рудно-магматических систем концентрация HF в отделяющихся от гранитного расплава водных флюидах составляет около 0.01 моль/кг H2O для медно-молибденовых порфировых месторождений. Она на 1 порядок выше на грейзеновых месторождениях W, Mo, Sn, Be, Bi типа Акчатау (0.1 моль/кг H2O) и достигает максимальных значений 1.0 моль/кг H2O на редкометальных месторождениях тантала в литий-фтористых “апогранитах” типа Орловского и Этыкинского редкометальных массивов. В наших опытах в качестве предельных концентраций HF использовались 2.0 моль/кг H2O растворы.
При подготовке экспериментов в платиновую пробирку размером 8 × 0.2 × 50 мм вносили 50 мг исследуемого твердого вещества, заливали раствор в количестве, соответствующем T–P–X–f(O2)-параметрам опыта, а затем герметизировали пробирку электродуговой сваркой. Снаряженные пробирки и специальные контейнеры из нержавеющей стали с кислородным буфером Со–СоО помещали в реакторы гидротермальной установки высокого давления, рабочие зоны которых позволяют изолировать пробирки из благородных металлов от буферных устройств. Длительность опытов составляла 15–30 сут в зависимости от выбранных параметров. После окончания опыта пробирки вынимали из реактора, взвешивали и вскрывали. Взвешивание проводили на электронных весах AP250D (марки “Ohaus”) с точностью ±0.01 мг. Раствор из пробирки отделяли от навески методом центрифугирования (регулируемая скорость вращения до 10 000 об/мин) и отбирали для анализа. Навеску тщательно промывали и высушивали при 100°С в сушильном шкафу. Анализ закалочных растворов на определение концентрации Та, Nb и примесей других элементов (Mn, Fe, Ti, W, Sn и др.) проводился наиболее прецизионными и современными методами индукционно связанной плазмы ICP/MS и ICP/AES. Фазовый состав твердых продуктов опытов исследовали методом порошковой рентгеновской дифракции XRD, а состав кристаллов определяли на электронном сканирующем микроскопе Cam Scan MV2300 (“VEGA” 130mm).
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ И ИХ ОБСУЖДЕНИЕ
Используя современные методы исследования, впервые были получены данные по растворимости оксидов ниобия (β-Nb2O5) и тантала (β-Ta2O5), а также природных минералов – пирохлора (Ca,Na)2(Nb,Ta)2O6(O,OH,F) и танталита (Mn,Fe)2(Ta,Nb)2O6 в растворах смешанного состава (mHF + 0.5 mHCl) в температурном интервале 300–550°C, давлении 100 МПа и фугитивности кислорода, соответствующей буферу Co–CoO (табл. 1).
Таблица 1.
Экспериментальные данные по растворимости минералов пирохлора, танталита и оксидов тантала и ниобия в (mHF + 0.5mHCl) флюидах
| Исходный материал | Исходный раствор, моль/кг H2O | Nb, моль/кг | Na, моль/кг | Ca, моль/кг | Ta, моль/кг | Mn, моль/кг | Fe, моль/кг |
|---|---|---|---|---|---|---|---|
| T = 550°C, P = 100 МПа, буфер Со–СоО | |||||||
| пирохлор | 0.01mHF + 0.5mHCl | 1.66E–04 | 6.21E–02 | 2.73E–02 | |||
| пирохлор | 0.1mHF + 0.5mHCl | 1.55E–03 | 1.43E–01 | 4.80E–02 | |||
| пирохлор | 0.5mHF + 0.5mHCl | 1.78E–03 | 2.93E–01 | 2.75E–02 | |||
| пирохлор | 1mHF + 0.5mHCl | 2.54E–03 | 2.97E–01 | 2.07E–02 | |||
| пирохлор | 2mHF + 0.5mHCl | 1.33E–02 | 2.94E–01 | 1.02E–02 | |||
| танталит | 0.01mHF + 0.5mHCl | 3.77E–05 | 1.44E–07 | 7.74E–03 | 3.94E–03 | ||
| танталит | 0.1mHF + 0.5mHCl | 7.10E–05 | 4.42E–07 | 2.04E–02 | 1.73E–02 | ||
| танталит | 0.5mHF + 0.5mHCl | 1.52E–04 | 7.18E–07 | 1.26E–02 | 1.22E–02 | ||
| танталит | 1mHF + 0.5mHCl | 1.83E–05 | 2.76E–07 | 6.53E–03 | 2.51E–04 | ||
| танталит | 2mHF + 0.5mHCl | 4.06E–04 | 9.45E–07 | 7.90E–03 | 1.04E–02 | ||
| Ta2O5 | 0.01mHF + 0.5mHCl | 2.98E–07 | |||||
| Ta2O5 | 0.1mHF + 0.5mHCl | 1.11E–05 | |||||
| Ta2O5 | 0.5mHF + 0.5mHCl | 4.03E–04 | |||||
| Ta2O5 | 1mHF + 0.5mHCl | 2.84E–03 | |||||
| Ta2O5 | 2mHF + 0.5mHCl | 9.93E–03 | |||||
| Nb2O5 | 0.01mHF + 0.5mHCl | 8.61E–06 | |||||
| Nb2O5 | 0.1mHF + 0.5mHCl | 2.64E–04 | |||||
| Nb2O5 | 0.5mHF + 0.5mHCl | 6.44E–04 | |||||
| Nb2O5 | 1mHF + 0.5mHCl | 6.10E–03 | |||||
| Nb2O5 | 2mHF + 0.5mHCl | 5.60E–02 | |||||
| T = 500°C, P = 100 МПа, буфер Со–СоО | |||||||
| пирохлор | 0.01mHF + 0.5mHCl | 2.46E–04 | 0.154 | 0.093 | |||
| пирохлор | 0.1mHF + 0.5mHCl | 1.83E–04 | 0.119 | 0.0895 | |||
| пирохлор | 0.5mHF + 0.5mHCl | 2.14E–03 | 0.286 | 0.0542 | |||
| пирохлор | 1mHF + 0.5mHCl | 4.16E–03 | 0.267 | 0.0217 | |||
| пирохлор | 2mHF + 0.5mHCl | 3.24E–02 | 0.436 | 0.0025 | |||
| танталит | 0.01mHF + 0.5mHCl | 2.26E–06 | 8.84E–08 | 0.113 | 7.23E–03 | ||
| танталит | 0.1mHF + 0.5mHCl | 5.70E–06 | 3.92E–07 | 0.115 | 5.50E–03 | ||
| танталит | 1mHF + 0.5mHCl | 2.32E–04 | 4.14E–04 | 0.126 | 1.65E–02 | ||
| танталит | 2mHF + 0.5mHCl | 3.79E–03 | 8.27E–03 | 0.185 | 6.05E–03 | ||
| танталит | 0.5mHF + 0.5mHCl | 2.26E–05 | 1.38E–06 | 7.26E–02 | 3.94E–03 | ||
| Ta2O5 | 0.01mHF + 0.5mHCl | 1.60E–07 | |||||
| Ta2O5 | 0.1mHF + 0.5mHCl | 6.08E–06 | |||||
| Ta2O5 | 0.5mHF + 0.5mHCl | 2.80E–04 | |||||
| Ta2O5 | 1mHF + 0.5mHCl | 2.00E–03 | |||||
| Ta2O5 | 2mHF + 0.5mHCl | 4.00E–03 | |||||
| Nb2O5 | 0.01mHF + 0.5mHCl | 8.07E–06 | |||||
| Nb2O5 | 0.1mHF + 0.5mHCl | 8.93E–05 | |||||
| Nb2O5 | 0.5mHF + 0.5mHCl | 6.73E–04 | |||||
| Nb2O5 | 1mHF + 0.5mHCl | 1.32E–02 | |||||
| Nb2O5 | 2mHF + 0.5mHCl | 3.90E–02 | |||||
| T = 400°C, P = 100 МПа, буфер Со–СоО | |||||||
| пирохлор | 0.01mHF + 0.5mHCl | 2.05E–05 | 0.108 | 7.59E–02 | |||
| пирохлор | 0.1mHF + 0.5mHCl | 2.26E–05 | 0.142 | 8.18E–02 | |||
| пирохлор | 1mHF + 0.5mHCl | 6.12E–03 | 0.201 | 2.37E–02 | |||
| пирохлор | 2mHF + 0.5mHCl | 2.52E–02 | 0.351 | 4.14E–04 | |||
| танталит | 0.01mHF + 0.5mHCl | 1.51E–07 | 2.21E–09 | 3.93E–03 | 7.70E–04 | ||
| танталит | 0.1mHF + 0.5mHCl | 2.15E–07 | 9.39E–09 | 6.21E–03 | 7.41E–04 | ||
| танталит | 1mHF + 0.5mHCl | 1.06E–04 | 1.44E–04 | 8.46E–03 | 7.25E–04 | ||
| танталит | 2mHF + 0.5mHCl | 3.69E–04 | 9.06E–04 | 1.08E–02 | 6.41E–04 | ||
| Ta2O5 | 0.01mHF + 0.5mHCl | 9.35E–08 | |||||
| Ta2O5 | 0.1mHF + 0.5mHCl | 1.22E–05 | |||||
| Ta2O5 | 0.5mHF + 0.5mHCl | 2.03E–04 | |||||
| Ta2O5 | 1mHF + 0.5mHCl | 3.00E–03 | |||||
| Ta2O5 | 2mHF + 0.5mHCl | 1.50E–02 | |||||
| Nb2O5 | 0.01mHF + 0.5mHCl | 7.64E–06 | |||||
| Nb2O5 | 0.1mHF + 0.5mHCl | 8.93E–05 | |||||
| Nb2O5 | 0.5mHF + 0.5mHCl | 1.03E–03 | |||||
| Nb2O5 | 1mHF + 0.5mHCl | 6.08E–03 | |||||
| Nb2O5 | 2mHF + 0.5mHCl | 4.78E–02 | |||||
| T = 300°C, P = 100 МПа, буфер Со–СоО | |||||||
| пирохлор | 0.01mHF + 0.5mHCl | 3.60E–06 | 0.196 | 0.108 | |||
| пирохлор | 0.1mHF + 0.5mHCl | 6.67E-06 | 0.229 | 7.41E–02 | |||
| пирохлор | 0.5mHF + 0.5mHCl | 1.16E–05 | 0.366 | 1.55E–02 | |||
| пирохлор | 1mHF + 0.5mHCl | 4.61E–03 | 0.4405 | 8.76E–04 | |||
| пирохлор | 2mHF + 0.5mHCl | 3.39E–02 | 0.394 | 2.99E–03 | |||
| танталит | 0.01mHF + 0.5mHCl | 9.90E–06 | 1.33E–07 | 1.85E–02 | 1.42E–03 | ||
| танталит | 0.1mHF + 0.5mHCl | 1.11E–04 | 2.54E–07 | 4.09E–02 | 1.97E–03 | ||
| танталит | 0.5mHF + 0.5mHCl | 3.35E–04 | 3.45E–04 | 3.70E–02 | 2.33E–03 | ||
| танталит | 1mHF + 0.5mHCl | 4.74E–03 | 5.23E–03 | 4.19E–02 | 1.67E–03 | ||
| Ta2O5 | 0.01mHF + 0.5mHCl | <ПО | |||||
| Ta2O5 | 0.1mHF + 0.5mHCl | 2.43E–06 | |||||
| Ta2O5 | 0.5mHF + 0.5mHCl | 2.63E–04 | |||||
| Ta2O5 | 1mHF + 0.5mHCl | 5.24E–03 | |||||
| Ta2O5 | 2mHF + 0.5mHCl | 4.97E–02 | |||||
| Nb2O5 | 0.01mHF + 0.5mHCl | 5.71E–06 | |||||
| Nb2O5 | 0.1mHF + 0.5mHCl | 1.79E–06 | |||||
| Nb2O5 | 0.5mHF + 0.5mHCl | 1.44E–03 | |||||
| Nb2O5 | 1mHF + 0.5mHCl | 1.30E–02 | |||||
| Nb2O5 | 2mHF + 0.5mHCl | 7.41E–02 | |||||
На рис. 1a приведены результаты экспериментов по изучению концентрационных зависимостей равновесных содержаний ниобия при растворении оксида ниобия и пирохлора в (mHF + + 0.5 mHCl) растворах при Т = 550°С и Р = 100 МПа в присутствии кислородного буфера Со–СоО. Анализ полученных данных показал, что при растворении Nb2О5 во фторидно-хлоридных растворах с низкими концентрациями фторидов: (0.01 mHF + 0.5 mHCl) и (0.1 mHF + 0.5 mHCl), равновесное содержание ниобия в растворе составляет 10–5m, что примерно на 1 порядок ниже, чем для пирохлора. С повышением концентрации F-иона растворимость Nb2O5 сильно возрастает, и при концентрации HF – 1.0 m и выше содержание ниобия становится больше, чем для пирохлора. В растворе (2 mHF + 0.5 mHCl) равновесное содержание ниобия достигает значительных величин (n × 10–1m), вполне достаточных для реального массопереноса ниобия гидротермальными растворами [9]. По данным рентгенофазового метода анализа твердых продуктов, растворение пирохлора в (2 mHF + 0.5 mHCl) растворе происходит инконгруэнтно, с образованием новой фазы состава Na2Nb4O11.
Рис. 1.
Концентрационные зависимости содержания ниобия и тантала в (m HF + 0.5m HCl) флюидах: (а) при растворении Nb2O5 и пирохлора; (б) при растворении Ta2O5 и танталита (Т = 550°С, Р = 100 МПа, буфер Со–СоО).
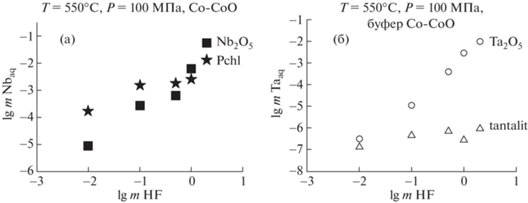
В ходе экспериментов по растворимости оксида тантала [12] и танталита [11] в смешанных растворах (mHF + 0.5 mHCl) (рис. 1б) установлено, что при низких концентрациях фторидов (0.01 mHF + 0.5 mHCl) равновесные содержания тантала для оксида тантала и танталита близки между собой и составляют 10–6.5m. Но с ростом концентрации HF содержание Ta для Ta2O5 резко возрастает и в растворе (2 mHF + 0.5 mHCl) достигает значений 10–2m, что на 4 порядка выше по сравнению с танталитом. Обнаружено, что при 550°С и 100 МПа во фторидно-хлоридных растворах (mHF + 0.5 mHCl) оксид тантала имеет четко выраженную положительную зависимость растворимости от концентрации F-иона, в логарифмических единицах близкую к линейной.
При растворении танталита во фторидно-хлоридных флюидах при 550°С и 100 МПа с ростом концентрации HF равновесное содержание Ta практически не меняется, оставаясь на низком уровне 10–6m. Установлено, что танталит, как и пирохлор, в высокотемпературных флюидах сложного состава (mHF + 0.5mHCl) растворяется инконгруэнтно с образованием новых фаз. Это можно объяснить присутствием Mn и Fe в танталите, которые образуют хорошо растворимые комплексы с Cl-ионом. Содержания Mn и Fe в смешанных (mHF + 0.5 mHCl) растворах значительно выше, чем для тантала [9]. Так, в (0.01 mHF + + 0.5 mHCl) равновесное содержание Mn составляет 3.93 × 10–3, а Fe – 7.70 × 10–4m. В области высоких концентраций HF содержание марганца при 550°С и 100 МПа составляет n × 10–2m, а содержание Fe остается практически неизменным.
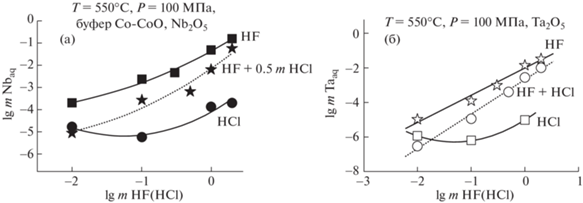
Проведен сравнительный анализ экспериментальных данных по изучению концентрационной зависимости равновесных содержаний ниобия и тантала при растворении оксидов ниобия и тантала, пирохлора и танталита во фторидных [16, 17], хлоридных [8] и смешанных фторидно-хлоридных растворах. Показано (рис. 2а, б), что при Т = 550°С и P = 100 МПа добавка Cl-иона к фторидным растворам снижает растворимость ниобия и тантала при растворении Nb2O5 и Ta2O5 примерно на 1–1.5 порядка. Тренды концентрационной зависимости растворимости Nb2O5 и Ta2O5 от концентрации F-иона во фторидно-хлоридных растворах занимают промежуточное положение между трендами растворимости оксидов в чистых фторидных и хлоридных растворах. Однако при высоких содержаниях F-иона в растворах (1 mHF + 0.5 mHCl) и (2 mHF + 0.5 mHCl) равновесные содержания Nb и Ta при растворении оксидов во фторидных и смешанных растворах становятся сопоставимыми и достигают 10–1 и 10–2 моль/кг Н2О соответственно.
Рис. 2.
Концентрационные зависимости содержания ниобия и тантала в HF, HCl и HF + 0.5m HCl) флюидах: (а) при растворении Nb2O5; (б) при растворении Ta2O5 (Т = 550°С, Р = 100 МПа, буфер Со–СоО).
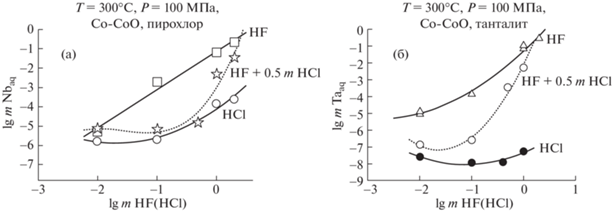
Сопоставление полученных данных по изучению концентрационных зависимостей растворимости пирохлора и танталита в HF, HCl и (mHF + + 0.5 mHCl) растворах при Т = 300°С и Р = 100 МПа (рис. 3а, б) показывает, что в области низких концентраций исходных растворов: (0.01 mHF; 0.01 mHCl) и (0.01 mHF + 0.5 mHCl), равновесные содержания ниобия практически одинаковы и составляют всего n × 10–5 моль/кг Н2О. Но с ростом концентрации исходных растворов содержание Nb в HF растворах резко возрастает и становится на 2 порядка выше, чем в смешанных (mHF + + 0.5 mHCl) и HCl растворах (рис. 3а). Аналогичная картина наблюдается и для тантала: содержание Ta при растворении танталита в HF растворах на несколько порядков выше, чем в хлоридных и смешанных (mHF + 0.5 mHCl) растворах (рис. 3б).
Рис. 3.
Концентрационные зависимости содержания ниобия и тантала в HF, HCl и (mHF + 0.5m HCl) флюидах: (а) при растворении пирохлора; (б) при растворении танталита (Т = 300°С, Р = 100 МПа, буфер Со–СоО).
Температурные зависимости равновесных содержаний ниобия и тантала при растворении Nb2O5, Ta2O5, пирохлора и танталита в (mHF + + 0.5 mHCl) растворах представлены на рис. 4а, б. Проведенные экспериментальные исследования не обнаружили четко выраженных однозначных зависимостей влияния температуры на растворимость соединений Nb и Ta в растворах (mHF + 0.5 mHCl) разной концентрации. Установлено, что при растворении Nb2O5 в (0.1 mHF + + 0.5 mHCl) растворах с низкой концентрацией HF при 300°С и 100 МПа равновесное содержание ниобия на 1.5 порядка выше, чем у пирохлора, на 3.5 порядка выше, чем у танталита, и составляет n × 10–4 m (рис. 4а). Изменение температуры не оказывает существенного влияния на растворимость оксида ниобия в (0.1 mHF + 0.5 mHCl) растворах, в то время как для пирохлора и танталита наблюдается положительная температурная зависимость. При 550°С, 100 МПа содержание ниобия для пирохлора возрастает на 1 порядок и составляет n × 10–3m. Для танталита равновесное содержание ниобия составляет n × 10–5m.
Рис. 4.
Температурная зависимость равновесного содержания ниобия при растворении Nb2O5, пирохлора и танталита в (m HF + 0.5m HCl) флюидах (буфер Со–СоО): (а) в (0.1m HF + 0.5m HCl); (б) в (1m HF + 0.5m HCl).
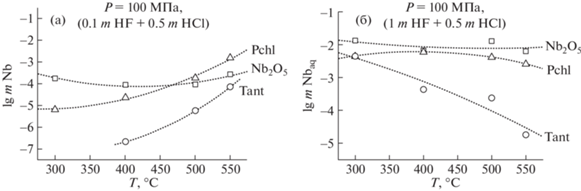
В растворах с высоким содержанием F-иона (1 mHF + 0.5 mHCl) (рис. 4 б) растворимость оксида ниобия увеличивается на 1.5 порядка и составляет n × 10–2m, что практически совпадает с содержанием ниобия при растворении пирохлора при тех же параметрах [9]. Рост температуры не оказывает заметного влияния на изменение растворимости пирохлора и оксида ниобия. Для танталита наблюдается обратная температурная зависимость растворимости. При 300°С, 100 МПа равновесное содержание ниобия составляет n × × 10–3m, при 550°С – n × 10–5m.
Анализ экспериментальных данных, полученных при изучении температурных зависимостей равновесных содержаний тантала при растворении Ta2O5 и танталита в (0.1 mHF + 0.5 mHCl) и (1 mHF + 0.5 mHCl) флюидах показал, что при растворении Ta2O5 в (0.1 mHF + 0.5 mHCl) растворе содержание тантала составляет n × 10–5m. Причем температура мало влияет на растворимость оксида тантала. При растворении танталита в (0.1 mHF + 0.5 mHCl) растворе при 300, 500 и 550°С и 100 МПа содержание тантала практически одинаково и составляет n × 10–6.5m, что на 1.5 порядка меньше, чем для Ta2O5. При 400°С равновесное содержание тантала минимально (n × 10–8m), что связано с образованием в растворе твердой фазы состава Mn2TaO3. При высоких концентрациях F-иона в (1 mHF + 0.5 mHCl) растворах равновесное содержание Ta при растворении Ta2O5 резко возрастает и при 550°С и 100 МПа достигает значений n × 10–2.5m, что на 4 порядка выше по сравнению с танталитом. Температурная зависимость растворимости оксида тантала в (1 mHF + + 0.5 mHCl) растворах практически отсутствует. В то же время при растворении танталита в концентрированных (1 mHF + 0.5 mHCl) фторидно-хлоридных растворах рост температуры приводит к резкому уменьшению равновесного содержания тантала от n × 10–2m при 300°С до n × 10–6.5m при 550°С и 100 МПа.
ЗАКЛЮЧЕНИЕ
Исходя из вышесказанного, можно сделать вывод о том, что принципиально важным для понимания генезиса месторождений тантала и ниобия является экспериментально установленный факт, состоящий в том, что гидротермальному транспорту металлов Ta и Nb в количествах, необходимых для образования их промышленных концентраций благоприятствуют только фторсодержащие растворы, при незначительной роли хлоридных растворов.
На основе полученных в ходе этих исследований данных можно предложить геохимические модели переноса и отложения Ta и Nb в природных условиях и конкретизировать физико-химические параметры рудоносных флюидов (температуры, давления, солевой состав и концентрации редких элементов во флюиде).
Список литературы
Аксюк А.М. Экспериментально-обоснованные геофториметры и режим фтора в гранитных флюидах // Петрология. 2002. Т. 10. № 6. С. 628–642.
Беус А.А., Северов Э.А., Ситнин Ф.Ф., Субботин К.Д. Альбизированные и грейзенизированные граниты (апограниты). Москва: Изд-во АН СССР, 1962. 196 с.
Зарайский Г.П. Условия формирования главных фациальных типов грейзенов по экспериментальным данным // Петрология. 1999. № 4. С. 460–480.
Зарайский Г.П. Условия образования редкометальных месторождений, связанных с гранитным магматизмом // Смирновский сборник. М.: Фонд им. акад. В.И. Смирнова, 2004. С. 105–192.
Коваленко В.И. Петрология и геохимия редкометальных гранитоидов. Новосибирск: Наука СО, 1977. 207 с.
Коваль П.В. Главные парагенетические типы и фации плюмазитовых альбитизированных гранитов // Метасоматизм и рудообразование. М.: Наука, 1974. С. 215–225.
Коваль П.В. Петрология и геохимия альбитизированных гранитов. Новосибирск: Наука СО, 1975. 198 с.
Коржинская В.С., Котова Н.П., Шаповалов Ю.Б. Экспериментальное исследование растворимости манган-танталита и Та2О5 в хлоридных растворах // ДАН. 2014. Т. 459. № 2. С. 194–197.
Коржинская В.С., Котова Н.П. Экспериментальное изучение влияния состава флюида (HF+HCl) на поведение ниобия при растворении пирохлора и оксида ниобия при Т = 550°С, Р = 1000 бар (буфер Сo-СoO) / Труды Всерос. ежегодного семинара по экспериментальной минералогии, петрологии и геохимии. Москва. (ВЕСЭМПГ–2016). ГЕОХИ РАН; А.А. Кадик (ред.). 2016. С. 132–133.
Коржинская В.С., Котова Н.П., Шаповалов Ю.Б. Экспериментальное исследование растворимости природного пирохлора и оксида ниобия в щелочных гидротермальных растворах // ДАН. 2017. Т. 475. № 2. С. 191–194.
Коржинская В.С. Влияние состава флюида (HF + + HCl) на поведение металлов (Ta,Nb, Mn, Fe) при растворении танталита при Т = 550°С, Р = 1000 бар (буфер Со–СоО) // Труды Всерос. ежегодного семинара по экспериментальной минералогии, петрологии и геохимии. Москва. (ВЕСЭМПГ–2017). ГЕОХИ РАН. О.А. Луканин (ред.). 2017. С. 120–121.
Котова Н.П. Экспериментальное изучение влияния состава флюида (HF +HCl) на растворимость оксида тантала при Т = 550°С, Р = 100МПа // Труды Всерос. ежегодного семинара по экспериментальной минералогии, петрологии и геохимии. Москва. (ВЕСЭМПГ–2017). ГЕОХИ РАН. О.А. Луканин (ред.). 2017. С. 132–133.
Лукьянова Е.В., Акинфиев Н.Н., Зотов А.В., Расс И.Т., Котова Н.П., Коржинская В.С. Ниобий в гидротермальных системах: термодинамическое описание гидроксо- и гидроксофторидных комплексов // Геология рудных месторождений. 2017. Т. 59. № 4. С. 308–318.
Akinfiev N., Korzhinskaya V., Kotova N., Redkin A., Zotov A., Niobium and Tantalum in Hydrothermal Fluids: Thermodynamic Description of Hydroxide and Hydroxofluoride Complexes // Geochimica et Cosmochimica Acta. Pergamon Press Ltd. (United Kingdom). 2020. V. 280. P. 102–105.
Beus A.A., Zhalashkova N.Y. Postmagmatic High Temperature Metasomatic Processes in Granitic Rocks // International Geology Review. V. 6. 1964. P. 668–681.
Korzhinskaya V.S., Kotova N.P. Experimental Modeling of Possibility of Hydrothermal Transferring Niobium by Fluoride Solutions // Exp. GeoSciences. 2012. V. 18. P. 119–121.
Zaraisky G.P., Korzhinskaya V.S., Kotova N.P. Experimental Studies of Ta2O5 and Columbite-tantalite Solubility in Fluoride Solutions from 300 to 550°C and 50 to 100 MPa // J. Mineral Petrol. 2010. V. 99. № 3/4. P. 287–300.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле


