Доклады Российской академии наук. Науки о Земле, 2022, T. 505, № 2, стр. 149-158
Физико-химическое и энергетическое воздействие на процесс выщелачивания эвдиалитового концентрата
Академик РАН В. А. Чантурия 1, В. Г. Миненко 1, А. Л. Самусев 1, *, Е. В. Копорулина 1, Г. А. Кожевников 1
1 Институт проблем комплексного освоения недр
им. Н.В. Мельникова Российской академии наук
Москва, Россия
* E-mail: Andrey63vzm@mail.ru
Поступила в редакцию 20.04.2022
После доработки 28.04.2022
Принята к публикации 28.04.2022
- EDN: FRUQMM
- DOI: 10.31857/S2686739722080060
Аннотация
Представлены результаты экспериментальных исследований щелочного разложения эвдиалитового концентрата в условиях физико-химических и энергетических воздействий перед последующим процессом его кислотного выщелачивания для перевода циркония и редкоземельных элементов (РЗЭ) в продуктивный раствор. Экспериментально обоснованы оптимальные параметры щелочного разложения эвдиалитового концентрата (крупность концентрата – 63 мкм, температура – 130°С; продолжительность – 6 ч; концентрация гидроксида натрия – 40%, содержание твердой фазы – 10%), обеспечивающие извлечение кремния в раствор 22.9%. Представлена морфология основных минералов эвдиалитового концентрата после кислотного и щелочного выщелачивания. Наиболее интенсивному щелочному выщелачиванию подвергаются зерна калиевого полевого шпата, что сопровождается обогащением продуктивного раствора такими элементами, как K, Al и Si, при этом большинство частиц кека свободно от силикатного геля. Установлена возможность интенсификации щелочного разложения эвдиалитового концентрата за счет применения ультразвуковых воздействий, обеспечивающих повышение извлечения кремния в раствор на 2.5‒5.3%. Последующее кислотное выщелачивание кека щелочного разложения эвдиалитового концентрата приводит к снижению объема силикатного геля в продуктивном растворе в 1.1‒1.4 раза с 66.5 до 61.8% (раствор азотной кислоты) и 48.5% (соляная кислота) в сравнении с обычным кислотным выщелачиванием. При этом установлена интенсификация процесса растворения эвдиалитового концентрата: – потеря массы навески увеличивается с 60 до 68% при использовании соляной кислоты и до 78.9% для раствора азотной кислоты; – суммарное извлечение Zr повышается с 76.9 до 86.1 и 90.8%, РЗЭ – с 79.6 до 88.5 и 92.6% для соляной и азотной кислот соответственно.
ВВЕДЕНИЕ
Редкие и редкоземельные элементы (РЗЭ) имеют стратегическое значение для развития и модернизации современных высокотехнологичных производств: создания электронных приборов, интеллектуальных систем управления, новых и возобновляемых источников энергии, транспортной техники нового поколения. Основные источники РЗЭ в природе − бастнезит, монацит, лопарит и ксенотим, а также ионно-абсорбционные глины. Особенность минерально-сырьевой базы России заключается в доминировании комплексного типа руд, в которых РЗЭ являются попутными компонентами (массовая доля не более 3%). Более половины балансовых запасов РЗЭ сосредоточено в Мурманской области, где находятся Хибинская группа апатит-нефелиновых месторождений и крупный Ловозёрский массив нефелиновых сиенитов. Несмотря на относительно низкое содержание циркония и редкоземельных элементов, эвдиалитовые руды Ловозёрского месторождения являются перспективным сырьем для производства РЗЭ благодаря практически неограниченному запасу, низкой радиоактивности и высокой химической активности [1, 2].
В настоящее время исследования по переработке эвдиалитовых концентратов ограничены лабораторными масштабами и основаны на многостадиальном разложении кислотами и щелочами. Основная проблема гидрометаллургической переработки эвдиалита − образование устойчивых силикатных гелей, что приводит к уменьшению степени извлечения ценных компонентов, снижению производительности фильтрации и затрудняет дальнейшую переработку продуктивных растворов. В научной литературе предложен ряд физико-химических (термоактивация, добавка фторид-ионов), механических (механоактивация) и энергетических (электрохимическая обработка, ультразвук, обработка низкотемпературной плазмой и др.) методов предотвращения образования силикагеля [3–8].
В ранее опубликованных работах [9, 10] была разработана принципиальная технологическая схема азотнокислотного выщелачивания эвдиалитового концентрата с использованием ультразвуковых воздействий, обеспечивающая как высокое извлечение ценных компонентов (95‒97%) при более грубом помоле исходного материала и относительно невысоких температурах суспензии (80°С), так и сокращение потерь РЗЭ в 2.0‒2.5 раза с силикатным гелем.
Несмотря на достаточно высокое извлечение Zr и РЗЭ, перспективными и актуальными направлениями последующих исследований являются изучение возможности применения различных выщелачивающих агентов (кислот и щелочей) и энергетических воздействий, обеспечивающих как повышение эффективности растворения эвдиалитового концентрата, так и снижение потерь ценных компонентов с силикатным гелем.
Одним из способов интенсификации процесса выщелачивания эвдиалитового концентрата является комбинирование щелочного разложения и кислотного выщелачивания для максимального и селективного извлечения кремния в раствор на стадии щелочного разложения и получения более богатого по РЗЭ и цирконию кека для последующего кислотного выщелачивания [11, 12].
В связи с этим целью данной работы являлось повышение эффективности щелочного разложения эвдиалитового концентрата в условиях физико-химических и энергетических воздействий с максимальным выделением и удалением силикатного геля перед последующим процессом кислотного выщелачивания кека для перевода циркония и РЗЭ в продуктивный раствор.
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ
Исследования проводились на опытной партии эвдиалитового концентрата Ловозёрского ГОКа, характеризующегося содержанием оксида циркония 11.5%, суммы оксидов редкоземельных металлов – 2.5%. Зерна эвдиалита в подавляющем большинстве случаев мономинеральные, остроугольные, с раковистым изломом. Основной посторонней примесью в концентрате являются отдельные зерна полевых шпатов, нефелина и эгирина и их сростки (до 10%). Намного меньше (до 3%) содержание сдвойникованных кристаллов лопарита-(Ce), их обломков и золотисто-коричневых кристаллов лампрофиллита. В акцессорных количествах присутствуют землистые массы вторичных цеолитов (натролита, гоннардита). Химический состав концентрата приведен в табл. 1.
Таблица 1.
Химический состав исходного эвдиалитового концентрата, %
| Компонент | Na2O | MgO | Al2O3 | SiO2 | K2O | CaO | TiO2 | MnO | Fe2O3 |
|---|---|---|---|---|---|---|---|---|---|
| Содержание | 10.14 | 0.18 | 6.90 | 44.96 | 1.37 | 5.42 | 3.29 | 1.660 | 5.20 |
| Компонент | Cl | SO3 | HfO2 | Nb2O5 | Rb2O | SrO | Ba | U | Th |
| Содержание | 0.97 | 0.20 | 0.14 | 0.81 | 0.01 | 2.63 | 0.09 | 0.004 | <0.02 |
| Компонент | ZrO2 | Ta2O5 | As | CeO2 | Y2O3 | Nd2O3 | La2O3 | Прочие РЗЭ | ППП |
| Содержание | 11.50 | 0.05 | 0.03 | 0.68 | 0.46 | 0.32 | 0.29 | 0.750 | 1.97 |
Щелочное разложение и кислотное выщелачивание концентрата проводили в лабораторном автоклаве (“Top Industrie”, Франция). Условия щелочного разложения: температура – от 90 до 140°С, концентрация гидроксида натрия – от 20 до 50%, содержание твердой фазы – от 6.7 до 20%, крупность концентрата от 630 до 50 мкм. После выщелачивания кек отделяли от продуктивного раствора методом фильтрации, промывали дистиллированной водой и высушивали. Последующее кислотное выщелачивание проводили при определенных ранее рациональных режимах: температура – 80°С, продолжительность – 1 ч, концентрация азотной кислоты – 450 г/л, содержание твердой фазы – 20%. После выщелачивания кек отделяли от продуктивного раствора, промывали дистиллированной водой и высушивали. В продуктивном растворе измеряли объем и степень естественного уплотнения силикатного геля. Отделение силикатного геля от продуктивного раствора производили центрифугированием при относительном центробежном ускорении лабораторной центрифуги UC-1536 E (“ULAB”, Китай) не менее 500 g в течение 10 мин.
Измельчение проб исходного эвдиалитового концентрата до крупности 315; 63 и 50 мкм проводили в лабораторной барабанно-валковой шаровой мельнице МШЛ-1, при следующих параметрах: соотношение массы шаров (материал шаров ‒ алюбит) к массе концентрата и воды Мш:Мк:Мв = = 6:1:1, продолжительность помола 5‒40 мин.
Параметры ультразвуковой обработки (УЗ) минеральной суспензии: рабочая частота, кГц – 22 ± 1.65, амплитуда механических колебаний, мкм, max – 25 ± 5, периодичность обработки – 1 раз в час, продолжительность обработки – от 10 до 30 мин.
Элементный состав кека и продуктивных растворов выщелачивания определяли методом масс-спектроскопии с индуктивно-связанной плазмой ICPE-9000 (“Shimadzu”, Япония) и рентгенофлуоресцентного анализа ARL ADVANT’X (“Thermo Scientific”, США).
Морфологию и элементный состав поверхности минералов концентрата исследовали методом аналитической растровой электронной микроскопии на микроскопе LEO 1420VP, оснащенном энергодисперсионным микроанализатором Oxford INCA Energy (“Carl Zeiss”, Великобритания).
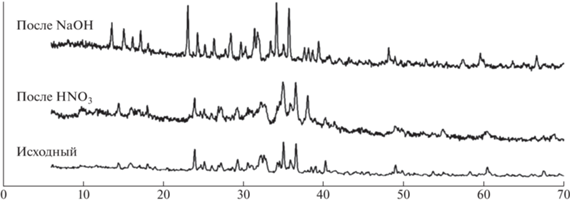
Рентгенофазовый анализ (РФА) концентрата выполнялся на дифрактометре АДП-2 (НПО “Буревестник”), CoKα-излучение. Идентификация фаз проводилась путем сравнения экспериментальных и рассчитанных спектров минералов с использованием кристаллографической базы данных неорганических соединений ISCD.
Эффективность извлечения компонентов (Si, Zr и РЗЭ) рассчитывалась по формулам (1, 2). Все эксперименты повторялись не менее трех раз, результаты усреднялись с относительной погрешностью ±3%. Расчеты проверялись балансом массы каждого элемента в твердой и жидкой фазе с относительной погрешностью ±5%.
(1)
$\varepsilon = \frac{{\alpha \times m - \beta {\kern 1pt} *{\kern 1pt} m{\kern 1pt} '}}{{\alpha \times m}} \times 100$α – исходное содержание оксида кремния, %;
$m$ – масса пробы, г;
β – содержание элемента в кеке, %;
m' – масса кека, г;
C – концентрация элемента в растворе, г/л;
V – объем раствора, л.
АНАЛИЗ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние параметров щелочного разложения
На рис. 1 представлены кинетические зависимости извлечения кремния в продуктивный раствор от температуры суспензии, концентрации щелочи, содержания твердой фазы и крупности эвдиалитового концентрата.
Рис. 1.
Кинетика извлечения кремния в продуктивный раствор щелочного разложения эвдиалитового концентрата в зависимости от (а) – температуры, (б) – концентрации NaOH, (в) – содержания твердого, (г) – крупности концентрата.
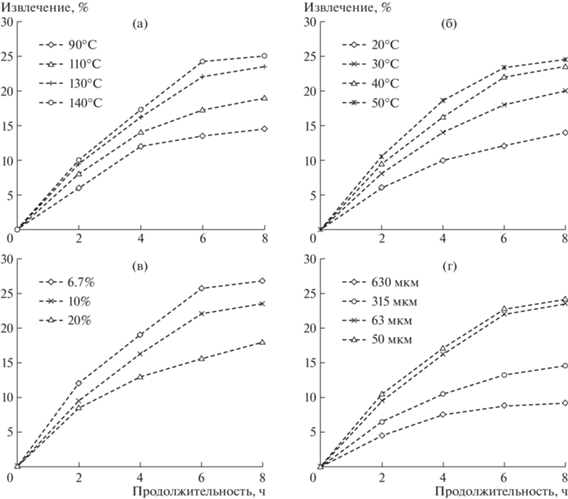
Установлено, что повышение температуры процесса щелочного разложения эвдиалитового концентрата с 90 до 110°С способствует увеличению извлечения кремния в раствор на 4.5% с 14.5 до 19.0% (рис. 1а), увеличение температуры с 110 до 130°С – на 4.5% с 19.0 до 23.5%. Дальнейшее повышение температуры суспензии до 140°С увеличивает извлечение кремния всего на 1.5% с 23.5 до 25.0%.
Повышение концентрации NaOH с 20 до 30% в процессе щелочного разложения эвдиалитового концентрата обеспечивает увеличение извлечения кремния в раствор на 6.1% с 14.0 до 20.1% ‒ до 40% – на 3.4% с 20.1 до 23.5% ‒ до 50% на 1.0% с 23.5 до 24.5% (рис. 1б).
Снижение содержания твердой фазы в суспензии с 20% до 10% в процессе щелочного разложения эвдиалитового концентрата обеспечивает увеличение извлечения кремния в раствор на 5.5% с 18.0 до 23.5% (рис. 1в). Дальнейшее снижение содержания твердой фазы до 6.7% увеличивает извлечение кремния на 3.3% с 23.5 до 26.8%, однако при этом расход воды на процесс повышается в 1.5 раза.Снижение крупности исходного эвдиалитового концентрата с 630 мкм до 315 мкм обеспечивает повышение извлечения кремния в раствор на 5.4% с 9.2 до 14.6% (рис. 1г); последующее снижение крупности до 63–50 мкм обеспечивает значительный прирост извлечения кремния в щелочной раствор на 8.9–9.6% с 14.6% до 23.5–24.2%.Таким образом, установлены наиболее рациональные параметры щелочного разложения эвдиалитового концентрата, обеспечивающие извлечение кремния в раствор до 22.9%: крупность концентрата – 63 мкм, Т – 130°С; t – 6 ч; СNaOH – 40%, содержание твердой фазы – 10%. При этом, во всех исследуемых растворах щелочного разложения эвдиалитового концентрата не было обнаружено редких и редкоземельных элементов, т.е. они все оставались в кеке. Повышение температуры и концентрации раствора едкого натра, снижение содержания твердой фазы повышает извлечение кремния в раствор на 1.0–3.3%, однако это приводит к резкому увеличению расхода воды и эксплуатационных затрат на нагрев раствора и приобретение щелочи.Морфология поверхности эвдиалитового концентратаРанее [13] были подробно проанализированы особенности взаимодействия основных минералов концентрата с различными кислотами (азотной, серной и соляной) в зависимости от их растворимости. По данным АСЭМ характерной особенностью минеральных зерен эвдиалита из осадка после кислотного выщелачивания является достаточно высокая степень их растворения и присутствие на них корки силикатного геля различной толщины, которая в ряде случаев покрывает всю частицу целиком (рис. 2а, б). На поверхности пластинчатых кристаллов лампрофиллита наблюдается серия кристаллографически ориентированных параллельных трещин. Зерна кислотоупорных лопарита, эгирина и полевых шпатов остаются морфологически практически не измененными (в пределах разрешающей способности используемого микроскопа) [9, 10, 13].На дифрактограммах продуктов кислотного выщелачивания фиксируется повышение фона и гало в области малых углов, связанное с присутствием аморфного силикатного геля, изменение формы пиков (их уширение), а также уменьшение относительных интенсивностей диагностических рефлексов хорошо растворимых в кислотах минералов (эвдиалита и нефелина) с одновременным увеличением этого параметра для слабо растворимых лопарита и минералов группы полевых шпатов (рис. 3).
В противоположность этому при обработке концентрата раствором NaOH наиболее интенсивному выщелачиванию подвергаются зерна калиевого полевого шпата (рис. 4а), что сопровождается обогащением продуктивного раствора такими элементами, как K, Al и Si. Следы селективного растворения несут на себе также отдельные частицы эвдиалита (рис. 4б). На остальных компонентах пробы не наблюдается каких-либо значительных морфологических изменений (рис. 5а‒г). Большинство частиц твердого осадка выщелачивания свободно от силикатного геля.
Рис. 5.
Морфологически неизмененные зерна лампрофиллита (а), нефелина (б), эгирина (в) и лопарита (г).

Дифрактограммы проб концентрата после щелочного выщелачивания подтверждают морфологические наблюдения. Отмечается незначительное повышение фона, в то же время основные диагностические пики минералов острые и хорошо выраженные.
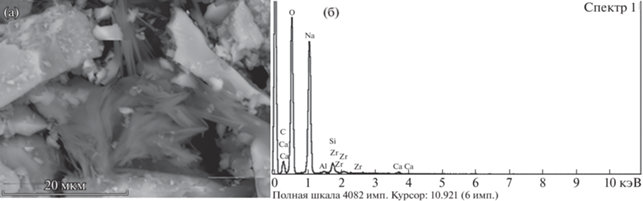
Среди продуктов выщелачивания обнаружены игольчатые кристаллы, вторичной фазы, энергодисперсионные спектры которых содержат только Na и O, предположительно, гидрокарбоната натрия NaHCO3 (нахколита) (рис. 6 а, б). Общее количество этой фазы невелико, а основные ее рентген-дифракционные диагностические пики совпадают с пиками основных минералов концентрата, что и не позволяет ее однозначно диагностировать.
Рис. 6.
Игольчатые кристаллы вторичной фазы в продуктах щелочного выщелачивания и их энергодисперсионный спектр.
Кинетика щелочного растворения. Для понимания механизма растворения была также исследована кинетика выщелачивания кремния из эвдиалитового концентрата с использованием данных, полученных при различных температурах. Предполагая участие сферических частиц твердого образца в процессе выщелачивания, этап, определяющий скорость процесса, выявляли посредством сравнения кинетических данных с моделями диффузионной и химически контролируемой усадки ядра [14].
Данные модели описываются следующими уравнениями:
для диффузионной области:
(3)
$1--\frac{2}{3}x - {{\left( {1--x} \right)}^{{2/3}}} = {{K}_{{\text{d}}}}t = K\exp \left( { - \frac{{{{E}_{{\text{a}}}}}}{{RT}}} \right)t$для химической контролируемой области:
(4)
$1--{{\left( {1--x} \right)}^{{1/3}}} = {{K}_{{\text{r}}}}t = K\exp \left( { - \frac{{{{E}_{{\text{a}}}}}}{{RT}}} \right)t$В кинетических экспериментах энергия активации рассчитывается по уравнению Аррениуса [15, 16]:
где:х ‒ доля извлеченного компонента;
Kd и Kr ‒ константы скорости, рассчитанные по уравнениям (2) и (3) соответственно;
t ‒ время реакции, с;
K ‒ кинетическая константа;
Т ‒ абсолютная температура, K;
K0 ‒ постоянная Аррениуса;
R ‒ универсальная постоянная газа, 8.3 Дж/(моль K);
Ea ‒ энергия активации, Дж/моль.
На рис. 7 показаны взаимосвязи между экспериментальными данными, полученными на основе предложенных кинетических моделей, и временем выщелачивания при различных температурах. Значения кажущейся констант скорости Kr и Kd (табл. 2) рассчитывали как наклоны прямых линий, полученных на рис. 7.
Рис. 7.
Кинетические графики растворения кремния (а ‒ контролируемая химической реакцией, б ‒ диффузией).
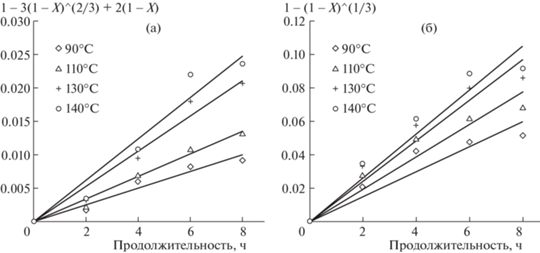
Таблица 2.
Значения Kr и Kd и коэффициентов корреляции R2 при различных температурах
| Температура (°С) | Kr | Kd | R2 | |
|---|---|---|---|---|
| Kr | Kd | |||
| 90 | 0.0075 | 0.0013 | 0.8616 | 0.9562 |
| 110 | 0.0097 | 0.0017 | 0.9105 | 0.9839 |
| 130 | 0.0121 | 0.0026 | 0.9342 | 0.9676 |
| 140 | 0.0131 | 0.0031 | 0.9290 | 0.9496 |
Более высокие значения коэффициентов корреляции Kd (0.9496‒0.9839) предполагают, что в данных условиях при выщелачивании кремния преобладает механизм, контролируемый внутренней диффузией.
Энергию активации (Ea) реакции выщелачивания рассчитывали по уравнению Аррениуса (5), выраженной в виде выражения (6):
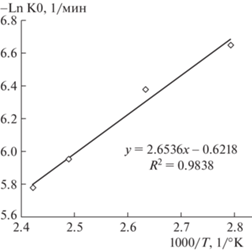
График зависимости Ln Kd от 1/T дает прямую линию (рис. 8) с наклоном − Ea/RT и точкой пересечения Ln K0. В процессе, контролируемом диффузией, энергия активации составляет <25 кДж/моль, а энергия активации для химически контролируемого процесса составляет >40 кДж/моль [17].
Рассчитанная энергия активации Ea реакции (Ea/R = 2.6536), равная 22.06 кДж/моль, подтверждает, что скорость растворения кремния контролируется внутренней диффузией, т.е. процесс растворения описывается внутридиффузионной кинетической моделью.
Влияние ультразвуковых воздействий на эффективность щелочного растворения. В предыдущих исследованиях [18] было установлено, что использование ультразвуковых воздействий приводит к образованию многочисленных дефектов и микротрещин на поверхности частиц эвдиалита, способствуя повышению эффективности взаимодействия с кислотой и интенсивному растворению минералов.
В табл. 3 приведены результаты влияния продолжительности ультразвуковой обработки на эффективность извлечения кремния при щелочном разложении. Использование ультразвуковых воздействий в процессе щелочного разложения концентрата крупностью 630 мкм способствует повышению извлечения кремния в раствор на 12.6% с 9.2 до 21.8%, что сопоставимо с результатами, полученными на более тонком классе (63 мкм) без обработки. УЗ-обработка эвдиалитового концентрата крупностью 63 мкм также позволяет повысить извлечение кремния при щелочном разложении на 2.8‒5.5% с 22.0 до 27.5%. Однако продолжительная ультразвуковая обработка (30 мин) тонкого класса приводит к значительному снижению скорости последующей фильтрации суспензии, за счет образования большого количества коллоидных частиц.
Таблица 3.
Влияние продолжительности ультразвуковой обработки на извлечение кремния (температура – 130°С, продолжительность – 6 ч, концентрация NaOH – 40%)
| Продолжительность УЗ, мин | Извлечение кремния, % | |
|---|---|---|
| 630 мкм | 63 мкм | |
| 0 | 9.2 | 22.0 |
| 10 | 12.4 | 24.8 |
| 20 | 16.7 | 26.3 |
| 30 | 21.8 | 27.5 |
Кислотное выщелачивание кека щелочного разложения эвдиалитового концентрата. В табл. 4 представлены результаты кислотного выщелачивания эвдиалитового концентрата после щелочного разложения. Из представленных данных следует, что в сравнении с азотнокислотным выщелачиванием эвдиалитового концентрата крупностью 63 мкм предварительное щелочное разложение приводит к снижению объема силикатного геля в продуктивном растворе (после центрифугирования) в 1.1‒1.4 раза с 66.5 до 61.8% (раствор азотной кислоты) и 48.5% (соляная кислота). При этом наблюдается интенсификация процесса растворения эвдиалитового концентрата – потеря массы навески увеличивается с 60 до 68% при использовании соляной кислоты и до 78.9% для раствора азотной кислоты, что также приводит к повышению общего извлечения Zr с 76.9 до 86.1 и 90.8%, РЗЭ – с 79.6 до 88.5 и 92.6%, для соляной и азотной кислот соответственно.
Таблица 4.
Технологические показатели кислотного выщелачивания (температура – 80°С, продолжительность – 1 ч, Т:Ж – 1:20)
| Кислота | Вид обработки | ∆m, % | V1, % об. | V2, % об. | ε, % | ∆, % | ||
|---|---|---|---|---|---|---|---|---|
| Zr | РЗЭ | Zr | РЗЭ | |||||
| HNO3 | – | 56.0 | 55.0 | 66.5 | 76.9 | 79.6 | 73.4 | 75.6 |
| HNO3 | Щелочное разложение | 78.9 | 97.2 | 61.8 | 90.8 | 92.6 | 70.4 | 71.7 |
| HCl | Щелочное разложение | 68.0 | 95.6 | 48.5 | 86.1 | 88.5 | 50.6 | 52.1 |
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований представлена морфология основных минералов эвдиалитового концентрата и установлены рациональные параметры его щелочного разложения: крупность концентрата – 63 мкм, Т – 130°С; t – 6 ч; СNaOH – 40%, Т:Ж = 1:10, обеспечивающие извлечение кремния в раствор до 22.9%, и, как следствие, снижение потерь ценных компонентов с силикатным гелем при последующем кислотном выщелачивании кека. Наиболее интенсивному разложению подвергаются зерна калиевого полевого шпата, что сопровождается обогащением продуктивного раствора такими элементами, как K, Al и Si.
Установлена перспективность использования УЗ-воздействий для интенсификации процесса щелочного разложения эвдиалитового концентрата, обеспечивающих идентичное (21.8%) извлечение кремния в раствор без измельчения исходного эвдиалитового концентрата.
Предварительное щелочное разложение эвдиалитового концентрата обеспечивает при последующем кислотном выщелачивании кека снижение объема силикатного геля в продуктивном растворе в 1.1‒1.4 раза в сравнении с обычным кислотным выщелачиванием и повышение общего извлечения Zr с 76.9 до 86.1 и 90.8%, РЗЭ – с 79.6 до 88.5 и 92.6% для соляной и азотной кислот соответственно.
Список литературы
Savel’eva I.L. The Rare-earth Metals Industry of Russia: Present Status, Resource Conditions of Development // Geography and Natural Resources. 2011. V. 32. № 1. P. 65–71.
Кулешевич Л.В., Дмитриева А.В. Редкоземельная минерализация в щелочных и умеренно щелочных комплексах Карелии, связанных с ними метасоматитах и рудах // Горн. журн. 2019. № 3. С. 45–50.
Rastsvetaeva R.K. Structural Mineralogy of the Eudialyte Group: A Review // Crystallography Reports. 2007. V. 52. P. 47–64.
Forrester K., Leijd M., Oczlon M., Holmstrom H., Saxon M. Beneficiation of Rare Earth Element Enriched Eudialyte from the Norra Kärr Peralkaline Intrusion with Wet High Intensity Magnetic Separation // Vancouver: Canadian Institute of Mining, Metallurgy and Petroleum., Conf. of Metallurgists. 2014. P. 1–14.
Захаров В.И., Скиба Г.С., Соловьев А.В., Лебедев В.Н., Майоров Д.В. Некоторые аспекты кислотной переработки эвдиалита // Цв. металлы. 2011. № 11. С. 25–29.
Лебедев В.Н. Сернокислотная технология эвдиалитового концентрата // Журн. прикл. химии. 2003. Т. 76. № 10. С. 1601–1605.
Лебедев В.Н., Щур Т.Е., Майоров Д.В., Попова Л.А., Серкова Р.П. Особенности кислотного разложения эвдиалита и некоторых редкометалльных концентратов Кольского полуострова // Журн. прикл. химии. 2003. Т. 76. № 8. С. 1233–1237.
Захаров В.И., Воскобойников Н.Б., Скиба Г.С., Соловьев А.В., Майоров Д.В., Матвеев В.А. Разработка солянокислотной технологии комплексной переработки эвдиалита // Зап. Горн. ин-та. 2005. Т. 165. С. 83–85.
Chanturiya V.A., Minenko V.G., Samusev A.L., Chanturia E.L., Koporulina E.V., Bunin I., Ryazantseva M.V. The Effect of Energy Impacts on the Acid Leaching of Eudialyte Concentrate // Mineral Processing and Extractive Metallurgy Review. 2021. 42(7). P. 484–495.
Chanturia V.A., Chanturia E.L., Minenko V.G., Samusev A.L. Acid Leaching Process Intensification for Eudialyte Concentrate Based on Energy Effects // Obogashchenie Rud. 2019. № 3. P. 29–36.
Богатырева Е.В., Чуб А.В., Ермилов А.Г., Хохлова О.В. Эффективность щелочно-кислотного способа комплексного выщелачивания эвдиалитового концентрата. Ч. 1 // Цв. металлы. 2018. № 7. С. 57–61.
Богатырева Е.В., Чуб А.В., Ермилов А.Г., Хохлова О.В. Эффективность щелочно-кислотного способа комплексного выщелачивания эвдиалитового концентрата. Ч. 2 // Цв. металлы. 2018. № 8. С. 69–74.
Chanturia V.A., Koporulina E.V., Minenko V.G., et al. Energy Effects on Structural and Chemical Transformations of Base Minerals of Eudialyte Concentrate in Nitric Acid Leaching // Journal of Mining Science. 2019. V. 55. P. 634–642.
Levenspiel O. Chemical Reaction Engineering. 3rd ed. John Wiley & Sons Inc., 1999. 684 p.
Davison R.L., Natusch D.F., Wallace J.R., Evans Jr C. Trace Elements in Fly Ash. Dependence of Concentration on Particle Size // Environmental Science & Technology. 1974. V. 8(13). P. 1107–1113.
Makanyire T., Jha A., Sutcliffe S. Kinetics of Hydrochloric Acid Leaching of Niobium from TiO2 Residues // Int. J. Miner. Process. 2016. 157 (Suppl. C). P. 1–6.
Wu D., Wang X., Li D. Extraction Kinetics of Sc(III), Y(III), La(III) and Gd(III) from Chloride Medium by Cyanex 302 in Heptane Using the Constant Interfacial Cell with Laminar Flow // Chem. Eng. Process. Process. Intensif. 2007. V. 46. P. 17–24.
Чантурия В.А., Миненко В.Г., Самусев А.Л., Чантурия Е.Л., Копорулина Е.В. Механизм влияния комбинированных энергетических воздействий на интенсификацию выщелачивания циркония и редкоземельных элементов из эвдиалитового концентрата // Физико-технические проблемы разработки полезных ископаемых. 2017. № 5. С. 105–112.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле