Доклады Российской академии наук. Науки о Земле, 2022, T. 507, № 1, стр. 42-45
Растворимость пирохлора в растворах NaF при 800°C и Р = 170–230 МПа
А. Ф. Редькин 1, *, Н. П. Котова 1, член-корреспондент РАН Ю. Б. Шаповалов 1
1 Институт экспериментальной минералогии
им. Д.С. Коржинского Российской академии наук
Черноголовка, Россия
* E-mail: redkin@iem.ac.ru
Поступила в редакцию 15.07.2022
После доработки 20.07.2022
Принята к публикации 01.08.2022
- EDN: KMHVAG
- DOI: 10.31857/S2686739722601405
Аннотация
Проведены экспериментальные исследования растворимости пирохлора (NaCa)Nb2O6F в системе NaF–H2O, охватывающей как гомогенную область гидротермальных растворов, так и область флюидной несмесимости, в интервале концентраций NaF от 0.1 до 16 моль кг–1 H2O при 800°С и давлении 170–230 МПа. Установлено, что содержание ниобия в растворах, насыщенных пирохлором и флюоритом находится в пределах от 10–5 до 10–3 моль кг–1 H2O. В области флюидной несмесимости при увеличении концентрации NaF наблюдается снижение mNb. Показано, что наиболее вероятными формами ниобия в изученных фторидных растворах могут быть частицы HNbO$_{3}^{0}$, NbO2F0. Сравнительный анализ экспериментальных данных указывает на то, что концентрация ниобия, равновесная с пирохлором и флюоритом, в 10–2–10 m NaF растворах, в 10–50 раз выше, чем концентрация тантала в равновесии с микролитом и флюоритом.
ВВЕДЕНИЕ
Пирохлор является важнейшим ниобий-содержащим рудным минералом, поэтому исследование его поведения в гидротермальных и магматических системах представляет интерес для генезиса соответствующих редкометальных месторождений. Рудные минералы (пирохлор и микролит), содержащие ниобий и тантал, обладают низкой растворимостью в гидротермальных растворах, поэтому считается, что их образование связано с эволюцией фторсодержащих магматических расплавов. Вместе с тем в ряде работ [1–3] было показано, что фторидные растворы способны накапливать значительные концентрации ниобия и участвовать в перекристаллизации редкометальных руд. Преимущественной формой переноса ниобия являются фторидные комплексы [4]. Особый интерес представляют растворы фторида натрия, поскольку натрий является доминирующим катионом большинства гидротермальных растворов магматогенного генезиса и при указанных выше TР-параметрах в системе NaF–H2O имеет место [3] явление флюидной несмесимости – распад гомогенного раствора на флюидные фазы, имеющие разную плотность.
МЕТОДИКА И РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Опыты проводили на установке высокого газового давления УВГД-10 000 с внутренним нагревом (газовый сосуд, ГС) при одновременной загрузке в контейнер 4–5 ампул, а также на гидротермальной установке (УВД-6000) в реакторах диаметром 6–8 мм при 800°С, p = 170–230 МПа. Длительность опытов составляла 7–9 сут. Материалами служили пирохлор (Pcl), полученный гидротермальным синтезом из тщательно перетертой смеси реагентов NaF + CaCO3 + Nb2O5, при 800°С и давлении 200 МПа в 1М растворе NaF; NaF в виде реактива марки осч; флюорит (Fl) – CaF2 и тридистиллированная H2O. Флюорит для опытов готовили из реактива CaF2 особой чистоты путем перекристаллизации в 0.1 mHF при 500°С, 100 МПа в течение 2 нед., с последующей сушкой при 100°С и отжиге на воздухе при 500°С. В Pt-ампулу вводили 10–15 мг Pcl, 0 – 5 мг Fl, NaF от 0 до 100 мг и 0.15 мл H2O. В опытах, где исходная концентрация NaF была ниже 1 моль кг–1 H2O, использовали растворы фторида натрия.
Процедура разгрузки ампул и анализа продуктов опытов была аналогична ранее описанной в деталях в работе [3].
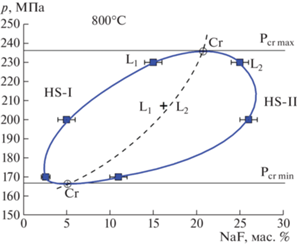
Исследование растворимости пирохлора (NaCa)Nb2O6F проведено в растворах, содержащих 0.1–16 mNaF, охватывающих как гомогенную область растворов (HS–I и HS–II), так и область флюидной несмесимости (L1 + L2) в системе NaF–H2O (рис. 1). В системе NaF–H2O при 800°С существует ограниченная область несмесимости растворов [3], в которой проявляется особенность гидролизa NaF, влияющая на растворимость рудного минерала. Область несмесимости (L1 + L2) оконтурена по результатам исследования растворимости микролита, (NaCa)Ta2O6F, в растворах NaF. При 800°С и 170, 200 и 230 МПа содержания NaF в L1 и L2 флюидных фазах равны 1 и 11 мас. %, 5 и 26%, 12 и 25% соответственно. Так как пирохлор, как это будет показано ниже, также имеет низкую растворимость в солевых NaF-растворах, то границы флюидной несмесимости не должны заметно измениться и все несоответствия могут быть связаны с методикой эксперимента, прежде всего точностью задания температуры и давления в реакционной зоне.
Рис. 1.
Границы флюидной несмесимости (L1 + L2) в системе NaF–H2O по экспериментальным данным (Редькин и др., 2016). HS–I и HS–II области гомогенности раствора NaF–H2O в интервале минимального (Pcr min) и максимального (Pcr max) критического давления флюида.
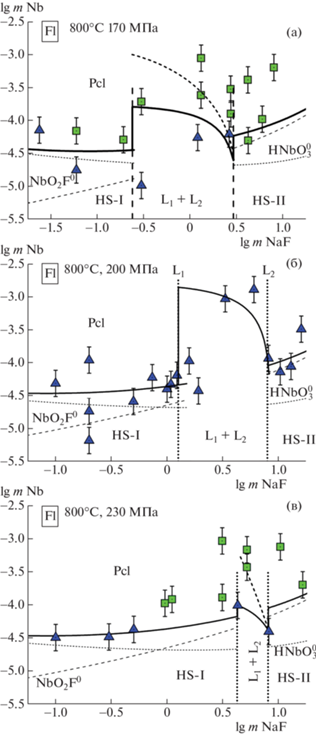
Результаты анализа растворов на содержание ниобия представлены на рис. 2. В опытах, проведенных при давлении 170 и 230 МПа на УВД и ГС, отмечается различие данных по содержанию ниобия. Следует отметить, что в системе NaF–H2O при 800°С указанные давления (170 и 230 МПа) близки к критическим давлениям (Pcr min= 165 ± 5 MПа и Pcr max = 236 ± 5 МПа). Мы допускаем, что давление в опытах на ГС было за пределами критической области, что могло оказать заметное влияние на результаты исследований. В экспериментах, проведенных на УВД, параметры опытов постоянно поддерживались с точностью (T ± 3°С, p ± 5 MПа). Результаты наших исследований удовлетворительно согласуются с данными [5], полученными в опытах по растворению природного пирохлора при 650°С, 100 МПа в 1 молярном NaF растворе в присутствии SiO2.
Рис. 2.
Результаты опытов по инконгруэнтной растворимости пирохлора (Pcl) в растворах NaF при 800°С, p = 170 (a), 200 (б) и 230 (в) МПа (треугольные символы – на УВД, квадратные символы – на ГС). Сплошными линиями показаны тренды изменения mNb от mNaF, пунктирными – концентрации преобладающих частиц Nb (по результатам термодинамических расчетов). Условные обозначения: HS-I – гомогенный раствор в области низких концентраций NaF, HS-II – гомогенный раствор в области высоких концентраций NaF, L1 + L2 – область несмесимости флюидных фаз в системе NaF–H2O.
Согласно результатам рентгенофазового анализа и исследований на электронном сканирующем микроскопе (CamScan, Vega-II), твердые продукты опытов были представлены двумя минеральными фазами: пирохлором (NaCa)Nb2O6F и флюоритом CaF2. В процессе эксперимента, особенно в высококонцентрированных растворах NaF, происходили перекристаллизация и заметное (в десятки раз) укрупнение отдельных кристаллов пирохлора.
Полученные экспериментальные данные были использованы для определения основных форм переноса Nb5+ во фторидных растворах. В качестве наиболее вероятных частиц Nb5+ были рассмотрены гидроксо- и гидроксо-фторидные комплексы, подобные частицам Ta5+ [3]. Принимая во внимание относительно слабую зависимость mNb от ионной силы раствора (~mNaF), можно ожидать, что доля заряженных комплексов Nb5+ [4, 6] в рассматриваемой системе будет незначительной. Расчеты выполнены по программе OptimA [7]. Установлено, что основными формами ниобия в изученных фторидных растворах могут быть частицы HNbO$_{3}^{0}$, NbO2F0. Другие частицы, NbOOHF$_{2}^{0}$, Na6H2Nb6O$_{{19}}^{0}$, NaNbO$_{3}^{0}$, подобные тем, которые установлены для тантала, если и присутствуют, то в подчиненных количествах. В результате проведенных термодинамических расчетов определены константы реакций:
(1)
$\begin{gathered} {\text{Pcl}} + 2{\text{H}}{{{\text{F}}}^{0}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Flu}} + 2{\text{HNbO}}_{3}^{0} + {\text{Na}}{{{\text{F}}}^{0}}, \\ \lg {{{\text{K}}}_{{\text{p}}}}(1) = --7.27, \\ \end{gathered} $(2)
$\begin{gathered} {\text{Pcl}} + 4{\text{H}}{{{\text{F}}}^{0}} = {\text{Flu}} + 2{\text{Nb}}{{{\text{O}}}_{{\text{2}}}}{{{\text{F}}}^{0}} + {\text{Na}}{{{\text{F}}}^{0}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \lg {{{\text{K}}}_{{\text{p}}}}(2) = --2.60. \\ \end{gathered} $На рис. 2 концентрации частиц HNbO$_{3}^{0}$, NbO2F0 показаны прерывистыми линиями, а суммарная концентрация ниобия в гомогенных растворах показана сплошной линией. Экспериментальные данные указывают на особенность изменения растворимости в области флюидной несмесимости – кажущаяся растворимость пирохлора (т.е. определенная в закаленном растворе, после смешения L1 и L2 флюидных фаз) падает с ростом суммарной концентрации NaF.
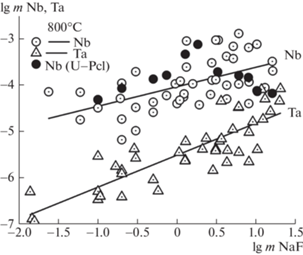
На рис. 3 обобщены экспериментальные данные по инконгруэнтной растворимости пирохлора (CaNa)Nb2O6F, микролита (CaNa)Ta2O6F и уран-пирохлора (Na1.2Ca0.4U0.3)Nb2O6.4F0.4 [8] в растворах NaF. Согласно проведенным исследованиям установлено, что концентрация ниобия, равновесная с Pcl + Flu, в 10–2–10 m NaF-растворах, в 10–50 раз выше, чем концентрация тантала в равновесии с микролитом и флюоритом. Уран, входящий в восьми координационную позицию A пирохлора, замещая Ca2+, практически не оказывает влияния на содержание ниобия в равновесном растворе.
Рис. 3.
Влияние mNaF на содержание Nb и Ta в растворах равновесных с Pcl+Flu (кружки), U–Pcl + Flu + UO2 (черные кружки) и Mic + Flu (треугольники) при 800°С, p = 170–230 МПа (по экспериментальным данным).
Проведенные исследования показали, что высокотемпературные (магматогенные) растворы, содержащие значительные концентрации фторидных солей, способны растворять и переносить ниобий в количествах ~10 ppm и участвовать в формировании гидротермальных рудных месторождений.
Список литературы
Zaraisky G.P., Korzhinskaya V., Kotova N. Experimental studies of Ta2O5 and columbite-tantalite solubility in fluoride solutions from 300 to 550oC and 50 to 100 MPa // Mineral. Petrol. 2010. V. 99. № 3–4. P. 287–300. https://doi.org/10.1007/s00710-010-0112-z
Korzhinskaya V.S., Kotova N.P. Experimental modeling of possibility of hydrothermal transferring niobium by fluoride // Experiment in Geosciences. 2012. V. 18. № 1. P. 119–121.
Редькин А.Ф., Котова Н.П., Шаповалов Ю.Б. Жидкостная несмесимость в системе NaF–H2O и растворимость микролита при 800°C // ДАН. 2016. Т. 469. № 2. С. 210–214. https://doi.org/10.7868/S0869565216200196
Akinfiev N.N., Korzhinskaya V.S., Kotova N.P., Redkin A.F., Zotov A.V. Niobium and tantalum in hydrothermal fluids: Thermodynamic description of hydroxide and hydroxofluoride complexes // Geochimica et Cosmochimica Acta. 2020. V. 280. P. 102–115. https://doi.org/10.1016/j.gca.2020.04.009
Kotelnikov A.R., Korzhinskaya V.S., Kotelnikova Z.A., Suk N.I. Influence of Silicate Substance on Pyrochlore and Tantalite Solubility in Fluoride Aqueous Solutions (Experimental Studies). In: Litvin Y., Safonov O. (eds.) Advances in Experimental and Genetic Mineralogy. Springer Mineralogy. Springer, Cham. 2020. P. 49–68. https://doi.org/10.1007/978-3-030-42859-4_3
Timofeev A., Migdisov Art.A., Williams-Jones A.E. An experimental study of the solubility and speciation of niobium in fluoride-bearing aqueous solutions at elevated temperature // Geochim. Cosmochim. Acta. 2015. V. 158. P. 103–111. https://doi.org/10.1016/j.gca.2015.02.015
Shvarov Yu.V. A suite of programs, OptimA, OptimB, OptimC, and OptimS compatible with the Unitherm database, for deriving the thermodynamic properties of aqueous species from solubility, potentiometry and spectroscopy measurements // Applied Geochemistry. 2015. V. 55. P. 17–27. https://doi.org/10.1016/j.apgeochem.2014.11.021
Redkin A.F., Kotova N.P., Shapovalov Y.B., Velichkin V.I. Experimental study and thermodynamic modeling of niobium, tantalum, and uranium behaviour in supercritical fluoride hydrothermal solutions. In: Solution Chemistry Advances in Research and Applications: (Ed.: Yongliang Xiong) Published by Nova Science Publishers, Inc. New York. 2018. P. 1–46. ISBN: 978-1-53613-101-7
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле


