Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 11-14
ВЛИЯНИЕ КЕТОСУБСТРАТА НА ВЫХОД ПРОДУКТА В РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ, КАТАЛИЗИРУЕМОЙ ТРАНСАМИНАЗОЙ ИЗ Thermoproteus Uzoniensis
Е. Ю. Безсуднова 1, *, Т. Н. Стеханова 1, К. М. Бойко 1, член-корреспондент РАН В. О. Попов 1, 2
1 Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской Академии наук
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: eubez@yandex.ru
Поступила в редакцию 13.09.2019
После доработки 13.09.2019
Принята к публикации 13.09.2019
Аннотация
Исследование равновесия реакций, катализируемых термостабильными ферментами, актуально для разработки биотехнологических процессов с их участием. Представлены результаты анализа равновесия реакции трансаминирования, катализируемой термостабильной трансаминазой из археи Thermoproteus uzoniensis. Было проведено сравнение глубины превращения субстратов в двух реакциях с L-лейцином и пируватом и L-лейцином и 2-оксобутиратом при 65°С. Установление равновесия контролировали по уменьшению концентрации 2-оксобутирата или пирувата и по накоплению кетоаналога L-лейцина. Показано, что степень превращения L-лейцина в реакции со специфическим кетосубстратом 2-оксобутиратом выше, чем в реакции с неспецифическим кетосубстратом пируватом.
Трансаминазы (ТА, EC 2.6.1.X) – это пиридоксаль 5'-фосфат (ПЛП)-зависимые ферменты, которые катализируют стереоселективный перенос аминогруппы с аминокислоты или амина на кетокислоту или кетон с образованием новых аминокислоты или амина и нового кетосоединения. Ферментативное трансаминирование – это реакция последовательного двойного замещения с промежуточным переносом аминогруппы на кофактор ПЛП; два субстрата последовательно связываются в одной области активного центра, все стадии реакции обратимы [1]. Как стереоселективные катализаторы переноса аминогруппы трансаминазы интересны для решения задач тонкого органического синтеза – асимметрического аминирования и разделения хиральных аминов [2]. Последнее десятилетие представило ряд ярких примеров применения TA в синтезе фармацевтических препаратов, в том числе ситаглиптина [3] и ингибитора Smo-рецептора [4]. Однако из-за особенностей реакции применение TA ограничено: обратимость реакции приводит к ингибированию продуктами, последовательное связывание двух субстратов в одном центре – к ингибированию субстратами. Эффективное применение TA невозможно как без преодоления этих двух ограничений, так и без разработки подходов к смещению равновесия реакции в сторону продуктов [2].
Как равновесный процесс трансаминирование характеризуется константой равновесия. Диапазон наблюдаемых констант равновесия для реакций трансаминирования составляет 0.016–100 [5, 6]; для некоторых реакций, например для катализируемого аланинглиоксилат трансаминазой человека переноса аминогруппы между глиоксилатом и L-аланином константа равновесия, достигает 9700 [7]. Цель настоящего исследования состояла в оценке влияния свойств кетосубстрата на равновесие реакции трансаминирования, катализируемой термостабильной трансаминазой из археи Thermoproteus uzoniensis (TUZN1299). Ранее было показано, что TUZN1299 активна с L-лейцином, L-изолейцином, L-валином, их неприродными гомологами и соответствующими кетокислотами, а также с положительно заряженными и серосодержащими аминокислотами. Оптимальный рН реакции трансаминирования между 4-метил-2-оксовалератом и L-аланином составил 8.0, оптимальная температура реакции превысила 95°С [8, 9]. Активность фермента не снижалась после пяти часов инкубации при 70°C; после 24 ч инкубации при 70°C потеря активности составила менее 40% [8]. Эти свойства позволили рассматривать TUZN1299 как фермент с высоким биотехнологическим потенциалом. В этом контексте нами проведен сравнительный анализ зависимости глубины превращения субстратов от специфичности TUZN1299 к кетосубстратам для реакций трансаминирования между L-лейцином и пируватом (1) и между L-лейцином и 2-оксобутиратом (2) при 65 °С:
(1)
$\begin{gathered} {\text{L - лейцин}} + {\text{пируват }} \leftrightarrow \\ \leftrightarrow 4{\text{ - метил - }}2{\text{ - оксовалерат}} + {\text{L - аланин}}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{L - лейцин}} + 2{\text{ - оксобутират}} \leftrightarrow \\ \leftrightarrow 4{\text{ - метил - }}2{\text{ - оксовалерат + }} \\ \, + 2{\text{ - аминобутановая кислота}}. \\ \end{gathered} $Глубину превращения и константы равновесия обеих реакций рассчитывали из значений концентраций кетосоединений, определенных хроматографически на колонке Source 30S (GE Healthсare), уравновешенной 5 мМ H2SO4 с добавлением 5% ацетонитрила. Специфичность TUZN1299 при 65°С к субстратам определяли из зависимостей скорости ферментативной реакции от концентрации субстрата с последующей обработкой кривой по уравнению Михаэлис–Ментен (табл. 1). Методы выделения и определения активности TUZN1299 приведены в работах [8, 9].
Таблица 1.
Кинетические параметры реакции трансаминирования, катализируемой TUZN1299 при 65°С в 50 мМ Na-фосфатном буфере, рН 8
| Субстрат | Косубстрат | kcat, с–1 | Km, мМ | kcat/Km, с–1 М–1 |
|---|---|---|---|---|
| 4-метил-2-оксовалерат | L-аланин | 3.0 ± 0.3 | 0.15 ± 0.06 | 20 000 ± 10 000 |
| L-лейцин | пируват | 1.31 ± 0.04 | 0.21 ± 0.08 | 6240 ± 2600 |
| 2-оксобутират | L-аланин | 10.2 ± 0.8 | 1.0 ± 0.3 | 10 000 ± 3500 |
| 2-аминобутановая кислота | Пируват | 7.2 ± 0.7 | 0.48 ± 0.11 | 15 000 ± 4900 |
| Пируват | L-лейцин | 1.78 ± 0.12 | 16.0 ± 3.0 | 111 ± 28 |
| L-аланин | 4-метил-2-оксовалерата | 2.7 ± 0.4 | 62 ± 18 | 43 ± 19 |
Как следует из табл. 1, при 65°С TUZN1299 наиболее специфична к 4-метил-2-оксовалерату. При этом 4-метил-2-оксовалерат значительно ингибирует активность TUZN1299 (рис. 1). По-видимому, по этой причине kcat реакций деаминирования L-лейцина и аминирования 4-метил-2-оксовалерата ниже kcat реакций деаминирования 2-аминобутановой кислоты и аминирования 2-оксобутирата, который не ингибирует активность TUZN1299 (рис. 1). Очевидно также, что L-аланин и пируват не являются специфическими субстратами для TUZN1299.
Рис. 1.
Зависимость отношения наблюдаемой скорости реакции V к максимальной скорости реакции Vmax от концентрации 2-оксобутирата (1) и 4-метил-2-оксовалерата (2) в реакции трансаминирования, катализируемой TUZN1299, при 65°С в Na-фосфатном буфере, рН 8.0, в присутствии 20 м/M L-аланина.
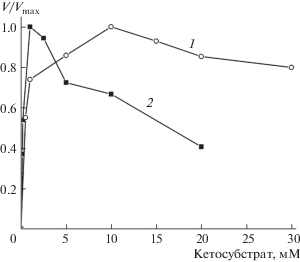
Чтобы наиболее адекватно оценить константу равновесия реакции, целесообразно анализировать систему, которая достигает равновесного состояния с противоположных направлений, т.е. систему, которая изначально содержит как субстраты, так и продукты. Однако, поскольку 4-метил-2-оксовалерат ингибирует фермент при концентрациях выше 1 мМ, был применен другой подход: реакцию инициировали в системе, которая содержала только субстраты (L-лейцин и кетосубстрат) в концентрациях 10 мМ, установление равновесия контролировали по уменьшению концентрации 2-оксобутирата или пирувата и по накоплению 4-метил-2-оксовалерата (рис. 2). Начальные скорости реакций (1) и (2) составили 1.2 и 4.5 U/mg соответственно. Равновесие в реакциях было достигнуто через 4 и 2 ч соответственно. Добавление свежей аликвоты фермента в равновесную смесь через 5 ч не привело к изменению достигнутых концентраций компонентов. Концентрации пирувата, 2-оксобутирата и 4-метил-2-оксовалерата были скорректированы с учетом термического разрушения, которое не превысило 5% по истечении 5 ч. L-лейцин, L-аланин и 2-аминобутановая кислота были стабильны при 65°С. Значения константы равновесия реакций (1) и (2) составили 0.08 и 1.66 соответственно. Степень превращения L-лейцина в реакции с пируватом составила около 20%, а в реакции с 2-оксобутиратом превысила 50%. Равновесная концентрация 4-метил-2-оксовалерата достигла 2.1 и 5.63 мМ соответственно. Важно отметить, что в обеих реакциях равновесная концентрация 4-метил-2-оксовалерата превысила порог ингибирования (рис. 1).
Рис. 2.
Установление равновесия в реакции транс- аминирования, катализируемой TUZN1299, в 50 мМ Na-фосфатном буфере, рН 8.0 при 65°С. а – 1.2 мкМ TUZN1299, 10 мМ L-лейцина, 10 мМ пирувата; 1 – убыль пирувата, 2 – накоплению 4-метил-2-оксовалерата. б – 1.2 мкМ TUZN1299, 10 мМ L-лейцина, 10 мМ 2-оксобутирата; 1 – убыль 2-оксобутирата, 2 – накопление 4-метил-2-оксовалерата.
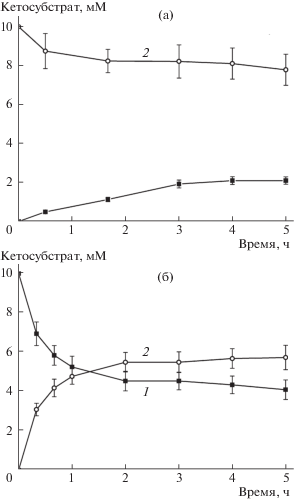
Очевидно, что глубина превращения L-лейцина выше в реакции со специфическим субстратом 2-оксобутиратом, чем в реакции с неспецифическим пируватом. При этом в обеих системах накопление 4-метил-2-оксовалерата неизбежно приводит к снижению скорости прямой реакции. В то же время реакция (2) останавливается при более высокой концентрации 4-метил-2-оксовалерата. Другими словами, в реакции со специфическим 2-оксобутиратом ингибирующий эффект продукта 4-метил-2-оксовалерата ниже и глубина аминирования 2-оксобутирата выше, чем аналогичные характеристики в реакции с пируватом. Учитывая имеющиеся кинетические параметры (табл. 1), можно утверждать, что отношение [S]/Km > 1 является исходным условием для 2-оксобутирата и быстро достигается для 4-метил-2-оксовалерата в реакции (2). Тогда kcat становится параметром, который характеризует специфичность TUZN1299 к субстрату в этой системе [10]. Тогда 2-оксобутират в насыщающей концентрации оказывается “специфичнее” 4-метил-2-оксовалерата. Достигнутое преимущество 2-оксобутирата, по-видимому, приводит к сдвигу равновесия в сторону продуктов в реакции (2). Специфичности TUZN1299 к пирувату оказывается недостаточно для достижения сходной глубины превращения в реакции (1).
Таким образом, эффективность аминирования кетосубстрата в реакциях (1) и (2) и степень ингибирования TUZN1299 продуктом – 4-метил-2-оксовалератом – зависят от природы кетосубстрата. Специфичный кетосубстрат, который не ингибирует TUZN1299, сдвигает равновесие в сторону продуктов. Для эффективного аминирования кетосоединений с применением TUZN1299 рекомендуется учитывать свойства образующегося кетопродукта и подбирать аминосубстрат так, чтобы kcat аминирования кетосубстрата в прямой реакции оказывалась выше kcat аминирования кетопродукта в обратной реакции при насыщающих концентрациях обоих кетосоединений.
Список литературы
Eliot A.C., Kirsch J.F. Pyridoxal Phosphate Enzymes: Mechanistic, Structural, and Evolutionary Considerations // Annu. Rev. Biochem. 2004. V. 73. C. 383–415. https://doi.org/10.1146/annurev.biochem.73.011303.074021
Slabu I., Galman J.L., Lloyd R.C., et al. Discovery, Engineering, and Synthetic Application of Transaminase Biocatalysts // ACS Catal. 2017. V. 7. C. 8263–8284. https://doi.org/10.1021/acscatal.7b02686
Savile C.K., Janey J.M., Mundorff E.C., et al. Biocatalytic Asymmetric Synthesis of Sitagliptin Manufacture // Science. 2010. V. 329. C. 305–309. https://doi.org/10.1126/science.1188934
Peng Z., Wong J.W., Hansen E.C., et al. Development of a Concise, Asymmetric Synthesis of a Smoothened Receptor (SMO) Inhibitor: Enzymatic Transamination of a 4-Piperidinone with Dynamic Kinetic Resolution // Org. Lett. 2014. V. 16. C. 860–863. https://doi.org/10.1021/ol403630g
Goldberg R.N., Tewari Y.B. Thermodynamics of Enzyme-Catalyzed Reactions: Part 2. Transferases // J. Phys. Chem. Ref. Data. 1994. V. 23. C. 547–617. https://doi.org/10.1063/1.555948
Tewari Y.B., Kishore N., Goldberg R.N., et al. An Equilibrium and Calorimetric Study of Some Transamination Reactions // J. Chem. Thermodynamics. 1998. V. 30. C. 777–793. https://doi.org/10.1006/jcht.1998.0342
Cellini B., Bertoldi M., Montioli R., et al. Human wild-type Alanine: Glyoxylate Aminotransferase and Its Naturally Occurring G82E Variant: Functional Properties and Physiological Implications // Biochem. J. 2007. V. 408. C. 39–50. https://doi.org/10.1042/BJ20070637
Boyko K.M., Stekhanova T.N., Nikolaeva A.Y., et al. First Structure of Archaeal Branched-Chain amino Acid Aminotransferase from Thermoproteus uzoniensis Specific for l-amino Acids and R-amines // Extremophiles. 2016. V. 20. C. 215–225.
Bezsudnova E.Y., Stekhanova T.N., Suplatov D.A., et al. Experimental and Computational Studies on the Unusual Substrate Specificity of Branched-Chain Amino Acid Aminotransferase from Thermoproteus uzoniensis // Arch. Biochem. Biophys. 2016. V. 607. C. 27–36. https://doi.org/10.1007/s00792-016-0816-z
Eisenthal R., Danson, M.J., Hough, D.W. Catalytic Efficiency and Kcat/KM: A Useful Comparator? // TRENDS in Biotech. 2007. T. 25. C. 247–249. https://doi.org/10.1016/j.tibtech.2007.03.010
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


