Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 62-66
МЕЖХРОМОСОМНЫЕ КОНТАКТЫ ГЕНОВ рРНК С ГЕНАМИ DUX В ХРОМОСОМЕ 4 ЧЕЛОВЕКА ЧУВСТВИТЕЛЬНЫ К ТЕПЛОВОМУ ШОКУ
Н. А. Чуриков 1, *, Е. С. Клушевская 1, Ю. В. Кравацкий 1, Г. И. Кравацкая 1, Д. М. Федосеева 1, О. В. Кретова 1
1 Институт молекулярной биологии
им. В.А. Энгельгардта Российской Академии наук
Москва, Россия
* E-mail: tchurikov@eimb.ru
Поступила в редакцию 14.10.2019
После доработки 14.10.2019
Принята к публикации 14.10.2019
Аннотация
Для изучения влияния теплового шока на образование контактов генов рРНК с генами DUX в хромосоме 4 человека использовали метод 4С. Наши данные свидетельствуют о том, что эти контакты пропадают после теплового шока. Ранее было показано, что кластеры генов рРНК наиболее часто контактируют с областями супер-энхансеров, имеющих протяженные метки H3K27ac. Недавно было обнаружено, что супер-энхансеры вовлечены в образование разделения фаз в ядре. Вместе взятые эти данные свидетельствуют о том, что обратимые контакты кластеров генов рРНК вовлечены в механизмы регуляции с помощью разделения фаз в ядре.
Трехмерные структуры хромосом важны не только для упаковки ДНК в ядре, но и для цис-регуляции экспрессии генов. Этот вывод подтверждается обнаружением и изучением топологически ассоциированных доменов, ТАДов (TADs – Topologically Associating Domains) [1], которые соответствуют бэндам в политенных хромосомах дрозофилы. Однако имеются данные, согласно которым ТАДы лишь в некоторых случаях определяют взаимодействия промоторов и энханмеров. Из генетических наблюдений следует, что в регуляции экспрессии генов важную роль играют и межхромосомные контакты. Они происходят между аллелями в гомологичных хромосомах (трансвекция) [2]. Считается, что контакты между негомологичными хромосомами происходят намного реже [3]. С помощью гибридизации in situ физические контакты ядрышек в клетках слюнных желез дрозофилы были обнаружены в разных хромосомах, преимущественно в областях интеркалярного гетерохроматина [4]. Методы Hi-C позволяют довольно точно картировать внутри- и межхромосомные контакты. С помощью метода 4С было обнаружено, что гены рРНК человека образуют контакты со всеми хромосомами, особенно часто в перицентромерных районах, в районах горячих точек двухцепочечных разрывов ДНК, а также в областях, содержащих протяженные (15–50 т.п.н.) метки H3K27ac, которые соответствуют супер-энхансерам [5, 6]. Недавно было продемонстрировано, что супер-энхансеры вовлечены в механизмы регуляции экспрессии генов с помощью разделения фаз в ядре и образования транскрипционных конденсатов или микрокапель [7]. Это означает, что контакты генов рРНК с супер-энхансерами связаны с механизмами разделения фаз. Гетерохроматизация кластеров генов рРНК иницирует репрессию или активацию транскрипции в разных районах хромосом [8]. Все эти данные позволяют предполагать, что физические контакты генов рРНК могут участвовать в трансрегуляции многих генов. Недавно было обнаружено, что контакты генов рРНК могут быть связаны с сайленсингом генов в клетках человека и дрозофилы [9, 10]. Было обнаружено, что вокруг генов DUX человека, расположенных в субтеломерной области хромосомы 4, находятся довольно частые места контактов генов рРНК [9]. Межхромосомные контакты, необходимые для регуляции экспрессии генов, должны пропадать в процессе митоза и восстанавливаются после каждого цикла деления дифференцированных клеток. Для того чтобы выяснить, могут ли другие физиологические причины нарушать контакты генов рРНК с генами DUX в хромосоме 4, мы использовали тепловой шок.
В результате нами впервые обнаружено, что после теплового шока почти все контакты генов рРНК с областью, содержащий гены DUX в хромосоме 4, пропадают. Эти данные убедительно свидетельствуют о том, что межхромосомные контакты генов рРНК обратимы и высокочувствительны к физиологическим воздействиям. Мы предполагаем, что обратимые межхромосомные контакты генов рРНК важны для глобальной регуляции экспрессии генов с помощью механизма разделения фаз в ядре.
Для анализа контактов генов рРНК в клетках HEK293T использовали метод 4С (Circular Chromosome Conformation Capture), как описано ранее [5]. Для амплификации областей генома, контактирующих с генами рРНК, использовали праймеры
Библиотеки для глубокого секвенирования готовили с помощью набора реактивов Illumina. Секвенирование биологических реплик 4C-рРНК проводили на приборе MiSeq (“Illumina”). Картирование чтений на геном человека версии hg19 проводили с помощью пакета программ BWA. Формат bedGraph использовали для анализа профилей контактов в браузерах IGB (Integrated Genome Browser, “Affymetrix”) и UCSC. Для отбора генов, контактирующих с генами рРНК, отбирали наиболее частые контакты генов рРНК (более 100 чтений 4C-рРНК). В экспериментах с тепловым шоком клетки HEK293T инкубировали 20 мин при температуре 43°C, а затем 2.5 ч при 37°C, как описано ранее [13]. Данные глубокого секвенирования 4C-рРНК помещены в базу данных GEO (accession number GSE49193).
Кластеры генов рРНК человека расположены на малых плечах пяти акроцентрических хромосом 13, 14, 15, 21 и 22. Ранее в хромосоме 4 человека было обнаружено много областей контактов генов рРНК [9]. Метод 4С позволяет количественно оценивать частоту контактов по числу чтений глубокого секвенирования. В данной работе мы детально изучили область контактов в субтеломерной области длиной 137 т.п.н. на длинном плече хромосомы 4. На рис. 1 показаны места контактов генов рРНК.
Рис. 1.
Физическая карта района хромосомы 4 человека длиной 137 т.п.н. и места контактов генов рРНК в ней. Вверху красным цветом показаны десятичные логарифмы числа чтений 4С-рРНК для двух биологических реплик 4С-рРНК после теплового шока (hs+). Ниже, синим цветом, аналогично показано распределение контактов генов рРНК в клетках, не подвергнутых тепловому шоку (hs–). Координаты хромосомы указаны для версии генома человека hg19 (браузер IGB). Некоторые эпигенетические характеристики района приведены согласно данным ENCODE в браузере UCSC для той же версии генома. Указаны треки Genome Segmentations для лимфобластоидных клеток GM12838, эмбриональных стволовых H1-клеток человека H1-hESC и для клеток хронической миелоидной лейкемии K562; данные RNA-Seq для ряда клеточных линий; области открытого хроматина в 125 линиях клеток (трек DNase Clusters); места связывания факторов транскрипции (Transcription Factor ChIP-Seq Clusters) и результаты экспериментов ChIA-PET.
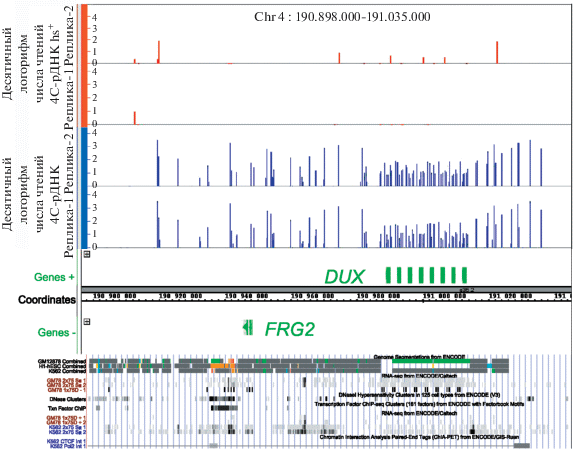
Представлены данные для двух биологических реплик в экспериментах без теплового шока и после него. Видно, что данные в параллельных репликах практически одинаковы. В исходных клетках имеются многочисленные контакты генов рРНК в районе, содержащем гены DUX, и вокруг них. Однако после теплового шока почти все контакты пропадают.
В указанном районе хромосомы 4 область контактов генов рРНК приходится на область репрессированного хроматина, который показан серым или белым цветом на треках состояний хроматина (рис. 1). Только в клетках лимфобластомы (GM12838) гены DUX транскрибируются (показано зеленым). В ряде лимфобластоидных линий, указанных на треках RNA-Seq, также обнаружены транскрипты генов DUX. В наших экспериментах RNA-Seq на клетках HEK293T транскрипты DUX не были обнаружены как до теплового шока, так и после него. В эмбриональных стволовых клетках человека (H1-hESC) данный район репрессирован, хотя в нем и обнаруживается слабый энхансер (показано желтым) в районе гена FRG2, а также видны сайты стартов транскрипции (показано красным). Известно, что гены DUX являются жизненно важными и определяют развитие зиготы человека [12]. Они кодируют факторы транскрипции, содержащие по два гомеобокса. Известно, что гомеодоменсодержащие факторы транскрипции контролируют раннее развитие. Они узнают специфические нуклеотидные последовательности ДНК и запускают транскрипцию определенных генов.
В 125 клеточных линиях, использованных ENCODE для анализа ДНКаза-I гиперчувствительных сайтов, область отрытого хроматина (трек DNase Clusters) в данном районе хромосомы 4 приходится лишь на район гена FRG2 и совпадает с местом связывания факторов транскрипции (трек Txn Factor ChIP). Следовательно, в этих линиях, как и в линии HEK293T, область генов DUX гетерохроматизирована и закрыта для экзогенной нуклеазы.
Независимо на образование хромосомных контактов данной области генома указывают результаты ChIA-PET (Chromatin Interaction Analysis by Paired-End Tag Sequencing) (рис. 1, нижний трек в данных UCSC). Этот метод использует иммунопреципитацию препаратов хроматина после лигирования контактирующих областей хроматина. Данные для антител к РНК полимеразе II свидетельствуют о том, что области хромосомных контактов расположены вокруг генов DUX и гена FRG2.
Таким образом, гены DUX в клетках HEK293T репрессированы и область хромосомы 4, в которой они расположены, контактирует с кластерами генов рРНК. Тепловой шок вызывает нарушение этих контактов. При этом сохраняется репрессированное состояние генов. Эти факты, взятые вместе с данными о том, что в дифференцировке репрессия генов рРНК инициирует репрессию или активацию транскрипции в разных районах хромосом [8], дает основания предполагать, что с генами DUX контактируют неактивные кластеры генов рРНК. В результате происходит трансрепрессия субтеломерной области хромосомы 4, содержащей гены DUX.
Каким образом межхромосомные контакты генов рРНК могут приводить к активации или репрессии соответствующих генов? В последние годы активно обсуждается механизм обратимого разделения жидких фаз в ядре (liquid-liquid phase separation), и образования транскрипционных конденсатов (transcriptional condensates) или микрокапель в ядре, которые являются безмембранными органеллами. Такое разделение фаз может объяснять пространственное сближение разных компартментов ядра и образование межхромосомных контактов [13]. Имеются данные о том, что геномные повторы, к которым относятся гены рРНК и гены DUX, вовлечены в эти механизмы [14, 15]. Поэтому мы предполагали, что механизмы разделения фаз могут объяснять обратимый и быстрый характер формирования контактов кластеров генов рРНК с разными областями хромосом. Действительно, высокая чувствительность контактов генов рРНК к тепловому шоку указывает на динамический характер этих межхромосомных контактов.
Полногеномный анализ изменений в контактах генов рРНК и в экспрессии генов, контактирующих с кластерами генов рРНК под действием теплового шока, будет опубликован отдельно. В настоящее время мы анализируем, какие группы генов образуют контакты с генами рРНК в разных типах клеток, а также изучаем образования транскрипционных конденсатов с участием генов рРНК.
Список литературы
Dekker J., Rippe K., Dekker M. Capturing Chromosome Conformation // Science. 2002. V. 95 P. 1306–1311. https://doi.org/10.1126/science.1067799
Lewis E.B. (1954). The Theory and Application of a New Method of Detecting Chromosomal Rearrangements in Drosophila melanogaster // The American Naturalist. 1954. V. 88. P. 225–239. https://doi.org/10.1086/281833
Sarnataro S., Chiariello A.M., Esposito A., Prisco A., Nicodemi M. Structure of the Human Chromosome Interaction Network // PLoS One. 2017. V. 12 (11): e0188201. doi: . eCollection 2017https://doi.org/10.1371/journal.pone.0188201
Ananiev E.V., Barsky V.E., Ilyin Y.V., Churiko N.A. Localization of Nucleoli in Drosophila melanogaster Polytene Chromosomes // Chromosoma. 1981. V. 81. P. 619–628. PMID:6790245
Tchurikov N.A., Fedoseeva D.M., Sosin D.V., Snezhkina A.V., Melnikova N.V., Kudryavtseva A.V., Kravatsky Y.V., Kretova O.V. Hot Spots of DNA Double-Strand Breaks and Genomic Contacts of Human rDNA Units Are Involved in Epigenetic Regulation // J. Mol. Cell. Biol. 2015. V. 7. P. 366–382. https://doi.org/10.1093/jmcb/mju038
Hnisz D., Abraham B.J., Lee T.I., Lau A., Saint-André V., Sigova A.A., Hoke H.A., Young R.A. // Super-Enhancers in the Control of Cell Identity and Disease. Cell // 2013. V. 155. P. 934–947. doi: . Epub 2013 Oct 10https://doi.org/10.1016/j.cell.2013.09.053
Sabari B.R., Dall’Agnese A., Boija A., Klein I.A., Coffey E.L., Shrinivas K., Abraham B.J., Hannett N.M., Zamudio A.V., Manteiga J.C., Li C.H., Guo Y.E., Day D.S., Schuijers J., Vasile E., Malik S., Hnisz D., Lee T.I., Cisse I.I., Roeder R.G., Sharp P.A., Chakraborty A.K., Young R.A. Coactivator Condensation at Super-Enhancers Links Phase Separation and Gene Control // Science. 2018. V. 361 (6400). pii: eaar3958. https://doi.org/10.1126/science.aar3958
Savić N., Bär D., Leone, S., Fromme S.C., Weber F.A., Vollenweider E., Ferrari E., Ziegler U., Kaech A., Sha-khova O., Cinelli P., Santoro R. lncRNA Maturation to Initiate Heterochromatin Formation in the Nucleolus is Required for Exit from Pluripotency in ESCs // Cell Stem Cell // 2014. V. 15. P. 720–734. https://doi.org/10.1016/j.stem.2014.10.005
Кретова О.В., Федосеева Д.М., Кравацкий Ю.В., Алембеков И.Р., Словохотов И.Ю., Чуриков Н.А. Гомеотические гены DUX4, контролирующие развитие эмбриона человека на стадии двух бластомеров, окружены областями, которые образуют контакты с кластерами генов рРНК // Молек. биол. 2019. Т. 53. С. 268–273 https://doi.org/10.1134/S0026898419020083
Кретова О.В., Федосеева Д. М., Словохотов И.Ю., Клушевская Е.С., Кравацкий Ю. В., Чуриков Н.А. Гены рРНК дрозофилы образуют устойчивае контакты с геном Tlk в области экспрессии малых РНК и влияют на организацию петлевых доменов // Молекулярная биология. 2020. Т. 54. № 2.
Sonna L.A., Gaffin S.L., Pratt R.E., Cullivan M.L., Angel K.C., Lilly C.M. Effect of Acute Heat Shock on Gene Expression by Human Peripheral Blood Mononuclear Cells // J. Appl. Physiol. 2002. V. 92. P. 2208–2220. https://doi.org/10.1152/japplphysiol.01002.2001
De Iaco A., Planet E., Coluccio A., Verp S., Duc J., Trono D. DUX-family Transcription Factors Regulate Zygotic Genome Activation in Placental Mammals // Nat. Genet. 2017. V. 49. P. 941–945. https://doi.org/10.1038/ng.3858
Shrinivas K., Sabari B.R., Coffey E.L., Klein I.A., Boija A., Zamudio A.V., Schuijers J., Hannett N.M., Sharp P.A., Young R.A., Chakraborty A.K. Enhancer Features that Drive Formation of Transcriptional Condensates // Mol Cell. 2019. V. 75. P. 549–561.e7. https://doi.org/10.1016/j.molcel.2019.07.009
Hall A.C., Ostrowski L.A., Mekhail K. Phase Separation as a Melting Pot for DNA Repeats // Trends Genet. 2019. V. 35. P. 589–600. https://doi.org/10.1016/j.tig.2019.05.001
Frottin F., Schueder F., Tiwary S., Gupta R., Körner R., Schlichthaerle T., Cox J., Jungmann R., Hartl F.U., Hipp M.S. The Nucleolus Functions as a Phase-Separated Protein Quality Control Compartment // Science. 2019. V. 365. P. 342–347. https://doi.org/10.1126/science.aaw9157. Epub 2019 Jul 11.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


