Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 19-23
ВЛИЯНИЕ ПРИРОДНЫХ ПОЛИФЕНОЛОВ НА ИЗОЛИРОВАННЫЕ МИТОХОНДРИИ ДРОЖЖЕЙ DIPODASCUS MAGNUSII
Д. И. Дергачева 1, О. И. Кляйн 1, Н. Н. Гесслер 1, Е. П. Исакова 1, Ю. И. Дерябина 1, *, член-корреспондент РАН А. В. Николаев 2
1 Институт биохимии им. А.Н. Баха РАН,
ФИЦ “Биотехнологии РАН”
Москва, Россия
2 Институт физики Земли им. О.Ю. Шмидта Российской Академии наук
Москва, Россия
* E-mail: yul_der@mail.ru
Поступила в редакцию 20.09.2019
После доработки 20.09.2019
Принята к публикации 20.09.2019
Аннотация
На изолированных митохондриях гриба Dipodascus (Endomyces) magnusii проведено исследование влияния стильбеновых полифенолов (ресвератрола и пиносильвина) и флавоноидов (дигидромирицетина, эпигаллокатехина и дигидрокверцетина) на генерацию активных форм кислорода в процессе дыхания. Показано, что ингибирование образования активных форм кислорода стильбеновыми полифенолами связано как с ингибированием потребления кислорода, так и с антиоксидантными свойствами, степень проявления которых зависела от количества гидроксильных групп в молекуле полифенола. Из флавоноидов дигидромирицетин проявлял наибольшую активность в снижении генерации активных форм кислорода, но ингибирующее действие на потребление кислорода митохондриями было значительно ниже, чем у стильбеновых полифенолов. Полученные данные показывают, что механизм снижения генерации активных форм кислорода полифенолами связан как с ингибированием дыхания, так и антиоксидантными свойствами.
Одним из типов антиоксидантов, наиболее активно используемых в фармацевтике, являются природные полифенолы растительного происхождения, проявляющие полезные свойства при терапии целого ряда метаболических заболеваний [1]. Полифенолы опосредуют своё защитное действие с помощью нескольких механизмов, которые в настоящее время интенсивно исследуются. Антиоксидантная активность полифенолов реализуется как путём непосредственного гашения свободных радикалов, так и предотвращением их образования путём хелатирования железа. Кроме того, полифенолы способны активировать антиоксидантные ферменты и ингибировать ферменты, продуцирующие активные формы кислорода (АФК) (липоксигеназы, НАДН-оксидазы, ксантиноксидазы) [2]. Наряду с выраженными антиоксидантными свойствами выявлена способность полифенолов модулировать процесс внутриклеточной передачи сигнала с участием протеинкиназы С и таким образом влиять на различные процессы в клетке [2]. Однако многие аспекты действия полифенолов по-прежнему остаются малоизученными.
Известно, что митохондрии играют фундаментальную роль в процессе поддержания клеточного гомеостаза. Нарушение митохонриальных функций с образованием избыточного количества свободных радикалов наблюдается при некоторых метаболических заболеваниях, включая старение, диабет, канцерогенез, ожирение [3].
Показано, что полифенолы оказывают существенное действие на функции митохондрий. Так, полифенол стильбенового ряда ресвератрол (РСВ) стимулирует экспрессию гена SIRT1 (НАД-зависимой деацетилазы) и улучшает окисление жирных кислот в митохондриях в условиях дефицита карнитинпальмитоилтрансферазы 2 [4]. Положительное влияние на функции митохондрий как в системе in vitro, так и в опытах in vivo оказывают и другие природные полифенолы – мирицитрин, кверцетин, лютеолин, эпигаллокатехин галлат [5, 6]. Было обнаружено, что проантоцианидины также могут смягчать митохондриальные дисфункции, индуцированные пероксидом водорода, за счёт поддержания мембранного потенциала и работы цепи переноса электронов и подавления продукции кислородных радикалов митохондриями [7]. Биофлавоноид гесперидин улучшает энзиматический статус комплексов I–IV цепи переноса электронов [8]. Однако помимо позитивного воздействия полифенолов на митохондриальные функции отмечено и противоположное действие этих соединений на органеллы, связанное с общим нарушением биоэнергетики и запусканием апоптозных реакций [9]. Точный механизм, посредством которого природные полифенолы модулируют функции и динамику митохондрий, остаётся неизвестным.
В данной работе изолированные митохондрии дрожжевых организмов, являющихся прекрасной экспериментальной моделью эукариотической клетки, использовались для выявления механизмов антиоксидантного действия стильбеновых и флавоноидных полифенолов. В качестве объекта исследования использовали дрожжеподобные грибы Dipodascus (Endomyces) magnusii, штамм ВКМ Y-261. Клетки дрожжей выращивали на полусинтетической среде с глицерином (1%) в качестве основного источника углерода, как описано в [10]. Биомассу собирали на поздней логарифмической стадии роста (10–13 г сырого веса на 1 л культуральной среды). Выделение митохондрий осуществляли по методу, описанному ранее [10].
Принимая во внимание тот факт, что митохондриальный компартмент клетки, а именно комплексы I и III цепи переноса электронов, является основным источником свободных радикалов в клетке, на первом этапе работы был исследован уровень АФК в митохондриальной суспензии. Для оценки этого показателя в присутствии полифенолов ресвератрола (РСВ), пиносильвина (ПС), дигидромирицетина (ДГМ), эпигаллокатехина (ЭГК) и дигидрокверцетина (ДГК) (рис. 1) при помощи флуоресцентного красителя Amplex Red (AR) (стоковый 10 мM раствор в ДМСО) митохондрии добавляли в среду для исследования дыхательной активности, содержащую 600 мМ маннит; 20 мМ Tris-HCl, pH 7.4; 0.2 мМ KH2PO4; 20 мМ пируват + малат; 0.4 мг/мл митохондриального белка. Затем разносили митохондриальную суспензию по лункам 96-луночного иммунологического планшета для флуоресцентных исследований. Туда же вносили экспериментальные образцы полифенолов в концентрации 10 мкМ, после чего добавляли Amplex Red (Hydrogen Peroxide/Peroxidase Assay Kit, “Sigma”) в конечной концентрации 25 мкМ. Реакцию запускали внесением в реакционную среду пероксидазы хрена (RZ = 0.6 = 150–170 ед/мг), применяя стоковый раствор с концентрацией 0.2 мг/мл. Измерение флуоресценции при длине волны λ = 590 ± 25 нм при возбуждении λ = 530 ± ± 35 нм проводили на фотометре-флуориметре Synergy 2 Multi-Mode Microplate Reader “BeoTek” (США) в течение 15 мин с последующим анализом данных в программе Microsoft Excel.
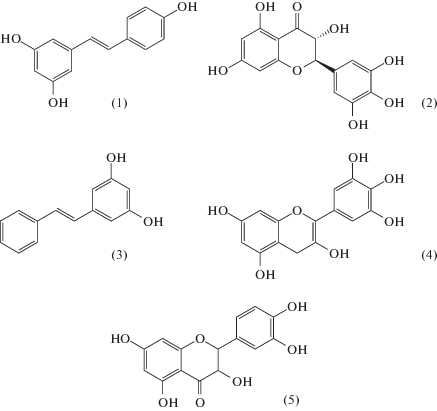
Рис. 1.
Структурные формулы полифенолов: ресвератрола (1); дигидромирицетина (2); пиносильвина (3); эпигаллокатехина (4); дигидрокверцетина (5).
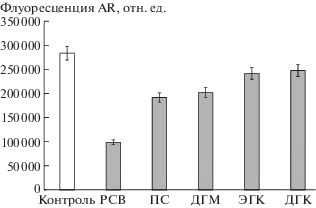
Результаты исследований представлены на рис. 2. Как видно, базовый уровень продукции АФК в митохондриях дрожжей D. magnusii оказался довольно высоким – более 280 тыс. относительных единиц флуоресценции (рис. 2). Внесение природных полифенолов в концентрации 10 мкМ приводило к уменьшению генерации АФК: в случае РСВ на 65%, ПС и ДГМ примерно на 30%, ЭГК и ДГК на 15% (рис. 2).
Рис. 2.
Влияние полифенолов на скорость генерации АФК (перекиси водорода) in vitro митохондриями дрожжей D. magnusii.
Известно, что некоторые полифенолы и, в частности, наиболее изученный РСВ способны непосредственно взаимодействовать с компонентами электрон-транспортной цепи и регулировать F0F1-ATФаза/ATP-синтазную активность [11], уменьшая скорость поглощения кислорода митохондриями животных. Для более детального исследования эффектов полифенолов на изолированных митохондриях дрожжей мы оценивали действие соединений, проявивших наибольшую эффективность в подавлении образования АФК (РСВ, ДГМ и ПС), на дыхательную активность и параметры сопряжения органелл. Потребление кислорода митохондриальной суспензией измеряли полярографически in vitro при 25° С в ячейке с электродами, закрытыми фторопластовой плёнкой, с постоянной разностью потенциалов 660 мВ. Результаты экспериментов представлены в табл 1. Как и в исследованиях по генерации АФК в митохондриальной суспензии, все протестированные полифенолы продемонстрировали подавление дыхательной активности митохондрий (табл. 1). РСВ, ингибирующий скорость дыхания в состоянии до добавления АТФ (состояние 4) более чем в 3 раза и скорость дыхания в состоянии после добавления АТФ (состояние 3) более чем в 5 раз оказался наиболее эффективным. Внесение ПС также уменьшало скорость дыхания митохондрий примерно в 3 и 4 раза в состоянии 4 и 3 соответственно (табл. 1). В то же время ДГМ, уменьшающий уровень генерации АФК в той же степени, что и ПС (рис. 2), ингибировал дыхательную активность митохондрий дрожжей примерно на 20% (табл. 1). Интересно отметить, что параметры сопряжения (показатели дыхательных контролей) в присутствии ДГМ улучшались на 25 и 9%, при добавлении ПС – снижались на 20 и 33% в случае ДКL и ДКCh, соответственно, в то время как при внесении РСВ они практически не изменялись (табл. 1).
Таблица 1.
Дыхательная активность изолированных митохондрий дрожжей D. magnusii в присутствии полифенолов
| Экспериментальный вариант | V4, нг-атом О мин–1 мг белка–1 | V3, нг-атом О мин–1 мг белка–1 | ${\text{ДК}}_{{\text{L}}}^{{{\text{**}}}}$ | ${\text{ДК}}_{{{\text{Ch}}}}^{{{\text{***}}}}$ |
|---|---|---|---|---|
| Контроль | 57.2 ± 9.0 | 222.2 ± 31.2 | 3.8 ± 0.3 | 4.4 ± 0.1 |
| РСВ* | 18.0 ± 0.7 | 40.0 ± 11.2 | 3.9 ± 0.1 | 3.7 ± 0.2 |
| ПС* | 19.2 ± 3.7 | 57.2 ± 15.2 | 3.1 ± 0.1 | 2.9 ± 0.7 |
| ДГМ* | 43.7 ± 3.7 | 200.0 ± 9.2 | 4.8 ± 0.3 | 4.8 ± 0.3 |
Ранее на изолированных митохондриях мозга было выявлено ингибирование поглощения кислорода в присутствии РСВ [11]. Поскольку полифенол не блокировал активность комплекса IV, авторы заключили, что его действие может быть связано с блокированием участка между комплексами I и III. В этом контексте Дескирет-Думас и соавт. [12] продемонстрировали, что низкие концентрации РСВ модулируют отношение НАД+/НАДН за счёт увеличения активности работы I комплекса в митохондриях печени. ДГМ оказывает антиоксидантное действие при индуцированном окислительном стрессе в эндотелиальных клетках человека HUVECs [13]. Однако механизм его действия на изолированные митохондрии также остаётся предметом дискуссий.
Наши результаты продемонстрировали, что природные полифенолы РСВ, ПС и ДГМ также способны ингибировать скорости поглощения кислорода митохондриями дрожжевых грибов D. magnusii. Можно предположить, что уменьшение уровня генерации АФК в присутствии этих метаболитов (рис. 2) обусловлено уменьшением скорости дыхания митохондрий в состоянии 4 (табл. 1). Аналогичные данные были получены в работе [14], свидетельствующей об уменьшении продукции перекиси водорода за счёт уменьшения скорости дыхания митохондрий в состоянии 4 под действием РСВ, однако точный механизм этого явления не был объяснён. Более того, нельзя исключить непосредственное антиоксидантное действие полифенолов на митохондриальные компоненты.
Положение и количество гидроксильных групп в бензольном кольце полифенолов может играть ключевую роль в проявлении их антиоксидантных свойств [15]. Полученные в работе результаты показали, что стильбеновые полифенолы РСВ и ПС, демонстрирующие сходное ингибирование дыхательной активности изолированных митохондрий (табл. 1), в разной степени влияли на скорость генерации АФК (рис. 2), что, вероятно, обусловлено наличием дополнительной гидроксильной группы в молекуле РСВ. Среди сходных по своей структуре исследованных флавоноидов ДГМ, обладающий тремя гидроксильными группами в бензольном кольце Б, был эффективнее как ЭГК с таким же строением кольца Б, так и ДГК, содержащего два гидроксильных остатка в бензольном кольце Б, хотя и в оптимальном для взаимодействия с АФК орто-положении [19 ] . Учитывая менее выраженную способность ДГМ ингибировать интенсивность митохондриального дыхания по сравнению со стильбеновыми полифенолами, можно предположить, что его антиоксидантное действие в основном обусловлено непосредственным взаимодействием с АФК.
Список литературы
Теплова В.В., Исакова Е.П., Кляйн О.И. и др. // Прикл. биохим. микробиол. 2018.Т. 54.№ 3. С. 215–235. https://doi.org/10.7868/S0555109918030017
Das J., Ramani R., Suraju O. // Biochim. Biophys. Acta. 2016. V. 1860. P. 2107–2121. https://doi.org/10.1016/j.bbagen.2016.06.022
Davalli P., Mitic T., Caporali A., et al. // Oxid. Med. Cell Longev. 2016. 23565127. https://doi.org/10.1155/2016/3565127
Bastin J., Lopes-Costa A., Djouadi F. // Hum. Mol. Genet. 2011. V. 20. № 10. P. 2048–2057. https://doi.org/10.1093/hmg/ddr089
Cai Z., Zeng W., Tao K., et al. // Biochem. Biophys. Res. Commun. 2015. V. 458. № 2. P. 227–233. https://doi.org/10.1016/j.bbrc.2015.01.060
Wang B., Sun J., Ma Y., et al. // J. Food Sci. 2014. V. 79. H1823–H1831. https://doi.org/10.3390/cells8040287
Zhang Z., Zheng L., Zhao Z., et al. // J. Toxicol. Sci. 2014. V. 39. № 2. P. 803–813. https://doi.org/10.2131/jts.39.803
Kamaraj S., Anandakumar P., Jagan G., et al. //Fund. Clin. Pharmacol. 2011. V. 25. № 1. P. 91–98. https://doi.org/10.1111/j.1472-8206.2010.00812.x
de Oliveira M.R., Nabavi S.F., Manayi A., et al. // Biochim. Biophys. Acta. 2016. V. 1860. № 4. P. 727–745. https://doi.org/10.1016/j.bbagen.2016.01.017
Deryabina Y., Isakova E., Sekova V., et al. / J. Bioenerg. Biomembr. 2014. V. 46. № 6. P. 479–492. https://doi.org/10.1007/s10863-014-9582-8
Madrigal-Perez L.A., Ramos-Gomez M. // Int. J. Mol. Sci. 2016. V. 17. № 3. P. 368. https://doi.org/10.3390/ijms17030368
Desquiret-Dumas V., Gueguen N., Leman G., et. al. // J. Biol. Chem. 2013. V. 288. № 51. P. 36 662–36 675.https://doi.org/10.1074/jbc.M113.466490
Hou X., Tong Q., Wang W., et al. // Life Sci. 2015. V. 130. № 1. P. 38–46. https://doi.org/10.1016/j.lfs.2015.03.007
Murphy M. // Biochem. J. 2009. V. 417. № 1. P. 1–13. https://doi.org/10.1042/BJ20081386
Thavasi V., Bettens R.P., Leong L.P. // J. Phys. Chem. A. 2009. V. 113. № 13. P. 3068–3077. https://doi.org/10.1021/jp806679v
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


