Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 27-30
ПОЛУЧЕНИЕ И ХАРАКТЕРИСТИКА АНТИТЕЛ К ПРОТЕКТИВНЫМ АНТИГЕНАМ ХОЛЕРНОГО ВИБРИОНА, КОНЪЮГИРОВАННЫМ С НАНОЧАСТИЦАМИ ЗОЛОТА
Л. А. Дыкман 1, *, О. А. Волох 2, О. В. Громова 2, О. С. Дуракова 2, С. А. Воробьева 2, М. Н. Киреев 2, Л. Ф. Ливанова 2, А. К. Никифоров 2, С. Ю. Щеголев 1, академик РАН В. В. Кутырев 2
1 Институт биохимии и физиологии растений
и микроорганизмов Российской Академии наук
Саратов, Россия
2 Российский научно-исследовательский противочумный институт “Микроб” Роспотребнадзора
Саратов, Россия
* E-mail: dykman_l@ibppm.ru
Поступила в редакцию 29.05.2019
После доработки 29.05.2019
Принята к публикации 29.05.2019
Аннотация
Синтезированы конъюгаты наночастиц золота с антигенами холерного вибриона. Проведена иммунизация животных полученными конъюгатами, получены кроличьи поликлональные антитела к исследуемым антигенам, показавшие высокую специфическую активность. На модели белых лабораторных мышей была оценена протективная активность конъюгатов холерных антигенов с наночастицами при заражении вакцинированных животных с применением в качестве контроля коммерческой вакцины. Показано, что по иммуногенности созданные прототипы холерной вакцины с использованием в качестве носителя и адъюванта наночастиц золота соответствовали регламенту производства на национальную российскую холерную химическую вакцину.
В последние десятилетия наночастицы золота (НЧЗ) нашли многочисленные применения в различных областях биомедицины [1, 2], однако работ, посвященных иммунологическим свойствам НЧЗ, не так много. Благодаря внедрению в медицину методов и достижений нанотехнологий в последние годы вырос интерес к наноносителям антигенов (Аг). При их применении меняются формы проявления иммуногенности заданного вещества в иммунной системе организма-хозяина. Подобные наночастицы могут выступать и в роли носителя Аг и в качестве адъюванта [3, 4].
В 1986 г. появились сведения об успешной попытке получения антител (Ат) к глютаминовой кислоте с использованием в качестве носителя частиц коллоидного золота [5]. После этого вышел ряд работ, авторы которых применяли и развивали предложенный метод для получения Ат к некоторым гаптенам и полноценным Аг. В результате получали антисыворотки с высоким титром, которые не требовали дальнейшей очистки от балластных Ат. В 1996 г. была опубликована статья [6], в которой авторы впервые показали возможность использования частиц коллоидного золота в составе антивирусной вакцины как носителей белкового Аг капсида вируса клещевого энцефалита. Несмотря на то, что в состав вакцины не входили адъюванты, предложенная экспериментальная вакцина обладала более высокими протективными свойствами по сравнению с коммерческими аналогами.
Настоящий всплеск активности в области иммунологического применения НЧЗ можно наблюдать последние три–четыре года [7, 8], когда НЧЗ начали использовать для создания экспериментальных пептидных и углеводных вакцин против вирусных и бактериальных инфекций, для разработки вакцин против заболеваний, вызываемых простейшими [8]. Кроме традиционных антибактериальных и антивирусных вакцин конъюгаты опухолевых Аг с НЧЗ предложено применять для создания антираковых вакцин и иммунотерапии рака [9].
В связи с эпидемической ситуацией по холере в России и в мире необходима специфическая профилактика этого заболевания [10, 11]. В 2001 г. в России вакцинация против холеры была включена в календарь профилактических прививок по эпидемическим показаниям. Поэтому разработка и усовершенствование современных вакцин против холеры является важным и перспективным направлением научных исследований. Vibrio cho-lerae имеет очень сложный антигенный состав, что препятствует созданию эффективных универсальных вакцин против большого разнообразия штаммов, биоваров и серогрупп холерного вибриона [12].
Основной целью работы являлось получение конъюгатов НЧЗ с Аг холерного вибриона и оценка эффективности иммунизации и вакцинации предложенными конъюгатами.
Наночастицы золота со средним диаметром частиц 15 нм получали по методу Frens [13], используя реакцию восстановления HAuCl4 цитратом натрия. Средний диаметр полученных наночастиц составил 15.2 нм. По нашим данным, использование для иммунизации НЧЗ сферической формы со средним диаметром 15 нм является оптимальным [14].
Были синтезированы конъюгаты НЧЗ с семью Аг холерного вибриона: холероген-анатоксином штамма 569В Инаба (Аг1), О-Аг штамма М41 Огава (Аг2), О-Аг штамма 569В Инаба (Аг3), О-Аг штамма КМ262 биовара Эль Тор серовара Огава (Аг4), О-Аг штамма КМ263 биовара Эль Тор серовара Инаба (Аг5), О-Аг штамма М377 О139 серогруппы (Аг6), холерным токсином штамма 569В Инаба (Аг7). Конъюгацию проводили простым смешением реагентов без использования сшивающих агентов.
Для получения иммунных сывороток использовали кроликов породы шиншилла весом 2–2.5 кг. В качестве иммуногенов применяли Аг3, Аг4, Аг5, Аг6 и Аг7. Для получения антисывороток был выбран подкожный метод введения материала с полным адъювантом Фрейнда. Был проведен цикл иммунизаций по пять подкожных инъекций в дозах от 1 до 4 мл с интервалом в 4 сут. Через 10 сут после дополнительной однократной иммунизации внутривенным введением 2 мг Аг проводили забор крови. Специфическую активность (титр) антисывороток определяли в реакции агглютинации (РА) пробирочным методом с соответствующими штаммами V. сholerae, в реакции диффузной преципитации (РДП) и в дот-иммуноанализе (ДИА) с гомологичными Аг. Токсин-нейтрализующие антитела сыворотки к холерному токсину определяются методом кожной пробы Крейга на кроликах по минимальному количеству сыворотки, нейтрализующей токсин, выраженному в активных единицах (АЕ). Иммуноферментный анализ (ИФА) для определения антител в сыворотке крови лабораторных животных проводили по общепринятой схеме, в качестве сенситинов использовались гомологичные антигены, в качестве маркёров – антивидовые антитела, меченные пероксидазой хрена.
Нами были получены пять серий кроличьих гипериммунных сывороток к холерным О-Аг, конъюгированным с НЧЗ. Усредненные показатели специфической активности полученных сывороток приведены в табл. 1. Как видно из таблицы, активность сывороток, полученных на экспериментальные Аг, была достаточно высокой по условиям нормативных требований.
Таблица 1.
Показатели специфической активности сывороток к Аг холерного вибриона, конъюгированным с НЧЗ
| Наименование сыворотки | Специфическая активность (титр) | ||
|---|---|---|---|
| РДП | РА | ДИА | |
| Сыворотка к Аг3 | 1 : 16 | 1 : 3200 | 1 : 500 |
| Сыворотка к Аг4 | 1 : 16 | 1 : 6400 | 1 : 80 |
| Сыворотка к Аг5 | 1 : 16 | 1 : 1600 | 1 : 40 |
| Сыворотка к Аг6 | 1 : 8 | 1 : 1600 | 1 : 640 |
| Сыворотка к Аг7 | 1 : 16 | 1 : 3200 | 1 : 500 |
Активность токсин-нейтрализующих антител сыворотки к Аг7 составила 3200 АЕ по сравнению с 1600 АЕ при иммунизации неконъюгированным Аг7.
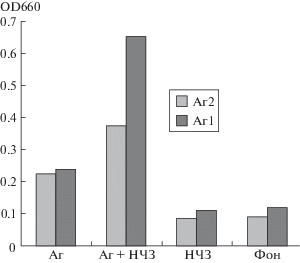
При иммунизации белых мышей препаратами Аг1 и Аг2 в дозе 10 мкг было установлено, что по результатам ИФА на 21-е сутки титр специфических антител к Аг1 и Аг2 для конъюгированных антигенов был значительно выше. Усредненные результаты по пулу из 10 мышей, измеренные в трёх повторностях, представлены на рис. 1.
Рис. 1.
Уровень антитоксических антител у белых мышей, иммунизированных протективными антигенами Аг1 и Аг2 холерного вибриона.
На модели белых лабораторных мышей была оценена протективная активность конъюгатов холерных Аг с НЧЗ при заражении вакцинированных мышей штаммом V. cholerae М879. Экспериментальная вакцина серии 012 состояла из смеси Аг1 (35 мг) и Аг3 (10 мг), конъюгированных с НЧЗ. В качестве контроля использовали коммерческую вакцину, серия 8 (РосНИПЧИ “Микроб”).
Иммунизацию мышей дозами по 0.5 мл, соответствующими 1 : 1000; 1 : 5000; 1 : 25 000; 1 : 125 000 части готовой формы вакцины, по восемь животных для каждой дозы проводили внутрибрюшинно. Значения эффективной дозы (ЕD50) холерной вакцины и летальной дозы (LD50) заражающего штамма определяли по методу Кербера в модификации Ашмарина [15]. Заражение иммунизированных мышей осуществляли штаммом V. cholerae М879 в дозе 350 LD50 спустя две недели после иммунизации. Мышей контролировали на протяжении 72 ч, учитывая количество павших, и определяли LD50 заражающего штамма. Заражение проводили внутрибрюшинно, используя клетки штамма V. cholerae М879 после их роста в течение (4 ± 1) ч на плотной питательной среде и разведенные до концентрации 6, 12, 24, 48 и 96 м.к. в 1 мл. Для контроля проводили заражение 10 неиммунизированных мышей этим же штаммом холерного вибриона.
Результаты исследований протективного эффекта конъюгатов Аг холерного вибриона с НЧЗ приведены в табл. 2. Данные таблицы свидетельствуют о том, что по иммуногенности прототип холерной химической вакцины (серия 012) соответствовал требованиям на вакцину, так как ЕD50 была не более 1/20 000 части готовой формы вакцины.
Таблица 2.
Выживаемость животных после вакцинации и заражения 350 LD50 штамма V. cholerae Eltor М879
| № серии, штамм | Доза вак-цинации | Пало после заражения | ЕD50 |
|---|---|---|---|
| 8 | 1/1000 | 2 | 1/102 333 |
| 1/5000 | 0 | ||
| 1/25 000 | 1 | ||
| 1/125 000 | 2 | ||
| 012 | 1/1000 | 0 | 1/102 333 |
| 1/5000 | 1 | ||
| 1/25 000 | 0 | ||
| 1/125 000 | 4 | ||
| V. cholerae Eltor М879 (контроль) | 350 LD50 | 10 |
Таким образом, были синтезированы конъюгаты НЧЗ с семью Аг холерного вибриона. Проведена иммунизация животных полученными конъюгатами, получены кроличьи поликлональные Ат к исследуемым Аг и иммунохимическими методами определены их титры, чувствительность и специфичность по отношению к растворимым иммуногенам и целым клеткам V. cholerae. Полученные антисыворотки показали высокую специфическую активность. На модели белых лабораторных мышей была оценена протективная активность конъюгатов холерных Аг с НЧЗ при заражении вакцинированных мышей штаммом V. cholerae М879 с применением в качестве контроля коммерческой вакцины. Приведенные данные свидетельствуют о том, что по иммуногенности созданные прототипы холерной химической вакцины с использованием в качестве носителя и адъюванта НЧЗ соответствовали регламенту производства на национальную российскую холерную химическую вакцину.
Отметим преимущества использования НЧЗ в качестве средств доставки вакцин: их относительно небольшой размер, который позволяет легко проникать в ткани, малая токсичность и длительная циркуляции in vivo, низкая стоимость, воспроизводимость. Вакцинация несколькими консервативными Аг, конъюгированными с НЧЗ, имеет преимущества перед использованием отдельных Аг. Кроме того, НЧЗ могут быть обнаружены с использованием неинвазивных методов визуализации, предоставляя информацию о том, были ли доставлены вакцины, что помогает прогнозировать или оценивать эффективность. Система доставки на основе НЧЗ может защитить вакцины от преждевременной деградации, улучшить стабильность, обладает хорошими адъювантными свойствами, а также способствует целевой доставке иммуногена антигенпрезентирующим клеткам.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют, что у них нет конфликта интересов.
СООТВЕТСТВИЕ ПРИНЦИПАМ ЭТИКИ
При работе с животными авторы руководствовались Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях
ИНФОРМАЦИЯ О ВКЛАДЕ АВТОРОВ
Все участники, внесшие существенный вклад в исследование, представлены как соавторы.
Список литературы
Dreaden E.C., Alkilany A.M., Huang X., Murphy C.J., El-Sayed M.A. // Chem. Soc. Rev. 2012. V. 41. P. 2740–2779.
Dykman L.A., Khlebtsov N.G. Gold Nanoparticles in Biomedical Applications. Boca Raton: CRC Press. 2017. 332 p.
Lin L.C.-W., Chattopadhyay S., Lin J.-C., Hu C.-M.J. // Adv. Healthc. Mater. 2018. V. 7. e1701395.
Kelly H.G., Kent S.J., Wheatley A.K. // Expert Rev. Vaccines. 2019. V. 18. P. 269–280.
Shiosaka S., Kiyama H., Wanaka A., Tohyama M. // Brain Research. 1986. V. 382. P. 399–403.
Деменев В.А., Щинова М.А., Иванов Л.И., Воробьева Р.Н., Здановская Н.И., Небайкина Н.В. // Вопр. вирусол. 1996. Т. 41. С. 107–110.
Carabineiro S.A.C. // Molecules. 2017. V. 22. e857.
Dykman L.A., Khlebtsov N.G. // Chem. Sci. 2017. V. 8. P. 1719–1735.
Evans E.R., Bugga P., Asthana V., Drezek R. // Mater. Today. 2018. V. 21. P. 673–685.
Онищенко Г.Г., Кутырев В.В., Щуковская Т.Н., Смирнова Н.И., Никифоров А.К., Еремин С.А., Топорков В.П. // Проблемы особо опасных инфекций. 2011. № 107. С. 5–12.
Harris J.B. // J. Infect. Dis. 2018. V. 218. P. S141–S146.
Никифоров А.К., Комиссаров А.В., Ульянов А.Ю., Еремин С.А., Волох О.А., Белякова Н.И., Алешина Ю.А., Васин Ю.Г. // Проблемы особо опасных инфекций. 2012. № 112. С. 85–88.
Frens G. // Nature Phys. Sci. 1973. V. 241. P. 20–22.
Dykman L.A., Staroverov S.A., Fomin A.S., Khanadeev V.A., Khlebtsov B.N., Bogatyrev V.A. // Int. Immunopharmacol. 2018. V. 54. P. 163–168.
Воробьев А.А., Кривошеин Ю.С., Широбоков В.П. Медицинская и санитарная микробиология. М.: Академия. 2003. 464 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


