Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 15-18
АКТИВАЦИЯ СИГНАЛЬНЫХ ПУТЕЙ АПОПТОЗА В УСЛОВИЯХ ПРОЛОНГИРОВАННОГО ЭР-СТРЕССА, ВЫЗВАННОГО ДЕЙСТВИЕМ СЕЛЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ НА КЛЕТКИ ТЕРАТОКАРЦИНОМЫ СЕМЕННИКОВ МЫШИ
М. В. Гольтяев 1, Е. Г. Варламова 1, *, С. В. Новосёлов 1, член-корреспондент РАН Е. Е. Фесенко 1
1 Институт биофизики клетки Российской академии наук – обособленное подразделение Федерального исследовательского центра “Пущинский научный центр биологических исследований Российской Академии наук”
Московской обл., Пущино, Россия
* E-mail: 1928lv@mail.ru
Поступила в редакцию 15.08.2019
После доработки 15.08.2019
Принята к публикации 15.08.2019
Аннотация
Целью работы было исследование молекулярных механизмов апоптотической гибели клеток тератокарциномы семенников мыши (линия F-9) при воздействии на них широко используемыми селенсодержащими соединениями, обладающими противоопухолевой активностью, селенитом натрия и метилселениновой кислотой. Использованы методы флуоресцентной микроскопии, МТТ‑анализ, Вестерн-блоттинг. Показано, что селенит натрия в концентрации 10 мкМ, метилселениновая кислота в концентрациях 1 и 10 мкМ вызывают апоптоз-зависимую гибель клеток линии F-9, исключая некротическую гибель. Методом Вестерн-блоттинга установлено увеличение экспрессии XBP1s при обработке клеток F-9 1-мкМ метилселениновой кислотой. Оказалось, что метилселениновая кислота в концентрации 10 мкМ приводит к апоптозу клеток, скорее всего, путём активации IRE1 сигнального пути в условиях пролонгированного стресса эндоплазматического ретикулума.
Селенит натрия (СН) и метилселениновая кислота (МСК) являются широко используемыми потенциальными противоопухолевыми селенсодержащими соединениями, что было неоднократно подтверждено в ряде исследований [1–11]. Известно, что гибель клеток при воздействии на них СН и МСК сопряжена с ЭР-стрессом [1, 2, 11, 12], который связан с сигнальными путями, объединёнными общим триггерным механизмом и представленных триадой трансмембранных белков: PERK, IRE1 и ATF6. Целью данной работы было исследование изменения экспрессии ключевых участников ATF4 и XBP1s двух сигнальных путей: PERK и IRE1 соответственно методом Вестрен-блот анализа при обработке раковых клеток линии F-9 (тератокарцинома семенников мыши) СН и МСК в концентрациях 1 и 10 мкМ.
Ранее нами установлено, что воздействие на клетки F-9 1-мкМ и 10-мкМ СН приводило к снижению жизнеспособности клеток [12], однако не было проведено аналогичных экспериментов относительно МСК. Для установления варианта гибели (апоптоз/некроз) изучаемых клеток после 24 ч воздействия на них СН и МСК в концентрациях 1 и 10 мкМ использовали набор реагентов Apoptosis/Necrosis Detection Kit (“Abcam”, США) в тандеме с флуоресцентной микроскопией. Данный флуоресцентный анализ позволяет детектировать живые клетки (синие, окрашенные CytoCalcein Violet 450), апоптотические (зеленые, окрашенные Apopxin Green) и некротизированные (красные, окрашенные 7-AAD). Клетки F-9 до обработки селенсодержащими соединениями высевали на 96-луночный планшет в среде ДМЕМ, содержащей 10%-ю сыворотку и подращивали в CO2-инкубаторе до 5 ⋅ 105 клеток/лунку в течение 24 ч, после чего к клеткам добавляли СН и МСК в соответствующих концентрациях. Спустя 24 ч клетки ресуспендировали в буфере для анализа согласно протоколу производителя. Для выявления апоптотических клеток использовали Apopxin Green Indicator, визуализировали с применением канала FITC (Ex/Em = 490/525 нм). Для обнаружения здоровых клеток использовали CytoCalcein 450 (Ex/Em = 405/450 нм), для выявления некротизированных клеток – 7-аминоактиномицин D (Ex/Em = 550/650 нм).
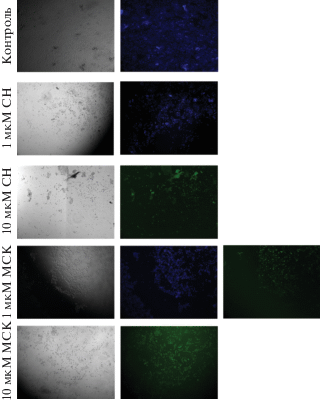
На рис. 1 представлены результаты качественного анализа, дающие информацию о наличии/отсутствии апоптоза или некроза в исследуемых раковых клетках. Они свидетельствуют о том, что после 24-часовой обработки 10-мкМ СН и 10-мкМ МСК в 100% визуализированных клеток наблюдался апоптоз. При воздействии на клетки 1-мкМ СН большая часть клеток не утратила своих адгезивных свойств, остались жизнеспособными, хотя их морфология изменилась (наблюдалось ошаривание клеток). Интересно, что при обработке клеток 1-мкМ МСК приблизительно 50% клеток подверглись апоптозу, тогда как остальные 50% остались жизнеспособными.
Рис. 1.
Флуоресцентный анализ жизнеспособности раковых клеток линии F-9 после 24 ч воздействия на клетки СН и МСК в концентрациях 1 и 10 мкМ. Живые клетки окрашены CytoCalcein Violet 450 (синие), апоптотические клетки окрашены Apopxin Green Indicator (зеленые).
Для установления сигнальных путей, активируемых при обработке исследуемых клеток СН и МСК в каждом конкретном случае, проверили, как меняется экспрессия их ключевых участников методом Вестерн-блоттинга. Для этого клетки подвергали воздействию 1-мкМ и 10-мкМ СН и МСК в течение 24 ч, после чего клетки были лизированы буфером PBS 1× (рН 7.4), содержащем 1 мM PMSF. Количество общего белка в каждом образце измерили колориметрическим методом Бредфорда. Разделение белков проводили методом ПААГ-электорофореза в 12%-м геле, количество белков в каждом из образцов (клеточный лизат) составило 50 мкг. Использовали коммерческие первичные антитела против ATF4-транскрипционного фактора, XBP1-(X-box связывающего белка 1) и контрольного белка GAPDH в разведении 1 : 200, а также вторичные с пероксидазой хрена фирмы Abcam, (США) в разведении 1 : 2000 (рис. 2).
Рис. 2.
Вестерн-блоттинг анализ экспрессии белков (XBP1s, ATF4 и GAPDH) в лизатах раковых клеток F-9 после 24 ч воздействия на них СН и МСК в концентрациях 1 и 10 мкМ методом иммунноблотинга: 1 – количество белка в интактных клетках, 2 –количество белка после воздействия на клетки 1-мкМ СН, 3 – 10-мкМ СН, 4 – 1-мкМ МСК, 5 – 10-мкМ МСК.
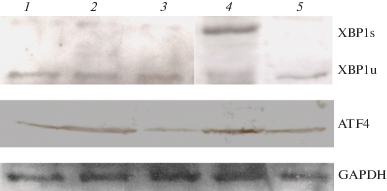
Количественную оценку белков проводили с использованием хемидокументирующей системы Fusion Solo (Viber, Франция). Данный эксперимент повторялся трижды (рис. 3). Установлено, что при обработке клеток 1-мкМ МСК экспрессия сплайсированной формы XBP1s значительно усиливалась, что может свидетельствовать об активации IRE1-сигнального пути. XBP1-транскрипционный фактор, который принимает участие в регуляции экспрессии генов, необходимых для функционирования иммунной системы и в регуляции ответа на ЭР-стресс. Активированный IRE1 (индозитол-требующий фермент 1) катализирует удаление нетрадиционного интрона (26 нуклеотидов) из повсеместно экспрессируемой мРНК XBP1u (несплайсированный XBP1, 29.5 кДа), что вызывает сдвиг рамки в кодирующей последовательности XBP1 и трансляцию изоформы XBP1s (сплайсированный XBP1, 55 кДа).
Рис. 3.
Количественная оценка содержания белков XBP1s и ATF4 относительно GAPDH в лизатах раковых клеток F-9 после 24 ч воздействия на них СН и МСК: 1 – количество белка в интактных клетках, 2 – количество белка после воздействия на клетки 1-мкМ СН, 3 – 10- мкМ СН, 4 – 1-мкМ МСК, 5 – 10-мкМ МСК.
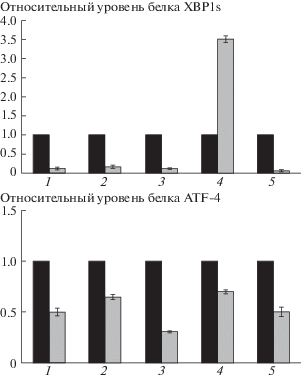
Во всех остальных образцах обработанных клеток как СН, так и МСК уровень экспрессии XBP1u и XBP1s приблизительно одинаковый. В случае активации PERK-сигнального пути ожидалось выявить усиление экспрессии ATF4-транскрипционного фактора, вызванное фосфорилированием eIF2α – ключевого участника трансляции белков. Однако при обработке клеток СН и МСК в исследуемых концентрациях уровень экспрессии ATF4 не отличался от контроля (интактные раковые клетки F-9). Возможно, апоптоз раковых клеток, в которых не наблюдалось усиления экспрессии ни ATF4, ни XBP1s, вызван активацией третьего сигнального пути ATF6, что требует более детального анализа и подтверждения в дальнейших исследованиях.
Список литературы
Shigemi Z., Manabe K., Hara N., et al. Methylseleninic Acid and Sodium Selenite Induce Severe ER Stress and Subsequent Apoptosis through UPR Activation in PEL Cells // Chem. Biol. Interact. 2017. V. 266. P. 28–37.https://doi.org/10.1016/j.cbi.2017.01.027
Han B., Ren Y., Guan L., et al. Sodium Selenite Induces Apoptosis in Acute Promyelocytic Leukemia-derived NB4 Cells through Mitochondria-dependent Pathway // Oncol Res. 2009. V. 17. № 8. P. 373–381.
Ramoutar R.R., Brumaghim J.L. Effects of Inorganic Selenium Compounds on Oxidative DNA Damage // J. Inorg. Biochem. 2007. V. 101. № 7. P. 1028–1035. https://doi.org/10.1016/j.jinorgbio.2007.03.016
Battin E.E., Zimmerman M.T., Ramoutar R.R. et al. Preventing Metal-mediated Oxidative DNA Damage with Selenium Compounds // Metallomics. 2011. V. 3. № 5. P. 503–512. https://doi.org/10.1039/c0mt00063a
Okuno T., Honda E., Arakawa T. et al. Glutathione-dependent Cell Cycle G1 Arrest and Apoptosis Induction in Human Lung Cancer A549 Cells Caused by Methylseleninic Acid: Comparison with Sodium Selenite // Biol. Pharm. Bull. 2014. V. 37. № 11. P. 1831–1837. https://doi.org/10.1248/bpb.b14-00453
Husbeck B., Bhattacharyya R.S., Feldman D. et al. Inhibition of Androgen Receptor Signaling by Selenite and Methylseleninic Acid in Prostate Cancer Cells: Two Distinct Mechanisms of Action // Mol. Cancer Ther. 2006. V. 5. № 8. P. 2078–2085. https://doi.org/10.1158/1535-7163
Zeng H., Wu M. The Inhibitory Efficacy of Methylseleninic Acid against Colon Cancer Xenografts in C57BL/6 Mice // Nutr. Cancer. 2015. V. 67. № 5. P. 831–838. https://doi.org/10.1080/01635581.2015.1042547
Tarrado-Castellarnau M., Cortés R., Zanuy M., et al. Methylseleninic Acid Promotes Antitumour Effects via Nuclear FOXO3a Translocation through Akt Inhibition // Pharmacol Res. 2015. V. 102. P. 218–234. https://doi.org/10.1016/j.phrs.2015.09.009
Варламова Е.Г., Гольтяев М.В., Кузнецова Ю.П. Влияние селенита натрия на экспрессию генов селенопротеинов SELV, SELW и TGR в клетках аденокарциномы предстательной железы человека // Молекулярная биология. 2018. Т. 52. № 3. С. 519–526. https://doi.org/10.7868/S0026898418030151
Варламова Е.Г., Гольтяев М.В., Новосёлов В.И., и др. Клонирование, внутриклеточная локализация и экспрессия селеноцистеин-содержащего белка млекопитающих SELENOI (SELI) в опухолевых клеточных линиях // ДАН. 2017. Т. 476. № 5. С. 581–583. https://doi.org/10.7868/S0869565217290229
Варламова Е.Г., Гольтяев М.В. Роль селенита натрия в регуляции экспрессии генов селенопротеинов-резидентов эндоплазматического ретикулума на примере фибросаркомы человека // Биофизика. 2018. Т.63. № 5. С. 880–887. https://doi.org/10.1134/S000630291805006X
Кузнецова Ю.П., Гольтяев М.В., Горбачева О.С., и др. Влияние селенита натрия на экспрессию мРНК генов селеноцистеин-содержащих белков млекопитающих в раковых клетках семенников и предстательной железы // ДАН. 2018. Т. 480. № 1. С. 107–111. https://doi.org/10.7868/S0869565218130224
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


