Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 31-34
НОВЫЕ РЕКОМБИНАНТНЫЕ НОСИТЕЛИ, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С РЕЦЕПТОРОМ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА
Т. С. Карягина 1, А. В. Уласов 1, А. А. Розенкранц 1, 2, Т. А. Сластникова 1, Ю. В. Храмцов 1, Т. Н. Лупанова 1, академик РАН Г. П. Георгиев 1, член-корреспондент РАН А. С. Соболев 1, 2, *
1 Институт биологии гена Российской Академии наук
Москва, Россия
2 Московский государственный университет
им. М.В. Ломоносова
Москва, Россия
* E-mail: sobolev@igb.ac.rualsobolev@yandex.ru
Поступила в редакцию 13.11.2019
После доработки 13.11.2019
Принята к публикации 13.11.2019
Аннотация
Разработаны и охарактеризованы новые рекомбинантные носители – модульные нанотранспортеры (МНТ), содержащие N-концевой лигандный модуль, специфически связывающийся с рецептором к эпидермальному фактору роста (рЭФР). В качестве лигандного модуля были использованы эпидермальный фактор роста (ЭФР) человека и антителоподобный белок Z1907. Показано, что данные МНТ способны к рецептор-специфической интернализации в опухолевые клетки-мишени и внутриядерному накоплению. Присоединение эмиттера электронов Оже (ЭО) 111In к этим МНТ значительно усиливало его цитотоксический эффект на клетки-мишени. Установлено, что перемещение ЭФР с С-конца на N-конец транспортера усиливало рост клеток-мишеней, тогда как использование Z1907 не приводило к подобному эффекту.
Доставка лекарственных средств в ядра клеток-мишеней является перспективным подходом увеличения эффективности противораковой терапии [1]. Однако такая доставка затруднена из-за наличия естественных биологических барьеров: плазматической мембраны, мембраны эндосом, деградации в лизосомах, ядерной мембраны [2].
Системой доставки, позволяющей эффективно преодолевать эти барьеры, являются многофункциональные полипептидные конструкции – модульные нанотранспортеры (МНТ). Их лигандный модуль обеспечивает специфическое связывание транспортера с соответствующим рецептором; эндосомолитический модуль необходим для выхода из эндосом в цитозоль, модуль с сигналом ядерной локализации обеспечивает эффективный транспорт в ядро, модуль-носитель служит для объединения модулей в единую структуру [3].
В разработанных ранее МНТ лигандный модуль, представленный эпидермальным фактором роста (ЭФР) человека, располагался на С-конце молекулы транспортера [4] (далее МНТ-ЭФР). Основываясь на проведенных ранее работах in vitro [5] и in vivo [6–8], мы проверили возможность создания новых МНТ, в которых лигандный модуль, способный специфически связываться с рецептором к ЭФР (рЭФР), был перенесен на N-конец молекулы (далее ЭФР-МНТ). Это делает С-конец доступным для модификации и расширяет возможности МНТ как платформы для переноса лекарств в ядро клетки-мишени. В качестве лигандного модуля новых МНТ были использованы ЭФР (для ЭФР-МНТ) или антителоподобный белок аффибоди Z1907 (Z1907-МНТ) [9]. Новые транспортеры были охарактеризованы по их способности проникать в ядра и цитотоксическому эффекту эмиттера ЭО 111In, доставляемого МНТ в опухолевые клетки-мишени.
Известно, что связывание рЭФР ряда опухолевых клеток с природными лигандами приводит к активации рецептора с последующим запуском внутриклеточных каскадов, усиливающих пролиферацию [10], оказывая проонкогенный эффект. Поскольку в состав исследуемых МНТ входят лиганды к рЭФР, была произведена оценка возможного влияния новых транспортеров на рост клеток-мишеней.
Новые транспортеры были наработаны в клетках E. coli, штамм C3029 (“NEB”, Великобритания), трансформированными плазмидами, кодирующими ЭФР-МНТ и Z1907-МНТ. Ген Z1907 был синтезирован “General Biosystems”, США, на основе опубликованной аминокислотной последовательности [9] и клонирован на N-конец безлигандного МНТ. Модульные нанотранспортеры были очищены методом аффинной хроматографии на Ni-NTA-агарозе (“Qiagen”, Германия).
Проверку способности МНТ к рецептор-опосредованной интернализации оценивали методом проточной цитометрии, для чего они были конъюгированы с Alexa Fluor 647 (“Molecular Probes”, США).
Оценку интернализации производили на клетках эпидермоидной карциномы человека A431, сверхэкспрессирующих рЭФР. Клетки культивировали в среде DMEM (“ПанЭко”, Россия) с добавлением 10% фетальной телячьей сыворотки (ФС) и гентамицина (50 мкг/мл) при 5% CO2 и 37°С в CO2-инкубаторе. Клетки были рассажены в 24-луночную плашку (2.5 × 104 клеток/лунка). Спустя 2 суток к клеткам были добавлены по 100 нМ ЭФР-МНТ, MНT-ЭФР и Z1907-МНТ, меченных Alexa Fluor 647. Клетки инкубировали с МНТ 18 ч при 37°C при 5% CO2 с или без избытка свободного ЭФР. Затем клетки с интернализованными транспортерами промывали, трипсинизировали, удаляя МНТ, находящиеся на поверхности клеток, центрифугировали при 200g в течение 10 мин и анализировали проточной цитометрией с использованием Epics Altra Flow Cytometer (“Beckman Coulter”, США) при возбуждении флуоресценции 633 нм и эмиссии при 675 нм. Для каждой пробы было проанализировано 0.5–1 × 104 клеток. Добавление 2 мкМ свободного ЭФР существенно уменьшало среднюю интенсивность флуоресценции, соответствующей интернализованной клетками фракции МНТ, до 19 ± 1, 38 ± 1 и 42 ± 1% от исходного уровня для МНТ-ЭФР, Z1907-МНТ и ЭФР-МНТ соответственно. Этот результат свидетельствует о рецептор-опосредованном (рЭФР-специфическом) эндоцитозе данных МНТ клетками-мишенями.
Для исследования накопления МНТ в ядрах клеток-мишеней к МНТ был присоединен 111In через бифункциональный хелатор p-SCN-Bn-NOTA, как описано ранее [11]. Клетки А431 были рассеяны в 12-луночную плашку (5 × 105 клеток/лунка) в среде DMEM с 10% ФС. Спустя 2 суток клетки были инкубированы 2 ч с 111In-NOTA-МНТ (0.6 МБк/мл, 1.9 мкг/мл) в свежей среде, после чего ядра клеток выделяли по описанной ранее методике [12] на льду. Полученные данные свидетельствуют, что все исследуемые МНТ способны к доставке 111In в ядра клеток-мишеней, где эффективность действия эмиттера ЭО максимальна (табл. 1).
Исследование влияния МНТ на рост клеток-мишеней проводили на клетках аденокарциномы молочной железы человека MCF-7. За 7 суток до эксперимента клетки переводили на среду DMEM с 0.5% ФС, после чего рассаживали в 24-луночные плашки по 8 тысяч клеток в лунку или 96-луночные плашки по 3 тысячи клеток в лунку. На следующий день к клеткам добавляли МНТ или ЭФР в концентрации 100 нМ. Рост клеток оценивали с помощью МТТ-теста на 10-й день инкубации. Оптическую плотность формазана и фона измеряли с помощью планшетного фотометра Synergy 4 (“Biotek”, США) при 570 и 650 нм соответственно.
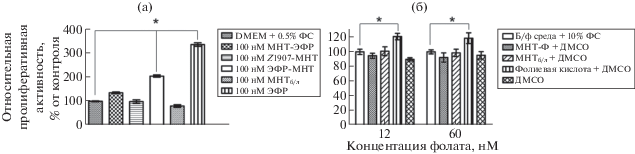
Было продемонстрировано, что ЭФР и ЭФР-МНТ приводят к достоверному увеличению роста опухолевых клеток-мишеней, тогда как Z1907-МНТ, МНТ-ЭФР и безлигандный МНТ не оказывают на него воздействия (рис. 1а). Необходимо отметить, что и другой тип МНТ, содержащий фолат в качестве лигандного модуля (МНТ-Ф) [11], в отличие от свободного фолата не вызывал увеличения пролиферации клеток в бесфолатной среде (б/ф) с 10% ФС (рис. 1б).
Рис. 1.
Влияние МНТ на пролиферативную активность клеток-мишеней MCF-7. а – влияние рЭФР-связанных МНТ. б – влияние МНТ-Ф. Среднее значение оптической плотности для контрольных клеток принято за 100% M ± m, n = 4. Звездочкой отмечены обозначены достоверно различающиеся результаты (p < 0.05).
Оценку цитотоксического эффекта 111In, доставляемого внутрь опухолевых клеток-мишеней посредством МНТ, производили с помощью метода колониеобразования на клетках культуры А431. В качестве контроля использовали свободный 111In. Клетки A431 рассевали в 24-луночную плашку (2 × 104 клеток/лунка) в среде DMEM с 10% ФС. Спустя 2 суток среду заменяли и добавляли 111In-NOTA-МНТ (0.02—6.5 МБк/мл), а также свободный 111In (0.22–20 МБк/мл). Клетки инкубировали 48 ч при 37°C и 5% CO2, после чего рассевали в 25-см2 флаконы (2 ⋅ 103 клеток на флакон) в среде DMEM/F12 с 10% ФС. Через 6 суток колонии фиксировали, окрашивали кристаллическим фиолетовым и подсчитывали.
Присоединение 111In к МНТ существенно увеличивало его цитотоксичность, наибольший цитотоксический эффект обнаруживался для 111In-NOTA-Z1907-МНТ и 111In-NOTA-MНT-ЭФР (табл. 2).
Таблица 2.
Цитотоксический эффект 111In на клетках эпидермоидной карциномы человека А431
| Цитотоксический агент | A50, МБк мл–l |
|---|---|
| 111In-NOTA- Z1907-МНТ | 0.11 ± 0.02 |
| 111In-NOTA-ЭФР-MНT | 0.41 ± 0.03 |
| Свободный 111In | 8 ± 1 |
Таким образом, разработаны и охарактеризованы новые МНТ с лигандными модулями на N-конце молекулы: ЭФР-МНТ и Z1907-МНТ, которые способны доставлять эмиттеры ЭО в ядра опухолевых клеток-мишеней, сверхэкспрессирующих рЭФР. Продемонстрировано, что Z1907-МНТ и МНТ-Ф не влияют на пролиферативную активность клеток-мишеней, в отличие от ЭФР, фолата и ЭФР-МНТ, что даёт основания считать их перспективным средством направленной доставки противораковых средств.
Список литературы
Розенкранц А.А., Уласов А.В., Сластникова Т.А. и др. // Биохимия. 2014. Т. 79. № 9. С. 1148–1168.
Belting M., Sandgren S., Wittrup A. // Adv. Drug Deliv. Rev. 2005. V. 57. № 4. P. 505–527.
Sobolev A.S. // Front Pharmacol. 2018. 9: 959.
Gilyazova D.G., Rosenkranz A.A., Gulak P.V., Lunin V.G., et al. // Cancer Res. 2006. V. 66. № 21. P. 10534–10540.
Slastnikova T.A., Koumarianou E., Rosenkranz A.A., et al. // EJNMMI Res. 2012. V.2. № 1. P. 59.
Slastnikova T.A., Rosenkranz A.A., Gulak P.V., et al. // Int. J. Nanomedicine. 2012. V. 7. P. 467–82.
Slastnikova T.A., Rosenkranz A.A., Morozova N.B., et al. // Int. J. Nanomedicine. 2017. V. 12. P. 395–410.
Rosenkranz A.A., Slastnikova T.A., Karmakova T.A., et al. // Front Pharmacol. 2018. 9: 1331.
Kim D., Yan Y., Valencia C.A., et al. // PLoS One. 2012. V. 7. № 8. P. e43 077.
Herbst R.S. // Int J Radiat Oncol Biol Phys. 2004. V. 59. № 2. P. 21–26.
Slastnikova T.A., Rosenkranz A.A., Khramtsov Y.V., et al. // Drug Des. Devel. Ther. 2017. V. 11. P. 1315–1334.
Lo H.W., Ali-Seyed M., Wu Y., et al. // J. Cell Biochem. 2006. V. 98. № 6. P. 1570–1583.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


