Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 94-100
ВЛИЯНИЕ УСЛОВИЙ ОСЛАБЛЕННОГО В 1000 РАЗ МАГНИТНОГО ПОЛЯ ЗЕМЛИ НА ЭМБРИОГЕНЕЗ И ОНТОГЕНЕЗ ЯПОНСКОГО ПЕРЕПЕЛА В РЯДУ ПОКОЛЕНИЙ
Академик РАН О. И. Орлов 1, *, Т. С. Гурьева 1, О. А. Дадашева 1, А. В. Спасский 2, М. В. Ездакова 1, Е. Д. Литвин 1, В. Н. Сычев 1
1 Государственный научный центр РФ – Институт медико-биологических проблем Российской Академии наук
Москва, Россия
2 Научно-исследовательский институт ядерной физики им. Д.В. Скобельцына Московского государственного университета им. М.В. Ломоносова
Москва, Россия
* E-mail: orlov@imbp.ru
Поступила в редакцию 15.10.2019
После доработки 15.10.2019
Принята к публикации 15.10.2019
Аннотация
Представлены экспериментальные данные по влиянию условий 1000-кратного ослабления магнитного поля Земли на эмбриональное и постэмбриональное развитие японского перепела в трех поколениях. Показано, что ослабление магнитного поля Земли в 1000 раз оказывает влияние на формирование сосудов кровеносной системы у эмбрионов японского перепела, в частности, вызывая снижение ангиогенеза у семисуточных эмбрионов как первого поколения (F1), так и последующих двух F2. и F3. Патолого-анатомические исследования разновозрастных эмбрионов во всех трех поколениях выявили различные патологии, связанные с нарушением сосудистой системы, а также нарушения в развитии клюва и глаз. В онтогенезе перепелов F3 отмечается снижение выводимости птенцов.
Перспективы межпланетных миссий или долговременного пребывания человека на Луне и Марсе ставят перед исследователями новую задачу – исследование влияния сниженного магнитного поля на организм человека. Известно, что на Луне однородное магнитное поле отсутствует. Магнитное поле на поверхности Луны обычно составляет около 10 нT или меньше, но есть очень небольшие области с намагниченностью до 100 нТ. На Марсе планетарного магнитного поля также не существует. Среднее магнитное поле на поверхности Земли ~5104 нТ, поэтому понятно, что космонавты будут находиться в гипомагнитных условиях как во время межпланетных миссий, так и во время нахождения на поверхности Луны и Марса. Однако реакция человеческого организма на гипомагнитные условия, особенно во время продолжительного воздействия, в настоящее время практически не изучена.
В последнее время появляется все больше экспериментальных и теоретических данных, свидетельствующих о важности геомагнитного поля (ГМП) для нормальной жизнедеятельности организма, в частности о возможных негативных последствиях для организма человека при длительном нахождении в условиях пониженного ГМП. Результаты клинико-физиологических обследований лиц, работавших в условиях пониженного в 4–10 раз магнитного поля (МП) Земли, показали функциональные изменения в ведущих системах организма человека. Так, со стороны центральной нервной системы выявлены признаки дисбаланса нервных процессов, наблюдается дистония мозговых сосудов, обнаружены нарушения со стороны сердечно-сосудистой системы, выражающиеся в нейроциркулярной дистонии [1].
Помимо исследования влияния пониженного ГМП на взрослый организм в настоящее время большое внимание уделяется изучению влияния ослабленного МП Земли на развивающийся организм животных, принадлежащих к различным таксономическим группам. В этих исследованиях показано патологическое действие ослабленного ГМП на эмбрионы, что свидетельствует о чувствительности эмбрионов всех видов животных к данному фактору. Так, содержание мышей в ослабленном ГМП (0.2 мкТл) вызывает в эмбриональных клетках нарушения барьерных свойств в плазматических мембранах и реорганизацию цитоскелета как в культуре in vitro, так и при нахождении в материнском организме [2]. Развитие куриных эмбрионов в десятикратно уменьшенном МП Земли приводит к ингибированию митотической активности вентрикулярных клеток, участвующих в процессе дифференцировки и морфогенеза головного мозга [3].
В экспериментах на эмбрионах японского перепела, подверженных воздействию ослабленного в 80–100 раз МП Земли, были обнаружены серьезные аномалии в развитии сердечно-сосудистой системы.
Целью данной работы являлось исследование влияния ослабленного в 1000 раз МП Земли на эмбриогенез птиц японского перепела первого поколения (F1) и последствия этого воздействия на эмбриогенез и онтогенез птиц в следующих поколениях (F2, F3).
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования были 7-, 10- и 14-суточные эмбрионы японского перепела; вылупившиеся птенцы, эмбриогенез которых проходил в условиях в 1000 раз пониженного МП Земли; птицы, выросшие их этих птенцов, а также эмбрионы и птицы, полученные во втором и третьем поколениях, развивавшиеся в нормальном МП Земли.
Инкубирование яиц японского перепела проводили на базе НИИЯФ МГУ внутри гипомагнитной камеры (ГМК) (рис. 1). Эта ГМК изготовлена из рулонного магнитного материала МАР-1К и позволяет ослабить ГМП Земли в 1000 раз [4].
Температура (37.5 ± 0.5°С) и влажность (65 ± 5%) внутри инкубатора поддерживалась с помощью водяного циркуляционного термостата LOIP LT-108. Температура и влажность измерялись цифровым гигрометром/термометром ExoTerra, оснащенным дистанционными датчиками, также температура измерялась и спиртовым термометром. По программе эксперимента для проветривания инкубатор дважды в сутки открывали. Величина МП в различных областях камеры контролировалась с помощью магнитометра НВ-0599А (“НПО ЭНТ”).
Перепелиные яйца, собранные от родительского поголовья в количестве 40 штук, закладывали в инкубаторы, которые представляли собой коробки из органического стекла размером 240 × 220 × 200 мм, внутри которых на специальной подставке располагались яйца перепелов.
Собранные от родительского поголовья перепелиные яйца были пронумерованы и распределены на две группы:
1-я группа – яйца, 20 штук, были заложены в инкубатор и помещены в камеру ГМК, где инкубирование проходило в условиях пониженного в 1000 раз МП Земли;
2-я группа – яйца, 20 штук, были заложены в инкубатор и помещены в камеру с нормальным МП Земли для проведения контрольного инкубирования.
По программе эксперимента для исследования развития кровеносных сосудов на седьмые сутки инкубирования проводилась выемка 10 яиц в каждой группе. После выемки яиц в освободившиеся ячейки закладывались новые яйца для получения дополнительных семисуточных эмбрионов для повторения данного этапа исследований.
Исследование развития кровеносных сосудов хориоаллантоиса (ХА) у семисуточных эмбрионов проводили по методике in ovo: яйцо вскрывали с тупого конца и с помощью пипетки вносили 1.5 мл физиологического раствора, затем удаляли подскорлуповую оболочку. На ХА наслаивали 1 мл фиксатора (4%-й парафармальдегид и 2%-й глютаральдегид на фосфатном буфере), через две минуты надрезали скорлупу и переносили содержимое яйца в чашку Петри. С помощью пинцета отделяли ХА и монтировали его на предметном стекле. Затем просушивали в течение суток на воздухе при комнатной температуре – такой препарат был готов для морфометрического анализа кровеносных сосудов. Препараты ХА изучали и фотографировали на стереомикроскопе “Zeiss” Stemi 2000-C и для захвата изображения Canon G9, на микроскопе Leica 500. Макроизображения получали с помощью фотокамеры Canon G9 (Япония). Для морфометрического анализа полученные изображения анализировали с помощью программы AngioQuant (Antti Niemisto, and all., www.cs.tut.fi), измеряя количество основных сосудов, от которых отходят ветви капилляров. Общее количество сосудов всех порядков вычислили суммированием предыдущих показателей [5].
На следующем этапе исследований для изучения процесса эмбриогенеза яйца японского перепела в обеих группах инкубировали с целью получения 10- и 14-суточных эмбрионов. После выемки яиц из инкубаторов вскрывали скорлупу яиц в области тупого конца и содержимое выливали в чашку Петри. Визуальный осмотр содержимого яйца и самого эмбриона проводили с помощью лупы с двукратным увеличением и подсветкой. Определяли стадию развития эмбриона, отмечали состояние желтка, сосудов желточного мешка, белковых оболочек, сосудистого поля и ХА, после чего эмбрион осторожно освобождали от оболочек и проводили его осмотр с определением массы тела зародыша с последующим фотографированием [7].
Для получения птенцов и в дальнейшем взрослых птиц поколения F1 было проведено инкубирование перепелиных яиц в течение 15 сут в ГМК с ослабленным в 1000 раз МП Земли и в условиях нормального МП Земли. Через 15 сут инкубирования в ГМК яйца были помещены в выводковые лотки лабораторного инкубатора. Вылупившихся птенцов содержали и выращивали в стандартных лабораторных условиях. На 90-е сутки от этих птиц были собраны яйца для инкубирования с целью получения птиц поколения F2, от которых на 90-е сутки собраны яйца для выведения птенцов с целью получения птиц поколения F3.
В течение всего периода онтогенеза птиц всех трёх поколений велось наблюдение за их поведением, массой тела, яйцекладкой.
Статистическую обработку данных и представление графиков проводили с использованием пакета программ Microsoft (Excel).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Эмбрионы японского перепела развиваются вне материнского организма, активно реагируя на различные изменения внешней среды, что позволяет проводить исследования влияния различных факторов среды на их эмбриогенез [7].
В эмбриогенезе японского перепела имеются четыре возрастных критических этапа: четвертые, седьмые сутки, 10-е и 15–16-е сутки развития, которые различаются не только анатомическими и морфологическими особенностями, но и особыми формами обмена. Зная отличительные особенности в развитии эмбрионов в эти сроки, исследователи используют их для изучения реакции эмбриона на измененные факторы внешней среды. Нами исследовались семи-, десяти- и 14-суточные эмбрионы, развивавшиеся в условиях сниженного МП Земли (F1), а также эмбрионы поколений F2 и F3.
В норме на седьмые сутки у эмбриона перепела хорошо развита сеть кровеносных сосудов желточного мешка, идущих к зародышу и от зародыша. Наряду с сосудистой системой желточного мешка в газообмене зародыша начинает участвовать сосудистая система аллантоиса, покрывающая своей поверхностью стенку скорлупы. Эти два органа выполняют основные жизненные функции эмбриона – питание и дыхание, и их кровеносные сосуды играют главную роль в эмбриональном кровообращении.
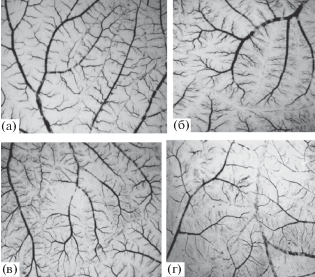
На рис. 2 представлена сравнительная картина сосудов ХА эмбрионов перепела в поколениях F1, F2 и F3. Результаты исследования ангиогенеза у семисуточных эмбрионов показали снижение количества сосудов ХА как у зародышей поколения F1, так и у семисуточных зародышей поколений F2 и F3.
Рис. 2.
Развитие сосудов ХА у семисуточных эмбрионов перепела: а – контроль, б – поколение F1, в – поколение F2, г – поколение F3.
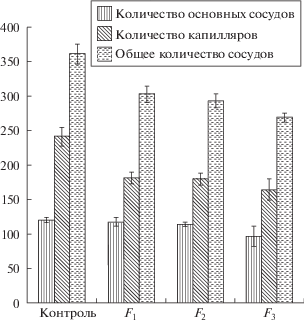
На рис. 3 представлены данные по количеству кровеносных сосудов первого и второго порядков, капилляров (ветви) и общее количество определяемых сосудов у семисуточных эмбрионов поколений F1,F2 и F3, а также контрольной группы. Результаты показали, что основные изменения в ангиогенезе ХА в опытных группах проявляются в уменьшении количества ветвей капилляров, что составляет соответственно для F1 на 25.0%, для F2 на 29.2% и для F3 на 32.2% по сравнению с контролем. Кровеносная система является критически важным фактором для нормального развития эмбриона, для роста и дифференцировки всех органов и тканей, так как благодаря наличию системы кровообращения осуществляется доставка кислорода и питательных веществ и происходит удаление продуктов жизнедеятельности [8].
Рис. 3.
Данные по количеству кровеносных сосудов ХА у семисуточных эмбрионов перепела поколений F1, F2 и F3 и в контроле. Примечание. *р < 0.05* – значимость различий по количеству капилляров кровеносных сосудов эмбрионов поколения F1, F2 и F3 относительно контроля.
Каждый период эмбрионального развития японского перепела имеет отличительные морфологические признаки. Так, у семисуточного эмбриона в норме на коже и по всему телу имеются зачатки перьев (сосочки) и формируется клюв. Идёт формирование пальцев конечностей.
Анализ эмбриологического материала, полученного при инкубировании перепелиных яиц в условиях пониженного в 1000 раз МП Земли показал, что процент живых эмбрионов, соответствующих семи суткам развития, составляет 88.9%. Большинство эмбрионов по анатомо-морфологическим признакам практически соответствуют норме развития и контролю, однако у 40% из них имеются признаки нарушения развития сосудов: ломкость сосудов, выражающаяся в кровоизлияниях в различные части тела (в затылочной области головы и шеи), а также наличие узких сосудов желточного мешка. У двух эмбрионов, погибших на 5-е–6-е сутки развития, отмечены обширные кровоизлияния в головной и туловищной частей тела, кровеносные сосуды желточного мешка и ХА полнокровны, но недоразвиты.
В норме на 10-е сутки развития у эмбриона перепела происходит полное замыкание сосудов ХА в остром конце яйца. ХА начинает выполнять дыхательную функцию, а также по сосудам ХА к эмбриону переносится абсорбированный из скорлупы растворимый биокарбанат кальция для построения скелета зародыша. Визуальный осмотр десятисуточных эмбрионов выявил у них различные патологии, связанные с нарушением сосудистой системы: отмечалась слабая разветвлённость микрокапилляров желточного сосудистого поля и сосудов хориоаллантоиса, а также анемия кожных покровов и дистрофия пальцев нижних конечностей.
В норме на 14-е сутки развития у эмбриона перепела желточный мешок начинает втягиваться в брюшную полость, на различных участках кожи зачатки перьев превращаются в пушинки. Глаза закрываются веками. Появляются и постепенно твердеют клюв и когти. Зародыш быстро растёт и занимает всё большее пространство в яйце. С развитием мускулатуры и нервной системы эмбрион приобретает способность к произвольным движениям.
Осмотр 14-суточных эмбрионов поколения F1 показал, что только пять из десяти эмбрионов соответствовали сроку развития, но и у них отмечались изменения в развитии сосудов, а именно сосуды желточного мешка узкие, слабо развиты. Анатомо-морфологические исследования погибших эмбрионов выявили у двух из них патологию развития глаз (двухсторонняя микрофтальмия), клюва (увеличение нижней пластины в длину).
Анатомо-морфологические исследования разновозрастных эмбрионов поколений F1, F2 и F3 показали, что по массе тела эмбрионы различаются незначительно между группами, но отстают от нормы развития (табл. 1).
Таблица 1.
Динамика изменения массы тела разновозрастных эмбрионов японского перепела в трёх поколениях в сравнении с контрольной группой
| Поколение | 7-е сутки | 10-е сутки | 14-е сутки | |||
|---|---|---|---|---|---|---|
| Кол-во эмбрионов, шт. | Масса эмбриона, г | Кол-во эмбрионов, шт. | Масса эмбриона, г | Кол-во эмбрионов, шт. | Масса эмбриона, г | |
| Контроль | 16 | 0.62 ± 0.05 | 10 | 1.74 ± 0.50 | 12 | 5.40 ± 0.16 |
| F1 | 10 | 0.59 ± 0.04 | 10 | 1.55 ± 0.06 | 10 | 4.70 ± 0.16 |
| F2 | 11 | 0.49 ± 0.60 | 10 | 1.49 ± 0.11 | 9 | 4.68 ± 0.23 |
| F3 | 8 | 0.53 ± 0.02 | 4 | 1.71 ± 0.02 | 4 | 4.84 ± 0.25 |
Однако из 11 семисуточных эмбрионов поколения F2 четыре отставали в развитии и соответствовали возрасту шеститисуточных эмбрионов. Они были анемичны, у них имелась патология клюва (клюв находится в зачаточном состоянии и недоразвит). Практически у всех остальных зародышей были очень слабые сосуды, наблюдались точечные кровоизлияния.
Из восьми просмотренных семисуточных эмбрионов поколения F3 три яйца были неоплодотворенными, у остальных пяти эмбрионов отмечены кровоизлияния на туловище, сосуды тонкие и переполнены кровью. При вскрытии яиц поколения F3 на 10-е и 14-е сутки инкубирования было обнаружено одно неоплодотворенное яйцо, у эмбрионов на 10-е сутки ХА незамкнут, а также в желточном мешке много желчи. Один зародыш погиб на третьи сутки развития, имея следующую патологию: эктопия грудной клетки, двусторонняя микрофтальмия. Обнаруженные на теле опытных эмбрионов перепела множественные кровоизлияния, по-видимому, связаны с изменением скорости кровотока и коллоидно-осмотического давления в капиллярах, при котором происходит изменение электропроводности в тканях и снижение потребности их в кислороде. Такие явления нами были обнаружены у эмбрионов японского перепела, развитие которых проходило в условиях гипоксии [9].
Для оценки состояния птенцов и птиц японского перепела в онтогенезе были проведены инкубирования яиц, полученные от 90-суточных птиц опытной и контрольной групп. В табл. 2 представлены сравнительные результаты инкубирования и выведения птенцов в опытных группах (поколениях F1, F2 и F3) и в лабораторном контроле. Во всех опытных группах процент выведения был значительно ниже, чем в контроле, в поколениях F1, F2 и F3 процент выведения составил 57.1, 69.2 и 45.8% соответственно.
Таблица 2.
Сравнительные результаты по выведению птенцов в опытных группах (поколениях F1, F2 и F3) и в лабораторном контроле
| Группы | Количество заложенных яиц, шт. | Осталось яиц на выведение, шт. | Количество выведен-ных птенцов, шт./ % | Средняя масса птенца, г | Инкубационные отходы, шт./% |
|---|---|---|---|---|---|
| Контроль | 39/12* | 27 | 22/81.5% | 7.58 ± 0.6 | 5/18.5% |
| Опыт F1 | 40** | 35 | 20/57.1% | 7.11 ± 0.8 | 15/42.9% |
| Опыт F2 | 34 /8* | 26 | 18/69.2% | 7.12 ± 0.4 | 8/30.1% |
| Опыт F3 | 39/15* | 24 | 11/45.8% | 7.44 ± 0.7 | 13/54.2% |
Анализ результатов патолого-анатомического изучения инкубационных отходов в опытной группе F1 показал, что погибло 15 эмбрионов, из них три эмбриона погибли в первые сутки развития, а 12 – на 15-е–17-е сутки инкубирования, т.е. в предвыводковый период, при этом эмбрионы морфологически были полностью сформированы, но не смогли проклюнуть скорлупу.
Из птиц, выращенных из птенцов поколения F1, при достижении ими 30-суточного возраста сформировали семьи, в каждой по три самки и одному самцу. Яйцекладка у самок птиц поколения F1 началась в 43-суточном возрасте.
Для создания поголовья птиц второго поколения F2 был проведен сбор яиц от перепелов поколения F1 для дальнейшего инкубирования и получения птенцов. Патолого-анатомическое изучение инкубационных отходов после выведения птенцов в опытной группе F2 показало, что из яиц, из которых не вывелись птенцы, два были неоплодотворёнными, четыре эмбриона погибли на 1-е–3-и сутки развития из-за патологии глаз, кровоизлияния в амнионе и гиперимии верхних отделов туловища. Два эмбриона погибли на 14-е–15-е сутки из-за гипоксии. Из птиц, выращенных из птенцов поколения F2, при достижении ими в 30-суточного возраста сформировали семьи, в каждой по три самки и одному самцу. Созданное поголовье перепелов F2 явилось основой для получения птиц группы F3.
Процент выведения птенцов опытной группе поколения F3 составил всего 45.8%, что практически на 50% ниже выводимости в контрольной группе, которая составила 81.5% (табл. 2). Изучение инкубационных отходов поколения F3 показал, что 11 яиц были неоплодотворёнными и ещё три неоплодотворенных яйца были из восьми, взятых на исследования, т.е. неоплодотворёнными были 14 из 39 яиц, положенных в инкубатор.
В процессе онтогенеза каждое животное проходит несколько периодов развития. В онтогенезе перепела различают основные периоды развития: это срок появления признаков полового диморфизма, возраст наступления яйцекладки. Каждый период развития, состоящий из ряда фаз, характеризуется определенными взаимоотношениями организма со средой. Между фазами существуют переломные этапы, называемые критическими периодами, которые характеризуются особой чувствительностью к совершенно определенным внешним воздействиям.
Половой диморфизм у птиц в опытной группе F1 определился на 25-е сутки, а в поколениях F2 и F3 только на 30-е сутки, тогда как в норме различие по оперению самки и самца наступает на 20-е–21-е сутки.
В норме яйцекладка у взрослых самок перепела наступает в возрасте 1.5–2 месяцев. В первый месяц после начала яйцекладки одна несушка приносит не больше 10 яиц, в следующие – около 25 яиц в месяц, масса яиц колеблется от 9 до 11 г. У самок поколений F1 и F2 яйцекладка наступила на 45-е сутки, а у поколения F3 первое яйцо самка снесла на 48-е сутки.
Живой вес птиц японского перепела во всех трёх поколениях в течение всего онтогенеза был значительно меньше живой массы птиц из контроля (табл. 3). Следует отметить, что в контроле все птицы достигли возраста 120 суток, в поколении F1 к 45-м суткам погибла одна птица, в поколении F2 к 21-м суткам погибли две птицы, а в поколении F3 все девять птиц погибли через 90 суток.
Таблица 3.
Масса тела птиц поколений F1, F2 и F3 и в лабораторном контроле в онтогенезе
| Возраст птиц, сут | Контроль | F1 | F2 | F3 | ||||
|---|---|---|---|---|---|---|---|---|
| Кол-во птиц | Масса птиц, г | Кол-во птиц | Масса птиц, г | Кол-во птиц | Масса птиц, г | Кол-во птиц | Масса птиц, г | |
| 7 | 36 | 35.30 ± 0.9 | 18 | 29.67 ± 2.4 | 18 | 33.12 ± 3.1 | 9 | 34.7 ± 2.3 |
| 21 | 36 | 133.25 ± 2.2 | 18 | 117.2 ± 4.1 | 16 | 126.6 ± 2.8 | 9 | 140.0 ± 4.7 |
| 45 | 36 | 157.4 ± 1.8 | 17 | 152.0 ± 5.6 | 16 | 154.0 ± 3.7 | 9 | 152.0 ± 3.9 |
| 60 | 36 | 243.35 ± 1.5 | 17 | 215.8 ± 6.4 | 16 | 200.3 ± 3.1 | 9 | 201.0 ± 2.5 |
| 90 | 36 | 260.0 ± 3.1 | 17 | 239.0 ± 5.2 | 16 | 223.0 ± 3.8 | 9 | 218.0 ± 3.5 |
| 120 | 36 | 261.0 ± 3.1 | 17 | 245.0 ± 3.1 | 16 | 222.0 ± 4.8 | 0 | – |
ВЫВОДЫ
1. Развитие эмбрионов перепела поколения F1 в условиях ослабленного в 1000 раз МП Земли привело к изменениям в ангиогенезе ХА у семисуточных эмбрионов как в поколении F1, так в последующих поколениях F2 и F3, что выразилось в уменьшении количества ветвей капилляров для поколения F1 на 25.0%, для F2 на 25.7% и для F3 на 32.2% по сравнению с контролем.
2. Патолого-анатомические исследования семи, десяти и 14-суточных эмбрионов во всех трёх поколениях выявили у них различные патологии, связанные с нарушением сосудистой системы: множественные кровоизлияния, анемия кожных покровов, дистрофия пальцев нижних конечностей, а также наиболее часто встречающиеся нарушения развития глаз (двухсторонняя микро-фтальмия), изменение клюва (увеличение нижней пластины в длину).
3. После инкубирования яиц перепела поколения F1 в условиях ослабленного в 1000 раз МП Земли в следующих двух поколениях обнаружено снижение выводимости птенцов после инкубирования яиц в нормальном МП Земли, наименьшее выведение птенцов было у поколения F3 – 45.8%.
4. В онтогенезе во всех трёх поколениях птиц перепела отмечались задержка определения полового диморфизма и начала яйцекладки в группах, падеж птиц, увеличение числа неоплодотворенных яиц.
Таким образом, проведенные исследования показали, что развитие зародышей птиц в гипомагнитых условиях оказывает влияние не только на сами эмбрионы, но и на организм взрослых особей, выросших из этих эмбрионов, а даже в большей степени на последующие поколения, вплоть до гибели всей популяции.
Список литературы
Рагульская М.В. Влияние вариаций солнечной активности на функционально здоровых людей. Автореф. на соискание степени кандидата физ.-мат. наук по специальности “Физика Солнца” (солнечно-земные связи). 2004.
Осипенко М.А., Межевикина Л.М., Крастс И.В., Яшин В.А., Новиков В.В., Фесенко Е.Е. Влияние “нулевого” магнитного поля на рост эмбриональных клеток и ранних зародышей мыши в культуре in vitro // Биофизика. 2008. Т. 53. № 4. С. 705.
Григорьев Ю.Г. Реакция организма в ослабленном геомагнитном поле (эффект магнитной депревации) // Радиационная биология. Радиоэкология. 1995.Т. 35. Вып.1. С.3.
Гудошников С.А., Венедиктов С.Н., Гребенщиков Ю.Б., Кузнецов П.А., Маннинен С.А., Васильева О.В., Криволапова О.Н., Труханов К.А., Круглов О.С., Спасский А.В. Экранирующая камера для ослабления магнитного поля Земли на основе рулонных магнитных материалов // Измерительная техника. 2012. № 3. С. 58–61.
Ездакова М.И. Андреева Е.Р., Гурьева Т.С., Дадашева О.А., Орлова В.С. Отработка подходов для изучения ангиогенеза in ovo и ex ovo на хориоаллантоисной оболочки яиц японского перепела // Технологии живых систем. 2014. Т.11. № 5. С. 60–65.
Гурьева Т.С., Мелешко Г.И., Дадашева О.А., Бодя К. Эмбриональное развитие птиц в условиях невесомости // Космическая биология и авиакосмическая медицина. 1991. Т. 25. № 1. С. 37–39.
Прицкер И.Я., Третьяков Н.П. Инкубаторы и их эксплуатация. 1937 г. М.: Сельхозгиз. С. 28–32.
Светлов П.Г. Теория критических периодов развития и ее значение для понимания действия среды на онтогенез. Сборн. Вопросы цитологии и общей физиологии. М.-Л.: Изд. АН СССР. 1960. 263 с.
Солдатов П.Э., Гурьева Т.С., Дадашева О.А., Лысенко Л.А., Ремизова С.Е. Воздействие аргонсодержащих гипоксических газовых сред на развитие эмбрионов японского перепела // Авиакосмическая и эколог. медицина. 2002. Т. 36. № 2. С. 25–28.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни



