Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 81-84
ФУНКЦИОНАЛЬНАЯ КОННЕКТОМИКА В ИССЛЕДОВАНИИ ЭФФЕКТОВ СЕЛАНКА И СЕМАКСА
Я. Р. Паникратова 1, *, И. С. Лебедева 1, О. Ю. Соколов 1, А. Д. Румшиская 2, Д. А. Куприянов 3, Н. В. Кост 1, академик РАН Н. Ф. Мясоедов 1
1 Научный центр психического здоровья
Москва, Россия
2 Городская клиническая больница
им. И.В. Давыдовского
Москва, Россия
3 ООО “Филипс”
Москва, Россия
* E-mail: panikratova@mail.ru
Поступила в редакцию 22.07.2019
После доработки 22.07.2019
Принята к публикации 22.07.2019
Аннотация
Исследовали влияние анксиолитика Селанка и ноотропа Семакса на функциональную связанность (ФС) каждой из предопределённых зон интереса с остальными зонами головного мозга у 52 здоровых испытуемых. В качестве зон интереса были выбраны миндалина (одна из ключевых зон, участвующих в регуляции тревоги) и дорсолатеральная префронтальная кора (ДЛПФК; ключевая зона для обеспечения управляющих функций, в том числе рабочей памяти) правого и левого полушария. Функциональную МРТ покоя проводили трижды: перед введением, через 5 и 20 мин после введения препаратов или плацебо. Между тремя группами испытуемых и между всеми временными точками были выявлены различия ФС правой миндалины с зоной в веретеновидной, нижней и средней височных и парагиппокампальной извилинах правого полушария. Post hoc анализ позволил впервые выявить как общие, так и специфичные эффекты Селанка и Семакса на ФС правой миндалины с выявленной зоной.
Развитие функциональной коннектомики открывает новые горизонты в фармакологических исследованиях в психиатрической клинике, так как этот нейровизуализационный подход позволяет выделять количественно измеряемые структурно-функциональные мозговые процессы действия препаратов, что может стать ключевым в развитии персонализированной медицины [1, 2].
Влияние лекарственных нейротропных препаратов на основе регуляторных пептидов на функциональные связи (ФС) головного мозга человека ранее не изучалось. В этой связи целью данного исследования была плацебоконтролируемая оценка влияния анксиолитика Селанка и ноотропа Семакса на ФС каждой из выбранных зон интереса (regions of interest, ROIs) с остальными зонами головного мозга здорового человека (ROI-to-voxel functional connectivity analysis). В качестве зон интереса были выбраны миндалина (одна из ключевых зон, участвующих в регуляции тревоги [3]) и дорсолатеральная префронтальная кора (ДЛПФК, ключевая зона для обеспечения функций программирования, регуляции и контроля психической деятельности [4]) в правом и левом полушарии.
Обследовали 52 практически здоровых праворуких испытуемых: 7 мужчин и 7 женщин (группа “Cемакс”; средний возраст 42.6 ± 9.5 года), 9 мужчин и 7 женщин (группа “Cеланк”; средний возраст 38.8 ± 11.9 лет), 10 мужчин и 12 женщин (контрольная группа; средний возраст 43.5 ± ± 9.3 лет). Cтатистически значимых межгрупповых различий по возрасту (F(2.49) = 1.015, p = 0.37) и полу (χ2 = 0.43, р = 0.81) выявлено не было. Исследование соответствовало этическим принципам Хельсинкской декларации Всемирной медицинской ассоциации; все испытуемые подписали добровольное информированное согласие. Испытуемых делили на группы в случайном порядке.
Исследование проводилось на томографе Philips 3Т. На первом этапе с помощью последовательности MPR были получены анатомические T1-изображения: 170 срезов, размер воксела 1 × 1 × 1 мм, TR/TE/FA = 8 мс/4 мс/8°. Функциональные T2*-изображения были получены с помощью последовательности EPI (100 измерений, 35 срезов, матрица 128 × 128 вокселов, размер воксела 1.8 × 1.8 × 4 мм, TR/TE/FA = 3 с/35 мс/90°).
После получения структурных изображений трижды проводили функциональную МРТ (фМРТ): непосредственно перед введением, через 5 и 20 мин после однократного интраназального (по 60 мкл в каждую ноздрю) введения: 1% Cемакса (доза 1.2 мг) или 0.15% Cеланка (доза 0.2 мг), или 0.1% нипагина (контроль). Препараты были безвозмездно предоставлены ЗАО “Пептоген”. Во время каждого подхода фМРТ-сканирования испытуемые фиксировали взгляд на белом кресте в центре серого поля монитора в течение 5 мин и старались избегать систематической мыслительной деятельности (фМРТ покоя).
Предобработку изображений проводили с использованием пакета SPM12 (http://www.fil. ion.ucl.ac.uk/spm/software/spm12/). Дальнейшая обработка данных фМРТ покоя проводилась с помощью CONN-fMRI toolbox 17.b [5]. Проводилась коррекция артефактов движения головы испытуемых (ART-based identification of outlier scans for scrubbing; шумоподавление – aCompCor). Использовали частотный фильтр 0.008 < f < 0.09 Гц. Индивидуальные параметры движения были включены в модель в качестве ковариаты первого уровня; центрированные переменные возраста, пола и поврежднных из-за движения изображений – в качестве ковариат второго уровня.
Затем данные фМРТ покоя обрабатывались методом анализа ФС между каждой зоной интереса и остальными вокселами во всем объёме мозга (ROI-to-voxel analysis). Зонами интереса выступили правая и левая миндалины (из анатомического атласа [6]) и правая и левая ДЛПФК (из функционального атласа, полученного методом анализа функциональных связей в состоянии покоя на 1000 испытуемых [7]).
С помощью общей линейной модели со случайными эффектами были получены групповые карты зон мозга, функционально связанных с каждой из зон интереса. Связи оценивались с помощью коэффициентов корреляции с трансформацией Фишера. Затем, контролируя указанные ковариаты, анализировали, имеются ли различия ФС каждой зоны интереса между тремя группами между тремя временными точками (3 × 3 mixed ANCOVA).
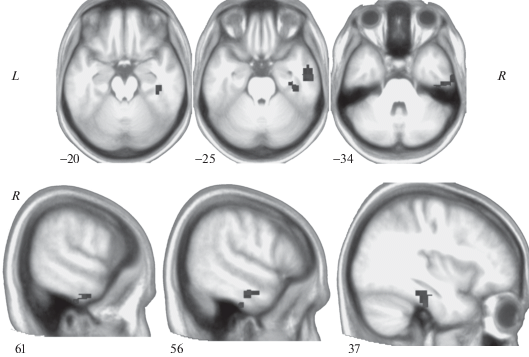
Между тремя группами испытуемых между всеми временными точками были выявлены различия ФС только у правой миндалины с зоной в височной веретеновидной, нижней и средней височных и парагиппокампальной извилинах правого полушария ({48; –22; –32}, объём кластера 9693 мм3) (p < 0.005 на уровне воксела с кластерной поправкой на множественные сравнения FWE, p(FWE-corrected) < 0.05; рис. 1).
Рис. 1.
Кластер в височных отделах правого полушария, ФС которого с правой миндалиной различалась между всеми группами испытуемых между всеми временными точками (p < 0.005 на уровне воксела с кластерной поправкой на множественные сравнения FWE, p(FWE-corrected) < 0.05). Кластер представлен на усредненной и пространственно нормализованной анатомии по данным всех испытуемых (N = 52). Приведено расположение кластера на нескольких срезах головного мозга (срезы указаны номерами).
Затем был проведен post hoc ROI-to-ROI анализ, а именно попарное сравнение ФС правой миндалины и правой височной области между всеми группами и временными точками. У препаратов Селанк и Семакс наблюдались как схожие эффекты на ФС правой миндалины с правой височной областью, так и различные (p(FDR-corrected) < 0.05).
Общим эффектом было увеличение ФС от 5 к 20 мин в каждой из групп при сравнении с контрольной группой (рис. 2). Семакс обладал более выраженным эффектом, чем Селанк, однако это может быть связано с большей дозировкой ноотропа (1.2 мг) по сравнению с анксиолитиком (0.2 мг).
Рис. 2.
Средние значения ФС правой миндалины с височной областью в правом полушарии по разным группам испытуемых до, через 5 и 20 мин после введения препарата. Статистически значимыми различиями (p(FDR-corrected) < 0.05) являются увеличение ФС от 5 к 20 мин в каждой из групп при сравнении с контрольной группой; уменьшение ФС от 0 к 5 мин в группе “Семакс” при сравнении с контрольной группой; увеличение ФС от 0 к 5 мин в группе “Селанк” по сравнению с группой “Семакс”.
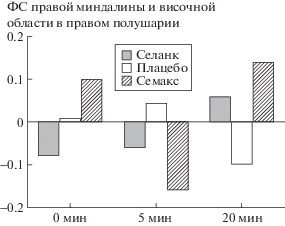
Различные эффекты наблюдались при сравнении точек “0” и “5 мин” (рис. 2): при сравнении с контрольной группой в группе “Семакс” ФС уменьшалась, а в группе “Селанк” – не изменялась. В группе “Селанк” по сравнению с группой “Семакс” ФС увеличивалась от 0 к 5 мин. Данные различия могут косвенно свидетельствовать о различных механизмах действия препаратов.
Интересно, что аналогичный “однополушарный” эффект был недавно обнаружен при интраназальном введении окситоцина больным с посттравматическим стрессовым расстройством. Окситоцин влиял на ФС миндалины и таламуса, хотя и не правого, а левого полушария [8].
Тем не менее как упомянутое выше исследование, так и наша работа показали вовлеченность ключевого элемента лимбической системы – миндалины в механизмы действия тестируемых препаратов.
Отсутствие межгрупповых различий по ФС ДЛПФК может быть связано со сходными нейрональными процессами в этой области при приёме препаратов и плацебо.
Определенные вопросы вызвали значимые различия ФС миндалины и височной области в исходной точке “0” между группами “Селанк” и “Семакс”. Учитывая “слепой” метод включения испытуемых в ту или иную группу, причины подобного явления могут определяться действием каких-либо случайных факторов, ассоциируемых с относительно небольшим размером выборок.
Вместе с тем в настоящей работе анализировались относительные показатели, а именно динамика ФС, что позволяет пока оставить вопрос о типологической значимости величины ФС у здоровых людей вне обсуждения.
В целом в данном исследовании показана возможность применения функциональной коннектомики для изучения действия пептидных препаратов на мозговые процессы. Доказано влияние Селанка и Семакса на нейрональные сети, отличное от эффекта плацебо, и выявлена его топография. Полученные пилотные данные говорят о различиях в механизмах действия пептидов, однако для окончательных выводов требуются дополнительные исследования.
Список литературы
Shin D.J., Jung W.H., He Y., et al. The Effects of Pharmacological Treatment on Functional Brain Connectome in Obsessive-Compulsive Disorder // Biol. Psychiatry. 2014. V. 75. № 8. P. 606–614. https://doi.org/10.1016/j.biopsych.2013.09.002
Dodhia S., Hosanagar A., Fitzgerald D.A., et al. Modulation of Resting-State Amygdala-Frontal Functional Connectivity by Oxytocin in Generalized Social Anxiety Disorder // Neuropsychopharmacology. 2014. V. 39. № 9. P. 2061–2069. https://doi.org/10.1186/s13587-014-0014-5
Tye K.M., Prakash R., Kim S.Y., et al. Amygdala Circuitry Mediating Reversible and Bidirectional Control of Anxiety // Nature. 2011. V. 471. № 7338. P. 358–362. https://doi.org/10.1038/nature09820
Leh S.E., Petrides M., Strafella A.P. The Neural Circuitry of Executive Functions in Ealthy Subjects and Parkinson’s Disease // Neuropsychopharmacology. 2010. V. 35. № 1. P. 70–85. https://doi.org/10.1038/npp.2009.88
Whitfield-Gabrieli S., Nieto-Castanon A. Conn: A Functional Connectivity Toolbox for Correlated and Anticorrelated Brain Networks // Brain connectivity. 2012. V. 2. № 3. P. 125–141. https://doi.org/10.1089/brain.2012.0073
Tzourio-Mazoyer N., Landeau B., Papathanassiou D., et al. Automated Anatomical Labeling of Activations in SPM Using a Macroscopic Anatomical Parcellation of the MNI MRI Single-Subject Brain // Neuroimage. 2002. V. 15. № 1. P. 273–289. https://doi.org/10.1006/nimg.2001.0978
Yeo B.T.T., Krienen F.M., Sepulcre J., et al. The Organization of the Human Cerebral Cortex Estimated by Intrinsic Functional Connectivity // J. Neurophysiology. 2011. V. 106. № 3. P. 1125–1165. https://doi.org/10.1152/jn.00338.2011
Koch S.B., van Zuiden M., Nawijn L., et al. Effects of Intranasal Oxytocin on Distraction as Emotion Regulation Strategy in Patients with Post-Traumatic Stress Disorder // Eur. Neuropsychopharmacology. 2019. V. 29. № 2. P. 266–277. https://doi.org/10.1016/j.euroneuro.2018.12.002
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


