Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 551-557
Природа резистентности структуры фактора свертывания крови XIII к гипохлорит-индуцированному окислению
А. Д. Васильева 1, *, Л. В. Юрина 1, А. Е. Бугрова 1, М. И. Индейкина 1, 3, А. С. Кононихин 2, А. Н. Щеголихин 1, В. С. Иванов 1, член-корреспондент РАН Е. Н. Николаев 4, М. А. Розенфельд 1
1 ФГБУН Институт биохимической физики
им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 ФИЦ ИХФ им. Семенова Российской академии наук, Институт энергетических проблем химической физики
им. В.Л. Тальрозе Российской академии наук
Москва, Россия
3 ФГАОУ ВО “Московский физико-технический институт (государственный университет)”
Москва, Россия
4 АНОО ВПО “Сколковский институт науки
и технологий”
Московская обл., Сколково, Россия
* E-mail: ms.kadaver@mail.ru
Поступила в редакцию 02.06.2020
После доработки 09.06.2020
Принята к публикации 09.06.2020
Аннотация
Изучено повреждение фактора свертывания крови XIII (FXIII) на отдельных этапах его ферментативной активации при действии различных физиологических количеств гипохлорит-иона. Результаты ВЭЖХ-МС/МС, ДСН-ПААГ электрофореза и колориметрии показали, что в процессе превращения профермента FXIII в фермент FXIIIa уязвимость FXIII к окислению гипохлорит-ионами возрастала. FXIII, окисленный 150 мкМ гипохлорита, полностью сохранял свою ферментативную активность, присущую неповрежденному белку, в то время как FXIIIa, окисленный 50 мкМ гипохлорита, демонстрировал резко сниженную ферментативную активность. Показано, что ряд остатков метионина и цистеина на каталитической субъединице наделен антиоксидантной функцией. Регуляторные субъединицы FXIII-B дополнительно способствуют антиоксидантной защите каталитического центра субъединицы FXIII-A, что вместе с плотной упаковкой тетрамерной структуры профермента FXIII, являются тремя факторами, которые обеспечивают высокую устойчивость белка к окислителю.
Фактор свертывания крови XIII (FXIII) играет ключевую роль в поддержании гемостаза благодаря ковалентной стабилизации полимеров фибрина, делая их устойчивыми к лизису плазмином, и сшиванию фибрина с белками фибринолитической системы. Подобно большинству факторов свертывания, FXIII циркулирует в крови как неактивный профермент. FXIII обладает гетеротетрамерной структурой, состоящей из двух каталитических субъединиц A (FXIII-A) и двух регуляторных субъединиц B (FXIII-B), которые удерживаются вместе нековалентными связями [1]. Физиологическая активация профермента FXIII, осуществляемая при последовательном действии тромбина и ионов кальция в присутствии фибрина, обусловливает диссоциацию каталитических и регуляторных субъединиц с экспонированием активного центра в каталитической субъединице и образование активной формы фермента FXIIIa [1].
Хорошо известно, что белки, в том числе белки, циркулирующие в плазме крови, являются основными мишенями для различных окислителей, которые могут изменять структуру белков и их функции. В настоящее время исследования по окислительным модификациям FXIII крайне немногочисленны [2–4]. Ранее было показано, что вызванное озоном окисление FXIII влияет на трансглутаминазную активность FXIIIa, которая в значительной степени зависит от стадии превращения FXIII в FXIIIa, на которой проводилось окисление белка [2]. С помощью масс-спектрометрии высокого разрешения было показано, что набор многочисленных сайтов окисления (включая остатки метионина) в каталитической субъединице, обнаруженных при озонировании FXIII, FXIII, частично активированного только Ca2+, и полностью активированного FXIII (т.е. после обработки белка тромбином и Ca2+) значительно различался [4].
В отличие от озона, гипохлорит, который был выбран в настоящем исследовании, является физиологическим окислителем. Образованный in vivo в результате реакции перекиси водорода и Cl– с помощью фермента миелопероксидазы, высвобождаемой из нейтрофилов при их активации, гипохлорит рассматривается как важный патофизиологический фактор при окислительном стрессе [5]. В настоящем исследовании впервые будут представлены доказательства того, что: 1) профермент FXIII является наименее чувствительной мишенью для гипохлорита по сравнению с его активированной формой; 2) полностью активированный FXIII (FXIIIа) проявляет максимальную уязвимость к действию гипохлорита; 3) часть остатков Met и Сys каталитической субъединицы наделена антиоксидантами свойствами; 4) регуляторные субъединицы способствуют дополнительной антиоксидантной защите каталитического домена.
FXIII выделяли из плазмы крови человека методом фракционного осаждения сульфатом аммония c последующей ионообменной хроматографией на DEAE-ToyoPearl M650. Превращение FXIII в FXIIIа осуществлялось совместным действием тромбина и ионов кальция [2]. Фибриноген был изолирован из плазмы фракционным осаждением глицином. Наличие перекрестно-сшитых цепей в фибрине, катализируемых FXIIIа, анализировалось методом ПААГ-электрофореза в восстанавливающих условиях.
Каждая серия образцов фактора XIII (неактивированный FXIII, FXIII, частично активированный Ca2+, и FXIIIа) обрабатывалась 50 и 150 мкМ HOCl/OCl–, соответственно, при температуре 37°С в течение 1 ч при постоянном перемешивании. Реакцию с HOCl/OCl– останавливали добавлением десятикратного молярного избытка L-метионина. Для избавления от избытка L-метионина образцы затем центрифугировали с использованием центрифужных фильтров Amicon Ultra с размером пор 3 кДа (Millipore, Ирландия).
Трансглутаминазная активность различных образцов FXIIIа оценивалась колориметрический методом, используя коммерческий набор (BioVision K522, USA). Набор для анализа активности BioVision’s Factor XIIIa определяет трансглутаминазную активность FXIIIa путем поперечной сшивки аминсодержащего субстрата с глутамин-содержащим субстратом, что приводит к потере аммиака, который можно количественно измерить колориметрическим анализом при 340 нм согласно инструкции производителя. Для всех образцов FXIIIa измерения трансглутаминазной активности проводили в трех повторах.
Окисляемые сайты выявляли с помощью хромато-масс-спектрометрического анализа (ВЭЖХ-МС/МС), используя хроматограф Agilent 1100 nano-LC (Agilent Technologies Inc., Santa Clara, USA), соединенным с масс спектрометром высокого разрешения 7T LTQ-FT Ultra (Thermo, Bremen, Germany), как было детально описано ранее [4]. Полученные пептиды FXIII были идентифицированы путем поиска в базе данных UniProtKB (UP000005640-9606 HUMAN, Homo sapiens) с использованием программного обеспечения PEAKS Studio (v. 8.5, Bioinformatics Solutions Inc., Waterloo, ON, Canada) с трипсином в качестве фермента и допустимым односторонним неспецифическим расщеплением; точность массы иона-предшественника была установлена равной 15 ч/млн (ppm); точность определения массы МС/МС фрагментов до 0.50 Да. Уровень допустимого ложного обнаружения false discovery rate (FDR) для пептидов был установлен на уровне <0.1%. Максимально допустимое количество модификаций на пептид было равно трем.
Идентификация PEAKS Post-Translational modifications (PEAKS PTM) достигается путем интеграции результатов поиска в базе данных PEAKS Data Base (PEAKS DB) и результатов секвенирования de novo. При поиске в базе данных PEAKS DB в качестве вариабельных может быть указано только ограниченное число часто встречающихся ПТМ. Алгоритм базы данных PEAKS DB используется для идентификации белков. В этом этапе указано несколько очень частых модификаций, чтобы максимизировать чувствительность к окислению: окисление (+15.99); ди- окисление (+31.99); хлорирование тирозина (+33.96) и др. Алгоритм PEAKS PTM используется для определения большего количества PTM. В этом этапе уже идентифицированные белки сопоставляются со спектрами, имеющими высокий показатель достоверности de novo, но не отнесенные к другим белкам при поиске в базе данных. На этом этапе можно расширить список модификаций до 640 известных модификаций базы данных UNIMOD. Точные сайты модификации определяются при наличии сайт-определяющих фрагментов ионов. Определение достоверно модифицированных аминокислот было достигнуто с использованием показателя Ascore – доверительной оценки модификации пептида в конкретной позиции, рассчитанной с помощью программного обеспечения PEAKS, как –10 log вероятности того, что модификация произошла в сообщенной позиции, по сравнению c другими возможными позициями. Те модификации, для которых достоверно не определено положение в аминокислотной последовательности, исключаются из расчета путем установки желаемого порога показателя Ascore. В этой работе использовался порог Ascore> 100.
Степень окисления для каждого типа модификации аминокислотного остатка рассчитывали как сумму площадей МС-пиков пептидов, несущих определенную окислительную модификацию этого аминокислотного остатка, нормированную на общую площадь МС-пиков всех пептидных форм (окисленных и не окисленных), содержащих этот аминокислотный остаток.
Общую степень окисления аминокислотного остатка рассчитывали, как сумму процентов всех типов модификаций для конкретного аминокислотного остатка. Каждый из аминокислотных остатков, окисленных по меньшей мере на 1% (степень модификации >1%), считался модифицированным. Представленные результаты (рис. 3 и 4) являются средними показателями общей степени окисления аминокислотного остатка, полученными при анализе 9 повторностей (3 биологических повторности, каждая из которых была отдельно обработана окислителем и подготовлена к анализу методом ВЭЖХ-МС/МС, трижды проанализированных методом ВЭЖХ-МС/МС), которые для удобства были отнесены к пяти диапазонам уровня окисления, с учетом стандартного отклонения.
Рис. 1.
Электрофоретический анализ гомогенности выделенных белков (а) и способности FXIII к образованию сшитых α-полимеров и γ-димеров (б). (а) Слева направо – маркеры молекулярной массы, выделенные из плазмы крови человека FXIII и фибриноген (Fg). (б) Слева направо – маркеры молекулярной массы, фибриновые цепи, сшитые неокисленными (К) и окисленными (50 или 150 мкМ гипохлорита) образцами FXIII на разных стадиях активации и образец необработанного FXIII фибриногена. Белковые полосы визуализировали окрашиванием Кумасси синим R250.

Рис. 2.
Значения трансглутаминазной активности FXIIIа (Loewy U/mg), образованного из различных образцов FXIII, подвергнутых воздействию 50 мкМ (заштрихованные колонки), 150 мкМ (серые колонки) гипохлорита и не окисленного FXIII (белые колонки). Трансглутаминазная активность выражена как среднее значение ± стандартное отклонение, n = 6.
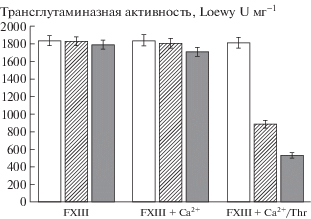
Рис. 3.
Покрытие первичной структуры (левые столбцы) и окислительные модификации каталитической субъединицы FXIII-A различных образцов FXIII, подвергнутых воздействию 50 мкМ (средние колонки) и 150 мкМ гипохлорита (правые колонки). FXIII, FXIII + Са2+ и FXIII + Ca2+/Тhр являются образцами каталитической субъединицы FXIII-A в неактивированном FXIII, FXIII, активированном только Ca2+, и FXIII, активированным совместным действием Ca2+ и тромбина, соответственно.
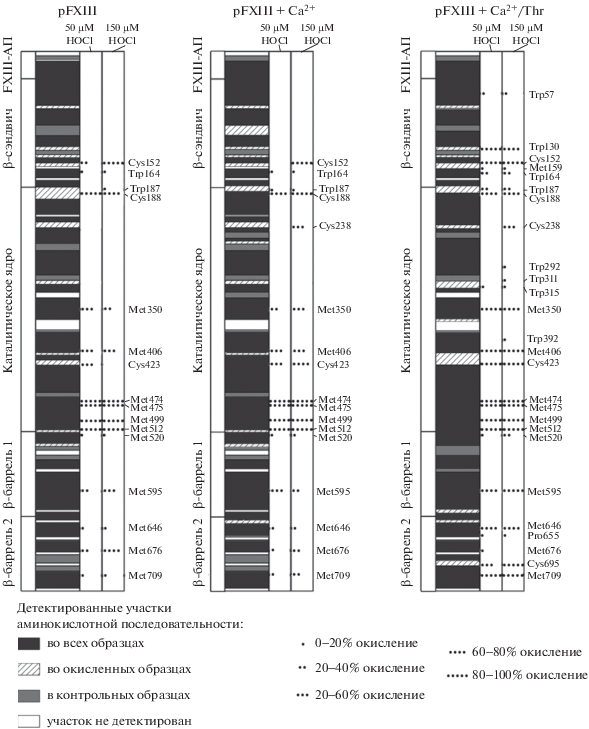
Рис. 4.
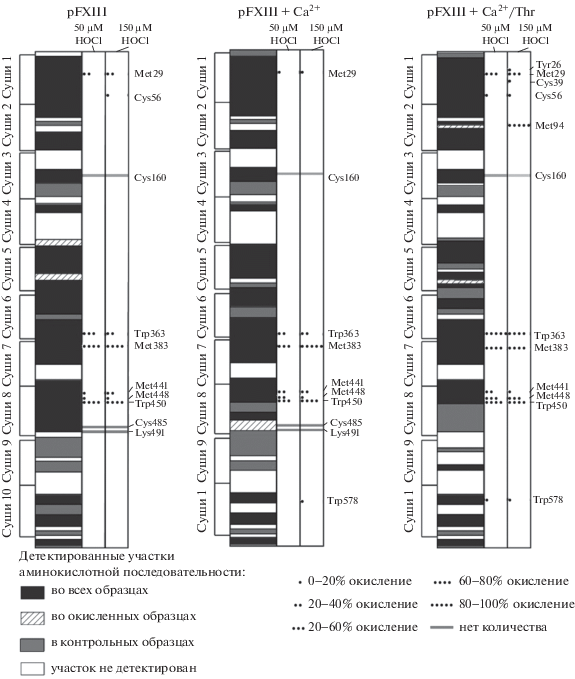
Покрытие первичной структуры (левые столбцы) и окислительные модификации регуляторной субъединицы FXIII-B различных образцов FXIII, подвергнутых воздействию 50 мкМ (средние колонки) и 150 мкМ гипохлорита (правые колонки). (Обозначения те же, как и в подписи к рис. 3).
Как видно из электрофореграмм (рис. 1), в присутствии FXIIIa полипептидные фибриновые цепи подвергаются ковалентному сшиванию с образованием γ–γ-димеров [6] и полидисперсных α–α-полимеров [7]. Окисление нативного FXIII (дорожки 3, 4), также, как и частично активированного Ca2+ образца, не оказывало влияния на последующий процесс ковалентного сшивания фибриновой сети. Это указывает на то, что трансглутаминазная активность окисленного белка практически полностью сохраняется при его инкубации с 50 или 150 мкМ гипохлорита. FXIIIa, обработанный 50 мкМ HOCl/OCl–, показал снижение ферментативной активности, о чем свидетельствуют как умеренное содержание γ–γ-димеров, так и наличие только незначительных количеств α–α-полимеров (дорожка 9). Окисление фермента 150 мкМ гипохлорита привело к кардинальному снижению участия γ полипептидных цепей в сшивании и практически полному отсутствию α–α-полимеров (дорожка 10).
Значения трансглутаминазной активности FXIIIа, измеренные колориметрическим методом для различных образцов, также подтвердили этот вывод (рис. 2). Для FXIIIа, полученного из не окисленного FXIII или FXIII, окисленного 50 мкМ и 150 мкМ гипохлорита, значения трансглутаминазной активности практически не изменялись и составили (1836 ± 55, 1830 ± 49 и 1790 ± ± 51) ед./мг по Loewy с соавт. [8] соответственно. Результаты показали, что значение трансглутаминазной активности FXIIIа, который был образован из FXIII + Са2+ составляло (1841 ± 62) ед./мг, а затем снижалось до (1804 ± 57 и 1710 ± 41) ед./мг при инкубации смеси FXIII + Са2+ с 50 или 150 мкМ гипохлорита. При окислении FXIIIа значения трансглутаминазной активности снизились с (886 ± 43) до (532 ± 31) ед./мг, тогда как в контроле (образец FXIII + Ca2+/тромбин), она была равной (1812 ± 61) ед./мг. Таким образом, можно сделать вывод, что каталитические субъединицы FXIII-A в FXIIIа более уязвимы для окислителя, чем в FXIII.
Масс-спектрометрические данные также свидетельствуют о том, что окислительная восприимчивость молекулы FXIII растет на разных этапах ее активации, причем ферментативная форма FXIIIа наиболее уязвима к окислению (рис. 3, 4). Окисленные аминокислотные остатки были обнаружены во всех структурных областях субъединицы FXIII-A, за исключением N-концевого активационного пептида. Набор окислительных сайтов, выявленных для нативных и окисленных гипохлоритом образцов FXIII, убедительно показывает, что каталитическая субъединица претерпевает значительные химические изменения при индуцированном окислении.
Поскольку в белках Cys и Met являются основными мишенями для гипохлорита [9], эти остатки в каталитической субъединице были доминирующими, подвергшимися модификации. Данные ВЭЖХ-МС/МС показывают, что из 19 остатков Met, присутствующих в первичной структуре белка, 12 остатков были идентифицированы в образцах FXIII и FXIII+ Са2+, 14 остатков в образцах FXIIIа, тогда как только пять остатков метионина, Met136, Met247, Met380, Met679 и Met 731 не были покрыты. Данные масс-спектрометрии показывают, что остатки метионина (Met242, Met350, Met406, Met474, Met475, Met499, Met512, Met520, Met595, Met646, Met676 и Met709) претерпевают модификации, процент окисления которых возрастал не только при увеличении концентрации окислителя, но и в зависимости от степени активации FXIII, на котором производилось окисление. Отражением этого является окислительная уязвимость активированного фермента в сравнении с проферментом.
Превращение метионина в метионин сульфоксид в белках является одной из наиболее часто встречающихся модификаций из-за особой восприимчивости метионина к окислительным условиям. Полагают, что остатки метионина действуют как внутримолекулярные антиоксиданты и защищают другие функционально ключевые аминокислоты от окисления [10]. Поскольку ни один из окисленных аминокислотных остатков, обнаруженных в окисленном проферменте, не является функционально значимым для фермента, вышеуказанные остатки метионина могут выполнять антиоксидантную роль и вместе с остатками Cys152, Cys188, Cys423, Cys152, Cys188 и Cys423 способны защищать каталитический центр белка от окисления.
Регуляторная субъединица FXIII-B также является мишенью для молекул гипохлорита (рис. 4). Как мы полагаем, субъединицы FXIII-B дополнительно способствуют антиоксидантной защите каталитической субъединицы. Хорошо известно, что в нативной конформации FXIII взаимодействия между всеми четырьмя субъединицами обеспечивают образование компактной глобулярной структуры мультимерного белкового комплекса. В результате вход в каталитический центр закрыт для любых веществ, включая малые молекулы [1], таких как HOCl/OCl–. Важно отметить, что, как и каталитическая субъединица, уязвимость регуляторной субъединицы к индуцированному окислению возрастает с активацией FXIII в следующем порядке: нативный FXIII < FXIII + Са2+ < < FXIII + Ca2+/тромбин (рис. 4). Кроме того, то, что на последней стадии активации FXIII в FXIII-B2 возникают новые сайты окисления (Tyr26, Cys39 и Met94), является фактом наличия конформационных изменений в FXIII-B, происходящих при диссоциации FXIII.
Таким образом, плотная упаковка тетрамерной структуры профермента FXIII, антиоксидантные остатки Met и Cys на субъединицах FXIII-A и дополнительная защитная функция субъединиц FXIII-B могут быть основными факторами, которые обеспечивают высокую устойчивость белка к окислителю.
В заключении хотелось бы отметить следующее. В текущем исследовании результаты получены с использованием изолированного фXIII, в то время как в кровотоке фXIII циркулирует вместе с другими белками, существенно превосходящими его по концентрации. Каждый из белков плазмы крови способен перехватывать АФК, экранируя тем самым фXIIIа от молекул окислителей. Было показано [11], что добавление 500 HOCl/OCl– мкМ в плазму крови не изменяло трансглутаминазную активность. Так как профермент, как установлено нами, обладает максимальной устойчивостью к действию гипохлорита, представляется разумным предположить, что белок остается либо не модифицированным, либо слегка окисленным. В последнем случае окислению могут подвергаться только те аминокислотные остатки (например, остатки Met), которые не являются “жизненно важными”.
Однако в месте воспаления локальный уровень HOCl/OCl– может достигать миллимолярных концентраций [12]. В плазме крови фXIII, как известно, за счет регуляторной субъединицы взаимодействует с фибриногеном [1], который, в свою очередь, путем связывания с интегрином альфаMbeta2 (Mac-1), экспрессируемым на активированных лейкоцитах, обеспечивает ключевую связь между тромбозом и воспалением [13]. Следовательно, влияние нейтрофильных окислителей на FXIII, скорее всего, будет локальным. При высоких локальных концентрациях HOCl/OCl– можно ожидать, что трансглутаминазная активность FXIIIa (наиболее уязвимой мишени для окислителей относительно FXIII) будет снижена, что приведет к уменьшению количества α-полимеров в фибриновой сети. Это убедительно показано в нашем текущем исследовании (рис. 1, 2). Поскольку α-полимеры вносят значительный вклад в устойчивость фибрина к гидролизу плазмина [14], их уменьшающееся количество можно рассматривать как компенсаторный механизм, когда из фибриногена, поврежденного окислением, образуется устойчивый к плазмину фибрин с аномальной структурой [15].
Список литературы
Muszbek L., Bereczky Z., Bagoly Z., Komaromi I., Katona E. // Physiol. Rev. 2011. V. 91. № 3. P. 931.
Rosenfeld M.A., Bychkova A.V., Shchegolikhin A.N., Leo-nova V.B., Biryukova M.I., Kostanova E.A. // Biochim. Biophys. Acta 2013. V. 1834. № 12. P. 2470–2479.
Васильева А.Д., Бычкова А.В., Бугрова А.Е., Индейкина М.И., Чикунова А.П., Леонова В.Б., Костано-ва Е.А., Бирюкова М.И., Константинова М.Л., Кононихин А.С., Николаев Е.Н., Розенфельд М.А. // ДАН. 2017. Т. 472. № 4. С. 471–474.
Vasilyeva A., Yurina L., Indeykina M., Bychkova A., Bugrova A., Biryukova M., Kononikhin A., Nikolaev E., Rosenfeld M. // Biochim. Biophys. Acta. 2018. V. 1866. № 8. P. 875–884.
Loria V., Dato I., Graziani F., Biasucci L.M. // Mediat. Inflamm. 2008. V. 271. C.1–4.
Chen R., Doolittle R.F. // Biochemistry 1971. V. 10. № 24. P. 4487–4491.
Sobel J.H., Gawinowicz M.A. // J. Biol. Chem. 1996.V. 271. № 32. P. 19288–19297.
Loewy A.G., Dunathan K., Kriel R., Wolfinger H.L. // J. Biol. Chem. 1961.V. 236. № 10. P. 2625–2633.
Hawkins C.L., Pattison, D.I., Davies M.J. // Amino Acids 2003. V. 25. № 3–4. P. 259–274.
Lim J., Kim G. Levine R. // Neurochem. Res. 2019. V. 44. № 1. P. 247–257.
Misztal T., Golaszewska A., Tomasiak-Lozowska M.M., Iwanicka M., Marcinczyk N., Leszczynska A., Chabielska E., Rusak T. // Free Radic. Biol. Med. 2019. V. 141. P. 426–437.
Stief T.W., Kurz J., Doss M.O., Fareed J. // Thromb. Res. 2000. V. 97. P. 473–480.
Lishko V.K., Podolnikova N.P., Yakubenko V.P., Yakov-lev S., Medved L., Yadav S.P., Ugarova T.P. // J. Biol. Chem. V. 279. P. 44897–44906. 2004.
Rijken D.C., Uitte de Willige S. // Biomed. Res. Int. 2017:1209676.
Martinez M., Weisel J.W., Ischiropoulos H. // Free Radic. Biol. Med. 2013. V. 65. P. 411–418.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


