Доклады Российской академии наук. Науки о жизни, 2021, T. 498, № 1, стр. 249-253
РЕКОМБИНАНТНЫЙ ФРАГМЕНТ ЭКСТРАЦЕЛЛЮЛЯРНОГО ДОМЕНА ДЕСМОГЛЕИНА 3 ЧЕЛОВЕКА, СЛИТЫЙ С Fc-ФРАГМЕНТОМ IgG1 ЧЕЛОВЕКА, СЕЛЕКТИВНО СОРБИРУЕТ АУТОРЕАКТИВНЫЕ АНТИТЕЛА ИЗ СЫВОРОТОК БОЛЬНЫХ ПУЗЫРЧАТКОЙ
Е. Н. Ларина 1, *, В. С. Карасев 1, М. В. Шпилевая 1, Т. К. Алиев 1, О. П. Бочкова 2, А. Э. Карамова 3, Д. С. Балабашин 1, Д. Г. Дерябин 3, Т. В. Бобик 1, И. В. Смирнов 1, член-корреспондент РАН А. А. Кубанов 3, С. М. Староверов 2, академик РАН А. Г. Габибов 1, академик РАН М. П. Кирпичников 1, 4
1 Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
2 АО “БиоХимМак СТ”
Москва, Россия
3 Государственный научный центр дерматовенерологии и косметологии Министерства здравоохранения Российской Федерации
Москва, Россия
4 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: Ekaterina.iljina.7@yandex.ru
Поступила в редакцию 30.11.2020
После доработки 28.02.2021
Принята к публикации 28.02.2021
Аннотация
С использованием в качестве аффинного лиганда рекомбинантного второго фрагмента экстрацеллюлярного домена (ЕС2) десмоглеина 3-го типа (Dsg3) человека был получен иммуносорбент, селективно связывающий аутореактивные антитела к указанному домену из иммунных сывороток больных пузырчаткой. Белок ЕС2 был получен в виде гибридного белка с Fc-фрагментом IgG1 человека, наработка осуществлялась методом транзиентной экспрессии в клетках CHO.
Пузырчатка является аутоиммунным буллезным дерматозом, который характеризуется тяжелым и прогрессирующим течением, высокой инвалидизацией и потенциальной летальностью. Болезнь развивается в связи с образованием в организме и дальнейшим взаимодействием аутореактивных антител (АТ) класса IgG с экстрацеллюлярным доменом Dsg3, что приводит к разрушению десмосом и потере межклеточной адгезии, т.е. к акантолизу [1].
В составе молекулы Dsg3 человека выделяют внутриклеточный, трансмембранный и экстрацеллюлярный домены. Антигенные сайты, с которыми и происходит взаимодействие аутореактивных АТ, располагаются в экстрацеллюлярном домене, состоящем из 5 фрагментов (EC1, EC2, EC3, EC4, EC5) [2]. Наиболее иммуногенными, т.е. против которых выделяется преимущественное количество патогенных аутореактивных АТ у больных, считаются фрагменты, располагающиеся на N-конце Dsg3, где образуются Ca2+-зависимые конформационные эпитопы [3].
Целью данной работы являлось получение рекомбинантного белка EC2-Fc Dsg3 человека, химическая иммобилизация его на носителе и анализ способности такого иммуносорбента селективно извлекать из сывороток пациентов с пузырчаткой специфические аутореактивные АТ.
С помощью полимеразно-цепной реакции (ПЦР) был амплифицирован фрагмент ДНК, кодирующий ЕС2-домен Dsg3 человека 159–268 а.о. в соответствии с P32926 базы последовательностей белков UniProt), а также получена нуклеотидная последовательность, соответствующая шарнирному участку и CH2-CH3 доменам IgG1 человека. Далее методом SOE-ПЦР данные фрагменты были объединены, при этом конечная экспрессионная кассета содержала последовательность Козак (CTCAAA), нативные лидерный (MMGLFPRTTGALAIFVVVILVHG) и прелидерный (ELRIETKGQYDEEEMTMQQAKRRQKR) пептиды Dsg3 человека. Наработку белка EC2-Fc проводили в клетках CHO методом транзиентной экспрессии, для чего была использована плазмида pcDNA3.4 (Invitrogen, США), в которую клонировали экспрессионную кассету по сайтам рестрикции NheI/XhoI. Очистку EC2-Fc из среды культивирования осуществляли методом аффинной хроматографии на протеин А-сефарозе. Аналитическая гель-фильтрационная хроматография была выполнена на колонке Superdex 200-10/300-GL (GE Healthcare, США). После проведения электрофореза в ПААГ-SDS белок EC2-Fc был выявлен как основная полоса, мигрирующая в соответствии с ожидаемой молекулярной массой 78 кДа. Продуктивность используемой транзиентной системы экспрессии составила до 110 мг/л среды культивирования.
Подобным образом также были получены гибридные белки EC1-Fc и EC4-Fc, содержащие фрагменты EC1 и EC4 экстрацеллюлярного домена Dsg3 соответственно.
Выделенный целевой белок с подтвержденной методом LC-MS/MS (анализ выполнен на приборе Orbitrap Tribrid Lumos, Thermo, США) аминокислотной последовательностью иммобилизовали на полимерном активированном носителе. В качестве носителя использовали макропористую, активированную бромгидриновыми -О-СН2СН(ОН)-СН2Вr группами матрицу WorkBeads 40/10000ACT (Bio-Works, Швеция).
Для оптимизации процесса иммобилизации использовали человеческий IgG. Разработан метод количественного связывания IgG (до 60 мг белка/мл носителя). Химическое связывание иммуноглобулина происходит в течение 1 ч в 0.5 М натрий-фосфатном буферном растворе при рН 8.5 при комнатной температуре. Иммобилизация через бромгидриновые группы при рН 8.5 приводит к прочной ковалентной связи с первичными аминогруппами без образования заряженных групп на поверхности. Остаточные активные группы носителя нейтрализовали обработкой 1 М раствором моноэтаноламина при рН 9.5 в течение 1 ч при комнатной температуре.
Рекомбинантный аффинный лиганд EC2-Fc иммобилизовали с концентрацией 5, 10, 15 и 28 мг/мл носителя. Такие концентрации выбраны исходя из возможности исследования свободного связывания и проявления потенциальных стерических препятствий в порах носителя при образовании сорбционного комплекса “ЕС2-Fc – АТ”.
Процесс сорбции антител к ЕС2-фрагменту Dsg3 был изучен на примере сыворотки больного вульгарной пузырчаткой. Для проведения сорбции в статических условиях использовали сорбенты в объеме 50 мкл, содержащие 5, 10, 15 и 28 мг лиганда ЕС2-Fc/мл носителя. Процесс иммуносорбции на колонке с рекомбинантным белком ЕС2-Fc в качестве лиганда оценивали методом двухэтапного конкурентного иммуноферментного анализа [4]. Активность аутоантител к полноразмерному экстрацеллюлярному домену Dsg3 человека оценивали в тест-системе “Anti-Dsg3 ELISA (IgG)” (Euroimmun, Германия). Взаимодействие АТ с отдельными фрагментами в виде EC1-Fc, ЕС2-Fc, EC4-Fc и отрицательным контролем для оценки неспецифической сорбции, БСА, определяли в иммунологических планшетах (Greiner-bio, Германия) с иммобилизованными соответствующими рекомбинантными белками в концентрации 10 мкг/мл.
Образцы сыворотки до и после взаимодействия с сорбентом в разведении 1:100 преинкубировали в течение 3 ч в лунках с сорбированными полноразмерным экстрацеллюлярным доменом Dsg3 человека, отдельными фрагментами экстрацеллюлярного домена Dsg3 человека, слитыми с Fc-доменом и БСА. Реакцию сыворотки с каждым фрагментом рассчитывали в соответствии с формулой (%):
Активность аутореактивных АТ сыворотки к полноразмерному экстрацеллюлярному домену Dsg3 человека, выраженная в условных единицах (RU), составила 310–320 RU/мл; активность к ЕС2 – 140 RU/мл.
Определение статической емкости проводили путем внесения в колонку, объем которой составлял 50 мкл, сыворотки больного пузырчаткой с известным содержанием антител к ЕС2-фрагменту Dsg3 человека. Объем сыворотки был кратным 1, 3, 4, 5 и 6 объемам колонки и содержал 7–42 RU аутореактивных АТ, специфично взаимодействующих с ЕС2-Fc, иммобилизованным на носителе.
После добавления сыворотки суспензию перемешивали на шейкере в течение 1 ч, затем декантировали равновесный раствор и определяли содержание в нем несвязавшихся антител к полноразмерному экстрацеллюлярному домену Dsg3 человека и к эпитопу ЕС2. Количество сорбированных АТ определяли по разнице их значений в растворах до и после сорбции. На основании полученных данных строили графики насыщения аффинных сорбентов в зависимости от соотношения матрица/лиганд и количества аутоантител к ЕС2.
Динамическую емкость адсорбции AT к ЕС2-Fc и возможность регенерации определяли на сорбенте с содержанием привитого ЕС2-Fc-лиганда в количестве 15 мг/мл носителя. Объем сорбента в колонке составлял 200 мкл. За один цикл сорбции через колонку пропускали 1 мл сыворотки, что соответствует пяти объемам колонки, при скорости потока 50 см/ч. После каждого цикла аффинного связывания колонку регенерировали 0.1 М раствором глицина с 5 мМ CaCl2 и уравновешивали ФСБ буфером, затем пропускали через колонку новую порцию сыворотки. Всего было проведено три цикла аффинного связывания/регенерации, при этом в проскоке после каждого цикла определяли содержание несвязавшихся аутоантител к полноразмерному экстрацеллюлярному домену Dsg3 человека и к фрагментам ЕС1, ЕС2, ЕС4. На основании полученных данных были построены иммунные профили сыворотки до и после взаимодействия с сорбентом.
Исследование стабильности состава плазмы крови при контакте с полученным аффинным сорбентом проводили в соответствии со статьей [5] путем сравнения ряда показателей (прозрачность, цветность, рН, белок, фракционный состав, активность фактора VIII) до и после пропускания плазмы через колонку (5 объемов колонки при скорости 50 cм/ч).
Таким образом, в результате определения статической емкости было показано следующее: при проведении сорбции с использованием возрастающей нагрузки на сорбенты установлено, что с повышением концентрации привитого лиганда EC2-Fc от 5 до 15 мг/мл матрицы количество сорбируемых специфических аутореактивных АТ возрастает от 280 RU/мл сорбента до 530 RU/мл сорбента (рис. 1).
Рис. 1.
Аффинное связывание на сорбентах с различным содержанием лиганда (5 мг/мл кривая точек; 10 мг/мл пунктирная кривая; 15 мг/мл кривая точка-пунктир).
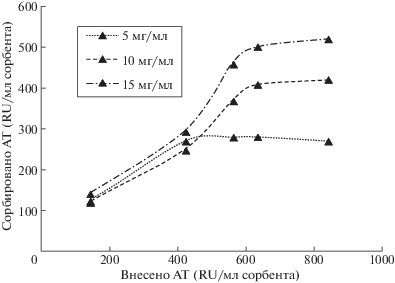
Сорбент с содержанием 15 мг EC2-Fc/мл носителя связывает около 80% всех добавленных АТ, тогда как сорбенты с концентрацией закрепленного ЕС2-Fc 5 мг/мл и 10 мг/мл сорбируют лишь 70% добавленных АТ. Если оценить величину связывания в расчете на 1 мг привитого лиганда EC2-Fc, то можно видеть, что при снижении количества закрепленных лигандов эффективность связывания возрастает. Для сорбента с концентрацией 15 мг EC2-Fc/мл эта величина составляет 30–35 RU АТ/мг привитого лиганда, а для сорбента 5 мг EC2-Fc/мл увеличивается до 55 RU АТ/мг привитого лиганда. Полученный результат свидетельствует о том, что в диапазоне исследованных концентраций, вероятно, начинают проявляться стерические препятствия при аффинном связывании АТ, обусловленные значительными размерами как лиганда, так и сорбируемых иммуноглобулиновых молекул. Тем не менее анализ полученных данных показал, что возможности увеличения емкости далеко не исчерпаны. Для исследования закономерностей роста емкости с возрастанием поверхностной концентрации привитого аффинного лиганда нами был получен сорбент с концентрацией закрепленных групп EC2-Fc 28 мг/мл носителя, что на наш взгляд близко к предельным возможным значениям эффективной работы иммобилизованных ЕС2-Fc лигандов.
Действительно, эта величина составляет 50% от максимально возможной концентрации привитого иммуноглобулина, полученной нами на этом сорбенте, и должна быть близка к максимально возможной концентрации аффинного комплекса “лиганд-антитело” с учетом его размера. Нами установлено, что такой сорбент количественно связывает добавленные АТ из объема сыворотки, в 7 раз превышающей объем сорбента, тогда как сорбент, содержащий 15 мг EC2-Fc/мл сорбента, способен связать не более 80% антител из 5-6 объемов добавленной сыворотки, т.е. сорбционная емкость увеличивается с возрастанием количества закрепленных лигандов, но не пропорционально увеличению их количества.
В процессе определения динамической емкости было установлено, что после первого и второго циклов сорбции остаточная активность сыворотки по отношению к ЕС2 в элюате составила около 50% от исходного содержания, после третьего около 40% (табл. 1). Соответственно после каждого цикла с колонкой связывается 40–50% АТ к ЕС2, что соответствует динамической сорбционной емкости на уровне 300–400 RU АТ/мл сорбента.
Таблица 1.
Показатели динамической сорбции колонки объемом 200 мкл с лигандом ЕС2-Fc с концентрацией 15 мг/мл в отношении аутореактивных АТ к ЕС2 домену в течение трех циклов сорбции/регенерации сыворотки больного пузырчаткой (активность исходной сыворотки 140 RU/мл)
| 1-й цикл сорбции | 2-й цикл сорбции | 3-й цикл сорбции | |
|---|---|---|---|
| Активность сыворотки в элюате (RU/мл) | 63 | 70 | 85 |
| Количество связанных с колонкой антител (RU/мл) | 77 | 70 | 55 |
| Динамическая емкость колонки (RU/мл) | 385 | 350 | 275 |
Селективность взаимодействия оценивали до и после цикла аффинного связывания при динамической сорбции по изменению эпитопного профиля сыворотки (табл. 2).
Таблица 2.
Эпитопные профили сыворотки до и после аффинного связывания на сорбенте с привитым лигандом EC2-Fc с концентрацией 15 мг/мл
| Dsg3-full-Fc | EC1-Fc | EC2-Fc | EC4-Fc | |
|---|---|---|---|---|
| До взаимодействия с сорбентом | 320 | 60 | 140 | 71 |
| После взаимодействия с сорбентом | 249 | 47 | 75 | 58 |
| Относительное изменение содержания АТ к разным эпитопам, % | 22 | 21.6 | 46 | 18 |
Из табл. 2 видно, что содержание АТ к EC1-Fс и EC4-Fс, а также полноразмерному экстрацеллюлярному домену Dsg3 человека уменьшилось на 18–22%, тогда как концентрация АТ к EC2-Fc снизилась на 46%. Полученные значения демонстрируют высокую селективность сорбента, а по величине сорбции соответствуют результатам динамического связывания АТ. Примерно одинаковое относительное снижение антител к EC1-Fс, EC4-Fс и полноразмерному экстрацеллюлярному домену Dsg3 указывает на дополнительный механизм неселективного связывания с аффинным сорбентом.
Анализ характеристик плазмы крови после пропускания ее через сорбент показал, что для ряда изученных параметров заметных изменений не происходит, что свидетельствует об инертности сорбента к плазме крови.
В результате проделанной работы впервые был получен иммуносорбент на основе рекомбинантного отдельного фрагмента EC2 экстрацеллюлярного домена Dsg3 человека, способного селективно связывать аутореактивные АТ к указанному домену. Сорбент инертен по отношению к компонентам плазмы крови. Высокая емкость сорбента и эффективность связывания в динамическом режиме позволяют надеяться на получение эффективных сорбентов для гемосорбции.
Список литературы
Koga H., Tsuruta D., Ohyama B., Ishii N., Hamada T., Ohata Ch., Furumura M., Hashimoto T. // Expert Opinion on Therapeutic Targets. 2013. V. 3. P. 293–306.
Wan H. // Choi S. Encyclopedia of Signaling Molecules. Springer, Cham. 2016. https://doi.org/10.1007/978-1-4614-6438-9_101583-1
Futei Y., Amagai M., Sekiguchi M., Nishifuji K., Fujii Y., Nishikawa T. // Journal of Investigative Dermatology. 2000. V. 115. P. 829–834.
Sekiguchi M., Futei Y., Fujii Y., Iwasaki T., Nishikawa T., Amagai M. // Journal of Immunology. 2001. V. 167. P. 5439–5448.
Государственная Фармакопея Российской Федерации // ФС.3.3.2.0001.15 “Плазма человека для фракционирования. Москва 2018. XIV издание, том IV.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


