Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 407-413
ДРЕВНЕЙШИЕ ЭУКАРИОТЫ ЛАХАНДИНСКОЙ БИОТЫ (МЕЗОПРОТЕРОЗОЙ, ЮГО-ВОСТОЧНАЯ СИБИРЬ) – МОРФОЛОГИЧЕСКИЕ И БИОГЕОХИМИЧЕСКИЕ ДАННЫЕ
Ю. В. Шувалова 1, 2, *, К. Е. Наговицин 3, 4, Я.-П. Дуда 5, П. Ю. Пархаев 1
1 Палеонтологический институт
им. А.А. Борисяка РАН
Москва, Россия
2 Технологический университет Суинберна
Хоторн, Австралия
3 Институт нефтегазовой геологии и геофизики
им. А.А. Трофимука СО РАН
Новосибирск, Россия
4 Новосибирский государственный университет
Новосибирск, Россия
5 Университет Тюбингена
Тюбинген, Германия
* E-mail: pinmuse@gmail.com
Поступила в редакцию 11.05.2021
После доработки 31.05.2021
Принята к публикации 31.05.2021
Аннотация
Мезопротерозойская лахандинская серия (~1030 млн лет) содержит богатейшую доэдиакарскую биоту, из которой описаны более 20 видов эукариот, но степень достоверности их принадлежности к ядерным организмам различна. Семь из этих таксонов можно уверенно отнести к эукариотам, используя современные критерии определения эукариотических организмов в ископаемой летописи. К ним относятся ранее описанные Valeria lophostriata, Trachyhystrichosphaera aimika, Aimonema ramosa, Palaeovaucheria clavata, Caudosphaera expansa, Germinosphaera bispinosa и Jacutianema solubila. Выявлена новая спорангиеподобная ископаемая форма, близкая к возможным высшим грибам рода Ourasphaira, известного из (?) мезо- и неопротерозойских отложений Арктической Канады. Эукариотическая природа восьми вышеперечисленных ископаемых не вызывает сомнений в связи со сложностью их морфологии и крупными размерами. В то же время проведенный анализ органического вещества пород лахандинской серии показывает полное отсутствие в них стеранов – диагностических биомаркеров эукариот. Полученные результаты подтверждают гипотезу о подчиненной роли эукариот в функционировании морских экосистем мезопротерозоя. Исследование акцентирует внимание на ограничениях в использовании биомаркеров для интерпретации систематического положения ископаемых остатков из отложений, подвергшихся термическому воздействию.
ВВЕДЕНИЕ
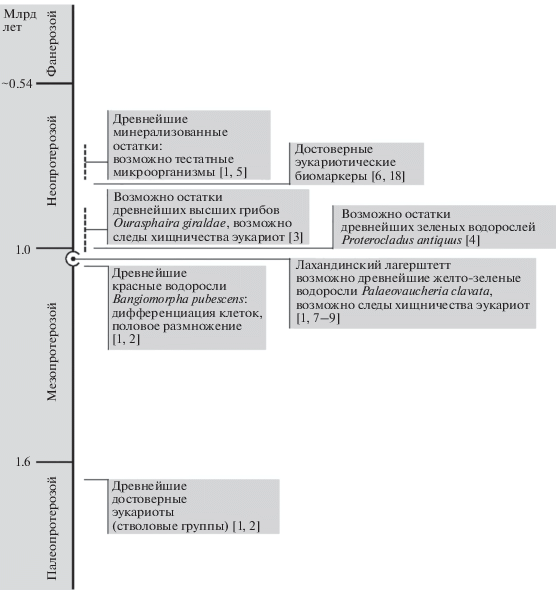
Радиация древнейших эукариот является одним из важнейших этапов в эволюции биосферы Земли. Для исследования особенностей этого эволюционного события мезопротерозойская эра (1600–1000 млн лет) представляет особый интерес. Первые достоверные эукариотические организмы появились на границе палео- и мезопротерозоя (~1600 млн лет) – они известны из отложений Австралии, Китая и Индии [1, 2] и представлены остатками, вероятно, стволовых линий эукариот, в подавляющем большинстве объединяющими в себе признаки различных филогенетически удаленных групп, а порой не имеющими аналогов среди современных организмов. К концу мезопротерозоя – началу неопротерозоя (~1000 млн лет) среди эукариот появляются формы, которые можно уверено относить к кроновым ветвям филогенетического дерева домена (рис. 1). К их числу принадлежат красные водоросли Bangiomorpha pubescens Butterfield, 2000 (Rhodophyceae), зеленые водоросли Proterocladus antiquus Tang et al., 2020 (Chloroplastida), а также грибы Ourasphaira giraldae Loron et al., 2019 (Nucletmycea) [1–4]. Отложения средней части неопротерозоя богаты остатками систематически разнообразных эукариот, включая первые формы с минеральным скелетом [1, 5].
Несмотря на постоянно пополняющийся архив ископаемой летописи эукариот, филогенетические взаимоотношения их древнейших представителей остаются неясными. Также сейчас довольно сложно оценить роль эукариотических организмов в мезопротерозойской биосфере. Основными препятствиями, с которыми приходится сталкиваться на пути решения этих вопросов, являются ограниченное число находок, сравнительно простая морфология организмов, а также плохая сохранность морфологически выраженных ископаемых остатков (эуфоссилий). В современной палеонтологии при реконструкции филогенетических и палеоэкологических взаимоотношений древнейших организмов наряду с классическими морфологическими методами в качестве важного источника информации используются данные анализа хемофоссилий (биомаркеров), которые представляют собой остатки органических молекул, входивших в состав клеток живых организмов [6]. Биомаркеры образуются из всех организмов и могут существенно дополнять информацию о структуре и функционировании древних экосистем. Однако у данного вида исследований существуют ограничения – как и эуфоссилии, биомаркеры могут подвергаться необратимым преобразованиям, таким как биодеградация и термическое разрушение в процессе захоронения, что приводит к утрате молекулярных диагностических признаков [6].
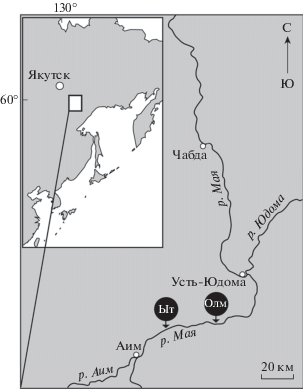
Лахандинская серия возрастом ~1030 млн лет содержит одну из самых богатых доэдиакарских биот, представленную органостенными остатками микроорганизмов, прекрасно сохранившимися в морских глинистых породах. Самое богатое ископаемыми лахандинское местонахождение располагается в среднем течении р. Маи Учуро-Майского района юго-восточной Сибири (рис. 2). За более чем полувековую историю изучения ископаемых из лаханды описаны почти четыре десятка морфологически и экологически разнообразных таксонов, из которых более половины с различной степенью достоверности отнесены к ядерным организмам [7, 8]. Некоторые из этих таксонов могут принадлежать к кроновым ветвям филогенетического дерева группы. Кроме того, анализ перфораций оболочек лахандинских эукариот выявил следы возможной избирательной эукариофагии [9]. По мнению некоторых исследователей, хищничество одних эукариот на других ядерных организмах было одним из главных факторов, приведших к диверсификации ранних эукариот [3]. Таким образом, лахандинская биота исключительно важна для понимания эволюции древнейших организмов.
Рис. 2.
Расположение изученных разрезов: Ыт – разрез Ытырында, GPS-координаты (WGS84) 58.907510 с.ш., 134.518742 в.д.; Олм – разрез Олемекен; GPS-координаты (WGS84) 58.931815 с.ш., 134.958032 в.д.
Ниже обсуждаются находки лахандинских эуфоссилий, наиболее значимые с точки зрения диагностических признаков, позволяющих относить эти формы к домену эукариот. Также приводится краткая информация по биогеохимии вмещающих пород лахандинской серии (детальные результаты этих исследований публикуются отдельно).
МОРФОЛОГИЯ ЭУКАРИОТ ЛАХАНДИНСКОЙ БИОТЫ
В настоящее время не существует единого подхода в определении эукариот из отложений протерозоя, хотя определенные успехи в разработке различных методик уже достигнуты. Наиболее надежной из них считается выявление диагностических признаков – синапоморфий, позволяющих относить ископаемые формы к кроновым ветвям филогенетического дерева путем сравнения морфологии эуфоссилий с морфологией современных организмов [1, 10]. Такой подход применим к относительно сложно устроенным крупным формам.
В составе лахандинской биоты следует выделить таксоны, традиционно признаваемые эукариотическими в связи с их характерной морфологией: Palaeovaucheria clavata Hermann, 1981, Aimonema ramosa Hermann et Podkovyrov, 2010, Valeria lophostriata (Jankauskas, 1979) Jankauskas, 1982, Trachyhystrichosphaera aimika Hermann, 1976, Caudosphaera expansa Hermann et Timofeev, 1989, Germinosphaera bispinosa Mikhailova, 1986, и Jacutianema solubila Timofeev et Hermann, 1979, [7, 8], краткий анализ морфологии которых будет приведен ниже.
Сочетание признаков P. clavata, включающее редкое ветвление таллома (диаметр 18–50 мкм), нерегулярно расположенные поперечные септы (в основном приуроченные к булавовидно закругленным окончаниям нитей), круглые отверстия, встречающиеся на концах булавовидных окончаний и расположенные вдоль оси боковые вздутия, характеризует вегетативную фазу современных желто-зеленых водорослей рода Vaucheria (Stramenopila) (рис. 3а, 3б). По аналогии с вошерией, булавовидные окончания у Palaeovaucheria, отделенные от основной нити септой, интерпретировались как зооспорангии, терминальные отверстия – как структуры, через которые высвобождались зооспоры, а боковые вздутия, разделенные септой, – как органы полового размножения – антеридии и оогонии [7]. Таким образом, P. clavata оказалась самым древним представителем автотрофных страменопил.
Рис. 3.
Эукариоты лахандинской биоты: а, б – нитчатые ценоцитные остатки Palaeovaucheria clavata: а – экз. ИГГД РАН, № 28/4, боковые вздутия, разделенные септой (предполагаемые антеридий и оогоний) на редко ветвящемся талломе, б – экз. ИГГД РАН, № 27/25, круглое отверстие на конце утолщенного окончания нити (предполагаемый зоо-спорангий), в – сетчатый анастомозный бесклеточный таллом Aimonema ramosa, голотип ИГГД РАН, № 7/5-III.08; г, д – орнаментированные Valeria lophospriata, экз. ЦКП “Геохрон” ИНГГ СО РАН, № 396-14: г – общий вид, д – увеличенный участок оболочки со стриатной структурой; е, ж – акантоморфные Trachyhystrichosphaera aimika, экз. ЦКП “Геохрон” ИНГГ СО РАН, № МН-8-2-1: е – общий вид, ж – увеличенный участок оболочки с выростами; з, и – спорангиеподобные эукариоты Caudosphaera expansa Hermann et Timofeev, 1989: з – голотип ИГГД РАН, №26/7-IV.69, и – экз. ПИН РАН, № 5805/3001; к, л – неописанная форма: к – экз. ЦКП “Геохрон” ИНГГ СО РАН, № 395-9, л – экз. ЦКП “Геохрон” ИНГГ СО РАН, № 395-10; м, н – формы, напоминающие прорастающие споры эукариот Jacutianema solubila: м – экз. ПИН РАН, № 5805/3002, н – экз. ПИН РАН, № 5805/3003; юго-восточная Сибирь, Учуро-Майский район, р. Мая, лахандинская серия: кумахинская свита, разрез Ытырында (а–и, м, н), нельканская свита, разрез Олемекен (к, л).
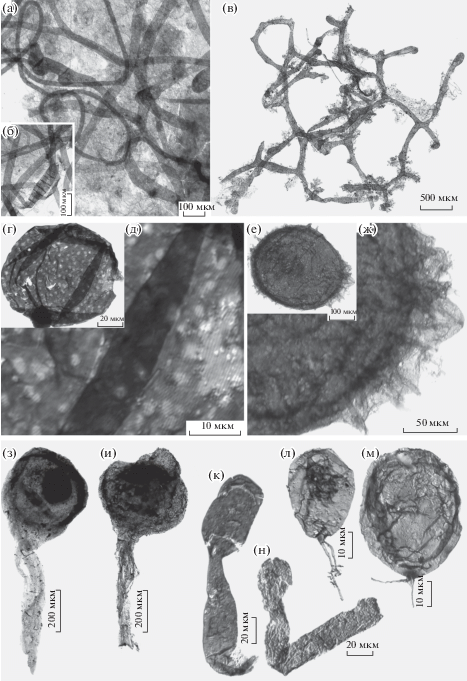
В то же время отсутствие полного экземпляра палеовошерии оставляет пространство для спекуляций. Например, сетчатый таллом A. ramosa, образованный анастомозирующими нитями, принимается некоторыми исследователями за более полную форму сохранности P. clavata [1]. Действительно, некоторые морфологические признаки аимонемы отмечаются и у палеовошерии. Это относится к ветвящемуся таллому и нерегулярной ширине нитей (30–50 мкм), иногда имеющих булавовидные очертания (рис. 3в). Однако таллому аимонемы свойственно анастомозное ветвление, не известное у желто-зеленых водорослей, но встречающееся у филогенетически удаленной группы хищных нематофаговых грибов [8]. Кроме того, в отличие от палеовошерии, таллом аимонемы полностью лишен перегородок, а на окончаниях нитей таллома не встречаются отверстия. Учитывая перечисленные различия, отождествление этих ископаемых таксонов представляется необоснованным. Но подчеркнем, что эукариотная природа палеовошерии и аимонемы сомнений не вызывает, поскольку хотя среди прокариот и встречаются формы, образующие ценоцитный ветвящийся мицелий, диаметр их нитей не превышает двух микрометров [11].
Пример палеовошерии относится к разряду редчайших. Большинство же протерозойских ископаемых остатков лишены диагностических признаков, позволяющих ассоциировать их с конкретными современными организмами. Это может быть связано либо с первичным отсутствием у них каких-либо синапоморфий, либо с их утратой в процессе фоссилизации. Поэтому для подавляющего большинства протерозойских эуфоссилий возможна интерпретация лишь до домена. Для этого достаточно выявить определенные конструктивные детали морфологии или их комбинации, возможные только при эффективной локализации основных внутриклеточных процессов (компартментализация внутриклеточного пространства), свойственной эукариотам и не встречающейся у прокариот. К таким деталям строения, например, можно отнести характер орнаментации клеточной стенки и наличие выростов, которые в сочетании с крупными размерами данных элементов не встречаются у прокариот.
Так, к эукариотам следует относить лахандинских стриатных акритарх Valeria lophostriata, акантоморфных акритарх Trachyhystrichosphaera aimika, спорангиоподобные структуры Caudosphaera expansa и новую еще неописанную форму, а также сферические и цилиндрические оболочки с единичными отростками ценоцитного уровня организации, напоминающие прорастающие споры низших грибов, страменопил и зеленых водорослей – Germinosphaera bispinosa и Jacutianema solubila.
Концентрически ребристые сферические оболочки V. lophostriata диаметром более 60 мкм относятся к эукариотам на основании крупных размеров элементов скульптуры – ребра имеют ширину около 1 мкм (рис. 3г, 3д), в то время как у прокариот аналогичные структуры не выходят из нанометрового класса. Значительно более крупные оболочки T. aimika (диаметр > 200 мкм) покрыты полыми нерегулярно расположенными выростами диаметром ~5 мкм и длиной более 40 мкм (рис. 3е, 3ж). Несмотря на то что среди бактерий, живущих в насыщенных питательными веществами условиях, встречаются клетки сравнимого размера, они не орнаментированы, как и макроскопические колониальные оболочки цианобактериальных водорослей. Следует отметить, что некоторые спорангиеподобные структуры бактерий могут быть снабжены выростами, но их диаметр не выходит из нанометрового диапазона [10]. Большая часть акритарх обычно относится к одноклеточным протистам, по-видимому, растительного происхождения, хотя встречаются формы, демонстрирующие морфологию, характерную для зооспоровых грибов. К сожалению, за недостатком диагностических признаков, определение их систематического положения внутри домена эукариот в значительной мере спекулятивно.
Отдельную группу в лахандинской биоте образуют гладкие сферические оболочки с одиночным отростком. Среди этих форм выделяются С. expansa – это сферы диаметром более 200 мкм, снабженные хвостообразным отростком, состоящим из более тонких нитей около 1 мкм толщиной (рис. 3з, 3и), и еще неописанная форма, представленная субсферическими оболочками диаметром более 30 мкм, прикрепленными через короткую ножку к нитям диаметром около 1 мкм (рис. 3к, 3л). Морфология этих ископаемых форм близка к виду Ourasphaira giraldae Loron et al., 2019 из (?) мезо- и неопротерозойских отложений Арктической Канады. В составе стенки оболочки O. giraldae присутствует хитин и отсутствует целлюлоза, что, учитывая внешний облик и относительно регулярное септирование таллома, является диагностическим признаком грибов [3]. На данный момент у нас пока нет данных о биохимии новой лахандинской фоссилии, что затрудняет систематическую интерпретацию этих ископаемых остатков. Сходной морфологией обладает G. bispinosa – это сферические оболочки диаметром 30–40 мкм, несущие постепенно сужающийся к свободному концу вырост, полость которого свободно сообщается с полостью сферы.
Кроме того, к морфогруппе гладких сфер с одиночным отростком могут быть отнесены представители вида J. solubila – сферические до цилиндрических оболочки 20–40 мкм в диаметре с одиночным, выдержанным по ширине трубчатым выростом, имеющим единую со сферой полость (рис. 3м, 3н). Хотя среди бактерий известны формы, cпоры которых при прорастании образуют длинные выросты, они значительно меньшего размера [10]. Также некоторые бактерии способны образовывать сложные ветвящиеся структуры со стеблями, увенчанными сферическими спорангиеподобными плодовыми телами до 1000 мкм [12]. Однако поверхность крупных плодовых тел не гладкая, а бугристая, повторяющая форму находящихся внутри спор [13].
Таким образом, несмотря на относительную простоту морфологии обсуждаемых фоссилий, их наиболее вероятные аналоги следует искать среди эукариот. Морфологию, близкую к таковой у C. expansa, G. bispinosa и новой неописанной формы, можно наблюдать у низших грибов, страменопил и зеленых водорослей [7, 14–16].
БИОГЕОХИМИЯ ПОРОД ЛАХАНДИНСКОЙ СЕРИИ
Как было продемонстрировано выше, породы лахандинской группы содержат комплекс достоверных эукариот. Возникает вопрос, сохранились ли в этих породах молекулярные следы ядерных организмов, учитывая, что породы палео- и мезопротерозоя, как правило, обеднены биомаркерами, специфичными для этого домена, а именно регулярными стеранами [6]. Об отсутствии стеранов из единственного исследованного образца глинистых пород лахандинской серии ранее сообщалось в статье М.М. Павловской и соавт. [17]. К сожалению, в упомянутой работе не рассмотрены такие вопросы, как термическая зрелость и сингенетичность углеводородов. В то же время верификация этих данных крайне желательна при исследованиях биомаркеров древних пород для обеспечения надежности результатов [6]. Для восполнения этого пробела мы проводим исследование по оценке сохранности органического вещества в 13 образцах лахандинских аргиллитов. Предварительные результаты анализа состава аутигенных биомаркеров в битумах и керогеновых фракциях из аргиллитов кумахинской и нельканской свит лахандинской серии, собранных нами в ходе полевых работ 2017–2019 гг., демонстрируют незначительное присутствие следов гопанов и полное отсутствие стеранов. Такой результат может подтверждать идею о подчиненной роли эукариот в функционировании морских экосистем мезопротерозоя [1, 6, 17, 18]. Однако анализ термической зрелости органического вещества демонстрирует, что оно было подвергнуто значительному термическому стрессу в зоне катагенеза. Термические преобразования привели к утрате углеводородами диагностических признаков, необходимых для выявления эндемичных биомаркеров.
Таким образом, наиболее надежным методом в определении систематического состава древнейших микроорганизмов из протерозойских отложений остается сравнительно-морфологический подход. Это особенно актуально для отложений, подвергшихся термическому воздействию, при анализе которых использование биогеохимических методов оказывается ограниченным.
ЗАКЛЮЧЕНИЕ
Руководствуясь современными критериями определения эукариот в ископаемой летописи, в лахандинской биоте можно выделить несколько групп достоверно эукариотических организмов, к которым относятся описанные ранее орнаментированные акритархи (V. lophostriata, T. aimika), ценоцитные или сифоновые нитчатые (P. clavata и A. ramosa), а также гладкие сферические оболочки с единичным отростком (C. expansa, J. solubila и G. bispinosa). Кроме этого, наше исследование выявило ранее неописанную спорангиеподобную ископаемую форму, также отнесенную к эукариотам. Эукариотическая природа вышеперечисленных ископаемых форм не вызывает сомнений в связи c крупными размерами остатков и отдельными морфологическими элементами, не встречающимися у прокариот. Однако геохимическое исследование органического вещества вмещающих пород лахандинской серии не выявило в них биомаркеров, характерных для эукариот (регулярных стеранов). В сочетании с палеонтологическими данными это может указывать на незначительный вклад эукариот в функционировании лахандинской биоты. Также проведенное исследование показывает, что наиболее надежным методом в определении систематического состава древнейших микроорганизмов из большинства протерозойских отложений остается сравнительно-морфологический анализ.
Список литературы
Butterfield N.J. Early evolution of the Eukaryota // Palaeontology. 2015. V. 58. P. 5–17.
Javaux E.J., Lepot K. The Paleoproterozoic fossil record: Implications for the evolution of the biosphere during Earth’s middle-age // Earth-Science Reviews. 2018. V. 176. P. 68–86.
Loron C.C., François C., Rainbird R.H. et al. Early fungi from the Proterozoic era in Arctic Canada // Nature. 2019. V. 570. № 7760. P. 232–235.
Tang Q., Pang K., Yuan X.L., Xiao S.H. A one-billion-year-old multicellular chlorophyte // Nature Ecology & Evolution. 2020. V. 4. № 4. P. 543–559.
Wood R. Exploring the drivers of early biomineralization // Emerging Topics in Life Sciences. 2018. V. 2. № 2. P. 201–212.
Love G.D., Zumberge J.A. Emerging patterns in Proterozoic lipid biomarker records // Proterozoic Lipid Biomarker Records. Cambridge: Cambridge University Press, 2021. P. 1–95.
Янкаускас Т.В., Михайлова Н.С., Герман Т.Н. и др. Микрофоссилии докембрия СССР. Ленинград: Наука, 1989. 191 с.
Герман Т.Н., Подковыров В.Н. Находки рифейских гетеротрофов в лахандинской серии Сибири // Палеонтологический журнал. 2010. № 4. С. 15–23.
Шувалова Ю.В., Наговицин К.Е., Пархаев П.Ю. Следы древнейших трофических взаимодействий в рифейской биоте (лахандинский лагерштетт, юго-восточная Сибирь) // Доклады Российской академии наук. Науки о жизни. 2021. V. 496. P. 34–40.
Javaux E.J., Knoll A.H., Walter M.R. Recognizing and interpreting the fossils of early eukaryotes // Origins of Life and Evolution of Biospheres. 2003. V. 33. № 1. P. 75–94.
Kämpfer P., Parkes L., van Keulen G., Dyson P. The Family Streptomycetaceae // The Prokaryotes: Actinobacteria. Berlin, Springer: 2014. P. 889–1010.
Shimkets L.J., Dworkin M., Reichenbach H. The Myxobacteria // The Prokaryotes: Volume 7: Proteobacteria: Delta, Epsilon Subclass. NY: Springer, 2006. P. 31–115.
Grilione P.L., Pangborn J. Scanning electron microscopy of fruiting body formation by myxobacteria // Journal of Bacteriology. 1975. V. 124. № 3. P. 1558–1565.
Tell G. Contribución al conocimiento de las algas del suelo bonaerense. I. Botrydium granulatum y B. tuberosum // Darwiniana. 1970. V. 16. № 1/2. P. 139–143.
Longcore J. Morphology and zoospore ultrastructure of Entophlyctis luteolus sp. nov. (Chytridiales): implications for chytrid taxonomy // Mycologia. 1995. V. 87. P. 25–33.
An J.W., Kang P.J., Nam K.W. Derbesia maxima sp. nov. (Bryopsidales, Chlorophyta) from Korea based on morphological and molecular data // Journal of Applied Phycology. 2020. V. 32. № 4. P. 2689–2696.
Pawlowska M.M., Butterfield N.J., Brocks J.J. Lipid taphonomy in the Proterozoic and the effect of microbial mats on biomarker preservation // Geology. 2013. V. 41. № 2. P. 103–106.
Knoll A.H., Summons R.E., Waldbauer J.R., Zum-berge J.E. The geological succession of primary producers in the oceans // Evolution of primary producers in the sea. Cambridge: Academic Press, 2007. P. 133–163. https://doi.org/10.1016/B978-012370518-1/50009-6
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни