Доклады Российской академии наук. Науки о жизни, 2022, T. 502, № 1, стр. 5-9
АНТИТЕЛА К N-КОНЦЕВОМУ ДОМЕНУ АНГИОТЕНЗИН-КОНВЕРТИРУЮЩЕГО ФЕРМЕНТА (АСЕ2) БЛОКИРУЮТ ЕГО ВЗАИМОДЕЙСТВИЕ С S БЕЛКОМ ВИРУСА SARS-CoV-2
В. Г. Круть 1, И. В. Астраханцева 1, С. А. Чувпило 1, Г. А. Ефимов 2, С. Г. Амбарян 1, М. С. Друцкая 1, 3, академик РАН С. А. Недоспасов 1, 3, *
1 Научно-технологический университет Сириус
Федеральная территория Сириус/Сочи, Россия
2 Национальный медицинский исследовательский центр гематологии Министерства здравоохранения Российской Федерации
Москва, Россия
3 Институт молекулярной биологии
им. В.А. Энгельгардта Российской академии наук
Москва, Россия
* E-mail: sergei.nedospasov@gmail.com
Поступила в редакцию 10.10.2021
После доработки 15.10.2021
Принята к публикации 15.10.2021
- EDN: LXRTOB
- DOI: 10.31857/S2686738922010012
Аннотация
SARS-CoV-2 – новый коронавирус, который является причиной пандемии COVID-19. Для проникновения в клетку вирус использует взаимодействие поверхностного S белка c ангиотензин-конвертирующим ферментом 2 (АСЕ2) как основным рецептором на мембране клетки. Большинство защитных антител, в том числе индуцированных вакцинацией, специфичны к S белку, что препятствует его взаимодействию с ACE2 рецептором. Нами изучена альтернативная возможность блокировки взаимодействия S белка с АСЕ2 с помощью новых антипептидных антител, связывающих N-конец молекулы АСЕ2. Полученные антитела позволяют детектировать АСЕ2 человека in vitro и ex vivo.
Вирус SARS-CoV-2, массовая инфекция которым вызвала разрушительную пандемию – заболевание COVID-19, затронувшее и Россию [1], в качестве своего основного рецептора на клетках человека использует заякоренную на мембране протеазу – ангиотензин-конвертирующий фермент (АСЕ2). Пепломеры вириона, образованные мультимерами S белка, входят в контакт с АСЕ2 своими рецептор-связывающими доменами (RBD). Считается, что нейтрализующие антитела у переболевших и вакцинированных связываются именно c этими доменами на пепломерах вируса и предотвращают его взаимодействие с рецептором АСЕ2, а также вход вируса в клетку. В настоящей работе мы исследовали альтернативный способ разрушить взаимодействие вируса и рецептора с помощью антител к N-концевому домену АСЕ2 человека, вовлеченного в контакт с RBD.
На основании данных рентгеноструктурного анализа комплекса RBD-ACE2 [2, 3] был выбран 32-членный пептид (P1), включающий аминокислоты 19-50 последовательности АСЕ2 и имеющий выраженную конформацию альфа-спирали, который в составе АСЕ2 осуществляет несколько контактов с белками шипа коронавируса SARS-CoV-2. Этот пептид был химически синтезирован стандартным твердофазным методом и очищен высокоэффективной жидкостной хроматографией, a его последовательность была подтверждена масс-спектрометрией (данные не показаны). Параллельно был приготовлен вариант того же пептида, содержащий на N-конце флуоресцентную метку (5,6-карбоксифлуоресцеин (FAM)). Далее, немеченым 32-членным пептидом, не конъюгированным с белком-носителем, в полном адъюванте Фрейнда были иммунизированы 2 кролика, которые получили две инъекции пептида с интервалом в 21 день. Хотя полученные антитела являются поликлональными, мы предполагаем, что они распознают очень небольшое число близко расположенных линейных эпитопов на молекуле АСЕ2 человека, что делает их свойства, по сути, близкими к моноспецифическим антителам.
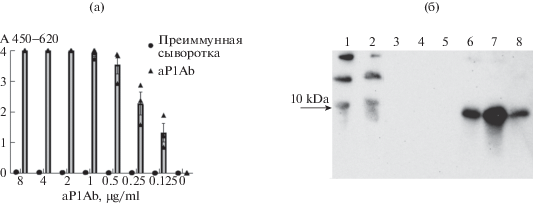
Через 40 дней после начала иммунизации антитела из сыворотки крови кроликов, в дальнейшем называемые aP1Ab, были очищены хроматографическим методом с помощью конъюгированной с А-белком агарозы и испытаны в ИФА тесте с пептидным антигеном, использованным для иммунизации (рис. 1а). Кроме того, они были подвергнуты Вестерн-анализу с небольшим рекомбинантным белком Р2, соответствующим N-концу АСЕ2 (аминокислоты 19-101) (рис. 1б). 6His-меченный белок Р2 был клонирован в вектор pET-22(+), экспрессирован в E. Coli BL21 и очищен по стандартной методике с использованием металло-аффинной хроматографии (рис. 1б).
Рис. 1.
Взаимодействие антител aP1Ab с фрагментами N-концевого участка белка ACE2. (а) Взаимодействие очищенных антител с пептидом Р1, сорбированным на микропланшете (1 мкг/мл), в сравнении с преиммунной сывороткой кролика. Реакция была проявлена после добавления анти-кроличьих антител, меченных HRP, и ТМБ (тетраметилбензидин) субстрата при длинах волн 450–620 нм (А 450–620 – оптическая плотность образца). Эксперимент проводили в трех повторах, на рисунке представлены медиана±SEM. (б) Взаимодействие aP1Ab (1 мкг/мл) с фракциями очищенного белка P2 при анализе Вестерн-блот. 1 – бактериальный лизат, 2 – белки, не связавшиеся с колонкой, 3–5 – фракции после промывки колонки, 6–8 – элюат.
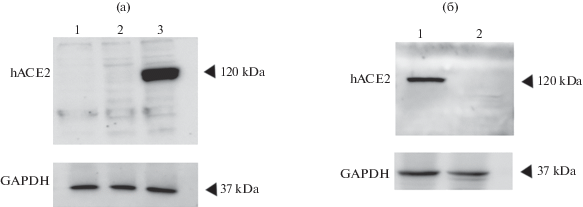
На этом этапе мы оценили антитела aP1Ab по способности детектировать АСЕ2 человека в клетках НЕК293Т, индуцибельно продуцирующих АСЕ2 в Cre-зависимой системе (рис. 2а), а также в тканях трансгенных мышей, экспрессирующих АСЕ2 человека под контролем эпителиального промотора К18 (рис. 2б) [4–7].
Рис. 2.
Анализ экспрессии hACE2 в трансфицированных клетках линии HEK293T и в тканях трансгенных мышей методом Вестерн-блоттинга. (а) 1 – HEK293T (без трансфекции), 2 – HEK293T, трансфицированные p-Cre-hACE2-Kat (2.5 мкг), 3 – HEK293T, трансфицированные p-Cre-hACE2-Kat (2.5 мкг) + плазмидой, кодирующей Cre-рекомбиназу (0.75 мкг). (б) Белковый экстракт, выделенный из гомогената ткани кишечника: 1 – трансгенной мыши K18-hACE2 и 2 – мыши дикого типа C57Bl/6.
Отметим, что эпитопы для антител aP1Ab находятся далеко от положения активного центра АСЕ2 [8], и не должны интерферировать с ферментативной активностью этой протеазы, регулирующей многие аспекты физиологии сердечно-сосудистой системы.
Убедившись в чистоте и специфичности антител aP1Ab, мы приступили к проверке нашей гипотезы о возможности альтернативной блокировки взаимодействия S белка SARS-CoV-2 и АСЕ2. Рекомбинантный полноразмерный 6His-меченный S белок был экспрессирован в эукариотической системе Expi293F (Termo) и очищен с помощью металло-аффинной хроматографии. Сорбированный на подложке S белок специфически связывал как 5,6-FAM-меченный пептид P1 (рис. 3а), так и белок P2 (рис. 3б).
Рис. 3.
Взаимодействие фрагментов ACE2 с S белком вируса SARS-CoV-2. (а) Интенсивность флуоресценции (FI: возбуждение – 483 нм, эмиссия – 530 нм) измеряли после инкубации пептида 5,6-FAM-P1 в течение 1 ч при комнатной температуре на микропланшете с сорбированным S белком (1 мкг/мл). (б) Оптическую плотность (A 450–620) оценивали после инкубации белка P2 в различных концентрациях на микропланшете с сорбированным S белком. aP1Ab были использованы в качестве первичных антител (1 мкг/мл). Реакцию проявляли после добавления анти-кроличьих антител, меченных HRP, и ТМБ в качестве субстрата. Все эксперименты проводили в трех повторах, на рисунке представлены медиана±SEM.

Добавление в систему антител aP1Ab приводило к дозозависимой блокировке взаимодействия S белка SARS-CoV-2 и белка Р2 (рис. 4), соответствующего N-концу АСЕ2, что согласуется с нашей гипотезой.
Рис. 4.
Дозозависимая блокировка взаимодействия фрагмента АСЕ2 с S белком вируса SARS-CoV-2. Белок P2 (200 нг/мл) предварительно инкубировали с aP1Ab в различных концентрациях при комнатной температуре в течение 30 мин. Затем комплекс Р2-aP1Ab добавляли в микропланшет с сорбированным полноразмерным S белком (1 мкг/мл). Оптическую плотность (A 450–620) оценивали после инкубации с анти-His-HRP антителами и ТМБ в качестве субстрата. Все эксперименты проводили в трех повторах, на рисунке представлены медиана±SEM.

Каково возможное клиническое значение наших результатов? Во-первых, в большинстве существующих (прошедших испытания и одобренных к применению) профилактических вакцинах иммуногеном является оригинальный Уханьский вариант S белка вируса SARS-CoV-2. Иммунный (антительный) ответ на RBD S белка вируса, индуцированный вакцинацией, может быть неэффективен в отношении новых вариантов вируса [9], по-прежнему способных эффективно связываться с АСЕ2. Действительно, структура АСЕ2, являющегося рецептором всех вариантов вируса SARS-CoV-2, остается неизменной, поэтому антитела к той части молекулы АСЕ2, которая взаимодействует с RBD S белка вириона, могут блокировать любые варианты вируса (рис. 5). Отметим, что вирус, который вследствие мутаций утратил способность связываться с АСЕ2 человека, теряет возможность входа в клетку с использованием этого рецептора.
Рис. 5.
Два типа антител, разрушающих взаимодействие S белка вируса SARS-CoV-2 и рецептора АСЕ2. Как антитела против RBD S белка вируса (светлые), так и антитела к взаимодействующему с RBD N-концевому домену АСЕ2 (темные), могут препятствовать входу вируса в клетку с использованием этого рецептора.

Во-вторых, в литературе [10] описаны аутоантитела к АСЕ2 у людей, но расположение распознаваемых эпитопов на молекуле АСЕ2 не было определено. На основании наших результатов можно предположить, что некоторые индивидуумы с аутоантителами к собственному АСЕ2 могут обладать повышенной резистентностью к инфекции широким спектром вариантов SARS-CoV-2 (рис. 5). Эта интересная гипотеза может быть экспериментально проверена в будущем.
Список литературы
Bobik T.V., Kostin N.N., Skryabin G.A., et al. COVID-19 in Russia: Clinical and Immunological Features of the First-Wave Patients. // Acta Naturae. 2021. V. 13. № 1. P. 102–115.
Shang J., Ye G., Shi K., et al. Structural basis of receptor recognition by SARS-CoV-2. // Nature. 2020. V. 581. P. 221–224.
Yan R., Zhang Y., Li Y., et al. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. // Science. 2020. V. 367. P. 1444–1448.
Zheng J., Wong L.R., Li K., et al. COVID-19 treatments and pathogenesis including anosmia in K18-hACE2 mice. // Nature. 2021. V. 589. P. 603–607.
Yinda C.K., Port J.R., Bushmaker T., et al. K18-hACE2 mice develop respiratory disease resembling severe COVID-19. // PLoS Pathog. 2021. V. 17. № 1. e1009195.
Liu X., Zaid A., Freitas J.R., et al. Infectious Clones Produce SARS-CoV-2 That Causes Severe Pulmonary Disease in Infected K18-Human ACE2 Mice. // mBio. 2021. V. 12. № 2. P. 1–10.
Oladunni F.S., Park J.G., Pino P.A., et al. Lethality of SARS-CoV-2 infection in K18 human angiotensin-converting enzyme 2 transgenic mice. // Nat Commun. 2020. V. 11. P. 6122–6139.
Turner A.J., Tipnis S.R., Guy J.L., et al. ACEH/ACE2 is a novel mammalian metallocarboxypeptidase and a homologue of angiotensin-converting enzyme insensitive to ACE inhibitors. // Can J Physiol Pharmacol. 2002. V. 80. P. 346–353.
Chen R.E., Zhang X., Case J.B., et al. Resistance of SARS-CoV-2 variants to neutralization by monoclonal and serum-derived polyclonal antibodies. // Nat Med. 2021. V. 27. P. 717–726.
Takahashi Y., Haga S., Ishizaka Y., et al. Autoantibodies to angiotensin-converting enzyme 2 in patients with connective tissue diseases. // Arthritis Res Ther. 2010. V. 12. № 3. P. 1–8.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


