Доклады Российской академии наук. Науки о жизни, 2022, T. 502, № 1, стр. 15-20
УРОВЕНЬ ПЛОИДНОСТИ РАСТЕНИЙ И НАЛИЧИЕ КАДМИЯ В СРЕДЕ ВЫРАЩИВАНИЯ ИЗМЕНЯЮТ СОДЕРЖАНИЕ ОСНОВНЫХ КОМПОНЕНТОВ ФЕНОЛЬНОГО КОМПЛЕКСА В ПРОРОСТКАХ ГРЕЧИХИ
В. В. Казанцева 1, *, Е. А. Гончарук 1, Г. П. Зайцев 2, Н. В. Загоскина 1, член-корреспондент РАН А. Г. Клыков 3
1 Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное учреждение науки “Всероссийский национальный научно-исследовательский институт виноградарства
и виноделия “Магарач” Российской академии наук
Ялта, Россия
3 Федеральный научный центр агробиотехнологий Дальнего Востока им. А.К. Чайки
Уссурийск, Россия
* E-mail: vkazantceva90@gmail.com
Поступила в редакцию 06.09.2021
После доработки 17.09.2021
Принята к публикации 17.09.2021
- EDN: JNUUUQ
- DOI: 10.31857/S2686738922010115
Аннотация
Впервые методом высокоэффективной жидкостной хроматографии исследованы состав и содержание основных компонентов фенольного комплекса надземных органов растений гречихи (Fagopyrum esculentum Moench) с различным уровнем плоидности (2n и 4n) на начальных этапах онтогенеза и их изменениях при действии кадмия (Cd; 65 мкМ). Фенольные соединения (ФС) во всех вариантах были представлены хлорогеновой кислотой (фенилпропаноид), рутином (флавонол), а также ориентином, изоориентином, витексином и изовитексином (флавоны). Их количество в семядольных листьях в большинстве случаев превышало таковое в гипокотилях. Для проростков гречихи тетраплоидного генотипа характерно более высокое накопление ФС по сравнению с диплоидным. При действии Cd содержание отдельных их представителей изменялось: в гипокотилях диплоидного генотипа оно в большинстве случаев снижалось, а у тетраплоидного – возрастало, тогда как в семядольных листьях – тенденция была противоположной. Установлено, что проростки двух генотипов F. esculentum с различным уровнем плоидности отличались по содержанию основных ФС и ответной реакции на действие Cd, что имеет важное значение для селекции этой культуры в отношении стресс-устойчивости.
Фенольные соединения (ФС) представляют собой одни из наиболее распространенных вторичных метаболитов растений, для которых характерна высокая антиоксидантная активность [1]. Они имеют важное значение при защите растительных клеток от активных форм кислорода (АФК), количество которых повышается при стрессовых воздействиях, и “дополняют” действие высокомолекулярных ферментов-антиоксидантов [2].
К наиболее агрессивным стрессорам в биосфере относятся тяжелые металлы, в том числе широко распространенный и высокотоксичный кадмий (Cd) [3]. Он влияет на рост растений, изменяет их физиолого-биохимические характеристики, снижает качество сельскохозяйственной продукции, а также наносит вред здоровью человека в связи с поступлением в пищевые цепи. Известно, что Cd вызывает повреждение мембран, нарушает транспорт электронов, ингибирует/активирует ферменты, влияет на структуру ДНК и приводит к другим метаболическим изменениям [4]. Несмотря на все это, растения сохраняют жизнеспособность, в том числе и за счет накопления антиоксидантов фенольной природы [5, 6]. Предполагают, что эти вторичные метаболиты могут выступать в качестве биомаркеров воздействия на них металлов.
К числу важнейших культур промышленного использования во многих странах мира относится гречиха посевная (Fagopyrum esculentum). Для нее характерно накопление ФС, преимущественно флавоноидов – веществ с высокой антиоксидантной активностью [7]. Литературные данные свидетельствуют об ее высокой устойчивости к действию алюминия [8], способности к накоплению свинца [9], но крайне мало данных о влиянии на нее Cd [10, 11].
Одной из характерных особенностей растительных организмов является уровень их плоидности [12]. Предполагается, что при его повышении может отмечаться более выраженная устойчивость растений к действию неблагоприятных факторов окружающей среды. В некоторых случаях это сопровождалось накоплением в тканях ФС [13]. Однако до сих пор ясности в этом вопросе нет.
В настоящей работе представлены приоритетные данные, полученные методом высокоэффективной жидкостной хроматографии, о составе и содержании основных компонентов фенольного комплекса надземных органов проростков гречихи с различным уровнем плоидности (2n и 4n), выращенных в стандартных условиях и в присутствии Cd. Впервые выявлено более высокое накопление ФС у тетраплоидного генотипа этой культуры по сравнению с диплоидным. Получены новые данные о влиянии Cd на содержание фенольных биоантиоксидантов в ценной сельскохозяйственной культуре гречихи.
Исследования проводили на проростках гречихи посевной (F. esculentum Moench) с различным уровнем плоидности, используя для этого сорта Девятка (2n = 16) и Большевик 4 (4n = 32). Их выращивали рулонным способом в течение 14 дней на воде (контроль) или водном растворе Сd(NO3)2 (концентрация 65 мкМ была подобрана в предварительных экспериментах, не вызывала гибели проростков) при +24°С и 16-час. фотопериоде (5000 люкс).
Состав и содержание ФС определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) [14]. Гипокотили и семядольные листья проростков гречихи экстрагировали 96% этанолом (45°С, 45 мин). Гомогенат центрифугировали (18 000 g/мин, 2 мин), надосадочную жидкость отделяли и анализировали с использованием системы Agilent Technologies (модель 1100). Хроматограф укомплектован проточным вакуумным дегазатором G1379А, 4-канальным насосом градиента низкого давления G13111А, автоматическим инжектором G1313А, термостатом колонок G13116А, диодноматричным детектором G1316A и флуоресцентным детектором G1315B.
Для разделения ФС применяли хроматографическую колонку “ZORBAX” SB-C18 (2.1 × 150 мм), заполненную силикагелем с привитой октадецилсилильной фазой зернением 3.5 мкм. Состав элюента: раствор А – метанол, раствор В – 0.6%-ный водный раствор трифторуксусной кислоты. Хроматографирование проводили в градиентном режиме. Состав элюента изменялся по следующей схеме (по содержанию компонента В): 0 мин – 8%; 0–8 мин – 8–38%; 8–24 мин – 38–100%; 24–30 мин – 100%. Скорость потока элюента – 0.25 мл/мин. Объем вводимой пробы – 1 мкл. Хроматограммы регистрировали при 280 нм (для хлорогеновой кислоты) и 350 нм (для флавоноидов). Идентификацию ФС производили путем сравнения их спектральных характеристик и времени удерживания с аналогичными характеристиками стандартов. Спектральные характеристики отдельных веществ получали с использованием данных литературы [14, 15]. Содержание ФС рассчитывали по калибровочным графикам зависимости площади пика от концентрации вещества.
В экспериментах использовали 3-кратные биологические и 2-кратные аналитические повторности измерений. Статистическую обработку данных осуществляли с помощью программ Microsoft Excel 2010 и SigmaPlot 12.5. На рисунках представлены средние арифметические значения определений и их стандартные ошибки (±SEM). Достоверность различий средних значений определяли по t-критерию Стьюдента при p ≤ 0.05 и обозначали ее разными латинскими буквами.
Состав ФС, экстрагируемых этанолом из надземных органов проростков двух генотипов гречихи, выращенных как в стандартных условиях, так и в присутствии Cd, был одинаков (рис. 1). Он представлен наиболее разнообразной группой ФС – флавоноидами, образование которых характерно для большинства растений [7]. Их накопление в большей степени было выражено в семядольных листьях, которое значительно превышало таковое в гипокотилях (рис. 2, 3). Это, вероятно, обусловлено функционированием в них хлоропластов – одного из основных мест их биосинтеза [1]. Преобладающими флавоноидами надземных органов проростков двух генотипов гречихи были флавоны, такие как ориентин, изоориентин, витексин, изовитексин, а также флавонол рутин (рис. 1).
Рис. 1.
ВЭЖХ хроматограммы этанольных экстрактов гипокотилей (а) и семядольных листьев (б) проростков гречихи (Base Peak Chromatogram, 350 нм). По оси абсцисс – время удерживания, мин; по оси ординат – сигнал детектора, единицы оптической плотности. Основные фенольные соединения: хлорогеновая кислота (1), ориентин (2), изоориентин (3), витексин (4), изовитексин (5), рутин (6).
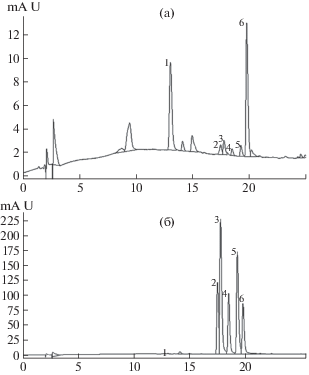
Рис. 2.
Содержание различных фенольных соединений в гипокотилях (а) и семядольных листьях (б) проростков диплоидного (ДГГ) и тетраплоидного (ТГГ) генотипов гречихи, выращенных в стандартных условиях. Достоверность различий средних значений определяли по t-критерию Стьюдента при p ≤ 0.05 и обозначали ее разными латинскими буквами.
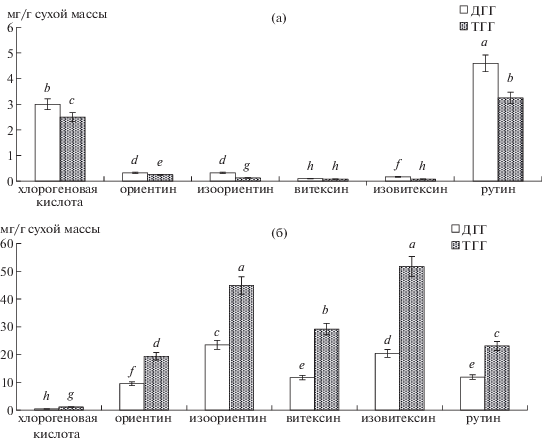
Рис. 3.
Содержание различных фенольных соединений в гипокотилях (а) и семядольных листьях (б) проростков диплоидного (ДГГ) и тетраплоидного (ТГГ) генотипов гречихи, выращенных в присутствии Cd (65 мкМ). Достоверность различий средних значений определяли по t-критерию Стьюдента при p ≤ 0.05 и обозначали ее разными латинскими буквами.

Как отмечалось ранее, образование флавонов характерно лишь для начальных этапов онтогенеза гречихи [7]. Во всех вариантах присутствовала хлорогеновая кислота, представляющая собой сложный эфир кофейной и хинной кислот и относящаяся к фенилпропаноидам, количество которой было высоким в гипокотилях (рис. 1а).
Следующим этапом наших исследований было определение содержания основных ФС в надземных органах проростков двух генотипов гречихи, выращенных в стандартных условиях в отсутствие Cd (рис. 2). В гипокотилях доминировали хлорогеновая кислота и рутин, содержание которых у ДГГ было выше, по сравнению с ТГГ.
В семядольных листьях преобладали флавоны (ориентин, изоориентин, изовитексин, витексин) и флавонолы (рутин), содержание которых превышало таковое в гипокотилях в среднем на 96 и 61% у ДГГ, а у ТГГ – на 99 и 94% соответственно. Следует также отметить более высокую способность к накоплению этих метаболитов в семядольных листьях проростков ТГГ, которое было вдвое выше, чем у ДГГ. Основными ФС были изоориентин и изовитексин, содержание которых у ДГГ и ТГГ составило 56 и 29% от общего количества ФС (рис. 2).
Фенилпропаноиды – еще одна группа ФС гречихи, которые также являются биологически активными соединениями и могут выполнять антиоксидантную функцию [2]. При этом в большинство литературных источников по гречихе сообщается о накоплении флавоноидов и очень мало о фенилпропаноидах. В гипокотилях ДГГ и ТГГ, выращенных в стандартных условиях, на их долю приходилось соответственно 35 и 40% от общего содержания в них ФС, тогда как в семядольных листьях – только 0.5%. Высокое содержание хлорогеновой кислоты в гипокотилях можно рассматривать как “резерв” кофейной кислоты, используемой для образования лигнина в стеблях проростков гречихи для придания им механической прочности [1].
Литературные данные свидетельствуют о различных тенденциях в изменении содержания и состава ФС при действии Cd на растения, хотя в большинстве случаев сообщалось об увеличении их накопления [16, 17 ] . В нашем эксперименте не выявлено изменений в составе ФС надземных органов проростков гречихи, хотя их содержание изменялось (рис. 3). Так, в условиях действия Cd в гипокотилях проростков ДГГ количество хлорогеновой кислоты уменьшалось на 27% по сравнению с контролем, ориентина и изоориентина – на 48%, витексина – на 50%, изовитексина – на 60%, рутина – на 56%. Иная тенденция отмечалась в гипокотилях проростков ТГГ, где их уровень повышался относительно контроля: хлорогеновой кислоты – на 28%, ориентина – на 50%, изоориентина и витексина на 86%, изовитексина на 90%, рутина – на 38%.
Изучение содержания ФС в семядольных листьях показало, что у проростков ДГГ, подвергнутых действию поллютанта, количество хлорогеновой кислоты повышалось в среднем на 32% относительно контроля, количество ориентина и изоориентина – на 23%, а количество витексина и изовитексина не изменялось (рис. 3). У проростков ТГГ в присутствии Cd тенденция была противоположной, что выражалось в снижении количества большинства основных компонентов фенольного комплекса семядольных листьев. Так, содержание хлорогеновой кислоты уменьшалось на 60% относительно контроля, ориентина – на 10%, витексина и изовитексина – на 34%, тогда как содержание изоориентина и рутина не изменялось.
Впервые получены данные, свидетельствующие об отличиях в ответной реакции проростков двух генотипов гречихи на действие Cd, которая зависела как от уровня их плоидности (2n и 4n), так и исследуемого органа (гипокотили, семядольные листья). Судя по литературным данным [1], снижение количества ФС в стрессовых условиях может быть следствием либо их транспорта в другие органы проростков, либо катаболизма и использования в качестве дополнительного источника углерода. Таким образом, оценка генотипов гречихи на начальном этапе онтогенеза по содержанию и составу ФС, в том числе в условиях действия Cd, может быть использована в практической селекции при отборе растений, устойчивых к стрессовым факторам.
Список литературы
Cheynier V., Comte G., Davies, K.M., et al. // Plant Physiol. and Biochem. 2013. V. 72. P. 1–20.
Biela M., Rimarcík J., Senajova E., et al. // Phytochem. 2020. V. 180. P. 112528.
Vardhan K.H., Kumar P.S., Panda R.C. //J. Molecular Liquids. 2019. V. 290. P. 111197.
Seregin I.V., Ivanov V.B. // Rus. J. Plant Physiol. 2001. V. 48. P. 523–544.
Elguera J.C.T., Barrientos E.Y., Wrobel K., et al. // Acta Physiol. Plant. 2013. V. 35. P. 431–441.
Chen S., Wang Q., Lu H., et al. // Ecotoxicol. and Environ. Saf. 2019. V. 169. P. 134–143.
Borovaya S.A., Klykov A.G. // Plant Biotechnol. Rep. 2020. V. 14. P. 213–225.
Shen R.F., Chen R.F., Ma J.F. // Plant and Soil. 2006. V. 284. P. 265–271.
Horbowicz M., Dębski H., Wiczkowski W., et al. // Pol. J. Environ. Stud. 2013 V. 22. P. 1723–1730.
Nikolic D.B., Samardzic J.T., Bratic A.M., et al. // J. Agric. Food Chem. 2010. V. 58. P. 3488–3494.
Kazantseva V., Goncharuk E., Mammadov R., et al. // Biosci. Res. 2019. V. 16. P. 3475–3488.
Adams K.L., Wendel J.F. // Plant Biol. 2005. V. 8. P. 135–141.
Pradhan S.K., Gupta R.C., Goel R.K. // Nat. Prod. Res. 2018. V. 32. P. 2476–2482.
Woodring P.J., Edwards P.A., Chisholm M.G. // J. Agric. Food Chem. 1990. V. 38. P. 729–732.
Bagchi D., Sen C.K., Ray S.D., et al. // Mutat. Res-Fund. Mol. M. 2003. V. 523. P. 87–97.
Ulusu Y., Öztürk L., Elmastaş M. // Rus. J. Plant Physiol. 2017. V. 64. P. 883–888.
Zoufan P., Azad Z., Ghahfarokhie A.R., et al. // Ecotoxicol. Environ. Saf. 2020. V. 187. P. 109811.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


