Доклады Российской академии наук. Науки о жизни, 2022, T. 504, № 1, стр. 219-222
ИССЛЕДОВАНИЕ РАСПРЕДЕЛЕНИЯ МАГНИТНЫХ НАНОЧАСТИЦ В ОПУХОЛЕВЫХ ТКАНЯХ МЕТОДОМ СКАНИРУЮЩЕЙ МАГНИТНО-СИЛОВОЙ НАНОТОМОГРАФИИ
О. И. Агапова 1, А. Е. Ефимов 1, К. Е. Мочалов 2, Д. О. Соловьева 2, Е. В. Свирщевская 2, С. М. Климентов 3, А. А. Попов 3, В. А. Олейников 2, 3, И. И. Агапов 1, *, академик РАН С. В. Готье 1, 4
1 Федеральное государственное бюджетное учреждение “Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова” Министерства здравоохранения Российской Федерации
Москва, Россия
2 Федеральное государственное бюджетное учреждение науки Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
3 Федеральное государственное автономное образовательное учреждение высшего образования “Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
4 Федеральное государственное автономное образовательное учреждение высшего образования “Первый Московский государственный медицинский университет имени И.М. Сеченова” Министерства здравоохранения Российской Федерации (Сеченовский университет)
Москва, Россия
* E-mail: igor_agapov@mail.ru
Поступила в редакцию 25.12.2021
После доработки 20.01.2022
Принята к публикации 20.01.2022
- EDN: EBUELT
- DOI: 10.31857/S2686738922030027
Аннотация
Развитие эффективных биомедицинских технологий с применением магнитных наночастиц (МНЧ) для задач онкотерапии и нанодиагностики требует разработки и внедрения новых методов для анализа микро- и наномасштабных распределений МНЧ в объеме клеток и тканей. В работе представлен новый подход к трехмерному анализу распределений МНЧ – сканирующая магнитно-силовая нанотомография в применении к исследованиям опухолевых тканей. Коррелятивная реконструкция распределений МНЧ и особенностей наноструктуры исследуемых тканей позволила выполнить количественную оценку параметров трехмерных распределений композитных наночастиц на основе кремния и оксида железа, полученных методом фемтосекундной лазерной абляции и введенных внутривенно и интратуморально в образцы опухолевых тканей меланомы мыши B16/F1. Разработанная технология с использованием принципов сканирующей зондовой нанотомографии применима для исследования особенностей трехмерных микро- и наномасштабных распределений МНЧ в биоматериалах, клетках и тканях различных типов.
Твердотельные наноматериалы обладают уникальными физическими свойствами [1–3], которые могут быть эффективно использованы в биомедицинской диагностике и терапии [4–6]. В частности, одним из перспективных методов лечения онкологических заболеваний является магнитная гипертермия, основанная на разогреве пораженного органа до температуры выше 42°C [7, 8]. Хорошо установлено, что поддержание такой температуры в течение 20–30 мин приводит к некрозу раковых клеток, более подверженных влиянию повышенной температуры, чем нормальные ткани. Преимущества использования магнитных наночастиц (МНЧ) в магнитной гипертермии связаны с тем, что ансамбли суперпарамагнитных наночастиц способны обеспечить чрезвычайно большие значения удельного поглощения энергии, порядка 1 кВт на грамм вещества, а также с тем, что в силу малых размеров наночастицы могут глубоко проникать в биологические клетки, ткани и органы. С помощью магнитных полей с большим градиентом функционализированные наночастицы могут быть собраны в нужной области тела (магнитофекция) для направленного терапевтического воздействия, либо отфильтрованы из среды для последующего химического анализа захваченных на их поверхностях молекул [9].
Вместе с тем многие вопросы, связанные с применением магнитных наночастиц в биомедицине, все еще ждут своего решения. Например, необходимо обеспечить достаточно однородное биораспределение наночастиц в пораженном органе. На практике, пока весьма трудно оценить полученное в результате инъекций стационарное распределение наночастиц внутри опухоли и оценить их общую стационарную концентрацию, так как распределение наночастиц заметно варьируется в зависимости от органа и типа биологического материала и существенно зависит от архитектуры кровеносных сосудов в области воздействия. Аналогичные задачи возникают и при изучении локализации биосенсоров на основе МНЧ в анализируемых клетках и тканях с наноразмерным разрешением [10].
Для всестороннего изучения взаимодействия МНЧ с клетками и тканями in vivo необходимы разработка и внедрение новых технологических подходов для анализа микро- и наноструктурных распределений МНЧ в их составе, а также количественной оценки параметров взаимодействия клеток с МНЧ на микро- и наноуровне.
Используемые для подобных исследований в настоящий момент различные варианты микроскопии, такие как электронная микроскопия, атомно-силовая микроскопия и оптическая микроспектроскопия высокого разрешения, не позволяют одновременно определять положение частиц в объеме ткани с требуемой точностью и оценивать их магнитные свойства.
Нами разработана уникальная технология сканирующей оптическо-зондовой нанотомографии (СОЗНТ), комбинирующая ультрамикротом и сканирующий зондовый микроскоп (СЗМ) [11]. Использование методики СОЗНТ позволяет изучать трехмерную микро- и наноструктуру биополимерных материалов, в корреляции с исследованием локализации МНЧ в объеме изучаемых образцов и идентификации их магнитных свойств при помощи метода магнитной силовой микроскопии (МСМ) [12]. Однако исследования трехмерных распределений МНЧ в биологических клетках и тканях ранее не проводились.
Ниже представлены исследования распределений магнитных НЧ, введенных внутривенно и интратуморально в образцы опухолевых тканей меланомы мыши B16/F1.
Суспензии композитных наночастиц на основе кремния и оксида железа были получены методом фемтосекундной лазерной абляции в ацетоне и воде. Для получения наночастиц мишень из силицида железа FeSi2 (соотношение материалов в мишени Si:Fe 60%:40%) облучалась лазерным излучением (длина волны 1030 нм, длительность импульсов 270 фс, энергия импульсов 30 Дж, частота повторения импульсов 100 кГц, диаметр пучка 3 мм, модель лазера ТЕТА 10, Авеста, Россия). В ходе эксперимента были получены три фракции МНЧ различного размера, средние диаметры частиц в которых составляли 125, 55 и 32 нм.
Измерения магнитных свойств полученных МНЧ свидетельствуют о значительном росте магнитной восприимчивости и появлении слабого магнитного гистерезиса в полученных образцах фракции МНЧ со средним диаметром 55 нм. Все это указывает на наличие суперпарамагнитных свойств полученных МНЧ. Одновременно в экспериментах in vitro была замечена возможность управления накоплением таких МНЧ в водных средах за счет приложения градиента относительно слабого внешнего магнитного поля (~0.1 Тл).
Клетки B16/F1 выращивали в среде RPMI-1640 с добавлением 7% фетальной телячьей сыворотки (HyClone, США), пенициллин-стрептомицина и L-глютамина. Все клетки пассировали путем трипсинизации с помощью раствора трипсин/ЭДТА (ПанЭко, Москва). Для анализа распределения наночастиц в ткани опухоли мышам линии C57BL/6 перевивали опухолевые клетки меланомы мыши B16/F1 и в количестве 1 млн клеток на мышь. При достижении размера опухоли 200–400 мм3 одной группе мышей вводили внутривенно наночастицы размером 55 нм в количестве 300 мкг/мышь, а другой группе – интратуморально (непосредственно в опухоль) в той же дозе. Мышей выводили из эксперимента через сутки, забирали опухоль и фиксировали ее в 4% параформальдегида.
В ходе получения образцов для исследований методом сканирующей магнитно-силовой нанотомографии (СМСНТ) производили дегидратацию образцов опухолевых тканей проводкой по спиртам с увеличивающейся концентрацией и заливку образцов в эпоксидную среду [13].
Далее проводили ультрамикротомирование образцов с помощью ультрамикротома Reichert-Jung Ultracut с алмазным ножом Diatome AFM 2.0 mm, входящим в состав установки СОЗНТ. Данная уникальная научная установка – система зондово-оптической 3D-корреляционной микроскопии (http://ckp-rf.ru/usu/486825/), созданная с участием авторов настоящей работы, – позволяет выполнять серийные СЗМ-измерения наноструктуры поверхности объектов непосредственно после последовательных сверхтонких срезов образца ультрамикротомом [13]. Для каждого образца было выполнено 20 срезов с шагом 230 нм. Измерения с использованием СЗМ-зондов с магнитным покрытием проводились на поверхности образца после каждого среза. Каждое измерение выполнено двухпроходной методикой: в первом проходе измеряется топография поверхности, во втором – магнитные характеристики. Для более детального изображения клеточной структуры использовали режим отображения фазы. После получения серии коррелятивных 2D МСМ и фазовых изображений восстанавливали 3D структуру фрагмента образца при помощи программного пакета Image Pro Plus 6.0 3DConstructor (MediaCybernetics Inc.). Предварительно каждое фазовое изображение объединяли с МСМ изображением для локализации МНЧ.
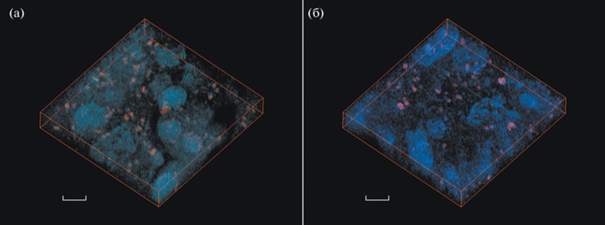
На рис. 1 приведены изображения фрагментов образцов опухолевых тканей В16/F1 с SiFe МНЧ, введенными внутривенно и интратуморально. Совокупность данных, полученных в результате трехмерной реконструкции методом СМСНТ, дает возможность вычислить ряд количественных параметров изучаемых распределений МНЧ, таких как общий объем восстановленной структуры Vtot, число кластеров в восстановленном объеме N, доля объема кластеров от общего объема r, средний размер кластеров d.
Рис. 1.
Совмещенные трехмерные реконструкции методами СЗНТ (в режиме отображения фазы) и СМСНТ фрагментов опухолевых тканей В16/F1 с SiFe МНЧ, введенными (а) внутривенно и (б) интратуморально. Красные участки соответствуют МНЧ. 30 × 30 × 4.6 мкм, толщина среза 230 нм, масштабный отрезок 5 мкм.
Параметры, полученные в результате анализа трехмерных реконструкций представлены в табл. 1.
Таблица 1.
Параметры реконструированных трехмерных распределений МНЧ в опухолевых тканях
| Исследуемый образец | Параметр | Значение |
|---|---|---|
| Опухоль В16/F1, внутривенное введение МНЧ | Vtot, мкм3 | 30 × 30 × 4.6 |
| N, ед | 297 | |
| r, % | 0.35 | |
| d, нм | 470 ± 154 | |
| Опухоль В16/F1, интратуморальное введение МНЧ | Vtot, мкм3 | 30 × 30 × 4.6 |
| N, ед | 161 | |
| r, % | 0.2 | |
| d, нм | 485 ± 169 |
Из полученных данных следует, что число N и доля объема кластеров от общего объема r кластеров МНЧ заметно (практически в 2 раза) ниже для случая интратуморального введения МНЧ. Стоит отметить, что, помимо кластеров МНЧ, в клетках имеются и отдельные МНЧ, причем локализуются они преимущественно в области ядер клеток, в отличие от кластеров, которые находятся в объеме клеток.
Разработанная технология исследования трехмерных характеристик наномасштабных распределений МНЧ с использованием принципов сканирующей магнитно-силовой нанотомографии применима для задач исследования особенностей взаимодействия МНЧ с клетками и тканями различных типов.
Список литературы
Canham L.T. Silicon quantum wire array fabrication by electrochemical and chemical dissolution of wafers. // Appl. Phys. Lett. 1990. V. 57. P. 1046–1048.
Cao G., Wang Y. Nanostructures and Nanomaterials. Synthesis, Properties, and Applications, World Scientific Series in Nanoscience and Nanotechnology: V. 2. 2nd Edition, World Sci. Publ., 2011, 596 p.
Ischenko A.A., Fetisov G.V., Aslalnov L.A. Nanosilicon: Properties, Synthesis, Applications, Methods of Analysis and Control, CRC Press, USA. 2014. 755 p.
Lal S., Clare S.E., Halas N.J. Nanoshell-enabled photothermal cancer therapy: impending clinical impact // Acc. Chem. Res. 2008. V. 41 № 12. P. 1842–1851.
Kabashin A., Evans P., Pastkovsky S. et al. Plasmonic nanorod metamaterials for biosensing. // Nature Mater. 2009. V. 8. P. 867–871.
Kabashin A.V., Timoshenko V.Yu. What theranostic applications could ultrapure laser-synthesized Si nanoparticles have in cancer? // Nanomedicine. 2016. V. 11. №17. P. 2247–2250.
Ortega D., Pankhurst Q.A. Magnetic hyperthermia. Nanoscience: V.1: Nanostructures through Chemistry. P. O’Brien, Ed., Royal Society of Chemistry: Cambridge. 2013. P. 60–88.
Riegler J., Liew A., Hynes S.O., et al. Superparamagnetic iron oxide nanoparticle targeting of MSCs in vascular injury. // Biomaterials. 2013. V. 34. №8. P. 1987–1994.
Zanini L.F., Dempsey N.M., Givord D., et al. Autonomous micro-magnet based systems for highly efficient magnetic separation. // Appl. Phys. Lett. 2011. V. 99. P. 232504.
Wu M., Huang S. Magnetic nanoparticles in cancer diagnosis, drug delivery and treatment. // Mol. Clin. Oncol. 2017. V. 7. P. 738–746.
Efimov A.E., Agapov I.I., Agapova O.I., et al. A novel design of a scanning probe microscope integrated with an ultramicrotome for serial block-face nanotomography. // Review of Scientific Instruments. 2017. V. 88. P. 023701.
Mochalov K.E., Agapova O.I., Generalova A.N., et al. Nanoscale Correlation Analysis of the Morphological, Optical, and Magnetic Structure of Polymer Microspheres for Multiplex Diagnostics // Tech Phys Lett. 2020 V. 46. № 3. P. 224–227.
Mochalov K.E., Chistyakov A.A., Solovyeva D.O. et al. An instrumental approach to combining confocal microspectroscopy and 3D scanning probe nanotomography. // Ultramicroscopy. 2017. V. 182. P. 118–123.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


