Доклады Российской академии наук. Науки о жизни, 2022, T. 506, № 1, стр. 433-436
ПЕРВЫЙ ОПЫТ СОДЕРЖАНИЯ ПОГОНОФОР (ANNELIDA: SIBOGLINIDAE) В ЛАБОРАТОРНЫХ УСЛОВИЯХ
А. А. Прудковский 1, Н. П. Карасева 1, *, М. Н. Римская-Корсакова 2, Т. П. Пименов 1, Н. Н. Римская-Корсакова 1, академик РАН В. В. Малахов 1
1 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
2 Институт океанологии им. П.П. Ширшова
Российской академии наук
Москва, Россия
* E-mail: oasisia@gmail.com
Поступила в редакцию 20.04.2022
После доработки 20.05.2022
Принята к публикации 20.05.2022
- EDN: EFEIZQ
- DOI: 10.31857/S2686738922050225
Аннотация
Описаны параметры содержания бескишечных симбиотрофных аннелид Siboglinum fiordicum в лабораторных условиях вне морского стационара в течение 64 дней.
Siboglinidae Caullery 1914 – семейство морских аннелид, все представители которого лишены пищеварительного тракта. Их жизнедеятельность обеспечивается благодаря симбиотическим бактериям, обитающим в специальном органе – трофосоме. Так называемые френулятные погонофоры (подсемейство Siboglininae Caullery, 1914) – наиболее многочисленная группа семейства, широко распространенная группа во всех океанах нашей планеты. Это тонкие нитевидные черви, обитающие в хитиновых трубках, погруженных в мягкие осадки. Представители френулятных погонофор имеют симбионтов, которые способны окислять сероводород или метан [1–5]. Френулятные погонофоры вызывают большой интерес как возможные организмы – индикаторы подводных залежей углеводородов [6–8]. В связи с этим представляет особый интерес исследование экологической физиологии френулятных погонофор, в частности определение тех концентраций растворенных в капиллярной воде газов (в первую очередь, сероводорода и кислорода), которые необходимы для поддержания их жизнедеятельности. Вплоть до настоящего времени в литературе отсутствовали сведения о возможности длительного культивирования френулятных погонофор вне морских стационаров. В настоящей работе сделана попытка культивирования френулятных погонофор в лабораторных условиях в специально спроектированном морском аквариуме и определения параметров их содержания.
Особи Siboglinum fiordicum Webb, 1963 и пробы осадка были собраны в Северном море в районе пролива Юпсесунд (Øpsesundet, 60°33'38" N, 5°0'20" E) при помощи дночерпателя Ван-Вина (0.25 м2) с глубины 33–35 м 7–15 февраля 2022 г. Для транспортировки живые погонофоры были помещены в 50 мл пробирки и перевезены в 2 л термосах (Thermos, США) с хладагентами. Черви были доставлены в Москву 18.02.2022, и 22.02.2022 помещены в специально спроектированный аквариум на кафедре зоологии беспозвоночных Московского государственного университета им. М.В. Ломоносова.
Воду для определения содержания растворенного кислорода и рН в придонном слое в проливе Юпсесунд отбирали при помощи батометра Руттнера (KC Denmark A/S), концентрации кислорода определяли методом Винклера [9], измерения температуры и солености проводили CTD-зондом SAIV A/S SD204 (SAIV A/S, Норвегия). Сероводород из поровой воды осадка (полученной с горизонтов 4 и 7 см от поверхности дна) определяли методом фотометрии с метиленовым голубым [10]. Два месяца спустя после посадки червей в аквариум аналогичным образом проведены измерения концентрации растворенного сероводорода в поровых водах осадка внутри аквариума с горизонтов 2–7 см.
Установка создана на основе аквариума размером 80 × 50 × 35 см, общим объемом 140 л. В целях водоподготовки использована система обратного осмоса Гейзер-престиж 2 (Россия) в сочетании с мембраной ULP1812/2012 (Vontron, Китай) и ионообменной смолой Spectrum SRDI (Великобритания). Для получения морской воды с соленостью 33 ‰ использовалась соль Coral Pro (Red Sea, Израиль). Два отсека аквариума содержали мелкопористую губку для механической фильтрации и осаждения взмученного осадка. Для поддержания постоянной температуры около 6–8°C использован аквариумный холодильник Mini 600 (Resun, Китай). Для постоянного мониторинга условий и регуляции концентрации кислорода и pH использован двухканальный промышленный контроллер WTW DIQ/S 282 (Xylem inc., США) в сочетании с pH электродом SensoLyt® SEA (Xylem inc., США) и оптическим датчиком содержания растворенного кислорода FDO®700 IQ SW (Xylem inc., США). Контроллер для управления электромагнитным клапаном G7J (Camozzi, Италия) включает подачу углекислого газа при повышении pH выше 7.6. Общая схема установки приведена на рис. 1. Аквариум был запущен за три месяца до посадки погонофор для стабилизации состава воды.
Рис. 1.
а – схема экспериментальной установки, б – Внешний вид Siboglinum fiordicum (масштаб: 1 мм), в – одна из емкостей с грунтом, использованная для посадки червей в аквариум.
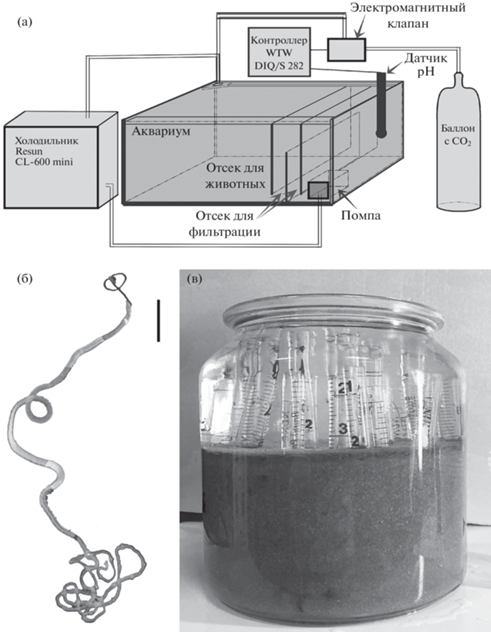
Всего в аквариум были помещены 44 особи S. fiordicum. Черви были помещены в пластиковые трубки с внутренним диаметром 7 и 8 мм, длиной 10–15 см. Нижний конец трубок был затянут мельничным ситом с ячеей 100 мкм, а в боковых стенах через каждые 1.5–2 см были просверлены отверстия диаметром 2 мм. Эти отверстия обеспечивали проникновение воды и частиц грунта внутрь трубки. Пластиковые трубки с червями помещались в стеклянные емкости объемом 0.5–2 л, частично заполненные осадком (табл. 1, рис. 1).
Таблица 1.
Параметры емкостей, погруженных в аквариум и распределение особей S. fiordicum при посадке в аквариум
| Емкость 1 | Емкость 2 | Емкость 3 | Емкость 4 | |
|---|---|---|---|---|
| Общий объем (л) | 0.5 | 0.5 | 1.64 | 2 |
| Объем грунта (л) | 0.3 | 0.3 | 0.6 | 1.4 |
| Глубина слоя осадка, см | 7.5 | 7.5 | 7 | 8.5 |
| Количество червей на момент посадки | 8 | 8 | 13 | 13 |
| Количество выживших к 26.04.2022 | 1 | 0 | 0 | 2 |
Таблица 2.
Сравнение основных абиотических параметров среды в проливе Юпсесунд и экспериментальной установке. “–” означает , что этот параметр не был измерен
| Параметры | Пролив Юпсесунд | Экспериментальная установка |
|---|---|---|
| Температура придонного слоя воды, °C | 9.2 | 6–8 |
| Соленость придонного слоя воды, ‰ | 33.2 | 33.0 |
| pH придонного слоя воды | 7.96 | ~7.6 |
| pH поровой воды в осадке на глубине 4–7 см | 7.5–7.7 | – |
| [O2] в придонном слое воды, мг/л | 7.71 | 7.65–8.5 |
| [H2S] в поровой воде в осадке на глубине 4–7 см, мкМ | 2.1–11.9 | 0.83–3.24 |
Осадок для размещения червей в аквариуме был отобран параллельно со сбором червей в проливе Юпсесунд и транспортировался в пластиковых контейнерах по 0.5 и 2 л. Черви S. fiordicum содержались в аквариуме на протяжении 64 дней с 22.02.2022 (момент посадки) по 26.04.2022 (момент проверки). Для оценки состояния червей на 26.04.2022 мы вынимали червей из пластиковой трубки и проводили их осмотр под стереомикроскопом. В качестве индикаторов состояния червя мы оценивали его подвижность внутри хитиновой трубки, целостность его переднего и заднего конца, наличие переднего щупальца и сохранение естественной красноватой окраски тела. В табл. 2 приведены параметры содержания S. fiordicum в лабораторных условиях, которые были максимально приближены к условиям среды обитания в месте сбора червей.
По результатам содержания в аквариуме в течение 64 дней в хорошем состоянии осталось 3 особи. Полученные результаты показывают возможность содержания френулятных погонофор в лабораторных условиях более 2-х месяцев при поддержании параметров среды, близких к таковым в естественном местообитании. Низкая выживаемость червей в лабораторных условиях, возможно, связана с травмирующим способом сбора червей. S. fiordicum обитают в относительно длинных (до 243 мм) и очень тонких (0.2–0.3 мм в диаметре) трубках. При сборе с помощью дночерпателя, промывке и извлечении S. fiordicum из проб грунта их трубки перегибаются, что приводит к повреждению мягких тканей, которое остается незамеченным при визуальном обследовании. Для успешного культивирования S. fiordicum необходимо разработать щадящие методы сбора червей и их транспортировки.
Список литературы
Schmaljohann R., Flügel H.J. Methane-oxidizing bacteria in Pogonophora // Sarsia. 1987. V. 72 (1). P. 91–98.
Schmaljohann R., Faber E., Whiticar M. et al. Co-existence of methane-and sulphur-based endosymbioses between bacteria and invertebrates at a site in the Skagerrak // Marine Ecology Progress Series. 1990. V. 61. P. 119–124.
Naganuma T., Elsaied H.E., Hoshii D., et al. Bacterial endosymbioses of gutless tube-dwelling worms in nonhydrothermal vent habitats // Marine biotechnology. 2005. V. 7 (5). P. 416–428.
Aida M., Kanemori M., Kubota N., et al. Distribution and population of free-living cells related to endosymbiont a harbored in Oligobrachia mashikoi (a Siboglinid Polychaete) inhabiting Tsukumo Bay // Microbes and environments. 2008. V. 23 (1). P. 81–88.
Lösekann T., Robador A., Niemann H., et al. Endosymbioses between bacteria and deep-sea siboglinid tubeworms from an Arctic Cold Seep (Haakon Mosby Mud Volcano, Barents Sea) // Environmental Microbiology. 2008. V. 10. P. 3237–3254.
Savvichev A.S., Kadnikov V.V., Kravchishina M.D., et al. Methane as an organic matter source and the trophic basis of a laptev sea cold seep microbial community // Geomicrobiology Journal. 2018. V. 35 (5). P. 411–423.
Rimskaya-Korsakova N.N., Karaseva N.P., Kokarev V.N., et al. First Discovery of Pogonophora (Annelida, Siboglinidae) in the Kara Sea Coincide with the Area of High Methane Concentration // Doklady Biological Sciences. 2020. V. 490 (1). P. 25–27.
Karaseva N., Gantsevich M., Obzhirov A., Shakirov R., Starovoitov A., Smirnov R., et al. Correlation of the siboglinid (Annelida: Siboglinidae) distribution to higher concentrations of hydrocarbons in the Sea of Okhotsk // Marine Pollution Bulletin. 2020. V. 158. P. 111448.
Современные методы гидрохимических исследований океана. М.: ИОАН СССР; 1992. 200 p.
Cline J.D. Spectrophotometric determination of hydrogen sulfide in natural waters // Limnology and Oceanography. 1969. V. 14. P. 454–458.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


