Доклады Российской академии наук. Науки о жизни, 2022, T. 507, № 1, стр. 483-487
НЕЙРОПРОТЕКТОРНЫЙ ЭФФЕКТ НЕЙРОПЕПТИДА ЦИКЛОПРОЛИЛГЛИЦИНА ЗАВИСИТ ОТ АКТИВАЦИИ AMPA- И TRK-РЕЦЕПТОРОВ
Член-корреспондент РАН Т. А. Гудашева 1, *, К. Н. Колясникова 1, А. Г. Аляева 1, С. В. Николаев 1, Т. А. Антипова 1, академик РАН С. Б. Середенин 1
1 ФГБНУ “НИИ фармакологии имени В.В. Закусова”
Москва, Россия
* E-mail: tata-sosnovka@mail.ru
Поступила в редакцию 20.06.2022
После доработки 18.07.2022
Принята к публикации 20.07.2022
- EDN: LZLJPW
- DOI: 10.31857/S2686738922060099
Аннотация
Ранее нами было показано, что эндогенный нейропептид циклопролилглицин (ЦПГ) является положительным модулятором АМРА-рецепторов, выявлена зависимость анксиолитического и антигипоксического действия циклодипептида от BDNF/Trk сигналинга. В настоящей работе в экспериментах in vitro с применением блокаторов AMPA-рецепторов DNQX и GYKI 52466 и блокатора Trk-рецепторов K252a впервые выявлено, что нейропротекторный эффект ЦПГ зависит от активации как АМРА, так и Trk рецепторов.
Циклопролилглицин (ЦПГ), эндогенный циклодипептид, теоретически предполагался в качестве топологического пептидного аналога классического ноотропа пирацетама (N-карбамидометилпирролидона-2) [1], а в дальнейшем был идентифицирован в головном мозге грызунов [2], в плазме крови, цереброспинальной жидкости и головном мозге человека [3]. Установлено, что ЦПГ подобен по структуре пирацетаму, и обладает сходным спектром фармакологических эффектов, включая ноотропную, антигипоксическую, нейропротекторную и анксиолитическую активности [4, 5].
В электрофизиологических экспериментах на изолированных клетках Пуркинье мозжечка крыс выявлена способность ЦПГ положительно модулировать токи AMPA-рецепторов [6]. Подобно другим ампакинам [7, 8], ЦПГ повышает содержание мозгового нейротрофического фактора (brain derived neurotrophic factor, BDNF) в нейрональных культурах [9]. При этом важно, что спектр фармакологической активности ЦПГ, включая нейропротекторную, прокогнитивную, антидепрессивную, анальгетическую [10], близок к имеющемуся у BDNF [11, 12]. На основе этих данных нами сформулирована гипотеза, что фармакологические эффекты ЦПГ обусловлены стимуляцией BDNF/TrkB сигналинга вследствие активации AMPA-рецепторов, что было подтверждено введением блокатора Trk-рецепторов K252A или конкурентного антагониста AMPA-рецепторов, соединения DNQX, которые препятствовали проявлению анксиолитического [13] и антигипоксического [5] эффектов ЦПГ.
Логично предположить, что и другие фармакологические эффекты ЦПГ также обусловлены стимуляцией АМРА/BDNF/TrkB каскада. Поэтому в настоящей работе мы изучили влияние конкурентного и неконкурентного антагонистов AMPA-рецепторов, DNQX [14] и GYKI 52466 [15] соответственно, и блокатора Trk-рецепторов K252a [16] на нейропротекторную активность ЦПГ на клеточной модели окислительного стресса.
Модель окислительного стресса на культуре гиппокампальных нейронов линии НТ-22 воспроизводили согласно [17]. Концентрация ЦПГ 10–6 М была выбрана как наиболее активная в электрофизиологических экспериментах на клетках Пуркинье [6], она также соответствует содержанию эндогенного ЦПГ в мозге у грызунов [2]. Окислительный стресс моделировали путем внесения перекиси водорода в конечной концентрации 1.5 мM в течение 30 мин, затем среду заменяли на обычную. Через 4 ч выполняли измерение жизнеспособности клеток методом MTT-теста с использованием 0.5% водного раствора бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолия [18], измеряя оптическую плотность при 600 нм. Статистическую обработку данных проводили с использованием критерия Краскела–Уоллиса с последующим тестом по Данну (ANOVA) или U-критерия Манна–Уитни. Данные представлены в виде m ± s.d.
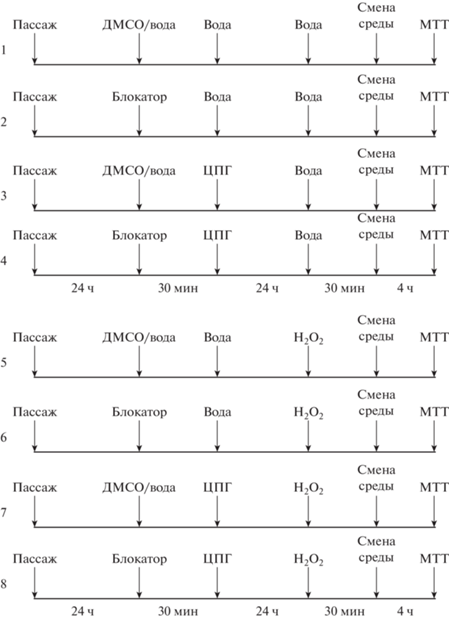
ЦПГ, растворенный в стерильной деионизованной воде в конечной концентрации 10–6 М, вносили в культуру клеток за 24 ч до окислительного стресса. Все блокаторы вносили за 30 мин до ЦПГ через 24 ч после пассажа. При этом K252a в 0.2% ДМСО вносили в конечной концентрации 0.2 мкМ [19], DNQX, также растворенный в 0.2% ДМСО, вносили в конечной концентрации 20 мкМ [20], блокатор GYKI 52466, растворенный в воде, вносили в конечной концентрации 100 мкМ [21]. Схема эксперимента по группам представлена на рис. 1.
Рис. 1.
Схема эксперимента. Группы: 1 – контроль, 2 – блокатор, 3 – ЦПГ, 4 – блокатор+ЦПГ, 5 – H2O2, 6 – блокатор + + H2O2, 7 – ЦПГ + H2O2, 8 – блокатор + ЦПГ + H2O2.
Внесение конкурентного антагониста AMPA-рецепторов DNQX, или ЦПГ, или обоих соединений в культуру гиппокампальных клеток НТ-22 при отсутствии повреждающего агента не оказывало статистически значимого влияния на жизнеспособность нейронов (рис. 2). Внесение H2O2 снижало жизнеспособность клеток достоверно по сравнению с контролем. Внесение DNQX не влияло на повреждающий эффект перекиси водорода. ЦПГ достоверно восстанавливал жизнеспособность клеток, а его нейропротекторный эффект предотвращался внесением антагониста DNQX.
Рис. 2.
Конкурентный антагонист AMPA-рецепторов DNQX снимает нейропротекторное действие ЦПГ на модели окислительного стресса. *– p < 0.05 по сравнению с группой “Контроль”, ^– p < 0.05 по сравнению с группой “H2O2”, #– p < 0.05 по сравнению с группой “ЦПГ+H2O2” (с использованием критерия Краскела–Уоллиса с последующим тестом по Данну (ANOVA)). Данные представлены в виде m ± s.d.

Аналогично, внесение неконкурентного антагониста AMPA-рецепторов GYKI 52466, ЦПГ или обоих соединений в культуру клеток HT-22 без повреждения не приводило к изменению жизнеспособности нейронов (рис. 3). Внесение GYKI 52466 не влияло на повреждающий эффект перекиси водорода. ЦПГ достоверно повышал жизнеспособность клеток в присутствии перекиси водорода, чего не наблюдалось в случае предварительного внесения неконкурентного антагониста GYKI 52466.
Рис. 3.
Неконкурентный антагонист AMPA-рецепторов GYKI 52466 снимает нейропротекторное действие ЦПГ на модели окислительного стресса. *– p < 0.05 по сравнению с группой “Контроль”, ^– p < 0.05 по сравнению с группой “H2O2”, #– p < 0.05 по сравнению с группой “ЦПГ+H2O2” (с использованием критерия Краскела–Уоллиса с последующим тестом по Данну (ANOVA)). Данные представлены в виде m ± s.d.

Таким образом, можно полагать, что АМРА-рецепторы включены в механизмы нейропротекторной активности ЦПГ.
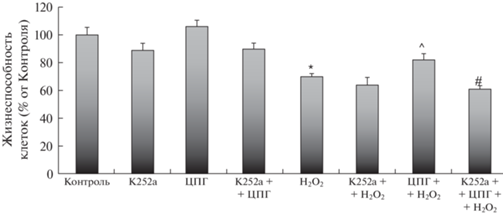
Блокатор Trk-рецепторов K-K252a и ЦПГ по отдельности или вместе не приводили к изменениям жизнеспособности в культуре клеток HT-22 (рис. 4). Соединение K252a не изменяло характера действия перекиси водорода. ЦПГ достоверно восстанавливал жизнеспособность клеток, что полностью снималось предварительным внесением K252a.
Рис. 4.
Блокатор Trk-рецепторов K252a снимает нейропротекторное действие ЦПГ на модели окислительного стресса.
*– p < 0.05 по сравнению с группой “Контроль”, ^– p < 0.05 по сравнению с группой “H2O2”, #– p < 0.05 по сравнению с группой “ЦПГ+H2O2” (с использованием критерия Манна–Уитни).
Данные представлены в виде m ± s.d.
Полученные данные свидетельствуют в пользу участия BDNF/TrkB сигналинга в нейропротекторной активности ЦПГ.
Совокупность полученных результатов позволяет сделать заключение об участии опосредованного AMPA-рецепторами TrkB-зависимого сигналинга в нейропротекторном действии ЦПГ, который, вероятно, является эндогенным модулятором АМРА-рецепторов.
Список литературы
Gudasheva T.A., Ostrovskaya R.U., Maksimova F.V., et al. Proline-based topologic pyracetam analogs and their nootropic activity // Pharm. Chem. J. 1989. V. 23. P. 203–208.
Gudasheva T.A., Boyko S.S., Akparov V.Kh., et al. Identification of a novel endogenous memory facilitating cyclic dipeptide cyclo-prolylglycine in rat brain // FEBS Letters. 1996. V. 391. P. 149–152.
Kang D., Waldvogel H.J., Wang A., et al. The autocrine regulation of insulin-like growth factor-1 in human brain of Alzheimer’s disease // Psychoneuroendocrinology. 2021 V. 127. P. 105191.
Gudasheva T.A., Konstantinopol’skii M.A., Ostrov-skaya R.U., et al. Anxiolytic activity of endogenous nootropic dipeptide cycloprolylglycine in elevated plus-maze test // Bulletin of experimental biology and medicine. 2001. V. 131. № 5. P. 464–466.
Колясникова К.Н. Григоркевич О.С., Аляева А.Г., Гудашева Т.А. Изучение вовлеченности TrkB-рецепторов в антигипоксическое действие нейропептида цикло-пролилглицина // Вопросы биологической, медицинской и фармацевтической химии. 2022. Т. 25. № 1. С. 39–42.
Gudasheva T.A., Grigoriev V.V., Koliasnikova K.N., et al. Neuropeptide cycloprolylglycine is an endogenous positive modulator of AMPA receptors // Doklady Biochemistry and Biophysics. 2016. V. 471. № 1. P. 387–389.
Lauteborn J.C., Lynch G., Vanderklish P., et al. Positive Modulaion of AMPA Receptors Increases Neurotrophin Expression by Hippocampal and Cortical Neurons // Journal of Neuroscience. 2000. V. 20. № 1. P. 8–21.
Jourdi H., Hsu Y.-T., Zhou M., et al. Positive AMPA Receptor Modulation Rapidly Stimulates BDNF Release and Increases Dendritic mRNA Translation // Journal of Neuroscience. 2009. V. 29. № 27. P. 8688–8697.
Gudasheva T.A., Koliasnikova K.N., Antipova T.A., Seredenin S.B. Neuropeptide cycloprolylglycine increases the levels of brain-derived neurotrophic factor in neuronal cells // Doklady Biochemistry and Biophysics. 2016. V. 469, № 1. P. 273–276.
Ferro J.N., de Aquino F.L., de Brito R.G., et al. Cyclo-Gly-Pro, a cyclic dipeptide, attenuates nociceptive behaviour and inflammatory response in mice // Clin Exp Pharmacol Physiol. 2015. V. 42. № 12. P.1287–1295.
Schmidt H.D., Duman R.S. Peripheral BDNF Produces Antidepressant-Like Effects in Cellular and Behavioral Models // Neuropsychopharmacology. 2010. V. 35. P. 2378–2391.
Bathina S., Das U.N. Brain-derived neurotrophic factor and its clinical implications // Archives of Medical Science. 2015. V. 11. № 6. P. 1164–1178.
Gudasheva T.A., Povarnina P.Y., Koliasnikova K.N., et al. The Anxiolytic Effect of the Neuropeptide Cycloprolylglycine Is Mediated by AMPA and TrkB Receptors // Doklady Biochemistry and Biophysics. 2020 V. 493. № 1. P. 190–192.
Sheardown M.J., Nielsen E.O., Hansen A.J., et al. 2,3-Dihydroxy-6-nitro-7-sulfamoyl-benzo(F)quinoxaline: a neuroprotectant for cerebral ischemia // Science. 1990. V. 247. № 4942. P. 571–574.
Birch P.J., Grossman C.J., Hayes A.G. 6,7-Dinitro-quinoxaline-2,3-dion and 6-nitro,7-cyano-quinoxaline-2,3-dion antagonise responses to NMDA in the rat spinal cord via an action at the strychnine-insensitive glycine receptor // European Journal of Pharmacology. 1988. V. 156. № 1. P. 177–180.
Sólyom S., Tarnawa I. Non-competitive AMPA antagonists of 2,3-benzodiazepine type // Current Pharmaceutical Design. 2002. V. 8. № 10. P. 913–939.
Jackson G.R., Werrbach-Perez K., Ezell E.L., Post J.F., Perez-Polo J.R. Nerve growth factor effects on pyridine nucleotides after oxidant injury of rat pheochromocytoma cells // Brain Research. 1992. V. 592. № 1–2. P. 239–248.
UedaY., Walsh E., Nakanishi H., Yoshida K. A colorimetric assay method for the evaluation of neurotrophic activity in vitro // Neuroscience Letters.1994. V. 165. P. 203–207.
Chang J.H., Mellon E., Schanen N.C., Twiss J.L. Persistent TrkA Activity Is Necessary to Maintain Transcription in Neuronally Differentiated PC12 Cells // Journal of Biological Chemistry. 2003. V. 278. № 44. P. 42877–42885.
Lee S.-H., Govindaiah G., Cox C.L. Selective excitatory actions of DNQX and CNQX in rat thalamic neurons // Journal of Neurophysiology. 2010. V. 103. № 4. P. 1728–1734.
Mathiesen C., Varming T., Jensen L.H. In vivo and in vitro evaluation of AMPA receptor antagonists in rat hippocampal neurones and cultured mouse cortical neurons // European Journal of Pharmacology. 1998. V. 353. № 2–3. P. 159–167.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


