Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 211-214
Выбор аминокислотного сайта с одной из самых быстрых кинетик расщепления эндосомной протеазой катепсином В для потенциального применения в системах доставки лекарств
Ю. В. Храмцов 1, **, академик РАН Г. П. Георгиев 1, член-корреспондент РАН А. С. Соболев 1, 2, *
1 Институт биологии гена Российской академии наук
Москва, Россия
2 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
** E-mail: ykhram2000@mail.ru
* E-mail: alsobolev@yandex.ru
Поступила в редакцию 21.11.2022
После доработки 17.12.2022
Принята к публикации 19.12.2022
- EDN: NBOJNC
- DOI: 10.31857/S2686738923700166
Аннотация
На основании известных литературных данных были выбраны шесть пептидных последовательностей, которые потенциально способны быстро расщепляться эндосомной протеазой катепсином В. Для сравнения изучалось также расщепление катепсином В распространенных линкерных последовательностей – полиглицина и полиглицин-серина. Разные концы данных пептидов были помечены флуоресцентными красителями sulfoCyanine3 и sulfoCyanine5, между которыми возможен резонансный перенос энергии по Фёрстеру (FRET). Кинетика расщепления пептидов катепсином В изучалась на мультимодальном плашечном ридере по уменьшению сигнала FRET. Было показано, что для потенциального использования в различных системах доставки лекарств наиболее подходящими являются сайты расщепления FKFL и FRRG. Данные сайты значительно эффективнее расщепляются в слабокислых условиях эндосом, чем при нейтральных значениях рН, характерных для внеклеточной среды.
Многие высокомолекулярные биоактивные вещества не способны самостоятельно проникать в клетки-мишени, поэтому для их проникновения обычно используются различные системы доставки [1, 2]. Для попадания доставляемого вещества в цитозоль необходимо, чтобы оно вышло из эндосом [1, 2]. При этом отщепление в эндосомах доставляемого вещества от системы доставки потенциально может заметно улучшить попадание этого вещества в цитозоль [3]. Примером протеазы, которую можно использовать для этих целей, является катепсин В, который многие вирусы используют для активации поверхностных белков для выхода этих вирусов из эндосом [4]. Специфичность и эффективность данной протеазы сильно зависят от рН среды. В литературе известен целый ряд аминокислотных сайтов, которые могут расщепляться катепсином В при слабокислых рН эндосом, но не расщепляться или слабо расщепляться при нейтральных значениях рН, характерных для внеклеточной среды. Примером таких сайтов могут служить: FKFL [3], GFLG [5], FRRG [6], HRFR [7], EGEF [8] и AVGGAG [9]. Однако система доставки находится в эндосомах относительно недолго, поэтому скорость расщепления выбранного сайта должна быть максимально возможной. В то время как по литературным данным не представляется возможности сравнить кинетику расщепления разных сайтов в одних и тех же условиях. Это было сделано в настоящей работе, что позволило выбрать наиболее оптимальные сайты расщепления катепсином В. В полипептидных системах доставки, таких, например, как разработанных нами модульных нанотранспортерах [2, 10], могут использоваться различные аминокислотные линкеры, например, полиглицин и полиглицин-серин. Чтобы узнать, способен ли катепсин В расщеплять эти линкеры, в данной работе также были выбраны пептиды GGGG и GSGS. Кинетика расщепления этих пептидов интересна еще и потому, что катепсин В потенциально способен расщеплять связь глицин-глицин [9]. Для изучения кинетики расщепления выбранных пептидов они были мечены с обеих концов флуоресцентными красителями sulfo-Cyanine3 и sulfo-Cyanine5, между которыми может происходить резонансный перенос энергии по Фёрстеру (FRET). Уменьшение сигнала FRET говорило о расщеплении пептида.
Пептиды FKFLC, GFLGC, FRRGC, HRFRC, EGEFC, AVGGAGC, GGGGC и GSGSC были получены химическим синтезом на заказ (Elabscience Biotechnology Inc., США) с чистотой ≥95%. В буфере 10 мМ Na2HPO4, 150 мМ NaCl, рН 7.0 к 400 мкМ пептида добавляли 800 мкМ sulfo-Cyanine3 активированный эфир и 800 мкМ sulfo-Cyanine5 малеимид. Инкубировали 1 ч при комнатной температуре и постоянном перемешивании. Измерение сигнала FRET проводили в плашках Costar 96 с черными стенками на мультимодальном ридере ClarioStar (BMG LABTECH, Германия) при длине возбуждения 485 нм и длине флуоресценции 715 нм, ширина оптической щели 15 нм. Пептид разводился в буфере 20 мМ HEPES, 20 мМ MES, 20 мМ цитрат натрия, 110 мМ NaCl с разными значениями рН до конечной концентрации 20 мкМ. Для расщепления использовался катепсин В (Native human Cathepsin B protein (ab90387, Abcam)) в концентрации 1 мкг/мл. Перед применением катепсин В активировался, как описано в [3]. Измерение снижения интенсивности сигнала FRET проводили до 1 ч с периодичностью 2 мин. Эксперименты повторяли от 3 до 9 раз. В качестве контроля были получены данные по кинетике изменения сигнала FRET для образцов (три повтора), к которым не был добавлен катепсин В (максимальный уровень сигнала FRET), а также данные по кинетике изменения сигнала FRET для образцов, не содержащих пептид, а только флуоресцентные красители sulfo-Cyanine3 и sulfo-Cyanine5 в соответствующей концентрации (нулевой уровень). Это позволило для каждого пептида рассчитать его долю, подвергшуюся расщеплению для соответствующих значений рН и времен. По зависимостям доли расщепленного пептида от времени, t, была рассчитана константа скорости расщепления, k, путем интерполяции данных кривых зависимостью 1 – exp(–k × t).
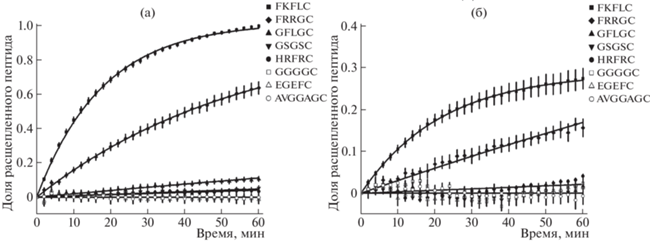
На рис. 1 представлены данные по кинетике расщепления пептидов FKFLC, FRRGC, GFLGC, GSGSC, HRFRC, GGGGC, EGEFC и AVGGAGC катепсином В при рН 6.0 и 7.5, которые, как считается [9], отвечают рН эндосом и внеклеточного пространства. При рН 6.0 значения k составляют 0.057 ± 0.004 мин–1, 0.0173 ± 0.0016 мин–1, 0.00198 ± ± 0.00012 мин–1, 0.00081 ± 0.00011 мин–1 и 0.00073 ± ± 0.00005 мин–1 для пептидов FKFLC, FRRGC, GFLGC, GSGSC и HRFRC соответственно. Для пептидов GGGGC, EGEFC и AVGGAGC расщепления в данном временном интервале не наблюдалось (рис. 1а). При рН 7.5 доля расщепленного пептида была в несколько раз меньше, чем при рН 6.0 (рис. 1). При рН 7.5 значения k составляют 0.0068 ± 0.0007 мин–1, 0.0031 ± ± 0.0004 мин–1 и 0.00026 ± 0.00013 мин–1 для пептидов FKFLC, FRRGC и HRFRC соответственно. Для остальных пептидов при этом рН расщепления не наблюдалось (рис. 1б).
Рис. 1.
Кинетика расщепления различных пептидов (20 мкМ) катепсином В (1 мкг/мл) при рН 6.0 (а) и 7.5 (б). Указана среднеквадратичная ошибка доли расщепленного пептида (3–9 повторов).
Для пептидов FKFLC и FRRGC, лучше всего подверженных расщеплению катепсином В, были получены более подробные зависимости значения k от рН буфера (рис. 2). По этим зависимостям видно, что эффективность расщепления данных пептидов возрастает по мере уменьшения рН буфера (рис. 2). Иными словами, данные сайты будут эффективнее расщепляться в поздних эндосомах (рН 5.5), чем в ранних эндосомах (рН 6.0).
Рис. 2.
Зависимость константы скорости расщепления, k, пептида (20 мкМ) FKFLC (а) и FRRGC (б) катепсином В (1 мкг/мл) от рН буфера. Указана среднеквадратичная ошибка константы k (3–9 повторов).
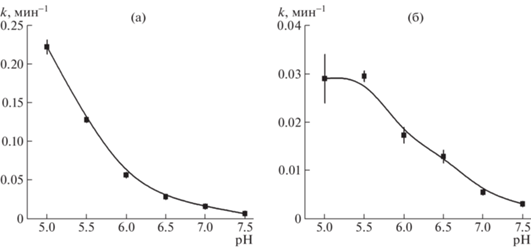
Таким образом, из восьми потенциальных сайтов расщепления катепсином В наиболее перспективными для расщепления в эндосомах являются сайты FKFL и FRRG. Эффективность их расщепления возрастает по мере уменьшения рН с 7.5 до 5. Для использования в системах доставки, нацеленных на нормальные клетки, лучше всего подходит сайт FKFL. Если доставка требуется в опухолевые клетки, то из-за сверхэкспрессии катепсина В в этих клетках [11] наиболее перспективным может оказаться сайт FRRG, т.к. он будет лучше расщепляться в опухолевых клетках, по сравнению с нормальными. Кроме того, известно, что некоторая доля катепсина В попадает во внеклеточное пространство [11], а в опухолях часто происходит закисление внеклеточной среды до рН 6.8 [12]. В этих условиях отщепление доставляемой молекулы от системы доставки может происходить раньше времени, тем самым снижая концентрацию этой молекулы в клетке-мишени. Учитывая, что при слабокислых рН эффективность ферментативного расщепления сайта FRRG значительно меньше, чем сайта FKFL (рис. 2), для использования в системах доставки в опухолевые клетки он может оказаться предпочтительнее сайта FKFL.
В результате проведенной работы нами было продемонстрировано, что при слабокислых условиях эндосом лучше всего расщепляются сайты FKFL и FRRG, в то время как при нейтральных рН эффективность расщепления этих сайтов значительно снижается. Данные сайты можно включить в состав выбранной системы доставки биологически активных веществ для потенциального увеличения эффективности их доставки в заданный компартмент клетки.
Список литературы
Liu G., Yang L., Chen G., et al. // Front Pharmacol. 2021. V. 12. 735446.
Sobolev A.S. // Front Pharmacol. 2018. V. 9. 952.
Kern H.B., Srinivasan S., Convertine A.J., et al. // Mol Pharmaceutics. 2017. V. 14. № 5. P. 1450–1459.
Bottcher-Friebertshauser E., Garten W., Klenk H.D. // Activation of viruses by host proteases. 2018. Springer. 337 p.
Jin X., Zhang J., Jin X., et al. // ACS Med Chem Lett. 2020. V. 11. № 8. P. 1514–1520.
Shim M.K., Park J., Yoon H.Y., et al. // J Contr Rel. 2019. V. 294. P. 376–389.
Poreba M., Rut W., Vizovisek M., Groborz K., et al. // Chem Sci. 2018. V. 9. P. 2113–2129.
Jordans S., Jenko-Kokalj S., Kuhl N.M., et al. // BMC Biochemistry. 2009. V. 10, 23.
Biniossek M.L., Nagler D.K., Becker-Pauly C., et al. // J. Proteome Res. 2011. V. 10. P. 5363.
Khramtsov Y.V., Vlasova A.D., Vlasov A.V., et al. // Acta Cryst. 2020. V. D76. P. 1270–1279.
Aggarwal N., Sloane B.F. // Proteomics Clin Appl. 2014. V. 8. P. 427–437.
Zhang X., Lin Y., Gillies R.J. // J Nucl Med. 2010. V. 51. P. 1167–1170.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


