Экология, 2019, № 3, стр. 196-204
Моделирование биоклиматического ареала крупнотравных сообществ Северо-Восточной Азии
К. А. Корзников a, *, Д. Е. Кислов a, П. В. Крестов a
a Ботанический сад-институт ДВО РАН
690024 Владивосток, ул. Маковского, 142, Россия
* E-mail: korzkir@mail.ru
Поступила в редакцию 18.06.2018
После доработки 12.11.2018
Принята к публикации 16.11.2018
Аннотация
Выполнено моделирование размещения биоклиматических ниш комплекса крупнотравных сообществ в условиях современной и прогнозируемой к 2070 г. климатической обстановки, а также в условиях климата максимального развития последнего оледенения (около 21 тыс. лет назад). Наиболее важными биоклиматическими параметрами, описывающими географическое распространение крупнотравья, являются количество выпавших в виде снега осадков (высота снежного покрова), тепловой и холодовой индексы Кира и индекс континентальности. В условиях максимума последнего оледенения биоклиматические рефугиумы крупнотравья могли сохраниться на Курильских островах, но отсутствовали на о-ве Сахалин и п-ове Камчатка. Современные тенденции изменения климата приведут к увеличению площади пригодных для крупнотравных сообществ территорий на российском Дальнем Востоке, но вызовут сокращение биоклиматического ареала крупнотравья в Японии.
Сообщества крупнотравья – характерный и узнаваемый компонент растительности приокеанических районов Северо-Восточной Азии. К крупным травам относят до 30–40 видов, из них высоты 2.5–4 м достигают не более 10, нередко именуемых “гигантскими” [1–6]. В оптимальных условиях отдельные растения вырастают до 4.5–5 м, обычно же высота сообществ крупнотравья составляет 2–2.5 м. Индекс листовой поверхности (leaf area index, LAI) в травостоях Filipendula camtschatica на Сахалине достигает 13.3 м2 м–2, средние запасы биомассы составляют 4.7 кг м–2, из которых 1.9 кг м–2 приходится на надземные части растений [4]. Впечатляющий внешний вид, высокая скорость роста и продуктивность позволяют считать эти сообщества феноменом умеренных широт [6, 7].
Поддерживающие существование крупнотравья факторы подробно обсуждались в ряде работ [4–11]. Основные из них: наличие глубокого снежного покрова, предохраняющего почву от промерзания в период зимнего покоя растений; большое количество осадков и высокая влажность воздуха в течение вегетационного периода; высокая микробиологическая активность почв и быстрая минерализация опада; преобладание рассеянной радиации над прямой, что уменьшает потерю углерода на фотодыхание; низкие ночные температуры, снижающие активность дыхания.
В рамках эколого-флористической классификации растительности крупнотравные сообщества объединены в класс Filipendulo–Artemisietea montanae Ohba 1973. Ассоциация Cirsio kamtschaticae–Polygonetum sachalinensis (Ohba 1973) Ohba et Sugawara 1982 включает травостои гигантских растений п-ова Камчатка, островов Сахалин и Хоккайдо, Курильского архипелага. Крупнотравье центральной и северной части Хонсю относится к ассоциации Angelico–Polygonetum sachalinensis Suz.-Tok. et al. 1956 [12, 13]. Также крупные травы формируют ярус в пойменных и долинных лесах, в лесах из каменной березы (Betula ermanii) [13–17].
Крупнотравье Северо-Восточной Азии считается древним автохтонным комплексом третичного времени [6, 18–20]. Изменения климата в плейстоцене сильно повлияли на состав и географическое размещение растительных комплексов региона [21–23]. Во время максимума последнего оледенения (Last Glacial Maximum, LGM, около 21 тыс. лет назад), среднегодовая температура в регионе была ниже современной на 8–9°C, а климат более сухим [24, 25]. Открытым остается вопрос, могли ли подобные условия поддерживать существование сообществ крупных трав в островном секторе Северо-Восточной Азии и на Камчатке?
Для реконструкции климата и растительного покрова широко используется спорово-пыльцевой анализ [26, 27]. Однако этот метод имеет ряд ограничений, например связанных с сохранностью пыльцы и неполной представленностью флоры в спорово-пыльцевых спектрах [28]. Другой подход основан на построении и интерполяции моделей, учитывающих взаимосвязь между распространением таксонов или сообществ и экологическими факторами, в частности климатическими [29–31]. Этот же подход применим для прогнозирования потенциальных ареалов видов и сообществ вследствие глобальных климатических изменений [32].
В настоящей работе мы приводим результаты моделирования биоклиматических ниш крупнотравных сообществ, для которых характерно доминирование одного или нескольких видов растений: Angelica ursina, Heracleum lanatum (Apiaceae), Filipendula camtschatica (Rosaceae), Petasites amplus (Asteraceae) и Reynoutria sachalinensis (Polygonaceae). Проверены две гипотезы: 1) в течение максимума последнего оледенения биоклиматические рефугиумы крупнотравья могли сохраниться на территории современных о-ва Сахалин, п-ова Камчатка, Курильских островах; 2) прогнозируемые климатические изменения в Северо-Восточной Азии будут способствовать сдвигу биоклиматического ареала крупнотравья в более северные широты, увеличению его площади на территории Дальнего Востока России и сокращению на Японских островах.
МАТЕРИАЛ И МЕТОДЫ
Подход к моделированию
Для создания модели распространения нами проанализированы все имеющиеся материалы, содержащие информацию как о распространении сообществ дальневосточного крупнотравья (геоботанические описания), так и о распространении видов, слагающих крупнотравные сообщества (гербарные данные). Каждая точка присутствия крупнотравного сообщества, включенная в выборку, имела точную географическую привязку.
В качестве независимых переменных рассматривали биоклиматические параметры местообитаний, включающие как формальные климатические параметры, так и физиологически значимые биоклиматические индексы, расчет которых был возможен на основании массовых метеорологических данных о среднемесячных показателях температуры и осадков. На первом этапе отбора биоклиматических параметров были исключены взаимоcкоррелированные показатели. На последующих этапах была проведена оценка вклада каждого параметра в объяснение вариации результативного признака (вероятность нахождения локалитета крупнотравного сообщества в данной точке) под влиянием данного биоклиматического параметра. Было протестировано 19 параметров, рассчитанных порталом Worldclim [33], 22 параметра, рассчитанных порталом Worldwide Bioclimatic Classification System [34], 2 параметра, предложенных Kira [35], и снеговой индекс [36]. Анализ параметров позволил в дальнейшем исключить из модели малоинформативные индексы. Полученные закономерности используются на финальных этапах создания актуальных, ретроспективных и прогнозных моделей распространения крупнотравных сообществ, основанных на климатических моделях.
Данные для моделирования
Локалитеты мест произрастания (точки присутствия) каждого из пяти видов-доминантов устанавливали по данным собственных полевых исследований и гербарным коллекциям MW, VBGI и VLA [37]. Также использовали имеющие пространственную привязку данные Global Biodiversity Information Facility [38] и материалы сеточного картирования флоры о-ва Хоккайдо [39]. Порог максимальной плотности точек на участке земной поверхности 1 × 1 градус был выбран равным 40. В случае локального превышения плотности проводили исключение точек случайным образом до достижения заданного порога.
Обучающая выборка для комплекса крупнотравных сообществ сформирована путем объединения локалитетов пяти видов-доминантов. Учитывая, что ареалы видов шире, чем ареалы сообществ, также были исключены точки присутствия видов крупнотравья, не формирующих в данном локалитете крупнотравного сообщества и оказавшиеся за пределами известного по литературным источникам ареала высокотравья [6, 12]. Таким образом, размер обучающей выборки после предварительной обработки составил 727 точек присутствия. На ее основе провели калибровку модели взаимосвязи “биоклиматические параметры – крупнотравье” (рис. 1).
Рис. 1.
Кривые откликов модели распространения крупнотравья. Серой заливкой обозначена область 95%-ного доверительного интервала (число репликаций, n = 100).
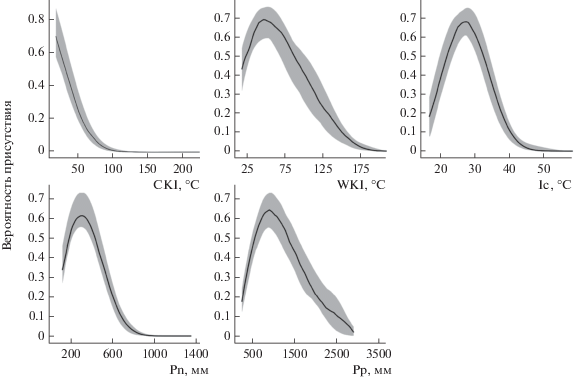
Для расчета биоклиматической ниши из более чем 30 биоклиматических параметров использованы наиболее информативные показатели: WKI – тепловой индекс Кира, сумма среднемесячных температур >5°C; CKI – холодовой индекс Кира, сумма (по модулю) среднемесячных температур <5°C; Ic – индекс континентальности, разность средних температур самого теплого и самого холодного месяцев; Pp – сумма осадков за период со среднемесячными температурами >0°C; Pn – сумма осадков за период со среднемесячными температурами <0°C [35, 36, 40, 41].
Значения биоклиматических индексов вычислены по данным из базы WorldClim v. 1.4 [33, 42]. Построенная на основе современных климатических параметров модель была спроецирована на условия максимума последнего оледенения и прогнозируемые к 2070 г. климатические условия. В обоих случаях использовали климатическую модель CCSM 4 (Community Climate System Model) [43]. Принимали во внимание два сценария изменения климата: RCP2.6 (подразумевает рост температуры на планете в среднем на 1°C) и RCP8.5 (рост на 3.7°C) (representative concentration pathways) [44]. Пространственное разрешение климатических данных современного и прогнозируемого климата составило 30 угловых секунд, климата последнего ледникового максимума – 2.5 угловые минуты. Контуры суши времени максимума последнего оледенения приведены с учетом понижения уровня моря до изобаты –120 м.
Моделирование
Решение задачи моделирования растительного покрова предполагает выбор и обучение классификационного алгоритма, позволяющего с наилучшей точностью предсказать факт присутствия объекта моделирования (вида или сообщества) с учетом актуальных экологических условий или оценить вероятность такого присутствия. Хорошие результаты показывают методы, основанные на логистической регрессии (в том числе с регуляризацией), а также деревья решений. Преимуществом последних является возможность воспроизведения сложных нелинейных зависимостей между предикторами и вероятностями целевых классов, а также сравнительная простота интерпретации каждого отдельно взятого процесса классификации. В каждом узле дерева решений присутствует легко интерпретируемое условие, выражаемое в терминах исходных предикторов, а не каких-либо их комбинаций, как в случае, например, с аддитивными моделями.
В качестве основного алгоритма машинного обучения для построения моделей был использован “случайный лес” (random forest) – реализация из пакета scikit-learn программной среды Python [45], с числом решающих деревьев, равным 100. “Случайный лес” успешно применяется для моделирования распространения объектов растительного покрова [46–48].
Постановка задачи моделирования как задачи бинарной классификации предполагает дополнение полученной выборки точками отсутствия. Для этой цели традиционен подход, заключающийся в случайном выборе точек на всем ареале моделирования [49]. При этом случайный выбор виртуальных точек отсутствия (pseudo-absence) производится с достаточно малой плотностью их пространственного размещения, чтобы существенно не повлиять на распределение вероятностей в окрестности точек присутствия. В настоящей работе число случайно выбираемых виртуальных точек отсутствия было равным порядка 10 000, следуя Phillips et al. [49, 50].
Для верификации построенных моделей использовалась площадь (AUC) под ROC-кривой (ROC – receiver operating characteristic – кривая ошибок, AUC – area under the curve – площадь под кривой ошибок), а также средние значения показателей ошибок первого и второго рода [49, 50]. Оценка параметров точности модели производилась на формируемых случайным образом тестовых выборках. Для генерации тестовых выборок использовался алгоритм stratified K-fold cross validation (K = 20) из пакета scikit-learn [45]. Для каждой пары тестовой и тренировочной выборок формировались оценки AUC и ошибок первого (вероятность ошибочно предсказать отсутствие) и второго (вероятность ошибочно предсказать присутствие) рода, что, учитывая многократность разбиений выборки, позволило получить осредненные величины этих показателей.
Отбор признаков (feature selection) при построении модели является важнейшим этапом, определяющим ее адекватность. При этом возможны различные подходы, апеллирующие как к экспертным представлениям, так и основывающиеся на результатах верификации модели на базе обучающей выборки. В нашей работе отбор производился в два этапа. На первом этапе формировался максимально полный набор признаков (включающий все биоклиматические переменные из базы WorldClim, ряд отдельно вычисленных показателей, как, например, индексы Кира, индекс континентальности и др.), который впоследствии был подвергнут фильтрации на основе взаимной корреляции показателей. На втором этапе к оставшимся переменным применялся алгоритм последовательного исключения признаков (из пакета scikit-learn) при постоянном отслеживании показателей AUC и ошибок первого и второго рода. В результате такой процедуры был определён используемый набор биоклиматических переменных.
В целях оценки связи моделируемого уровня вероятности присутствия объекта моделирования с биоклиматическими переменными были построены кривые отклика (response curves) для случаев, когда выбранный фактор является единственным предиктором модели, т.е. без участия других факторов. Кривые отклика строили для каждого вида отдельно и для всей выборки локалитетов, характеризующей область распространения крупнотравья.
Подсчет площадей биоклиматических ареалов провели для области современного развития крупнотравья и примыкающих к ней участков Дальнего Востока. Координаты крайней юго-восточной точки этого сектора – 30° с.ш. и 126.5° в.д., северо-восточной – 61° с.ш. 168 в.д. (рис. 1). Построение карт и подсчет площадей выполнены в программе ArcMap 10.4.1.
РЕЗУЛЬТАТЫ
Проведенная верификация дерева решений с использованием алгоритма перекрестной проверки (K-fold cross-validation) показала потенциально высокую прогностическую точность модели (табл. 1). В частности, максимальные значения вероятностей ошибочного предсказания присутствия видов (0.26–0.27) соответствуют A. ursina и H. lanatum, а в отношении других видов и сообщества крупнотравья в целом прогноз оказался еще более оптимистичным.
Таблица 1.
Значения AUC, вероятности ошибок и вклад факторов в модель (средние значения и стандартные отклонения)
| Объект моделирования | AUC | Вклад биоклиматических факторов | Вероятность ошибки | |||||
|---|---|---|---|---|---|---|---|---|
| Pn | WKI | Ic | CKI | Pp | 1-го рода | 2-го рода | ||
| Angelica ursina | 0.98 ± 0.06 | 0.34 ± 0.008 | 0.21 ± 0.007 | 0.13 ± 0.005 | 0.13 ± 0.007 | 0.17 ± 0.007 | 0.01 ± 0.004 | 0.27 ± 0.14 |
| Filipendula camtschatica | 0.97 ± 0.03 | 0.43 ± 0.005 | 0.15 ± 0.003 | 0.14 ± 0.004 | 0.13 ± 0.006 | 0.14 ± 0.005 | 0.02 ± 0.006 | 0.06 ± 0.05 |
| Heracleum lanatum | 0.95 ± 0.04 | 0.35 ± 0.007 | 0.21 ± 0.007 | 0.13 ± 0.004 | 0.12 ± 0.006 | 0.17 ± 0.007 | 0.01 ± 0.004 | 0.26 ± 0.13 |
| Petasites amplus | 0.98 ± 0.03 | 0.17 ± 0.003 | 0.21 ± 0.004 | 0.21 ± 0.003 | 0.08 ± 0.003 | 0.30 ± 0.003 | 0.02 ± 0.007 | 0.11 ± 0.05 |
| Reynoutria sachalinensis | 0.97 ± 0.05 | 0.28 ± 0.007 | 0.21 ± 0.012 | 0.20 ± 0.009 | 0.06 ± 0.005 | 0.23 ± 0.007 | 0.01 ± 0.006 | 0.12 ± 0.09 |
| Крупнотравье | 0.96 ± 0.03 | 0.42 ± 0.006 | 0.16 ± 0.006 | 0.15 ± 0.003 | 0.12 ± 0.004 | 0.14 ± 0.005 | 0.02 ± 0.01 | 0.08 ± 0.02 |
Наиболее значимым фактором при моделировании биоклиматических ниш крупнотравья и слагающих его видов-доминантов (кроме Petasites amplus) оказалась сумма осадков в месяцы с отрицательными температурами, интерпретируемая как мощность снегового покрова [36, 41]. Вклад всех других биоклиматических параметров был приблизительно равным. Для модели биоклиматического ареала P. amplus наиболее важным фактором стала сумма осадков в теплый период года (см. табл. 1).
Графики откликов представлены колоколовидными кривыми, кроме имеющего нулевые значения холодового индекса Кира (см. рис. 1). В силу различного географического распространения и отличий в экологии кривые отклика отдельных видов-доминантов крупнотравья не идентичны – виды занимают близкие, но не полностью совпадающие биоклиматические ниши.
Площадь современного биоклиматического ареала крупнотравных сообществ с уровнем вероятности присутствия более 0.5 составляет около 250 тыс. км2. В условиях LGM модель предсказывает существование биоклиматически пригодных для крупнотравья территорий (с вероятностью присутствия сообществ более 0.5) на площади около 224 тыс. км2 (табл. 2, рис. 2). Центр потенциального ареала сообществ располагался примерно на 10 градусов южнее современного, а наиболее оптимальные условия формировались вдоль побережья Японского моря в широтных пределах 30–42° с.ш., в том числе на приморских равнинах, образовавшихся вследствие регрессии моря. С вероятностью присутствия 0.1–0.5 участки, удовлетворяющие биоклиматическим потребностям крупных трав, сохранялись на территории современного о-ва Хоккайдо и Курильских островах.
Таблица 2.
Размеры (площадь) биоклиматических ареалов крупнотравья, км2 (доля, %)
| Период | Вероятность присутствия | ||
|---|---|---|---|
| 0–0.1 | 0.1–0.5 | 0.5–1 | |
| Настоящее время | 3 049 976 (87.14) | 200 659 (5.73) | 249 318 (7.12) |
| LGM | 4 031 522 (87.76) | 338 781 (7.37) | 223 609 (4.87) |
| 2070 г. RCP 2.6 | 2 831 021 (80.89) | 276 385 (7.90) | 392 548 (11.22) |
| 2070 г. RCP 8.5 | 2 629 353 (75.13) | 334 109 (9.55) | 536 496 (15.30) |
Рис. 2.
Биоклиматический ареал крупнотравья: а – настоящее время; б – максимум последнего оледенения; в – 2070 г., сценарий RCP2.6; г – 2070 г., сценарий RCP8.5; 1–3 – вероятность присутствия: 1 – 0.5–1; 2 – 0.1–0.5; 3 – 0–0.1.
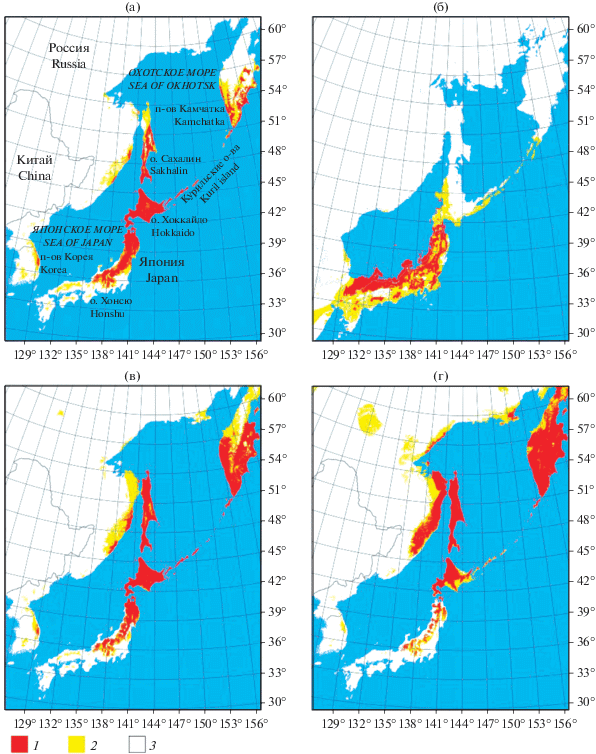
При реализации климатических сценариев RCP2.6 и RCP8.5 к 2070 г. произойдет увеличение площадей биоклиматических ниш крупнотравья до 393 и 536 тыс. км2 соответственно. Потенциально приемлемыми для сообществ крупных трав станут территории на севере Сахалина, центральной и северной Камчатке, в материковой части российского Дальнего Востока – по побережьям Японского и Охотского морей в широтных пределах 45–54° с.ш. Ухудшение условий для крупнотравных сообществ произойдет в южной части их современного ареала – на о-ве Хонсю, вплоть до фрагментации области сплошного распространения и образования отдельных “островов”, соответствующих верхним поясам гор.
ОБСУЖДЕНИЕ
Современное распространение крупнотравья соответствует условиям субокеанического и океанического биоклимата [36]. В зональном отношении ареал крупнотравья простирается от листопадных умеренных широколиственных лесов Хонсю (Fagetea crenatae-регион согласно [51]) до подзоны северной тайги на Камчатском полуострове [52]. Ранее среди климатических факторов, оказывающих влияние на распространение крупнотравных сообществ, исследователи указывали на особую роль зимних осадков и мощного снегового покрова [6]. Результаты моделирования подтверждают эту точку зрения. Мощный снеговой покров не только предохраняет почву от вымерзания и поддерживает высокую микробиологическую активность, но и обеспечивает растения обильной влагой в весенний период, когда рост крупных трав наиболее интенсивный. Длительное стаивание снега (например, в условиях п-ова Камчатка снеговой покров мощностью 2–4 м исчезает к концу июня, когда температура воздуха существенно превышает уровни, при которых возможна вегетация) приводит к сокращению вегетационного периода. Таким образом, короткий вегетационный период оказывается достаточным для развития крупнотравья, исключает конкуренцию со стороны деревьев и кустарников.
С продолжительностью вегетационного периода связан второй по информативности в полученной нами модели предиктор – тепловой индекс Кира, значения которого в районах распространения крупнотравья существенно ниже диапазона толерантности прямоствольной лесной растительности [36, 53].
Холодовой индекс Кира показывает продолжительность холодного периода. Его вклад в разработанную модель – определение южных пределов распространения крупнотравных сообществ. Он связан со снеговым индексом (суммой осадков в холодный период года), вместе они разделяют районы, где даже большие отложения снега в весеннее время стаивают очень быстро и не препятствуют развитию кустарниковой и лесной растительности, и районы, где длительное залеживание снега существенно сокращает вегетационный период.
Индекс континентальности отражает сезонную контрастность температурного режима, и его вклад в модель – определение материковой (западной) границы распространения крупнотравья. Увеличение индекса во внутриконтинентальных районах происходит в том числе и за счет резкого и сильного роста летних температур, что также вызывает очень быстрое таяние даже очень мощного снегового покрова и соответственно не укорачивает вегетационный сезон [41].
Согласно существующим реконструкциям и данным спорово-пыльцевого анализа [24, 25, 54–58], в период максимума последнего оледенения в восточной части п-ова Камчатка, на Курильских островах и на северо-востоке о-ва Хоккайдо были развиты лугово-тундровые комплексы с участками лиственничников; в западной части п-ова Камчатка – тундры с фрагментами лиственнично-березовых редколесий, а в горах – гольцовые пустыни, горные тундры и нивальные луга. На о-ве Сахалин наибольшее развитие получили лиственнично-березовые леса с травяно-кустарниковыми сообществами. В горных районах о-ва Сахалин существовали рефугиумы с фрагментами темнохвойных лесов [23]. Реконструкции [54, 55, 59] указывают на устойчивое развитие темнохвойных бореальных лесов на западе и юге о-ва Хоккайдо, в северной части о-ва Хонсю. Леса умеренного типа, хвойные и хвойно-широколиственные, севернее 38° с.ш. проникали только по побережьям. Вследствие регрессии моря побережья были представлены субаэральными пологонаклонными аккумулятивно-денудационными равнинами, расчлененными речными долинами [25]. Ранее было показано [60, 61], что освободившегося от воды участки морского дна были важными рефугиумами для вида умеренной флоры – диморфанта (Kalopanax septemlobus, Araliaceae).
Результаты проведенного нами моделирования показывают, что климатическая обстановка LGM не могла поддерживать существование сообществ крупнотравья на территории современного Сахалина и Камчатки. Факторами, лимитирующими развитие крупных трав, в это время были не только более низкие по сравнению с современными температуры, но и аридизация климата, повлекшая за собой уменьшение мощности снегового покрова и летнего увлажнения.
Территории с биоклиматическими параметрами, удовлетворяющими развитию крупнотравных видов (с невысокой вероятностью присутствия), соответствовали приморским равнинам западной части о-ва Хоккайдо. То же характерно для участка суши в районе нынешней Малой Курильской дуги, ранее соединенной с п-овом Немуро на о-ве Хоккайдо. Модель демонстрирует возможность сохранения рефугиумов крупнотравья – биоклиматически приемлемых местообитаний, на всем протяжении Курильского архипелага, вплоть до южной оконечности п-ова Камчатка. Крупнотравные сообщества на этой территории, видимо, были образованы наиболее холодостойкими видами – Filipendula camtschatica и Heracleum lanatum. Таким образом, наша первая гипотеза оказалась подтверждена лишь частично – биоклиматы о-ва Сахалин и п-ова Камчатка не могли поддерживать, а Курильских островов – могли поддерживать возможность сохранения крупнотравных сообществ в период LGM.
Современное изменение климата вызывает смещение ареалов теплоумеренных видов в северные широты и перераспределение растений в высотных поясах [62–65]. Важным фактором, влияющим на изменение ареалов отдельных видов и сообществ, считается не только увеличение эффективных температур, но и изменение режима увлажнения, соотношение количества осадков, выпадающих в виде дождя и снега.
В рамках построенных модельных представлений вторая гипотеза также получила подтверждение. Согласно сценариям RCP2.6 и RCP8.5, прогнозируемое к 2070 г. изменение климата в Северо-Восточной Азии будет способствовать увеличению площади потенциального биоклиматического ареала крупнотравья на Дальнем Востоке России, в том числе в материковой части, и уменьшению – на территории Японии. Однако это не вызовет столь же быстрой трансформации реальных ареалов видов и сообществ. Расселение видов запаздывает по сравнению с актуальной климатической обстановкой, что связано, например, с ограниченным поступлением диаспор растений и конкурентными взаимоотношениями в сообществах, эдафическими и многими другими факторами. Поэтому изменение климатических условий не приведет к одномоментному расширению области распространения крупнотравья, но будет определять тенденцию постепенного перемещения видов и сообществ в область оптимальной биоклиматической обстановки.
Список литературы
Степанова К.Д. Луга острова Сахалина и вопросы их улучшения. М.; Л.: Изд-во АН СССР, 1961. 100 с.
Степанова К.Д. Луга полуострова Камчатки. Владивосток: Дальневосточное кн. изд-во, 1965. 92 с.
Попов М.Г. Растительный мир Сахалина. М.: Наука, 1969. 136 с.
Морозов В.Л., Белая Г.А. Экология дальневосточного крупнотравья. М.: Наука, 1988. 255 с.
Белая Г.А., Морозов В.Л. Дальневосточное крупнотравье – особый тип растительности // Бюл. Московского об-ва испытателей природы. Отдел биологич. 2004. Т. 99. Вып. 3. С. 65–76.
Морозов В.Л. Феномен природы – крупнотравье. М.: Наука, 1994. 228 с.
Walter H. Über höchstwerte der produktion von natürlichen pflanzenbeständen in N.O. Asien // Vegetatio. 1981. V. 44. № 1. P. 37–41.
Тен Х.М., Федорова Л.В. Об уровне азотного питания в местах обитания крупнотравья на Сахалине // Почвоведение. 1974. № 4. С. 94–98.
Тен Х.М., Федорова Л.В. О роли крупнотравных растений в почвообразовании // Почвоведение. 1975. № 2. С. 15–19.
Белая Г.А. Экология доминантов камчатского крупнотравья. М.: Наука, 1978. 124 с.
Тен Х.М., Крысанова В.П. Закономерности роста крупнотравных растений на Сахалине и Курильских островах // Журн. общ. биол. 1978. Т. 39. № 4. С. 587–593.
Ohba T., Sugawara H. Vorschlag zur Systematik über japanischen Saumpflanzengesellschaften – Artemisietea principis Miywaki et Okuda 1971 // Bulletin of the Kanagawa Prefectural Museum. 1982. № 13. P. 143–169.
Vegetation of Japan. V. 9. Hokkaido. Ed. Miyawaki A. Tokyo: Shibundo, 1988. 563 p.
Кабанов Н.Е. Лесная растительность Советского Сахалина. Владивосток: Горнотаежная станция АН СССР, 1940. 210 с.
Тюлина Л.Н. Растительность западного побережья Камчатки / Отв. ред. Ветрова В.П. // Труды Камчатского ин-та экологии и природопользования ДВО РАН. Вып. 2. Петропавловск-Камчатский: Камчатский печатный двор, 2001. 304 с.
Нешатаева В.Ю. Растительность полуострова Камчатки. М.: Тов. научн. изд. КМК, 2009. 537 с.
Krestov P.V., Omelko A.M., Nakamura Yu. Vegetation and natural habitats of Kamchatka // Berichte der Reinhold-Tüxen-Gesellschaft. 2008. V. 20. P. 195–218.
Толмачев А.И. О флоре острова Сахалин // Комаровские чтения. Вып. 12. М.; Л.: Изд-во АН СССР, 1959. 104 с.
Толмачев А.И. Введение в географию растений. Л.: Изд-во ЛГУ, 1974. 244 с.
Ярошенко П.Д. Теоретические вопросы в курсах ботаники для высшей школы. Владимир: ВГПИ, 1969. 216 с.
Величко А.А. Природный процесс в плейстоцене. М.: Наука, 1973. 256 с.
Величко А.А. Структура ландшафтной оболочки эпохи максимального оледенения // Палеоклиматы и палеоландшафты внетропического пространства Северного полушария. Поздний плейстоцен–голоцен. Отв. ред. Величко А.А. М.: Геос, 2009. С. 95–98.
Крестов П.В., Баркалов В.Ю., Омелько А.М. и др. Реликтовые комплексы растительности современных рефугиумов Северо-Восточной Азии // Комаровские чтения. 2009. Вып. 56. С. 5–63.
Александрова А.Н. Плейстоцен Сахалина. М.: Наука, 1982. 192 с.
Короткий А.М., Гребенникова Т.А., Пушкарь В.С. и др. Климатические смены на территории юга Дальнего Востока в позднем кайнозое (миоцен–плейстоцен). Владивосток: Изд-во Дальневосточного ун-та, 1996. 56 с.
Bartlein P.J., Harrison S.P., Brewer S. et al. Pollen-based continental climate reconstructions at 6 and 21 ka: a global synthesis // Clim. Dynam. 2011. V. 37. № 3–4. P. 775–802.
Binney H., Edwards M., Macias-Fauria M. et al. Vegetation of Eurasia from the last glacial maximum to present: key biogeographic patterns // Quaternary Sci. Rev. 2017. V. 157. P. 80–97.
Klerk P., Joosten H. The difference between pollen types and plant taxa: a plea for clarity and scientific freedom // Quaternary Science J. 2007. V. 56. P. 162–171.
Potts A.J., Hedderson1 T.A., Franklin J., Cowling R.M. The Last Glacial Maximum distribution of South African subtropical thicket inferred from community distribution modelling // J. Biogeogr. 2013. V. 40. № 2. P. 310–322.
Hais M., Komprdová K., Ermakov N., Chytrý M. Modelling the Last Glacial Maximum environments for a refugium of Pleistocene biota in the Russian Altai Mountains, Siberia // Palaeogeogr. Palaeocl. 2015. V. 438. P. 13–145.
Janská V., Jiménez-Alfaro B., Chytrý M. et al. Palaeodistribution modelling of European vegetation types at the Last Glacial Maximum using modern analogues from Siberia: Prospects and limitations // Quaternary Sci. Rev. 2017. V. 159. P. 103–115.
Chen I.-C., Hill J.K., Ohlemüller R. et al. Rapid range shifts of species associated with high levels of climate warming // Science. 2011. V. 333. № 6045. P. 1024–1026.
Hijmans R.J., Cameron S.E., Parra J.L. et al. Very high resolution interpolated climate surfaces for global land areas // International J. of Climatology. 2005. V. 25. № 15. P. 1965–1978.
Rivas-Martínez S., Rivas-Sáenz S. Worldwide Bioclimatic Classification System, 1996–2018, Phytosociological Research Center, Spain. http://www.globalbioclimatics.org
Kira T. A climatological interpretation of Japanese vegetation zones // Vegetation science and environmental protection. Ed. Miyawaki A. Tokyo: Maruzen, 1977. P. 21–30.
Nakamura Yu., Krestov P.V., Omelko A.M. Bioclimate and zonal vegetation in Northeast Asia: first approximation to an integrated study // Phytocoenologia. 2007. V. 37. № 3–4. P. 443–470.
Thiers B. Index Herbariorum: A global directory of public herbaria and associated staff. New York Botanical Garden’s Virtual Herbarium, 2018 (continuously updated). http://sweetgum.nybg.org/science/ih/
GBIF.org (18 March 2018) GBIF Occurrence Download https://doi.org/ https://doi.org/10.15468/dl.54267l
Distribution maps of vascular plants in Hokkaido, Japan. 2017. http://www.hinoma.com/maps/
Rivas-Martínez S., Sánchez-Mata D., Costa M. North American boreal and western temperate forest vegetation. (Syntaxonomical synopsis of the potential natural plant communities of North America, II) // Itinera Geobotanica. 1999. V. 12. P. 5–316.
Krestov P.V., Omelko A.M., Nakamura Yu. Phytogeography of higher units of forests and krummholz in North Asia and formation of vegetation complex in the Holocene // Phytocoenologia. 2010. V. 40. № 1. P. 41–56.
Hijmans R.J., Graham C.H. The ability of climate envelope models to predict the effect of climate change on species distributions // Glob. Change Biol. 2006. V. 12. № 12. P. 2272–2281.
Gent P.R., Danabasoglu G., Donner L.G. et al. The Community Climate System Model version 4 // J. Climate. 2011. V. 24. № 19. P. 4973–4991.
Moss R.H., Edmonds J.A., Hibbard K.A. et al. The next generation of scenarios for climate change research and assessment // Nature. 2010. V. 463. P. 747–756.
Pedregosa F., Varoquaux G., Gramfort A. et al. Scikit-learn: machine learning in Python // J. Mach. Learn. Res. 2011. V. 12. P. 2825–2830.
Cutler D.R., Edwards T.C., Beard K.H. et al. Random forests for classification in ecology // Ecology. 2007. V. 88. № 11. P. 2783–2792.
Nakao K., Higa M., Tsuyama I. et al. Spatial conservation planning under climate change: using species distribution modeling to assess priority for adaptive management of Fagus crenata in Japan // J. Nat. Conserv. 2013. V. 21. № 6. P. 406–413.
Matsui T., Nakao K., Higa M. et al. Potential impact of climate change on canopy tree species composition of cool-temperate forests in Japan using a multivariate classification tree model // Ecol. Res. 2018. V. 33. № 2. P. 289–302.
Phillips S.J., Dudik M. Modeling of species distributions with MaxEnt: new extensions and a comprehensive evaluation // Ecography. 2008. V. 31. P. 161–175.
Phillips S.J., Dudík M., Elith J. et al. Sample selection bias and presence only distribution models: implications for background and pseudo absence data // Ecol. Appl. 2009. V. 19. № 1. P. 181–197.
Miyawaki A. A vegetation-ecological view of the Japanese Archipelago // Bull. of the Institute of Environmental Science and Technology, Yokohama National University, 1984. V. 11. P. 85–101.
Зоны и типы поясности растительности России и сопредельных стран. Пояснительный текст и легенда карты / Отв. ред. Огуреева Г.Н. М.: ЭКОР, 1999. 64 с.
Box E.O. Climatic relations of the forests of East and South-East Asia // Vegetation science in forestry / Box E.O. et al. (eds.). Amsterdam: Kluwer Academic Publishers, 1995. P. 23–55.
Tsukada M. Vegetation and climate during the Last Glacial Maximum in Japan // Quaternary Res. 1983. V. 19. № 2. P. 212–235.
Tsukada M. Map of vegetation during the Last Glacial Maximum in Japan // Quaternary Res. 1985. V. 23. № 3. P. 369–381.
Igarashi Y., Igarashi T., Daimaru H. et al. Vegetation history of Kenbuchi basin and Furano basin in Hokkaido, north Japan, since 32 000 yrs BP // The Quaternary Research (Daiyonki-Kenkyu). 1993. V. 32. № 2. P. 89–105.
Igarashi Y., Murayama M., Igarashi T. et al. History of Larix forest in Hokkaido and Sakhalin, northeast Asia since the last glacial // Acta Palaeontologica Sinica. 2002. V. 41. № 4. P. 524–533.
Igarashi Y., Zharov A.E. Climate and vegetation change during the late Pleistocene and early Holocene in Sakhalin and Hokkaido, northeast Asia // Quatern. Int. 2011. V. 237. № 1–2. P. 24–31.
Takahara H., Sugita S., Harrison S.P. et al. Pollen-based reconstructions of Japanese biomes at 0, 600 and 18 000 14C yr BP // J. Biogeogr. 2000. V. 27. № 3. P. 665–683.
Sakaguchi S., Sakurai S., Yamasaki M., Isagi Y. How did the exposed seafloor function in postglacial northward range expansion of Kalopanax septemlobus? Evidence from ecological niche modeling // Ecol. Res. 2010. V. 25. № 6. P. 1183–1195.
Sakaguchi S., Qiu Y.-X., Liu Y.-H. et al. Climate oscillation during the Quaternary associated with landscape heterogeneity promoted allopatric lineage divergence of a temperate tree Kalopanax septemlobus (Araliaceae) in East Asia // Mol. Ecol. 2012. V. 21. P. 3823–3838.
Birks H.J.B., Willis K.J. Alpines, trees, and refugia in Europe // Plant Ecol. Divers. 2008. V. 1. № 2. P. 147–160.
Morelli T.L., Daly C., Dobrowski S.Z. et al. Managing climate change refugia for climate adaptation // PLoS One. 2016. V. 12. № 1. e0169725.
Momohara A. Stages of major floral change in Japan based on macrofossil evidence and their connection to climate and geomorphological changes since the Pliocene // Quatern. Int. 2016. V. 397. P. 93–105.
Tang C.Q., Matsui T., Ohashi H. et al. Relict plant species in East Asia: identifying long-term stable refugia // Nat. Commun. 2018. V. 9. Article number: 4488.
Дополнительные материалы отсутствуют.


