Экология, 2019, № 4, стр. 297-308
Гистопатологии и изменения репродуктивных показателей у пеляди Coregonus peled из бассейна Нижней Оби
Л. А. Шуман a, *, А. Г. Селюков a, И. С. Некрасов a, Д. Н. Кыров a
a Тюменский государственный университет
625003 Тюмень, ул. Володарского, 6, Россия
* E-mail: leonidshuman@yandex.ru
Поступила в редакцию 09.06.2018
После доработки 20.08.2018
Принята к публикации 29.08.2018
Аннотация
Исследовали гистопатологии жабр, печени, почек и гонад, а также накопление тяжелых металлов у пеляди (Coregonus peled) из бассейна Нижней Оби. Установлены связь между концентрациями поллютантов в тканях и внешней среде и патологичностью внутренних органов пеляди, а также влияние морфофункционального состояния особей на их репродукционный потенциал. Выявлено уменьшение репродуктивных показателей пеляди, вызванное накоплением кадмия, ртути и свинца в тканях. Обсуждается двойственный характер влияния загрязнения на репродукционный потенциал популяции обской пеляди.
Западная Сибирь является одним из важнейших сырьевых регионов мира, и это определяет комплекс проблем окружающей среды. В водные экосистемы бассейна крупнейших рек региона – Оби и Иртыша – ежегодно вносится 120 тыс. т нефтепродуктов, что составляет почти 2.5% от общемирового поступления нефтепродуктов в окружающую среду из антропогенных источников [1, 2]; на отдельных участках акватории их концентрация может достигать 10 мг/л. Кроме нефтепродуктов, в воды региона также попадает значительное количество тяжелых металлов и органических соединений, что связано с деятельностью промышленных предприятий, сельского хозяйства и коммунальными стоками. Загрязнение вод напрямую влияет на здоровье водных экосистем и человека.
Среди рыб р. Оби наиболее подвержены антропогенному воздействию сиговые (Coregonidae), наименее устойчивые к интоксикации ксенобиотиками. Сиговые рыбы являются значимым элементом водных экосистем Обь-Иртышского бассейна, составляют важную компоненту его биоресурсного потенциала и существенную долю рациона малых народов Сибири. Большинство сиговых рыб, обитающих в Обской озерно-речной системе, являются полупроходными: летом они нагуливаются в Оби и ее притоках, а после нереста в осенне-зимний период мигрируют из заморных вод в Обскую губу. В настоящее время численность сиговых рыб Обского бассейна существенно сокращается. Это связано как с интенсивным промыслом, изменяющим структуру популяций, так и с поступлением в водные экосистемы ксенобиотиков антропогенного происхождения. Наиболее многочисленный вид семейства – пелядь – составляет значительную долю в структуре рыболовства Западной Сибири.
Для определения степени антропогенного воздействия на гидроэкосистемы и оценки качества и безопасности водной среды для гидробионтов используют такие биоиндикаторы, как состояние внутренних органов, крови, иммунологический статус и др. Гистологическое исследование жаберного аппарата, печени и почек, являющихся основными органами-мишенями для поллютантов, позволяет установить неблагоприятные факторы среды, с которыми организм сталкивался на протяжении длительного времени [3, 7].
Исследование закономерностей формирования репродукционного потенциала необходимо для получения представлений об устойчивости популяций рыб и формирования концепции здоровья экосистем. Общеизвестно, что размножение – необходимое условие преемственности поколений, обеспечивающее существование вида, поэтому любые изменения или нарушения в функционировании репродуктивной системы являются важным диагностическим показателем в оценке состояния популяции. Различные репродуктивные стратегии рыб влияют на способность популяций адаптироваться к климатическим и антропогенным изменениям среды обитания. Изучение гаметогенеза в течение годового цикла существенно для понимания репродуктивных стратегий разных видов рыб [8–10], поэтому гистологические исследования репродуктивной системы рыб из загрязненных акваторий весьма актуальны для оценки устойчивости и репродукционного потенциала популяции.
Цель настоящей работы состояла в оценке состояния и взаимосвязи морфофункциональных, гистопатологических и репродуктивных показателей пеляди (Coregonus peled) из речных систем бассейна Нижней Оби и их корреляции с характером и уровнем техногенного загрязнения среды.
МАТЕРИАЛ И МЕТОДЫ
Отбор образцов и пробоподготовка. Отбор и общий биологический анализ рыб проводили в устьевой зоне Оби (рис. 1): в начале ее миграции после зимовки в Обской губе (июнь 2012 г.), во время нагула в крупнейшем притоке Нижней Оби – Северной Сосьве (июль 2012 г.) и в период нерестовой миграции в Нижней Оби (сентябрь 2012 г.). Возраст определяли по чешуе. Для гистологического анализа гонады, печень, почки и жабры пеляди фиксировали в смеси Буэна и 4%-ном нейтральном формалине. Участки жабр, печени, почек, мышц и позвоночника замораживали для анализа на содержание тяжелых металлов. Всего для этих целей было отобрано 165 особей.
Рис. 1.
Места отбора проб: 1 – устье р. Оби; 2 – среднее течение р. Северной Сосьвы; 3 – р. Обь в районе слияния с р. Иртыш.
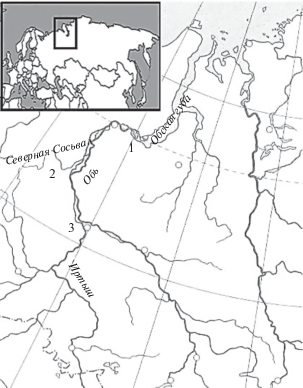
Одновременно со сбором ихтиологического материала в устье Оби, в Нижней Оби вблизи устья Иртыша и в Обской губе в районе пос. Новый Порт проводили отбор проб воды для гидрохимического анализа. Гидрохимические параметры р. Северная Сосьва взяты из литературных источников [11].
Участки зафиксированных органов дегидратировали в этаноле возрастающей концентрации и заливали в парафиновые блоки. Из блоков при помощи микротома готовили срезы толщиной 5 мкм и помещали их на предметные стекла. Препараты окрашивали железным гематоксилином по Гейденгайну, в дальнейшем анализировали на микроскопе при увеличениях ×40, ×100, ×200, ×400 и ×1000 и фотографировали.
Поскольку количественный анализ ооцитов в яичниках на разных стадиях затруднен из-за вероятности недооценки относительного количества ооцитов малых размерных групп, для выявления истинного соотношения половых клеток разных генераций в яичнике нами была использована методика получения 3D-моделей гонад. Из гонад, зафиксированных в 4%-ном формалине, изготавливали срезы толщиной 0.5–1 мм и окрашивали флуоресцентными красителями – пиронином Y и акридиновым оранжевым. Срезы дегидратировали в этаноле, заключали в среду “BioMount” (BioOptica) и монтировали под покровное стекло. Эти препараты анализировали на конфокальном лазерном сканирующем микроскопе LSM 510 META (Zeiss). При помощи программного обеспечения LSM 510 строили трехмерные модели участков яичника, подсчитывали и анализировали клетки по всей глубине среза. Определяли фазу развития, диаметры ооцитов и их ядер.
Гистологический анализ. Гистопатологические изменения внутренних органов оценивали полуколичественным методом [12], модифицированным нами:
Химический анализ воды был проведен в лаборатории качества вод, устойчивости экосистем и экотоксикологии Тюменского государственного университета. Анализируемые параметры включали pH, электропроводность (20°C), ${\text{NH}}_{4}^{ + }$, ${\text{PO}}_{4}^{{2 - }}$, катионы (Са2+, Mg2+, К+, Na+), которые были измерены с использованием атомно-абсорбционной спектроскопии, а анионы ${\text{(SO}}_{4}^{{2 - }}$, Сl–, ${\text{NO}}_{3}^{ - })$ измеряли с использованием ионной хроматографии.
Концентрации металлов определяли с использованием атомно-абсорбционной спектрометрии на графитовой печи (AAnalyst-800, Corp., Norwalk, CT, USA), концентрации ртути – с помощью анализатора ртути Perkin-Elmer FIMS-100. Стандартные растворы с соответствующими концентрациями для каждого элемента были изготовлены из 1000 ppm стандартов AAS (Merk, Darmstadt, Germany).
Измерение концентраций тяжелых металлов. Материалом для измерения концентрации тяжелых металлов послужили замороженные образцы внутренних органов (печень, почки, жабры), мышц и скелета рыб. В лабораторных условиях образцы были лиофилизированы (Labconco FreeZone 2.5 L) и озолены в 5 М HNO3 с использованием системы микроволнового разложения MW-800. Содержание металлов определяли методом атомно-адсорбционной спектрофотометрии в спектрофотометре AA-6300 с графитовой печью GFA-EX7i. Определение содержания ртути проводили методом холодного пара с применением ртутной приставки MVU-1A. Все результаты анализа выражены в мкг/г сухой массы.
Статистический анализ. Для анализа использовали программный пакет STATISTICA Statsoft, Inc. (v.6, 2006) и MS Excel (2007). Статистические различия в гистопатологических изменениях органов рыб оценивали с помощью непараметрического U-критерия Манна-Уитни. Корреляции между гистопатологическими и морфофизиологическими показателями были выражены через непараметрический коэффициент корреляции рангов Спирмана. Различия между выборками определяли с 95%-ной доверительной вероятностью безошибочных прогнозов.
РЕЗУЛЬТАТЫ
Химический состав воды. Гидрохимические характеристики приведены в табл. 1. Для Нижней Оби характерна относительно высокая концентрация хлоридов, сульфатов, отмечается присутствие нефтяных углеводородов и таких металлов, как Hg, Cd, Ni, Co, Al. На состав воды Обской губы заметное влияние оказывают морские воды, что проявляется в высокой минерализации и большом содержании хлорида натрия.
Таблица 1.
Гидрохимические показатели в речных системах Обского бассейна
| Показатель | Акватория | |||
|---|---|---|---|---|
| Обская губа (Новый Порт, июнь 2012 г.) | Устье Оби (июнь 2012 г.) | Нижняя Обь (вблизи устья Иртыша, сентябрь 2012 г.) | Северная Сосьва (данные из [12]) | |
| рН | 7.09 | 6.91 | 8.05 | 8.05 |
| Удельная электропроводность, mkSm/cm | 235 | 55.5 | 143.7 | – |
| ${\text{NH}}_{4}^{ + }$, mg/L | 0.077 | 0.025 | 0.27 | 0.42 |
| Li, mcg/L | 0.003 | 0.0013 | 3.07 | – |
| Ca2+, mg/L | 27.48 | 6.54 | 17.15 | 11.04 |
| Mg2+, mg/L | 0.33 | 2.08 | 3.79 | 3.60 |
| Na+, mg/L | 9.57 | 2.27 | 6.92 | 5.48 |
| K+, mg/L | 1.44 | 0.63 | 0.92 | 0.64 |
| ${\text{SO}}_{4}^{{2 + }}$, mg/L | 8.85 | 3.02 | 4.68 | 3.18 |
| ${\text{NO}}_{3}^{ + }$, mg/L | 2.74 | 0.11 | 0.02 | 0.04 |
| Cl–, mg/L | 7.31 | 1.53 | 2.7 | 3.19 |
| ${\text{PO}}_{4}^{{2 - }}$, mg/L | 0.052 | 0 | 0 | 0.05 |
| F–, mg/L | 0.12 | 0.04 | 0.12 | – |
| ${\text{NO}}_{2}^{ - }$, µg/L | 0.007 | 0.015 | 0.0034 | 0.00002 |
| Br, mg/L | 0.0185 | 0 | 0.0083 | – |
| ${\text{HCO}}_{3}^{ - }$, mg/L | 113.17 | 21.6 | 88.71 | 57.85 |
| Cu, µg/L | 2.08 | 1.74 | 1.96 | – |
| Cr, µg/L | 0.19 | 0.064 | 0.47 | – |
| Mn, µg/L | 1.21 | 1.0 | 1.17 | – |
| Zn, µg/L | 0.98 | 0.25 | 0.39 | 7.59 |
| Sr, µg/L | 210.4 | 22.74 | 117.1 | 37.53 |
| Pb, µg/L | 0 | 0 | 0 | – |
| Ni, µg/L | 0.68 | 14.92 | 2.05 | – |
| Al, µg/L | 83.01 | 32.95 | 32.21 | – |
| Cd, µg/L | 0.036 | 0 | 0.099 | 9.92 |
| Co, µg/L | 0.194 | 0.046 | 0.09 | 25.71 |
| Hg, µg/L | – | – | 0.158 | 0.04 |
| Oil HC, µg /L | – | – | 0.022 | 0.182 |
| Alk, µeqv/L | 1.85 | 0.35 | 1.45 | – |
Относительно высоки концентрации никеля и алюминия в Обской губе и устье Оби. В Северной Сосьве – притоке Оби – по литературным данным [12] отмечается высокая концентрация кадмия и кобальта. В этой реке также повышена концентрация нефтяных углеводородов.
Размерно-весовые показатели пеляди из исследованных акваторий приведены в табл 2. В уловах пеляди из устьевой зоны Оби при начале анадромной миграции были представлены неполовозрелые и фертильные особи возрастом 4+…7+. Размерно-весовые показатели слабо коррелируют с возрастом (r = 0.3), что может быть обусловлено преобладанием в выборке старших возрастных групп, у которых рост замедлен по причине конверсии трофических ресурсов на развитие половых продуктов. В р. Северная Сосьва нами были обнаружены особи возрастом от 4+ до 9+. В период нерестовой миграции в Нижней Оби самки пеляди были представлены половозрелыми особями 4+…9+, самцы – 4+…7+. В целом средние значения массы и длины тела пеляди соответствуют приведенным в литературе значениям, характерным для маловодного года [13, 14].
Таблица 2.
Размерно-весовые показатели пеляди
| Акватория | Показатели | Возраст | |||||
|---|---|---|---|---|---|---|---|
| 4+ | 5+ | 6+ | 7+ | 8+ | 9+ | ||
| Река Северная Сосьва | Длина по Смитту, мм | $\frac{{252 \pm 21}}{{212 - 318}}$ | $\frac{{293 \pm 14}}{{250 - 322}}$ | $\frac{{311 \pm 7}}{{294 - 325}}$ | $\frac{{307 \pm 7}}{{238 - 366}}$ | $\frac{{316 \pm 6}}{{304 - 336}}$ | $\frac{{335 \pm 21}}{{302 - 375}}$ |
| Масса тела, г | $\frac{{200 \pm 57}}{{104 - 403}}$ | $\frac{{315 \pm 50}}{{174 - 452}}$ | $\frac{{335 \pm 30}}{{139 - 273}}$ | $\frac{{350 \pm 25}}{{144 - 528}}$ | $\frac{{380 \pm 32}}{{282 - 459}}$ | $\frac{{505 \pm 121}}{{341 - 740}}$ | |
| Река Обь, устьевая зона |
Длина по Смитту, мм | $\frac{{293 \pm 26}}{{280 - 308}}$ | $\frac{{308 \pm 15}}{{286 - 324}}$ | $\frac{{310 \pm 12}}{{266 - 371}}$ | $\frac{{321 \pm 27}}{{299 - 402}}$ | – | – |
| Масса тела, г | $\frac{{262 \pm 15}}{{220 - 289}}$ | $\frac{{308 \pm 24}}{{226 - 373}}$ | $\frac{{306 \pm 13}}{{220 - 511}}$ | $\frac{{360 \pm 19}}{{252 - 771}}$ | – | – | |
| Река Обь, вблизи устья Иртыша | Длина по Смитту, мм | $\frac{{298 \pm 21}}{{212 - 318}}$ | $\frac{{302 \pm 17}}{{279 - 342}}$ | $\frac{{325 \pm 21}}{{280 - 340}}$ | $\frac{{324 \pm 23}}{{313 - 347}}$ | 323 | 362 |
| Масса тела, г | $\frac{{293 \pm 57}}{{259 - 323}}$ | $\frac{{339{\text{ }} \pm {\text{ }}23}}{{273 - 472}}$ | $\frac{{385 \pm 23}}{{284 - 480}}$ | $\frac{{375 \pm 25}}{{312 - 495}}$ | 422 | 615 | |
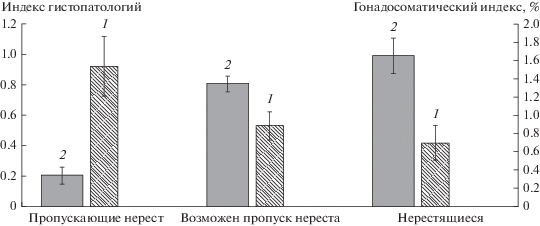
Гистопатологии. У всех изученных особей пеляди наблюдаются различные гистопатологии внутренних органов. В жабрах наиболее распространенными аномалиями были гиперплазия эпителия, утолщение, десквамация и разрушение респираторных ламелл (рис. 2).
Рис. 2.
Патоморфологические изменения жабр обской пеляди: а – десквамация эпителия и разрушение респираторных ламелл; б – то же при большем увеличении; в – утолщение респираторных ламелл и гиперплазия эпителия; г – то же при большем увеличении.
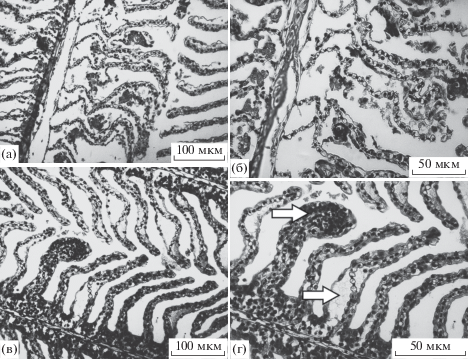
У рыб, отловленных в устье Оби, участки гистопатологий жаберного аппарата занимают в среднем 18% площади среза жабры при варьировании этого показателя у разных особей в пределах 1–60%. У пеляди из р. Северная Сосьва доля патологий составляла 30–40% площади среза, и наиболее значительными нарушениями были десквамация и разрушение ламелл, отмеченные у половины особей. У рыб, отловленных в Нижней Оби, участки с гистопатологиями жабр занимали 22% площади среза. Коэффициент патологичности при этом составлял в среднем 0.3, хотя у некоторых особей доходил до 1.1, что означает значительное нарушение жаберного аппарата, равносильное прекращению функционирования 30% жаберного эпителия. Патологичность жаберного аппарата у этой группы имела тенденцию увеличиваться с возрастом (r = 0.4).
В печени пеляди наиболее значимыми отклонениями были некроз и кавернизация печеночной ткани, участки дегенерации и апоптоза гепатоцитов, а также области с разрастаниями соединительной ткани (рис. 3).
Рис. 3.
Особенности патологических изменений печени пеляди из устья Оби: а – фиброз возле желчных протоков, ×20; б – то же при большем увеличении, виден апоптоз гепатоцитов (стрелка), ×100; в – разрушение печеночной ткани (стрелка), ×10; г – то же при большем увеличении, ×40.
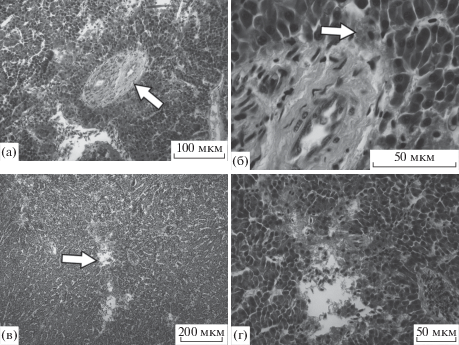
При микроскопическом анализе у 97% рыб из устья Оби были обнаружены большие или меньшие аномалии. Гепатоциты были в основном базофильны, но часто встречались клетки с жировой дистрофией. У 20% особей отмечали апоптоз гепатоцитов (см. рис. 3б). К наиболее серьезным патологиям можно отнести некроз и кавернизацию печеночной ткани, которые встречались у половины изученных особей из устья Оби и занимали в среднем 3% площади среза (см. рис. 3в, 3г), хотя у отдельных особей этот показатель достигал 20%.
У большинства особей пеляди из р. Северная Сосьва в печени отмечали признаки воспалительных процессов. Также были обнаружены различные по площади участки деструктивных изменений печеночной ткани, некротических преобразований гепатоцитов и образование каверн. Эти аномалии занимали в среднем 3% площади органа, у отдельных особей – до 13%. К распространенным формам патологий печени рыб из Северной Сосьвы относятся соединительнотканные разрастания: отдельные фиброзы сосудов отмечены у 50% рыб, фиброзы желчных протоков – у 31% (см. рис. 3а). В среднем участки с аномалиями занимают около 5% площади среза печени, у некоторых особей – до 13%.
У пеляди, отловленной в период нерестовой миграции, доля участков с патологиями в печени сравнительно невелика и составляет 2%, у некоторых особей возрастая до 9%.
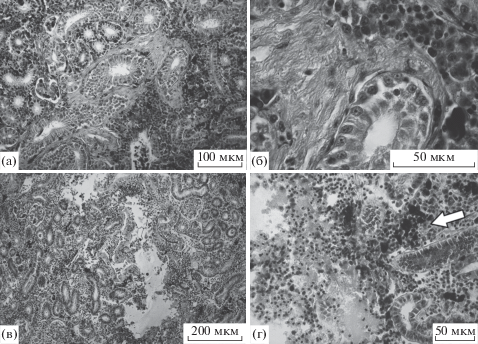
В почках пеляди встречались такие аномалии, как разрастания соединительной ткани (фиброэластоз), многочисленные мелано-макрофагальные центры, кровоизлияния и некроз почечной ткани (рис. 4). У пеляди из устья Оби участки почек с патологиями занимали в среднем 6.5% площади среза органа, но у отдельных особей этот показатель достигал 19%, коэффициент патологичности варьировал от 0.01 до 0.25, в среднем составляя 0.12. У пеляди из р. Северной Сосьвы доля участков почек с патологиями составляла в среднем 15%, коэффициент патологичности достигал 0.31. Следует отметить необычно частые для популяции признаки воспалительного процесса (ММЦ и инфильтрация лимфоцитов, см. рис. 4в, 4г) в почках, что может свидетельствовать об инфекционной или паразитарной инвазии, или о неспецифической стрессовой реакции. У особей пеляди во время нерестовой миграции участки почек с патологическими изменениями занимали 7.5% площади среза, максимально – до 30%; при этом коэффициент патологичности составлял 0.17.
Рис. 4.
Патологии почек пеляди из р. Оби: а – разрастания соединительной ткани (фиброэластоз), ×20; б – то же при большем увеличении, ×100; в – кровоизлияние и разрушение почечной ткани, ×10; г – то же при большем увеличении, хорошо заметны мелано-макрофагальные центры (стрелка), ×40.
В яичниках пеляди из устьевой зоны Оби в начале анадромной миграции старшей генерацией половых клеток были превителлогенные ооциты и ооциты фазы вакуолизации цитоплазмы (рис. 5а), рядом с которыми формировались гнезда оогоний и ооцитов ранней профазы мейоза (рис. 5б). У всех возрастных групп превителлогенные ооциты составляли большую часть половых клеток, и только 3–7% ооцитов вступали в фазу вакуолизации цитоплазмы и достигали 200–400 мкм в диаметре. В гонадах самок из р. Северной Сосьвы проходило активное развитие и пополнение ооцитов нерестового фонда (рис. 5в). Старшей генерацией половых клеток были ооциты фазы вакуолизации цитоплазмы или ооциты начала фазы накопления желтка (рис. 5г). У рыб во время нерестовой миграции большую часть яичника занимали вителлогенные ооциты. Значительных гистопатологий в гонадах всех изученных групп пеляди не обнаружено.
Рис. 5.
Состояние яичников обской пеляди: а – яичник пеляди из устьевой зоны Оби (июнь); б – то же при большем увеличении, видны оогонии (стрелка); в – яичник пеляди из Северной Сосьвы (июль); г – то же при большем увеличении; видны гранулы желтка, начинающие накапливаться в ооците (стрелки).
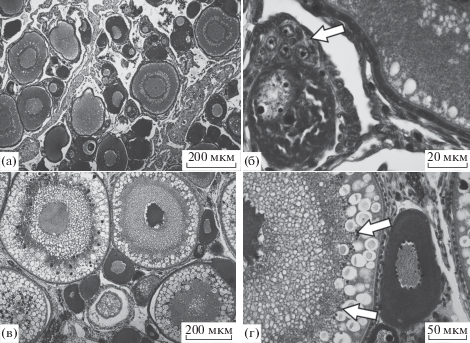
При сопоставлении степени патологичности жабр, печени и почек особей из разных участков бассейна Нижней Оби можно увидеть (рис. 6), что показатели патологичности печени и почек пеляди из р. Северной Сосьвы достоверно выше (U-критерий Манна-Уитни, p < 0.05), чем у пеляди из других мест.
Рис. 6.
Индекс гистопатологий внутренних органов пеляди в разных участках бассейна Нижней Оби: 1 – устье р. Оби (июнь 2012 г.); 2 – р. Нижняя Обь (сентябрь 2012 г.); 3 – р. Северная Сосьва (июль 2012 г.).
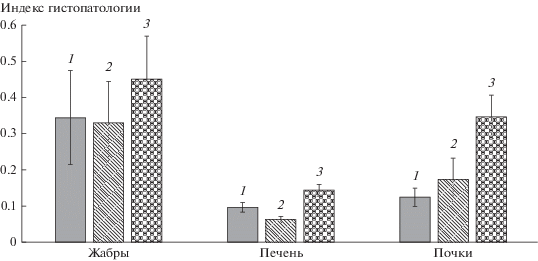
Корреляционный анализ репродуктивных показателей и гистопатологий внутренних органов продемонстрировал отрицательную связь гистопатологических индексов как с долей ооцитов нерестового фонда, так и с их размерами (p < 0.1). В значительной степени данная закономерность проявляется у пеляди во время нерестовой миграции.
У части половозрелых самок (11%) из р. Северной Сосьвы в гонадах присутствовали только превителлогенные ооциты. Такие особи пропустят предстоящий нерестовый сезон. Кроме того, у пеляди из этой реки была выявлена группа особей (23%), в яичниках которых присутствовали незначительные количества вителлогенных ооцитов. Эти особи с некоторой вероятностью также могут пропустить нерест. У пропускающих нерестовый сезон самок гистопатологии внутренних органов были достоверно выше, чем у особей, готовящихся к нересту (рис. 7).
Рис. 7.
Индекс гистопатологий внутренних органов (1) и гонадо-соматический индекс самок пеляди (2, июль) с разной вероятностью пропуска нереста.
Накопление тяжелых металлов. Так как в течение летнего сезона у рыб тяжелые металлы метаболизируются и выводятся из организма быстрее, чем в зимний период, когда обменные процессы замедлены, изучение их накопления в тканях пеляди было приурочено ко времени ее миграции из Обской губы. При анализе распределения кадмия, ртути и свинца установлено, что их концентрация в разных тканях значительно варьировала (табл. 3).
Таблица 3.
Содержание тяжелых металлов в тканях и органах пеляди в устье Оби
| Орган | Металл, мкг/г сухого веса | ||
|---|---|---|---|
| ртуть | свинец | кадмий | |
| Печень | 0.021 ± 0.012 | 0.146 ± 0.082 | 0.116 ± 0.031 |
| Почки | 0.022 ± 0.007 | 0.158 ± 0.148 | 0.791 ± 0.41 |
| Жабры | 0.006 ± 0.002 | 0.107 ± 0.024 | 0.02 ± 0.01 |
| Скелет | 0.003 ± 0.001 | 0.087 ± 0.009 | 0.002 ± 0.001 |
| Мышцы | 0.007 ± 0.003 | 0.118 ± 0.010 | 0.003 ± 0.001 |
В почках в наибольшей степени накапливался кадмий, в печени его содержание было невелико, а в жабрах, костных и мышечных тканях концентрация этого металла была незначительной. Для свинца и ртути характерно возрастание концентрации в ряду скелет–мышцы–жабры–печень–почки, но разница между содержанием этих металлов в исследованных тканях была невелика. Корреляционный анализ показал, что тяжелые металлы, особенно ртуть, накапливаются в организме с возрастом (r = 0.7…0.9; табл. 4).
Таблица 4.
Коэффициенты корреляции концентраций тяжелых металлов в тканях и морфофизиологических показателей пеляди
| Металл | Ткань | Возраст | Длина по Смитту | Масса | Патологии жабр | Патологии почек | Патологии печени | Количество превителогенных ооцитов | Количество вителлогенных ооцитов | Диаметр превителогенных ооцитов | Диаметр вителлогенных ооцитов |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Кадмий | Жабры | 0.74* | – | 0.07 | 0.32 | 0.32 | –0.11 | –0.31 | –0.12 | 0.25 | –0.54* |
| Почки | 0.73* | 0.26 | 0.04 | 0.35 | 0.42* | 0.02 | 0.02 | –0.06 | –0.88** | –0.42* | |
| Печень | 0.02 | 0.61 | 0.64 | 0.35 | 0.71* | 0.35 | –0.94** | –0.32 | 0.31 | –0.48* | |
| Костная ткань | 0.42* | –0.23 | –0.5 | 0.85* | 0.54* | 0.69* | –0.08 | –0.53* | –0.37* | –0.42* | |
| Ртуть | Жабры | 0.74* | 0.04 | 0.21 | 0.42* | –0.03 | –0.13 | 0.07 | –0.23 | 0.37 | 0.31 |
| Почки | 0.94** | 0.04 | 0.04 | 0.39 | 0.57* | 0.17 | 0.25 | –0.26 | –0.65* | 0.14 | |
| Печень | 0.97** | –0.21 | 0.16 | 0.14 | 0.21 | –0.3 | 0.14 | –0.2 | 0.42* | –0.4 | |
| Костная ткань | 0.63* | –0.41 | 0.61 | 0.07 | 0.53* | 0.4 | 0.07 | –0.75* | 0.21 | 0.16 | |
| Свинец | Жабры | 0.18 | –0.11 | 0.19 | 0.32 | 0.52* | 0.23 | –0.16 | 0.08 | –0.77* | –0.02 |
| Почки | 0.39* | 0.26 | 0.071 | 0.35 | –0.06 | –0.14 | –0.37 | –0.17 | 0.08 | –0.94** | |
| Печень | 0.06 | 0.76* | 0.80* | 0.25 | 0.67* | –0.09 | –0.54* | –0.34 | –0.25 | –0.77 |
Связь гистопатологий внутренних органов с накоплением в них тяжелых металлов была в основном слабой или средней. Патологии жабр слабо скоррелированы с накоплением в них тяжелых металлов (r = 0.3…0.4), но тесно связаны с концентрацией свинца, кадмия и ртути в скелете и мышцах (r = 0.7…0.8), что может означать длительные гистологические повреждения, сохраняющиеся даже после возможного прекращения их поступления в организм.
Сходная картина наблюдается и для печени: гистопатологии этого органа были слабо связаны с накоплением в них тяжелых металлов, но имели среднюю корреляцию (r = 0.5) с концентрацией металлов в скелетных и мышечных тканях, т.е. в тканях, способных сохранять в себе следы этих поллютантов длительное время после интоксикации, нередко хронической. Гистопатологические изменения почек, являющихся основным органом выведения из организма тяжелых металлов, слабо коррелировали с их накоплением во всех изученных тканях.
Корреляции содержания тяжелых металлов с репродуктивными показателями значительны. Характерно, что кадмий и свинец коррелируют с сокращением количества превителлогенных ооцитов (r = –0.82…–0.94; см. табл. 4), относящихся к резервному фонду половых клеток, а ртуть – с сокращением количества ооцитов старшей генерации, нерестового фонда (r = –0.75). На размеры ооцитов отрицательно влияют все исследованные металлы, в особенности свинец (r = –0.94) и кадмий (r = –0.88). Анализ показал, что кадмий и отчасти свинец накапливались с возрастом и соответственно коррелировали (r = 0.4…0.7) с размерно-весовыми показателями (см. табл. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Водоемы Обь-Иртышского бассейна отличаются большим разнообразием климатических, гидрологических, гидрохимических и биотических условий, поэтому те или иные биомаркеры, используемые для оценки здоровья популяции, можно связать лишь с интегральными показателями среды, характерными для всей речной системы. Особенно это справедливо для рыб, совершающих в речных системах длительные миграции. Воздействие поллютантов или других неблагоприятных факторов среды может быть локальным и врéменным, но оно отразится на морфофункциональном состоянии организма и после прекращения воздействия. В связи с этим для оценки состояния популяции целесообразно делать временны́е “срезы” на разных этапах жизненного цикла рыб, т.е. принимать исследуемые выборки за единый объект, изменяющийся во времени, хотя и с определенными нюансами: исследуемая популяция может распределяться по разным местам нагула и нереста, оказываясь в разных экологических условиях.
При оценке состояния внутренних органов выявляется следующая закономерность: у особей пеляди, отловленных в Нижней Оби, встречаемость и степень патологий в исследованных органах ниже, чем у рыб из Северной Сосьвы.
По данным ряда исследователей [15–17], при нефтяном загрязнении в жабрах на первый план выступают такие дегенеративные изменения, как некроз эпителия, десквамация респираторных ламелл, гемостаз и аневризмы в кровеносных сосудах, гиперплазия респираторных клеток. В жабрах исследованных нами рыб встречались все эти патологии, однако и по частоте встречаемости, и по степени их распространения они были менее значимы, чем у рыб, обитающих в условиях хронического нефтяного загрязнения.
Жабры являются первой и наиважнейшей мишенью растворенных в воде токсикантов, основным местом их поглощения, вследствие чего нарушаются физиологические процессы, ведущие к таким изменениям в структуре жаберного аппарата, как гиперплазия, слияние ламелл, аневризмы, деструкция ламеллярного эпителия, разрыв мембран клеток [6, 18, 19]. По частоте встречаемости аномалий можно предположить слабую загрязненность среды тяжелыми металлами в Нижней Оби и значительную – в Северной Сосьве.
В печени пеляди выявлены признаки интоксикации тяжелыми металлами. В этом органе у пеляди из р. Северной Сосьвы были обнаружены меланомакрофагальные центры. В то же время гистопатологических биомаркеров, свидетельствующих о нефтяном загрязнении, практически не было обнаружено.
Гистопатологии почек пеляди также являются следствием интоксикации тяжелыми металлами. Специфическим гистопатологическим маркером воздействия тяжелых металлов является почечнокаменная болезнь (нефрокальцитоз), выявленная нами у 50–60% изученных особей. Сходная встречаемость данной патологии обнаружена у рыб, подверженных воздействию сточных вод медно-никелевого и железорудного производства [20]. Также часто встречаются такие аномалии почечных канальцев, как некроз и вакуолизация эпителия, разрастания соединительной ткани (фиброэластоз) и др. В то же время повреждения сосудистых клубочков (гломерулопатии) встречались значительно реже. По мнению некоторых авторов [21], именно патологии почечных канальцев являются маркером поражения тяжелыми металлами. Кроме того, в почках исследованных рыб нами были обнаружены такие многочисленные неспецифические признаки нефропатии, как фиброэластоз и некроз гемопоэтической ткани, меланомакрофагальные центры, кровоизлияния и фиброз кровеносных сосудов. В целом почки имеют намного больше гистопатологий в качественном и количественном отношениях, чем печень.
Таким образом, у изученных особей пеляди во всех органах преобладают признаки интоксикации тяжелыми металлами. Достигая акваторий, в которых сиговые рыбы проводят большую часть года, загрязненная нефтепродуктами вода успевает разбавиться, а сами токсиканты подвергнуться биотрансформации, поэтому степень влияния нефтедобычи на обских сиговых рыб в настоящее время остается незначительной.
Концентрация кадмия в печени, почках, жабрах, мышцах и скелете пеляди из р. Оби меньше, чем у рыб, подвергающихся интенсивной интоксикации тяжелыми металлами в других регионах [22, 23].
Индексы гистопатологий внутренних органов слабо связаны с концентрациями кадмия, ртути и свинца в них, но корреляция гистопатологий жабр и печени с накоплением тяжелых металлов в мышцах и скелете была сильнее, чем с их накоплением в самих жабрах и печени. Можно предположить, что с момента интоксикации прошло достаточно много времени, и у интоксицированных рыб бóльшая часть вызвавших поражения внутренних органов металлов была выведена через почки. При этом в тканях, способных сохранять следы этих поллютантов длительное время после воздействия (костная ткань), концентрации металлов еще остаются повышенными.
В целом те или иные гистопатологии внутренних органов встречались у большинства (до 90%) особей пеляди. У 36% особей из устья Оби, у 75% особей из Северной Сосьвы и у 53% особей из Нижней Оби (вблизи устья Иртыша) коэффициенты патологичности жабр, печени и почек значительно превосходят фоновые значения, которые можно ожидать в незагрязненных водоемах [24]. Стоит отметить, что общая доля особей с различными гистологическими аномалиями значительно превосходит частоту встречаемости морфологических аномалий в бассейне Нижней Оби [25]. Это объясняется большей чувствительностью гистологических биомаркеров. Только значительные повреждения внутренних органов отражаются на органном и организменном уровнях и становятся заметны при морфологическом анализе.
Учитывая данные наших прежних исследований [6, 26], можно сделать вывод, что доля особей пеляди с гистологическими патологиями печени и жабр остается стабильно высокой.
Корреляционный анализ репродуктивных показателей и гистопатологий внутренних органов показывает отрицательную связь гистопатологических индексов как с долей ооцитов нерестового фонда, так и с их размерами. Кроме того, на примере пеляди из р. Северная Сосьва показано, что увеличение индексов гистопатологии и ухудшение морфофункционального состояния особей может привести к повышению вероятности пропуска очередного нереста.
Таким образом, можно считать высоковероятным влияние не только лишь естественного хода событий в годовом биологическом цикле, но и антропогенного загрязнения среды на долю ооцитов старшей генерации в яичниках пеляди и повышение численности пропускающих нерест особей.
Работа была выполнена при поддержке гранта правительства РФ (№ 11G34.31.0036) и гранта Российского фонда фундаментальных исследований (№ 15-29-06948-ofi). Авторы выражают благодарность Т.А. Кремлёвой за проведение химического анализа воды и А.К. Матковскому – за помощь в проведении экспедиций.
Список литературы
Wilson V.S., LeBlanc C.A. Petroleum pollution // Rev. Toxicol. 2000. V. 3. P. 77–112.
Хорошавин В.Ю., Моисеенко Т.И. Вынос нефтяных углеводородов реками с территорий нефтегазодобывающих районов севера западной Сибири // Водные ресурсы. 2014. Т. 41. № 5. С. 518–529. https://doi.org/10.7868/S0321059614050046. [Khoroshavin V.Y., Moiseenko T.I. Petroleum hydrocarbon runoff in rivers flowing from oil-and-gas-producing regions in northwestern Siberia // Water resources. 2014. V. 41. № 5. P. 532–542.]
Au D.W.T. The application of histocytopathological biomarkers in marine pollution monitoring: A review // Mar. Pollut. Bull. 2004. V. 48. P. 817–34. https://doi.org/10.1016/j.marpolbul.2004.02.032
Hinton D.E., Segner H., Au W.T. et al. Liver toxicology // The Toxicology of Fishes Eds. Di Giulio R. T., Hinton D.E. CRC Press, Boca Raton, FL, 2008. P. 327–400.
Schlenk D., Handy R., Steinert S. et al. Biomarkers // The Toxicology of Fishes Eds. Di Giulio R. T., Hinton D.E. CRC Press, Boca Raton, FL, 2008. P. 683–732.
Селюков А.Г. Морфофункциональные изменения рыб бассейна средней и Нижней Оби в условиях возрастающего антропогенного влияния // Вопросы ихтиологии. 2012. Т. 52. № 8. С. 547–565. https://elibrary.ru/item.asp?id=17928279.
Yancheva V., Velcheva I., Stoyanova S., Georgieva E. Histological biomarkers in fish as a tool in ecological risk assessment and monitoring programs: a review // Applied Ecology and Environmental Research. 2016. V. 14(1). P. 47–75. doi https://doi.org/10.15666/aeer/1401_047075
Hunter J.R., Macewicz B.J., Lo N.C.H., Kimbrell C.A. Fecundity, spawning, and maturity of female Dover Sole, Microstomus pacificus, with an evaluation of assumptions and precision // Fish Bull. 1992. V. 90. P. 101–128.
Richard J., Kestenmont R. Liver changes related to oocyte growth in roach a sigle spawner fish, and in bleak and white bream, twomultiple spawner fish // Int. Rev. Hydrobiol. 2003. V. 88. P. 68–76. https://doi.org/10.1007/s10152-013-0373-0
Murua H., Motos L. Reproductive strategy and spawning activity of the European hake Merluccius merllucius (L.) in the Bay of Biscay // J. Fish Biol. 2006. V. 69. P. 1288–1303. https://doi.org/https://doi.org/10.1111/j.1095-8649.2006.01169.x
Романова Т.И., Спиридонов А.Н., Спиридонова С.Ф. Геохимическая характеристика поверхностных вод бассейна реки Северная Сосьва // Вестн. Югорского гос. ун-та. 2009. № 3(14). С. 74–79.
Bernet D., Schmidt H., Meier W. et al. Histopathology in fish: Proposal for a protocol to assess aquatic pollution // J. Fish Dis. 1999. V. 22. P. 25–34. https://doi.org/https://doi.org/10.1046/j.1365-2761.1999.00134.x
Мельниченко И.П., Богданов В.Д. Динамика структуры нерестового стада пеляди в р. Северная Сосьва // Вестн. КрасГАУ. 2009. № 12. С. 75–79. [Melnichenko I.P., Bogdanov V.D. Dynamics of the syrok spawning run structure in the Northern Sosva river // The Bull. of KrasGAU. 2009. № 12. P. 75–79.]
Мельниченко И.П., Богданов В.Д. Динамика качественного состава нерестовых стад сиговых рыб реки Северной Сосьвы // Вестн. АГТУ. Сер.: Рыбное хозяйство. 2015. № 4. С. 32–37. [Melnichenko I.P., Bogdanov V.D. Dynamics of qualitative composition of the spawning stock of whitefishes in the Northern Sosva river // Vestnik of astrakhan state technical university. Series: fishing industry. 2015. № 4. P. 32–37.]
Simonato J.D., Guedes C.L.B., Martinez C.D.R. Biochemical, physiological and histological changes in the neotropical fish Prochilodus lineatus exposed to diesel oil // Ecotoxicol. Environ. Saf. 2008. V. 69. P.112–120. https://doi.org/https://doi.org/10.1016/j.ecoenv.2007.01.012
Silva C.A., Oliveira Ribeiro C.A., Katsumiti A. Evaluation of waterborne exposure to oil spill 5 years after accident in Southern Brazil // Ecotoxicol. Environ. Saf. 2009. V. 72. P. 400–409. https://doi.org/https://doi.org/10.1016/j.ecoenv.2008.03.009
Lukin A., Sharova J., Belicheva L., Camus L. Assessment of fish health status in the Pechora river: effects of contamination // Ecotoxicol. Environ. Saf. 2011. V. 74. № 3. P. 335–365. https://doi.org/10.1016/j.ecoenv.2010.10.022
Motoqueiro M., Satiko Okada Nakaghi L., De Souza J.P. et al. Histolopathological changes in the gill, liver and kidney of pacu (Piaractus mesopotamicus, Holmberg, 1887) exposed to various concentrations of trichlorfon // J. Appl. Ichthyol. 2008. V. 25. P. 124–127. https://doi.org/https://doi.org/10.1111/j.1439-0426.2008.01160.x
Santos T., Gomes V., Passos J. et al. Histopathological alterations in gills of juvenile Florida pompano Trachinotus carolinus (Perciformes, Carangidae) following sublethal acute and chronic exposure to naphthalene // Pan- American J. of Aquatic Sciences. 2011. V. 6(2). P. 109–120.
Moiseenko T.I., Kudryavtseva L.P. Trace metal accumulation and fish pathologies in areas affected by mining and metallurgical enterprises in the Kola Region, Russia // Environ. Pollut. 2001. V. 114(2). P. 285–297. https://www.ncbi.nlm.nih.gov/pubmed/11504351
Моисеенко Т.И., Шарова Ю.Н. Физиологические механизмы деградации популяций рыб в закисленных водоемах // Экология. 2006. Т. 37. № 4. С. 287–293. [Moiseyenko T.I., Sharova Y.N. Physiological mechanism of fish population degradation in acidified water // Russ. J. of Ecology. 2006. V. № 4. P. 257–263. doi 10.1134/S1067413606040072.]
Thophon S., Kruatrachue M., Upathan E.S. et al. Histopathological alterations of white seabass (Lates calca-rifer) in acute and subchronic cadmium exposure // Environ Pollut. 2003. V. 121. P. 307–320. https://doi.org/https://doi.org/10.1016/S0269-7491(02)00270-1
Conto Cinier C., Petit-Ramel M., Faure R. et al. Cadmium Bioaccumulation in Carp (Cyprino carpio) tissues during long-term exposure: analysis by Inductively Coupled Plasma-Mass Spectrometry // Ecotoxicol. Environ. Saf. 1997. V. 38. P. 137–143. https://doi.org/10.1006/eesa.1997.1569
Селюков А.Г., Шуман Л.А., Некрасов И.С. Состояние гонад у лососевидных рыб в субарктических озерах Ямала и Гыдана // Вестн. Тюменского гос. ун-та. Экология и природопользование. 2012. № 6. С. 31–40.
Госькова О.А., Мельниченко И.П., Богданов В.Д. Морфологические аномалии и травмы у пеляди в период нерестовой миграции в уральских притоках Оби // Вестн. АГТУ. Сер.: Рыбное хозяйство. 2014. № 4. С. 7–15. [Goskova O.A., Melnichenko I.P., Bogdanov V.D. Morphological anomalies and traumas of peled during spawning migration in the ural Ob tributaries // Vestnik of Astrakhan state technical university. Series: fishing industry. 2014. № 4. P. 7–15.]
Исаков П.В., Селюков А.Г. Сиговые рыбы в экосистеме Обской губы. Тюмень: Тюменский гос. ун-т, 2010. 184 с.
Дополнительные материалы отсутствуют.


