Экология, 2019, № 5, стр. 323-331
Разнообразие травяного яруса урбанизированных сообществ с доминированием инвазивного Acer negundo
Д. В. Веселкин a, *, Д. И. Дубровин a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: veselkin_dv@ipae.uran.ru
Поступила в редакцию 04.03.2019
После доработки 10.04.2019
Принята к публикации 17.04.2019
Аннотация
Сравнивали α-разнообразие травяного яруса сообществ, подверженных и не подверженных инвазии Acer negundo, но выровненных между собой по степени урбанизации, фрагментированности и антропогенной нарушенности. Исследования выполнены в г. Екатеринбурге (Россия; подзона южной тайги) на 13 участках по две пробные площади на каждом: одна – в сообществах с доминированием A. negundo; другая – в сообществах с доминированием других видов деревьев, т.е. всего 26 сообществ. Установлено, что ведущие причины варьирования характеристик травяного яруса – вид древесного доминанта (A. negundo или другие деревья) и площадь насаждений. В зарослях A. negundo число видов трав на 400 м2 было ниже, чем под кронами других деревьев: 17 ± 3 и 28 ± 3 соответственно. Однако сообщества с A. negundo и без него не различались по значениям индекса Шеннона и степени доминирования, а также по соотношениям однолетние/многолетние виды и граминоиды/разнотравье. Возрастание фрагментированности местообитаний сопровождалось ростом доли синантропных видов как под пологом A. negundo, так и в сообществах с доминированием других деревьев. В методическом плане результаты показали, что при оценке последствий растительных инвазий нужно обязательно учитывать пространственные закономерности детерминации структуры сообществ.
Биологические инвазии, или расселение видов растений и животных во вторичных ареалах, – один из глобальных факторов трансформации естественных экосистем [1–3]. Легко наблюдаемое и часто дискутируемое следствие расширения ареалов инвазивных растений – снижение разнообразия аборигенных сообществ [4]. Опубликовано много подтверждений негативных эффектов, сопровождающих внедрение чужеродных растений в сообщества-мишени [2, 5–7]. Самый радикальный эффект – вымирание аборигенных видов под влиянием чужеродных [8]. Однако существует альтернативная точка зрения, в соответствии с которой инвазивные виды могут повышать разнообразие, дополняя сообщества [9]. В региональном масштабе, т.е. на флористическом уровне, инвазии способствуют повышению разнообразия [10, 11].
Инвазивный клен ясенелистный Acer negundo L. активно расселяется в Евразии на нарушенных и полуестественных территориях [12–14]. В частности, A. negundo активно возобновляется в урбанизированных лесах Среднего Урала [15, 16]. Есть свидетельства, что в сообществах с доминированием A. negundo разнообразие аборигенных растений снижается [17, 18]. Аналогичное негативное влияние на разнообразие аборигенных сообществ оказывают при инвазии в ландшафты Северной Америки европейский Acer platanoides L. [19] и в меньшей степени – дальневосточный Acer ginnala Maxim. [20]. Однако накопленных сведений недостаточно для уверенного суждения о масштабах и механизмах влияния A. negundo на аборигенные сообщества и их компоненты. Например, мало известно, избирательны ли эффекты со стороны A. negundo на растения разных функциональных или флорогенетических групп. В Северной Америке при инвазии Acer ginnala более контрастны эффекты для богатства чужеродных трав, чем для нативных [20]. В Белоруссии в зарослях A. negundo очень высокими являются пропорции рудеральных, синантропных и чужеродных видов растений [14]. Инвазии других видов чужеродных деревьев также сопровождаются увеличением долей рудеральных [21] или адвентивных [22] видов.
Однозначная оценка последствий инвазий сильно затруднена их тесной и фактически облигатной сопряженностью с урбанизацией, фрагментацией и загрязнением местообитаний. Как правило, центрами проникновения, натурализации и распространения чужеродных растений являются именно города [10, 23–25], в том числе в России [11], или другие антропогенно преобразованные местообитания [26]. Чужеродные растения преимущественно осваивают местообитания с низким уровнем стресса и высокой частотой или интенсивностью нарушений [27], антропогенно трансформированные [26, 28] и фрагментированные [4, 29]. Вследствие этого сообщества с доминированием инвазивных растений часто или почти всегда располагаются внутри или вблизи населенных пунктов, занимают небольшие остатки или краевые зоны протяженных естественных сообществ, антропогенно нарушены или загрязнены. В г. Екатеринбурге богатство и обилие адвентивных растений подлеска увеличивается с ростом урбанизации [15], а богатство адвентивных трав – вблизи краев лесных насаждений [30]. Поэтому без специальных методических усилий невозможно разделить последствия урбанизации, фрагментации, загрязнения и трансформированности сообществ инвазиями.
Мы предприняли попытку методически строго подойти к оценке последствий инвазии A. negundo для сообществ трав под пологом деревьев, использовав для этого специальную схему отбора пробных площадей. Цель: сопоставить параметры α-разнообразия растительных сообществ, подверженных и не подверженных инвазии A. negundo, но выровненных между собой по другим значимым характеристикам (степень урбанизации, фрагментированность, антропогенная нарушенность). Проверяли три гипотезы, сформулированные как наиболее вероятные на основании суммирования результатов опубликованных данных: 1) в сообществах с доминированием инвазивного A. negundo α-разнообразие травяного яруса ниже, чем в сообществах с доминированием других видов деревьев; 2) влияние A. negundo на разнообразие травяного яруса проявляется независимо от эффектов положения пробной площади, фрагментации и антропогенной трансформации местообитаний; 3) влияние A. negundo проявляется избирательно по отношению к разным группам видов и приводит к увеличению долей адвентивных, синантропных и малолетних видов.
МАТЕРИАЛ И МЕТОДЫ
Район. Данные собраны в южно-таежной подзоне бореальной зоны Среднего Урала на территории Екатеринбургской городской агломерации: г. Екатеринбург, г. Арамиль, пос. Кольцово. Климат умеренно континентальный, средняя температура +3°C, января –12.6°C, июля +19.0°C, годовая сумма осадков 537 мм. Екатеринбург – крупный город с населением 1.5 млн человек, население г. Арамиль и пос. Кольцово – по 15 тыс. Расстояние между центрами поселений: Екатеринбург–Кольцово – 16 км; Екатеринбург–Арамиль – 21 км; Кольцово–Арамиль – 6.5 км.
Модельный вид. Acer negundo интродуцирован на Урале в конце XIX в. Активная экспансия началась в 1920–1930-х гг. путем распространения из посадок. В настоящее время на Среднем Урале A. negundo распространен повсеместно, успешно возобновляется, проникает в скверы, парки и лесопарки, часто встречается вдоль дорог, активно занимает нарушенные территории, регулярно регистрируется в пригородных лесах.
Участки и пробные площади. На 13 участках были заложены 26 пробных площадей (ПП): 9 – г. Екатеринбург; 3 – г. Арамиль; 1 – пос. Кольцово. На каждом участке подбирали по две ПП так, чтобы на одной в древостое доминировал A. negundo, а на другой – другие виды древесных растений. Две ПП на одном участке образуют связанную пару – ПП с изучаемым воздействием (A. negundo) и без воздействия, т.е. контрольная. Участки подбирали с учетом критериев: а) площадь участка позволяет заложить не менее двух ПП размером 20 × 20 м; б) парные ПП сходны по положению в рельефе и расположению относительно человеческого жилья и объектов инфраструктуры; в) парные ПП расположены по возможности близко, не далее 0.4 км друг от друга; г) на парных ПП близкие значения сомкнутости крон деревьев первого и второго ярусов; д) на одной части участка доминирует A. negundo, а на другой – какие-либо другие виды. По увлажнению на большинстве участков условия свежие, на трех участках – влажные, один из влажных участков расположен в пойме малой реки.
В качестве факторов, т.е. потенциальных причин изменчивости разнообразия и состава яруса трав, анализировали четыре параметра ПП, или описаний:
1. Год исследования или год выполнения описания (обозначение – год): 2017 или 2018 гг. На 11 парах ПП описания были выполнены в 2017 г. и повторно – в 2018 г. На одной паре ПП, описанных в 2017 г., к 2018 г. растительность была уничтожена. Поэтому была дополнительно подобрана и описана пара ПП на одном участке в 2018 г.
2. Доминирующий вид древесного растения – A. negundo или какой-то другой вид (обозначение переменной – доминант древостоя, доминант). Обозначения групп сообществ: An+ – сообщества с доминированием A. negundo; An– – сообщества с доминированием других деревьев: Ulmus laevis Pall. (3 участка), Pinus sylvestris L. (3), Malus baccata (L.) Borkh (2), Padus avium Mill. (1), Salix fragilis L. (1), Tilia cordata Mill. (1), Sorbus aucuparia L. (1), Salix alba L. (1).
3. Происхождение древостоя на ПП (обозначение – происхождение). Приняли, что древостой на ПП мог возникнуть в результате естественного расселения древесных или их целенаправленной посадки. Искусственное происхождение древостоя устанавливали по регулярности размещения деревьев и другим признакам. В сообществах An+ на 8 ПП древостой возник в результате посадки, а на 5 ПП он был естественного происхождения. В сообществах An– на 9 ПП древостой возник в результате посадки, а на 4 ПП он был естественного происхождения.
4. Общая площадь насаждения (обозначение – площадь), которую рассчитывали в программе SAS.Planet 14.12.12.8406 (SASGroup, 2014). Критерий границы насаждений: либо примыкание водотоков или антропогенных объектов (дороги, застройка), либо протяженность участка без покрытия кронами древесных растений более 50 м. Площади сообществ варьировали от 0.1 до 43 га.
Геоботанические описания и характеристики сообществ. 48 описаний ПП размером 20 × 20 м выполнены в июне–августе 2017 и 2018 гг. (по 24 каждый год). Регистрировали виды растений и общее проективное покрытие надземных органов растений травяного яруса (в %). Рассчитывали значения индексов Шеннона и Бергера–Паркера. Характеристика видового богатства – плотность видов, т.е. число видов на 400 м2 (общее и отдельных групп). Выделяли группы видов: 1) по происхождению – аборигенные и чужеродные [по: 31, 32]; 2) по степени синантропности – синантропные и индигенные [по: 31, 32]; 3) по типу онтогенеза – малолетние (одно- и двулетние) и многолетние; 4) по жизненной форме – граминоиды (растения граминоидной жизненной формы: виды семейств Poaceae, Cyperaceae и Juncaceae) и все другие.
Анализ данных. Для выбора переменных, оптимально объясняющих изменчивость характеристик богатства и состава травяного яруса, использовали мультимодельный вывод [33]. Рассчитывали состоятельный информационный критерий Акаике (AICc) с суммированием AICc-весов (W) в отношении отдельных предикторов (∑W). Значения ∑W интерпретировали как вероятность, что предиктор – лучший из исследованного набора, т.е. обладает наибольшей ценностью для объяснения изменчивости какой-либо переменной. Для сравнения характеристик богатства и состава травяного яруса на площадях с A. negundo и другими деревьями использовали общие (GLM) и смешанные (LMM) линейные модели. В LMM в качестве случайного эффекта использовали номер участка, на котором размещались объединенные в пару пробные площади. При сравнении переменных, выраженных в долях, их предварительно подвергали арксинус-преобразованию. Значения площадей насаждений логарифмировали. Контроль над ожидаемой частотой ложных отклонений (false discovery rate, FDR) при множественных проверках статистических гипотез осуществляли с помощью поправки Беньямини-Йекутили (везде приведены FDR-скорректированные значения уровня значимости P). Расчеты выполнены в пакетах JMP 10.0.0 (SAS Institute Inc., USA, 2012) и STATISTICA 8.0 (StatSoft Inc., USA, 1984–2007).
РЕЗУЛЬТАТЫ
Состав сообществ. Сообщества An+ сложены преимущественно рудеральными видами. В древесном ярусе часто присутствовали аборигенные (P. avium, S. aucuparia) и адвентивные (Populus balsamifera L., Grossularia uva-crispa L.) виды. В травяно-кустарничковом ярусе наиболее обычны Urtica dioica L., Glechoma hederacea L., Arabis pendula L. Сообщества An– также преимущественно сформированы рудеральными видами. Во втором ярусе наиболее обычны аборигенные P. avium и Viburnum opulus L. и адвентивные M. baccata и Cotoneaster lucidus Schltdl. В травяно-кустарничковом ярусе наиболее обычны U. dioica, G. hederacea и Arctium tomentosum Mill. Таким образом, сообщества An+ и An– по составу близки. Только на двух ПП в лесопарках представлены сосняки крапивно-снытевые.
Кустарнички (Linnaea borealis L., Vaccinium myrtillus L., Vaccinium vitis-idaea L.) и полукустарнички (Orthilia secunda (L.) House) встречены только на трех ПП с незначительным обилием. Основу покрытия на всех ПП составляют двудольные и в меньшей степени однодольные травы, поэтому для обозначения яруса напочвенной растительности вместо термина “травяно-кустарничковый ярус” мы использовали термин “травяной ярус”.
Факторы богатства и состава травяного яруса. При отборе оптимальных объясняющих моделей с помощью AICc результаты описаний 2017 и 2018 гг. не объединяли (n = 48). Сочетания предикторов для оптимального объяснения изменчивости разных признаков богатства и состава травяного яруса варьируют (табл. 1). Только число видов на 400 м2 и доля граминоидов преимущественно определяются тем, доминирует ли в древостое A. negundo или другой вид деревьев. Значения индексов Шеннона и Бергера–Паркера, а также доля малолетних видов сильнее всего связаны с площадью насаждения. Для объяснения изменчивости долей адвентивных и синантропных видов, а также обилия травяного яруса необходимо учитывать несколько факторов. Менее всего для объяснения состояния травяного яруса нужно учитывать межгодовую изменчивость. Год исследования вошел в лучшую объясняющую модель только для проективного покрытия.
Таблица 1.
Лучшие комбинации предикторов, объясняющих изменчивость характеристик травяного яруса
| Характеристики травяного яруса | Сочетание предикторов | AICc | W1 | W1/W2* |
|---|---|---|---|---|
| Число видов на 400 м2 | [Доминант] + [Доминант × Происхождение] | 361.84 | 0.150 | 1.53 |
| Индекс Шеннона | [Площадь] | 107.89 | 0.083 | 1.32 |
| Индекс Бергера–Паркера | [Площадь] | 0.24 | 0.094 | 1.33 |
| Общее покрытие | [Год] + [Доминант] + [Площадь] + + [Доминант × Происхождение] + + [Доминант × Площадь] | 16.39 | 0.111 | 1.37 |
| Доли групп видов: | ||||
| по происхождению: адвентивных | [Доминант] + [Происхождение] + + [Площадь] + [Доминант × Происхождение] | –63.28 | 0.291 | 2.22 |
| по синантропности: синантропных | [Доминант] + [Происхождение] + + [Площадь] + [Доминант × Происхождение] | –22.24 | 0.369 | 4.23 |
| по типу онтогенеза: малолетних | [Площадь] | –26.48 | 0.122 | 1.39 |
| по жизненной форме: граминоидов | [Доминант] | –50.44 | 0.169 | 2.28 |
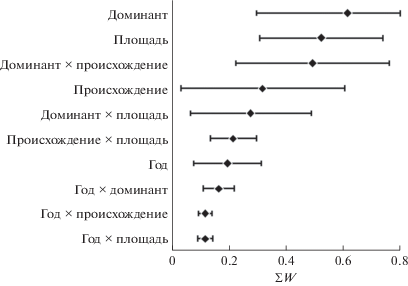
Наибольшая сумма весов ∑W установлена для фактора “доминант древостоя” (рис. 1), второй ранг имеет фактор “площадь насаждения”, третий – сочетание “доминант древостоя × происхождение насаждения”. Минимальные ∑W характерны для фактора “год исследования”. Таким образом, при анализе причин и направлений изменчивости богатства и структуры травяного яруса прежде всего необходимо учитывать фактор “доминант древостоя”. Менее обязателен учет площади насаждения, еще меньшую объясняющую ценность имеет происхождение насаждения. Фактором “год исследования” можно обоснованно пренебречь.
Рис. 1.
Ценность (∑W; m ± 95% CI) отдельных предикторов и их комбинаций в отношении характеристик травяного яруса.
Значимость влияния указанных выше факторов на характеристики травяного яруса определили в GLM (табл. 2). Предварительно для сообществ, описанных в 2017 и 2018 гг., характеристики усреднили за два года. В результате общий массив составил 26 описаний: nAn+ = nAn– = 13, по 11 повторных описаний 2017–2018 гг. плюс по одному описанию 2017 г. и по одному описанию 2018 г. Сочетания рассмотренных факторов объясняли до 29–66% изменчивости части характеристик травяного яруса – видового богатства, обилия, долей адвентивных и синантропных видов. Причины изменчивости значений индексов Шеннона, Бергера–Паркера, доли малолетних видов и граминоидов фактически объяснить не удалось.
Таблица 2.
Значимость (FDR-скорректированные значения P) влияния факторов на характеристики травяного яруса в общих линейных моделях
| Объясняемый признак | Доминант [1] | Происхож-дение [2] | Площадь [3] | [1] × [2] | [1] × [3] | $R_{{{\text{adj}}}}^{2}$ |
|---|---|---|---|---|---|---|
| Число видов на 400 м2 | 0.0151 | – | – | 0.2103 | – | 0.29 |
| Индекс Шеннона | – | – | 0.8470 | – | – | 0.01 |
| Индекс Бергера–Паркера | – | – | 0.7100 | – | – | 0.01 |
| Общее покрытие | 0.1701 | – | 0.1558 | 0.2760 | 0.0723 | 0.30 |
| Доли групп видов: | ||||||
| по происхождению: адвентивных | 0.0225 | 0.0753 | 0.2117 | 0.0175 | – | 0.56 |
| по синантропности: синантропных | 0.0148 | 0.1152 | 0.0250 | 0.0342 | – | 0.66 |
| по типу онтогенеза: малолетних | – | – | 0.2499 | – | – | 0.11 |
| по жизненной форме: граминоидов | 0.2279 | – | – | – | – | 0.07 |
Примечание. Комбинации предикторов и их взаимодействий определены по результатам отбора с помощью AICc (см. табл. 1); прочерк означает, что предиктор не входит в лучшую комбинацию.
С учетом FDR-коррекции значимое влияние фактора “доминант древостоя” установлено в отношении видового богатства и долей адвентивных и синантропных видов. Последние частично зависят также от особенностей происхождения древостоев, а доля адвентивных видов – от площади сообщества, в котором располагались пробные площади.
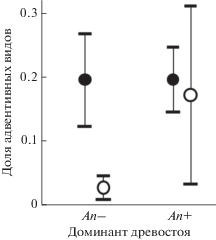
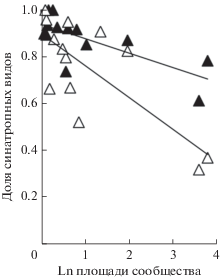
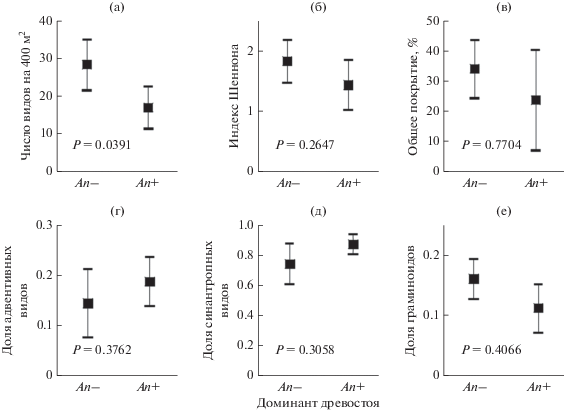
Направления изменения богатства и состава травяного яруса в зарослях Acer negundo. Таксономическое богатство травяного яруса в зарослях A. negundo значимо и примерно на 40% ниже, чем под пологом других видов древесных растений (рис. 2а). По результатам использования и GLM, и LMM доминирование A. negundo не сопровождается изменением разнообразия (рис. 2б) и обилия (рис. 2в) травяного яруса. Однако другие результаты частично не согласуются друг с другом: в LMM не подтверждено, что в сообществах с A. negundo изменяются доли адвентивных (рис. 2г) и синантропных (рис. 2д) видов, как и доля злаков и осок (рис. 2е). Вероятно, это объясняется выраженным сочетанным влиянием разных факторов на богатство адвентивных и синантропных видов (см. табл. 1, табл. 2). Так, очень низкая доля адвентивных видов (около 3%) свойственна только сообществам An– с естественно возникшим древостоем (рис. 3). В сообществах с доминированием A. negundo и сообществах An– с посаженным древостоем адвентивных видов 17–20%. Доля синантропных видов связана не только с уровнем доминирования A. negundo, но и с площадью сообществ (рис. 4). При увеличении площади сообществ, т.е. при уменьшении фрагментированности, доли синантропных видов значимо снижаются как под пологом A. negundo (r = – 0.67; n = 13; P = 0.0176), так и под пологом других деревьев (r = = – 0.72; n = 13; P = 0.0180).
Рис. 2.
Таксономическое богатство (а), разнообразие (б), обилие (в) и доли адвентивных (г), синантропных (д) видов и видов-граминоидов (е) в травяном ярусе сообществ с доминированием Acer negundo (An+) и других (An–) древесных растений (m ± 95% CI). Приведены FDR-скорректированные значения P для смешанных линейных моделей с фиксированным (доминант древостоя) и случайным (номер участка) эффектами.
ОБСУЖДЕНИЕ
В некотором отношении наши результаты могут казаться тривиальными. Учитывая достаточную согласованность данных, опубликованных по проблеме инвазий растений, ожидаемо, что в зарослях A. negundo видовое богатство трав ниже, чем в других урбанизированных сообществах. Неожиданно, скорее, что контраст богатства травяного яруса между сообществами An– и An+ не очень большой: 28 и 17 видов на 400 м2 соответственно. Однако, поскольку мы сравнивали сообщества, сходные по степени урбанизации, фрагментированности и нарушенности, установленное 40%-ное снижение видового богатства можно уверенно связать с влиянием A. negundo. Другие факторы, которые могли влиять или влияли на видовое богатство, были выравнены.
Установить влияние A. negundo на разнообразие, общее обилие, структуру доминирования в сообществах, а также на доли малолетних трав и граминоидов не удалось. Влияние A. negundo на пропорции адвентивных и синантропных трав проявлялось только в комплексе или на фоне эффектов, сопряженных с уровнем нарушенности и размером местообитаний. Таким образом, в целом эффекты для структуры травяного яруса, связанные с инвазией A. negundo, не очень велики.
Закономерно, что, если бы мы рассмотрели более широкий градиент условий, контрасты состояния травяного яруса также были бы больше. Так, если за контрольные сообщества взять городские лесопарки [30], разность с сообществами с доминированием A. negundo для богатства видов была бы 2-кратной: 35 видов на 400 м2 (лесопарки) и 17 (сообщества с доминированием A. negundo). Для проективного покрытия соответствующая разность была бы 2.5-кратной: 61 и 24; для доли синантропных видов – 2-кратной: 0.43 и 0.87, а для доли адвентивных видов разность была бы очень контрастной: 0.01 и 0.19. Однако важно понять, характеризуют ли эти разности строго влияние инвазивного дерева на аборигенную растительность? По-видимому, нет. Сравнивая небольшие внутригородские фрагментированные сообщества, в которых доминирует A. negundo, с сообществами протяженных лесопарков, мы не в состоянии разделить эффекты инвазии, урбанизации, фрагментации и интенсивности нарушений.
Следовательно, наше заключение о снижении видового богатства травяного яруса под пологом A. negundo, хотя и ожидаемо, содержит компонент новизны. Реализованная схема подбора ПП позволила уверенно интерпретировать установленные различия в видовом богатстве как результат влияния инвазивного дерева на живой напочвенный покров. Таким образом, наша первая гипотеза справедлива для урбанизированных сообществ на Среднем Урале. В сообществах с доминированием инвазивного A. negundo α-разнообразие травяного яруса действительно ниже, чем в сообществах с доминированием других видов деревьев, и наиболее вероятно, что это происходит именно вследствие влияния A. negundo.
Вторая гипотеза справедлива частично. Она предусматривала, что влияние A. negundo на разнообразие травяного яруса проявляется независимо от других особенностей местообитаний. Наши данные позволили строго установить трансформирующее влияние A. negundo на сообщества под его пологом, но только в отношении одного признака – видового богатства.
Третья гипотеза также справедлива только частично. По нашим данным, влияние A. negundo полностью неизбирательно по отношению к однолетним/многолетним видам и граминоидам/разнотравью. Неизбирательность проявляется также в том, что не установлено влияние A. negundo на обилие трав, соотношение между богатством и обилием видов, а также на среднюю степень доминирования. Под влиянием A. negundo изменяются пропорции адвентивных и синантропных трав, но подобные изменения сильно связаны с антропогенной нарушенностью и фрагментированностью местообитаний. Только на фоне изменения этих свойств местообитаний проявляется влияние A. negundo.
Наши данные позволяют быть уверенными, что под влиянием A. negundo происходит снижение видового богатства сообществ. Но меньше оснований полагать, что столь же однозначно доказано отсутствие эффектов со стороны A. negundo на разнообразие, структуру доминирования, соотношения однолетние/многолетние виды и граминоиды/разнотравье. Влияние A. negundo на эти признаки не доказано в рамках реализованного экспериментального дизайна.
Данные о негативных последствиях инвазий растений для биоразнообразия аборигенных сообществ растений многочисленны [2, 4–7]. Такие данные есть и для инвазии A. negundo [17, 18]. С другими опубликованными данными хорошо согласуется установленное возрастание доли синантропных видов при росте интенсивности нарушений и фрагментации [26–28] и доли адвентивных видов при росте фрагментации [4, 29]. Таким образом, эти эффекты наши результаты подтверждают. Однако в отношении некоторых эффектов наши результаты снижают неопределенность. Например, частично подтвердилось, что инвазия A. negundo способствует усилению адвентизации подчиненных ярусов. Это позволяли предполагать и опубликованные ранее результаты [14, 21, 22], хотя известны и противоположные примеры [20].
Повышенная адвентизация сообществ под пологом чужеродного дерева с большой конкурентной мощностью теоретически возможна по следующей цепи рассуждений. Высокое видовое богатство само по себе можно считать барьером для инвазий [34]. Если по какой-то причине видовое богатство снижается, в нашем случае – под влиянием A. negundo, это может приводить к росту открытости сообществ для внедрения других чужеродных растений. Мы действительно установили повышенную инвазибельность сообществ для чужеродных трав при доминировании A. negundo, хотя и проявляющуюся только при одновременном учете интенсивности нарушений.
Интересен вопрос, изменяется ли в присутствии сильного конкурента или вида, значительно преобразующего условия среды, перераспределение обилий второстепенных видов. В прирусловых лесах Западного Кавказа Robinia pseudoacacia L. не влияла на распределение обилий других древесных растений, Amorpha fruticosa L. влияла сильно, а Acer negundo промежуточным образом [35]. В нашем исследовании под влиянием A. negundo перераспределения в структуре доминирования травянистых растений не установлено. Однако при интерпретации этого результата важно учитывать, что одним из второстепенных критериев идентичности парных ПП внутри участка при их подборе было сходство покрытий крон деревьев: ПП An– и An+ не различаются по этому показателю – 88 ± 1 и 90 ± 1% соответственно. Поэтому и неудивительно, что значения индексов Шеннона и Бергера–Паркера не изменялись под влиянием A. negundo. В лесопарках г. Екатеринбурга [30] сомкнутость крон деревьев заметно меньше и составляет в среднем 42 ± 1%.
Обозначить механизмы конкурентного или средопреобразующего влияния A. negundo на растения нижних ярусов можно только гипотетически. Наиболее очевидное объяснение сильного средопреобразующего влияния чужеродных видов – эффективное использование или перехват ресурсов: света, влаги, элементов минерального питания [3, 20]. Активно исследуются также объяснения, предполагающие специфичность у чужеродных растений plant-soil feedback, включая аллелопатию и взаимодействия с микроорганизмами почвы [36], и способность к активному накоплению подстилки [37]. Конкретные механизмы конкурентного или средопреобразующего влияния A. negundo пока фактически не исследованы.
ЗАКЛЮЧЕНИЕ
Основной эффект, сопровождающий доминирование чужеродного североамериканского дерева Acer negundo в урбанизированных сообществах, – снижение видового богатства травяного яруса. Изменение большинства других характеристик сообществ под влиянием A. negundo не подтвердилось. Влияние A. negundo на виды трав, по-видимому, не избирательно или мало избирательно, но для надежного выяснения степени такой избирательности необходимы специальные исследования.
Мы считаем, что нам удалось достаточно строго вычленить эффект, связанный с доминированием A. negundo, так как для этого использовали специальную схему размещения пробных площадей на участках, различающихся размером и степенью антропогенной трансформированности. В результате установлено, что ведущие причины варьирования состава урбанизированных растительных сообществ – вид древесного доминанта (A. negundo или другие деревья) и площадь насаждений. Таким образом, в методическом плане наши результаты свидетельствуют о том, что при оценке последствий растительных инвазий в масштабе сообществ и местообитаний нужно обязательно учитывать пространственные и, вероятно, иные закономерности структуры сообществ. Строгое разделение эффектов урбанизации, фрагментации, загрязнения местообитаний, а также последствий вселения чужеродных растений возможно только при специальных методических усилиях. В противном случае существует вероятность ошибочно интерпретировать эффекты урбанизации или фрагментации как последствия инвазий чужеродных видов или наоборот.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН. Авторы признательны канд. биол. наук Н.В. Золотаревой и А.А. Коржиневской (Институт экологии растений и животных УрО РАН) за помощь в определении растений, Д.П. Крупиной – за помощь в выполнении полевых работ.
Список литературы
Wilcove D.S., Rothstein D., Dubow J. et al. Quantifying threats to imperiled species in the United States // Bioscience. 1998. V. 48. № 8. P. 607–615.
Vilà M., Espinar J.L., Hejda M. et al. Ecological impacts of invasive alien plants: a meta-analysis of their effects on species, communities and ecosystems // Ecol. Lett. 2011. V. 14. № 7. P. 702–708. https://doi.org/10.1111/j.1461-0248.2011.01628.x
Gioria M., Osborne B.A. Resource competition in plant invasions: emerging patterns and research needs // Front. Plant Sci. 2014. V. 5. № 501. https://doi.org/10.3389/fpls.2014.00501
Vilà M., Corbin J.D., Dukes J.S. et al. Linking plant invasions to global environmental change // Terrestrial ecosystems in a changing world / Canadell J., Pataki D., Pitelka L. Eds. Berlin: Springer, 2006. P. 93–102.
Maron J.L., Marler M. Effects of native species diversity and resource additions on invader impact // Am. Nat. 2008. V. 172. № 1. P. 18–33.https://doi.org/10.1086/588303
Hejda M., Pyšek P., Jarošík V. Impact of invasive plants on the species richness, diversity and composition of invaded communities // J. Ecol. 2009. V. 97. № 3. P. 393–403.
Lanta V., Hyvonen T., Norrdahl K. Non-native and native shrubs have differing impacts on species diversity and composition of associated plant communities // Plant Ecol. 2013. V. 214. № 12. P. 1517–1528. https://doi.org/10.1007/s11258-013-0272-0
Blackburn T.M., Bellard C., Ricciardi A. Alien versus native species as drivers of recent extinctions // Front. Ecol. Environ. 2019. https://doi.org/10.1002/fee.2020
Davis M., Chew M.K., Hobbs R.J. et al. Don’t judge species on their origins // Nature. 2011. V. 474 (7350). P. 153–154. https://doi.org/10.1038/474153a
Kowarik I., von der Lippe M., Cierjacks A. Prevalence of alien versus native species of woody plants in Berlin differs between habitats and at different scales // Preslia. 2013. V. 85. № 2. P. 113–132.
Veselkin D.V., Tretyakova A.S., Senator S.A. et al. Geographical factors of the abundance of flora in Russian cities // Dokl. Earth Sc. 2017. V. 476. № 1. P. 1113–1115. https://doi.org/10.1134/S1028334X1709029X
Виноградова Ю.К., Майоров С.Р., Хорун Л.В. Черная книга флоры Средней России: чужеродные виды растений в экосистемах Средней России. М.: ГЕОС, 2010. 512 с.
Рябинина З.Н., Никитина Н.В. Сукцессии пойменных лесов р. Урал в пределах Оренбургского градопромышленного комплекса // Вестник ОГУ. 2009. № 6 (112). С. 319–321.
Гусев А.П., Шпилевская Н.С., Веселкин Д.В. Воздействие Acer negundo L. на восстановительную сукцессию в ландшафтах Беларуси // Веснік Віцебскага дзяржаўнага універсітэта. 2017. № 1 (94). С. 47–53.
Веселкин Д.В., Коржиневская А.А. Пространственные факторы адвентизации подлеска в лесопарках крупного города // Изв. РАН. Сер. географич. 2018. № 4. С. 54–64.https://doi.org/10.1134/S2587556618040167
Veselkin D.V., Korzhinevskaya A.A., Podgayevskaya E.N. The species composition and abundance of alien and invasive understory shrubs and trees in urban forests of Yekaterinburg // Vestnik Tomskogo gosudarstvennogo universiteta. Biologiya. 2018. V. 42. P. 102–118. https://doi.org/10.17223/19988591/42/5
Emelyanov A.V., Frolova S.V. Ash-leaf maple (Acer negundo L.) in coastal phytocenoses of the Vorona River // Rus. J. Biol. Invasions. 2011. V. 2. № 2–3. P. 161–163.
Kostina M.V., Yasinskaya O.I., Barabanshchikova N.S., Orlyuk F.A. Toward a issue of box elder invasion into the forests around Moscow // Rus. J. Biol. Invasions. 2016. V. 7. № 1. P. 47–51.
Reinhart K.O., Greene E., Callaway R.M. Effects of Acer platanoides invasion on understory plant communities and tree regeneration in the Rocky Mountains // Ecography. 2005. V. 28. № 5. P. 573–582.
Schuster M.J., Reich P.B. Amur maple (Acer ginnala): an emerging invasive plant in North America // Biol. Invasions. 2018. V. 20. № 10. P. 2997–3007.
Del Vecchio S., Acosta A., Stanisci A. The impact of Acacia saligna invasion on Italian coastal dune EC habitats // C. R. Biol. 2013. V. 336. № 7. P. 364–369. https://doi.org/10.1016/j.crvi.2013.06.004
Slabejová D., Bacigál T., Hegedüšová K. et al. Comparison of the understory vegetation of native forests and adjacent Robinia pseudoacacia plantations in the Carpathian-Pannonian region // For. Ecol. Manag. 2019. V. 439. P. 28–40. https://doi.org/10.1016/j.foreco.2019.02.039
Vitousek P.M., Mooney H.A., Lubchenco J., Melillo J.M. Human domination of the earth’s ecosystems // Science. 1997. V. 277. № 5325. P. 494–499.
Pyšek P. Alien and native species in Central European urban floras: a quantitative comparison // J. Biogeogr. 1998. V. 25. № 1.P. 155–163.
Hui C., Richardson D.M., Visser V. Ranking of invasive spread through urban green areas in the world’s 100 most populous cities // Biol. Invasions. 2017. V. 19. № 12. P. 3527–3539. https://doi.org/10.1007/s10530-017-1584-0
Chytrý M., Jarošík V., Pyšek P. et al. Separating habitat invasibility by alien plants from the actual level of invasion // Ecology. 2008. V. 89. № 6. P. 1541–1553.
Arianoutsou M., Delipetrou P., Vilà M. et al. Comparative patterns of plant invasions in the mediterranean biome // PLoS One. 2013. V. 8. № 11. e79174. https://doi.org/10.1371/journal.pone.0079174
Pyšek P., Chytrý M., Perg J. et al. Plant invasions in the Czech Republic: current state, introduction dynamics, invasive species and invaded habitats // Preslia. 2012. V. 84. № 3. P. 575–629.
McDonald R.I., Urban D.L. Edge effects on species composition and exotic species abundance in the North Carolina Piedmont // Biol. Invasions. 2006. V. 8. № 5. P. 1049–1060.
Veselkin D.V., Korzhinevskaya A.A., Podgayevskaya E.N. The edge effect on the grass and bush layer of urbanized southern taiga forests // Rus. J. Ecol. 2018. V. 49. № 6. P. 411–420. https://doi.org/10.1134/S1067413618060139
Куликов П.В. Конспект флоры Челябинской области (сосудистые растения). Екатеринбург–Миасс: “Геотур”, 2005. 537 с.
Третьякова А.С. Флора Екатеринбурга. Екатеринбург: Изд-во Уральского ун-та, 2011. 192 с.
Burnham K.P., Anderson D.R. Model selection and multimodel inference: A practical information-theoretical approach. N.Y.: Springer-Verlag, 2002. 488 p.
Kennedy T.A., Naeem S., Howe K.M. et al. Biodiversity as a barrier to ecological invasion // Nature. 2002. V. 417 (6889). P. 636–638. https://doi.org/10.1038/nature00776
Akatov V.V., Shadzhe A.E., Akatova T.V. Species richness of tree and shrub layers in riparian forests of the Western Caucasus dominated by alien species // Rus. J. Ecol. 2012. V. 43. № 4. P. 294–301.
Suding K.N., Harpole W.S., Fukami T. et al. Consequences of plant-soil feedbacks in invasion // J. Ecol. 2013. V. 101. № 2. P. 298–308.
Zhang P., Li B., Wu J., Hu S. Invasive plants differentially affect soil biota through litter and rhizosphere pathways: a meta-analysis // Ecol. Lett. 2019. V. 22. № 1. P. 200–210. https://doi.org/10.1111/ele.13181
Дополнительные материалы отсутствуют.