Экология, 2019, № 6, стр. 463-470
Влияние колоний морских птиц в лесных экосистемах Причерноморья на сообщества крупных почвенных беспозвоночных
Д. И. Коробушкин a, *, Р. А. Сайфутдинов a, b
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
b Казанский федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Dkorobushkin@yandex.ru
Поступила в редакцию 28.08.2018
После доработки 30.01.2019
Принята к публикации 01.02.2019
Аннотация
Оценены изменения структуры сообществ крупных почвенных беспозвоночных (макрофауна) в причерноморском сосновом лесу – месте зимовки колонии большого баклана. Избыточное поступление морского органического вещества за счет жизнедеятельности колонии привело к значимому снижению pH, увеличению содержания фосфора, азота, серы и меди в почве. Несмотря на отсутствие значимых различий между контрольными и нарушенными участками в таксономическом разнообразии, суммарном обилии и обилии активно мигрирующих, геобионтных, растительноядных и хищных беспозвоночных животных, фактор присутствия птиц оказал статистически значимое негативное влияние на обилие всех маломобильных групп, а также эпибионтных сапротрофных беспозвоночных.
Перенос органического вещества из водных экосистем в наземные (“водная субсидия”) является важным или порой основным источником поступления биогенных элементов и химических соединений в наземные пищевые сети [1–3]. В морских экосистемах подобный перенос в большинстве случаев обусловлен волновой активностью и приливно-отливными явлениями, но может осуществляться и посредством таких живых организмов, как морские птицы, основной пищей которых служат морские позвоночные и беспозвоночные животные (в виде помета, остатков морской пищи, перьев и погибших особей) [3–5]. Если поступление и накопление аллохтонного органического вещества в ходе абиотических процессов в основном приурочено к зоне супралиторали, то за счет птиц аллохтонные ресурсы могут быть привнесены в удаленные от моря экосистемы, не имеющие непосредственного контакта с морем.
Места гнездования и зимовок колоний птиц, в частности большого баклана (Phalacrocorax carbo), обычно приурочены к прибрежным скалам, но могут занимать и лесные участки. Заселение нового местообитания сопровождается привнесением в наземную экосистему аллохтонного вещества, количество которого зависит от размера колонии. Например, большой баклан образует колонии из 50–5000 пар с плотностью гнездования до 2000 гнезд/га. Привнесение в почву помета и органических остатков от жизнедеятельности такой колонии может привести к увеличению содержания азота и фосфора в почве, повлиять на кислотность, соленость и влажность [6, 7]. Изменения характеристик почвы, как правило, отражаются на растительном покрове [3, 7]. Так, при очень высоких концентрациях гуано растительный покров может деградировать [8, 9] из-за токсичности избытка аммония и повышения кислотности почвы [6, 10]. Изменения почвенно-растительного покрова не могут не влиять на сообщества животных [11, 12], в том числе на почвенных беспозвоночных. Тем не менее данному вопросу уделено недостаточно внимания, и проведенные ранее исследования, как правило, ограничиваются участками постоянных скоплений морских птиц и посвящены отдельным таксономическим группам почвенных беспозвоночных (например, [13–15]) и паразитических организмов (например, [16, 17]). Мы предполагаем, что заселение птицами нового участка должно привести к сокращению обилия и таксономического разнообразия почвенных беспозвоночных животных, а также к изменению структуры сообществ беспозвоночных животных вследствие изменений почвенно-растительных условий.
Цель данной работы – оценить влияние морских птиц на структуру сообществ крупных почвенных беспозвоночных (макрофауна = мезофауна по М.С. Гилярову) прибрежных лесных экосистем. Для исследования были выбраны отделенные от моря клифом лесные экосистемы государственного природного заповедника “Утриш”, трехгодичное пребывание колонии большого баклана (P. carbo) в пределах которых привело к обильному накоплению помета и усыханию древесной растительности [18].
МАТЕРИАЛ И МЕТОДЫ
Сбор материала проводили в июне 2018 г. на двух участках зимовки колоний птиц (далее импактные участки), а также на двух контрольных (44°43′06 с.ш., 37°26′36 в.д.) в Анапском районе Краснодарского края поблизости от мыса М. Утриш. Гнездование в зимний период большого баклана на исследуемой территории отмечается с 2015 г. (по фондовым данным заповедника). Участки располагались на клифе высотой около 13 м. Растительность как импактных, так и контрольных площадок представлена ксерофитными растительными сообществами субсредиземноморского типа [19] с преобладанием в древесном ярусе сосны пицундской (Pinus brutia var. pityusa) с единичным участием можжевельника высокого (Juniperus excelsa), грабинника (Carpinus orientalis) и дуба пушистого (Quercus pubescens), кустарниковый ярус представлен иглицей понтийской (Ruscus ponticus), в травяном ярусе преобладают злаки (Hordeum leporinum, Bromus sterilis). Проективное покрытие травяного покрова импактных участков достигало 80%, в пределах контрольных не превышало 20%. Мощность подстилки в пределах импактных и контрольных участках была сходной (табл. 1), однако в импактных визуально преобладал опад хвои, а на почве и растениях наблюдались обилие помета птиц, перья, остатки пищи (рыба, чешуя, кости); древесная и кустарниковая растительность сильно угнетена и представляет собой сухостой (также см. [18]).
Таблица 1.
Физико-химические показатели почвы (средняя ± SE, n = 2) в пределах контрольных и импактных лесных участков заповедника “Утриш”, а также изотопный состав углерода и азота почвы и органического вещества
| Показатель | Участок | |
|---|---|---|
| контрольный | импактный | |
| Почвенные параметры | ||
| Подстилка, cм | 3.8 ± 0.2 | 3.6 ± 0.7 |
| pH почвы | 7 ± 0.1 | 5.9 ± 0.3** |
| Al, мг/кг | 1 ± 0.0 | 0.8 ± 0.0*** |
| P, мг/кг | 0.14 ± 0.01 | 1.7 ± 0.05*** |
| S, мг/кг | 0.11 ± 0.1 | 0.24 ± 0.2*** |
| K, мг/кг | 1615.9 ± 162.1 | 1380.5 ± 46.3 |
| Ca, мг/кг | 2346.2 ± 7.6 | 2178.4 ± 4.1 |
| Cr, мг/кг | 0.4 ± 0.1 | 0.9 ± 0** |
| Mn, мг/кг | 25 ± 3.3 | 18.2 ± 0.7* |
| Fe, мг/кг | 9524 ± 1501.1 | 10107 ± 365.6 |
| Cu, мг/кг | 13.3 ± 1.3 | 18.3 ± 0.3** |
| C, % | 10.8 ± 2.4 | 13.5 ± 0.5 |
| N, % | 0.6 ± 0.1 | 1.0 ± 0.1** |
| δ13C, ‰ | –26.1 ± 0.1 | –25.5 ± 0.0** |
| δ15N, ‰ | 2.2 ± 1.1 | 12.2 ± 2.8*** |
| Изотопный состав органического вещества | ||
| δ13C, ‰ | δ15N, ‰ | |
| Смешанный опад P. pityusa и Q. pubescens | –27.8 ± 0.2 | 0.18 ± 0.0 |
| Помет P. carbo | –21.1 ± 0.1 | 19.0 ± 0.1 |
| Водоросли C. barbata | –21.6 ± 0.1 | 6.9 ± 0.1 |
В пределах каждого участка были отобраны случайным образом по 5 почвенных проб буром (диаметр 20 см, глубина отбора 15 см). Во избежание краевого эффекта отбор проб проводился в центральной части участка на площадке 10 × 10 м. Для изотопного анализа в пятикратной повторности на площадках был собран опад P. pityusa и Q. pubescens, помет бакланов и водоросли Cystoseira barbata непосредственно из моря. Затем пробы были доставлены в изотермических контейнерах при температуре 9 ± 1°С в лабораторию ИПЭЭ РАН (г. Москва). Животных экстрагировали в течение 7 дней с использованием воронок Тульгрена, фиксировали в растворе спирта, воды и этиленгликоля (в соотношении 80 : 15 : 5), обилие выражали в экз/м2. Беспозвоночных определяли до уровня семейства, за исключением куколок двукрылых, ложноскорпионов (Pseudoscorpionida) и неполовозрелых особей кистевиков (Polyxenida), которые были определены до отряда. В общей сложности было собрано и идентифицировано 2096 представителей макрофауны (табл. 2). Далее на основании литературных данных [20, 21] животные были распределены на функциональные группы (“functional traits”, [22]) по особенностям питания (сапрофаги, фитофаги, хищники), стратификации в почве (эпибионтные и геобионтные), активности перемещения (мобильные – преимущественно способные к полету и маломобильные).
Таблица 2.
Обилие почвенной макрофауны в контрольных и импактных лесных участках: P – хищные, S – сапрофаги, F – фитофаги, ? – трофическая позиция не установлена, A – эпибионтные, B – геобионтные, M – мобильные, R – маломобильные
| Семейство | Трофическая специализация | Стратификация | Активность перемещения | Обилие (экз/м2 ± SE) в пределах участка | |
|---|---|---|---|---|---|
| контрольные | импактные | ||||
| Thomisidae | P | A | M | 5.9 ± 0 | 2.9 ± 2.9 |
| Gnaphosidae | P | A | M | 279.4 ± 44.1 | 79.4 ± 38.2 |
| Salticidae | P | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Dysderidae | P | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Scytodidae | P | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Lynyphiidae | P | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Lycosidae | P | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Phalangiidae | P | A | R | 8.8 ± 8.8 | 0 ± 0 |
| Pseudoscorpionida Fam. sp. | P | A | R | 235.3 ± 47.1 | 35.3 ± 11.8 |
| Geophilidae | P | B | R | 47.1 ± 23.5 | 52.9 ± 35.3 |
| Lithobiidae | P | A | R | 73.5 ± 14.7 | 41.2 ± 35.3 |
| Julidae | S | A | R | 35.3 ± 11.8 | 5.9 ± 0 |
| Polydesmidae | S | A | R | 35.3 ± 35.3 | 0 ± 0 |
| Lophoproctidae | S | A | R | 91.2 ± 20.6 | 29.4 ± 17.6 |
| Polyxenidae | S | A | R | 85.3 ± 38.2 | 20.6 ± 14.7 |
| Polyxenida Fam sp. juv. | S | A | R | 202.9 ± 55.9 | 29.4 ± 0 |
| Polyzoniidae | S | A | R | 50 ± 8.8 | 0 ± 0 |
| Anthicidae | S | A | M | 0 ± 0 | 2.9 ± 2.9 |
| Cantharidae | P | B | M | 85.3 ± 20.6 | 202.9 ± 44.1 |
| Carabidae | P | A | M | 8.8 ± 2.9 | 23.5 ± 5.9 |
| Chrysomelidae | F | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Coleoptera Fam. sp. 1 | ? | A | M | 23.5 ± 23.5 | 41.2 ± 5.9 |
| Coleoptera Fam. sp. 2 | ? | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Coleoptera Fam. sp. 3 | ? | A | M | 5.9 ± 5.9 | 11.8 ± 5.9 |
| Curculionidae | F | A | M | 5.9 ± 5.9 | 2.9 ± 2.9 |
| Lagriidae | P | A | M | 0 ± 0 | 17.6 ± 5.9 |
| Lampyridae | S | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Pselaphidae | S | A | M | 0 ± 0 | 2.9 ± 2.9 |
| Ptiliidae | S | A | M | 2.9 ± 2.9 | 0 ± 0 |
| Scarabaeidae | S | A | M | 0 ± 0 | 5.9 ± 5.9 |
| Staphylinidae | P | A | M | 26.5 ± 2.9 | 179.4 ± 73.5 |
| Anisopodidae | S | B | M | 5.9 ± 5.9 | 0 ± 0 |
| Asilidae | P | B | M | 32.4 ± 14.7 | 161.8 ± 79.4 |
| Cecidomyidae | F | B | M | 64.7 ± 52.9 | 5.9 ± 5.9 |
| Chironomidae | S | B | M | 0 ± 0 | 8.8 ± 8.8 |
| Diptera Fam. sp. pupa | ? | B | R | 5.9 ± 5.9 | 5.9 ± 5.9 |
| Muscidae | S | B | M | 5.9 ± 0 | 0 ± 0 |
| Platypezidae | S | B | M | 0 ± 0 | 20.6 ± 8.8 |
| Psychodidae | S | B | M | 8.8 ± 8.8 | 5.9 ± 5.9 |
| Stratiomyidae | P | A | M | 8.8 ± 8.8 | 126.5 ± 73.5 |
| Oligotomidae | P | B | M | 14.7 ± 8.8 | 32.4 ± 26.5 |
| Cicadellidae | F | A | M | 58.8 ± 41.2 | 5.9 ± 0 |
| Diaspididae | F | A | M | 14.7 ± 14.7 | 14.7 ± 14.7 |
| Pyrrhocoridae | S | A | M | 0 ± 0 | 108.8 ± 50 |
| Tenthredinidae | F | B | M | 0 ± 0 | 8.8 ± 2.9 |
| Geometridae | F | A | M | 2.9 ± 2.9 | 8.8 ± 8.8 |
| Thripidae | F | A | M | 1179.4 ± 344.1 | 1650.0 ± 797.1 |
| Trachelipodidae | S | A | R | 300.0 ± 35.3 | 176.5 ± 170.6 |
| Общая численность | 3035.3 ± 394.1 | 3067.6 ± 1238.2 | |||
| Всего таксонов | 40 | 34 | |||
| Таксономическое разнообразие (таксон/участок ± SE) | 13.6 ± 1.6 | 12.5 ± 2.3 | |||
Для каждой почвенной пробы были определены: pH водный (соотношение почва : вода по массе равно 1 : 2.5), валовое содержание (мг/кг) Al, P, S, K, Ca, Cr, Mn, Fe, Cu (рентгенофлуоресцентный анализатор S2 PICOFOX, Bruker). Валовое содержание C и N в почве (%), а также изотопный состав углерода (соотношение 13C/12C, далее δ13C) и азота (соотношение 15N/14N, далее δ15N) почвы, древесного опада, водорослей и помета P. carbo определяли на комплексе оборудования, состоящем из элементного анализатора Flash 1112 и изотопного масс-спектрометра Thermo Delta V Plus в Центре коллективного пользования “Инструментальные методы в экологии” при ИПЭЭ РАН.
Почвенные образцы, отобранные в пределах каждого исследуемого участка, считали мнимыми повторностями, в связи с этим обилие почвенной макрофауны приводится как среднее между двумя участками и для контрольного (n = 2), и для импактного (n = 2) вариантов ± стандартная ошибка среднего (SE). Для сравнения элементного состава почв, общего обилия и разнообразия макрофауны, обилия функциональных групп использовали иерархический дисперсионный анализ (проба вложена в участок) (Nested Design ANOVA) с последующим контролем частоты ложных отклонений по алгоритму Беньямини-Йекутили [23]. Перед проведением анализа данные были трансформированы логарифмированием ln(x + 1).
Анализ зависимости обилия таксонов от почвенных параметров был проведен методом главных компонент (PCA, n = 20 проб). В качестве активных переменных выбраны почвенные параметры, а обилие животных – в качестве дополнительных (пассивных) переменных, тип участка был выбран в качестве группирующей переменной. Для анализа использованы таксоны со встречаемостью не менее 4 на 20 проб.
Статистическая обработка данных выполнена с использованием программного обеспечения Statistica 13.0 (TIBCO Software Inc., Tulsa, США).
РЕЗУЛЬТАТЫ
В пределах контрольных участков в общей сложности были обнаружены животные 40 таксонов (см. табл. 2), в пределах импактных – 34, однако таксономическое разнообразие между площадками (13.6 ± 1.6 и 12.5 ± 2.3 соответственно) статистически значимо не различалось (F = 1.3, p = 0.26).
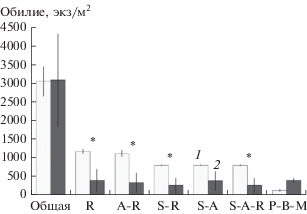
Суммарное обилие почвенной макрофауны статистически значимо не различалось между контрольными и импактными участками (рис. 1). Однако в пределах последних было значимо ниже обилие маломобильных и эпибионтных маломобильных групп животных (например, ложноскорпионы, костянки, кивсяки). Среди трофических групп в пределах импактных участков было ниже обилие сапротрофных беспозвоночных (417.6 ± 252.9 и 826.5 ± 8.8 экз/м2 в импактных и контрольных участках соответственно), однако статистически значимое негативное влияние присутствие птиц оказало только на обилие маломобильных и маломобильных эпибионтных сапрофагов (в первую очередь двупарноногих многоножек и мокриц) (см. рис. 1). Обилие геобионтных беспозвоночных значимо не различалось между контрольными и импактными участками (F = 3.0, p = 0.9) и даже было несколько выше в пределах импактных участков у геобионтных мобильных хищников (хищные личинки мух и эмбии) (см. рис. 1), однако статистически незначимо (F = 6.8, p = 0.2).
Рис. 1.
Обилие почвенных беспозвоночных (средняя ± ± SE, n = 2) на контрольных (1) и нарушенных (2) участках: Общая – общая численность макрофауны, A – эпибионтные, B – геобионтные, M – мобильные, R – маломобильные, P – хищные, S – сапрофаги; * –статистически значимые различия между контрольными и импактными участками по данным дисперсионного анализа.
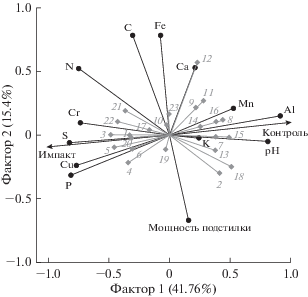
Почвы импактных участков по сравнению с контрольными характеризовались кислой реакцией (см. табл. 1, рис. 2), высоким содержанием азота, фосфора, серы, хрома и меди. В целом присутствие птиц положительно коррелировало с обилием целого ряда таксонов беспозвоночных (см. рис. 2), например трипсов (Thripidae), красноклопов (Pyrrhocoridae) и хищных жесткокрылых (Staphylinidae, Carabidae, Cantharidae), при этом увеличение обилия последних коррелировало также с ростом содержания фосфора и меди в почве. Повышение количества азота положительно коррелировало с обилием личинок грибных мушек (Platypezidae), но отрицательно влияло на обилие цикадок (Cicadellidae), половозрелых поликсенид (Polyxenidae) и личинок галлиц (Cecidomyiidae). В почве контрольных участков было значимо больше алюминия и магния (см. табл. 1), обилие полизониид (Polyzoniidae) и ложноскорпионов (Pseudoscorpionida) положительно коррелировало с их содержанием, а кивсяков (Julida) и неполовозрелых пауков-гнафозид (Gnaphosidae) – с pH. Мощность подстилки и содержание углерода, железа и кальция в почве значимо не различались между участками (см. табл. 1), при этом тесная корреляционная связь (см. рис. 2) была выявлена только между содержанием кальция и обилием неполовозрелых кистевиков (Polyxenida).
Рис. 2.
Ординационная диаграмма, иллюстрирующая результаты анализа методом главных компонент (PCA) обилия таксонов почвенных беспозвоночных (серые линии и ромбовидные символы) и почвенных параметров (черные линии и круглые символы): 1 – Thripidae; 2 – Cicadellidae; 3 – Pyrrhocoridae; 4 – Carabidae; 5 – Staphylinidae; 6 – Cantharidae; 7 – Gnaphosidae; 8 – Pseudoscorpionida; 9 – Trachelipodidae; 10 – Geophilidae; 11 – Lithobiidae; 12 – Polyxenida ювенильные; 13 – Polyxenidae; 14 – Lophoproctidae; 15 – Julidae; 16 – Polyzoniidae; 17 – Oligotomidae; 18 – Cecidomyiidae; 19 – Diaspididae; 20 – Asilidae; 21 – Platypezidae; 22 – Stratiomyiidae; 23 – куколки Diptera.
По данным изотопного анализа, величины δ13C и δ15N почв импактных участков были значимо выше, чем контрольных, что также характерно для макрофитов (C. barbata) и помета птиц по сравнению с наземным лиственным опадом (см. табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные лишь частично подтвердили наше предложение о том, что избыточный привнос морской органики в ранее не подверженные такому влиянию экосистемы окажет отрицательное влияние на суммарное обилие и таксономическое разнообразие почвенных беспозвоночных, тем не менее оба показателя значимо не различались между импактным и контрольным участками. Литературные данные также противоречивы. Например, исследования, проведенные на островах Швеции [10, 15], свидетельствуют о сокращении обилия почвенных животных на нарушенных птицами участках по сравнению с контрольными, несмотря на увеличение обилия некоторых групп (например, Astigmata). С другой стороны, на заселенных колониями птиц островах Калифорнийского залива [2, 4, 13, 24], Новой Зеландии и Австралии [25, 26] обилие фитофагов, сапрофагов и хищных беспозвоночных было статистически значимо выше, чем на островах без колоний птиц. Однако указанные работы касались более продолжительного периода присутствия птиц по сравнению с исследованными нами.
Тем не менее нами было установлено статистически значимое сокращение обилия всех маломобильных групп, а также эпибионтных сапрофагов – обитателей подстилки и верхних слоев почвы. Вероятно, сокращение обилия указанных выше групп можно объяснить как реакцию на повышенное содержание нитрата (${\text{NO}}_{3}^{ - }$) в подстилке и напочвенной растительности, источником которого является помет бакланов. Увеличение содержания азота, а также фосфора и серы именно за счет поступления помета птиц согласуется как с результатами проведенных ранее исследований [4, 8, 10, 27], так и полученными нами данными изотопного анализа. Для морской органики характерно высокое содержание 13C и 15N [3, 28], за счет чего величины δ13C и δ15N почвы импактных участков значимо выше, чем контрольных. Нами также было обнаружено значимое увеличение в почве импактных площадок количества хрома и меди, что, согласно данным других авторов [29], связано с биоаккумуляцией элементов в телах рыб – основном объекте питания бакланов, а также в самих птицах. Значимое сокращение количества алюминия в почве импактных площадок может быть вызвано методическим недочетом: взаимодействие помета птиц с породами, содержащими много аморфных соединений Fe и Al, приводит к образованию минерала таранкита [30], фракции которого в ходе пробоподготовки и просеивания почвы могли быть исключены из анализа.
Низкое обилие на импактных участках поверхностно обитающих сапротрофных животных также может быть вызвано снижением качества поступающего опада [31, 32]. Так, отмирание деревьев, в первую очередь доминанта древесного яруса – сосны пицундской, привело к резкому, обильному поступлению хвойного опада [18], разложение которого почвенными организмами происходит значительно медленне, чем листового [31, 32]. Вероятно, ежегодные зимовки баклана в пределах одного и того же участка являются фактором, усиливающим негативное воздействие на маломобильные группы животных из-за сокращения временного интервала для возможности восстановления на территории, что также усугубляется неспособностью представителей данной группы быстро покинуть участок с неблагоприятными условиями [21]. С другой стороны, за счет высокой активности передвижения, в том числе через нарушенные участки, весьма локальные относительно площади лесной экосистемы в целом [20], обилие мобильных групп животных значимо не различалось между импактными и контрольными участками.
Отсутствие различий в обилии геобионтных животных между участками может быть связано с процессом осаждения и высыхания помета птиц преимущественно на напочвенной растительности и подстилке, что в дальнейшем препятствует проникновению избытков нитратов в нижние слои почвы, чему также способствуют засушливый климат и невысокое количество осадков в регионе [19]. Вероятно, обилие хвойного опада, высокое проективное покрытие травяного яруса, а также снижение испарения вследствие увеличения альбедо участков, покрытых пометом птиц, к настоящему моменту нивелировало возможные изменения во влажности почвы, которые могли быть вызваны сокращением затененности участков из-за гибели древесного яруса. Однако данный тезис нуждается в дальнейшей проверке.
Обилие фитофагов также значимо не различалось на контрольных и импактных участках, что во многом вызвано развитием ксерофитных злаков в травяном ярусе за счет увеличения содержания фосфора и азота в почве, снижения проективного покрытия крон [33, 34], а также одновременным снижением пресса со стороны эпибионтных хищников (например, пауков).
ЗАКЛЮЧЕНИЕ
Полученные результаты в целом подтверждают и дополняют данные других авторов. Колонии большого баклана привели к кардинальным изменениям почвенно-растительных условий исследованных лесных экосистем и, как следствие, существенным изменениям в структуре сообществ почвенных беспозвоночных. Несмотря на отсутствие статистически значимой разницы в суммарном обилии и таксономическом разнообразии животных между контрольными и импактными участками, с помощью анализа функциональных групп было выявлено значимое снижение обилия маломобильных животных и эпибионтных сапрофагов, что делает данный подход перспективным инструментом для исследований нарушений экосистем, в том числе при прогнозировании и оценке последствий нарушений.
Следует упомянуть, что настоящее исследование является пилотным и проведено впервые как в лесных экосистемах, ранее не подверженных влиянию морских птиц, так и на побережье Черного моря в целом. Соответственно полученные результаты не позволяют однозначно судить о закономерности изменений обилия и структуры населения сообществ беспозвоночных при подобных нарушениях и требуют дальнейших исследований, увеличения объема выборки, количества участков отбора и изучаемых групп животных (например, хортобионтов, микро- и мезофауны).
Авторы выражают искреннюю признательность заместителю директора по научной работе Государственного природного заповедника “Утриш” О.Н. Быхаловой за содействие в организации полевых работ, Ю.М. Лебедеву – за помощь в отборе проб, К.Б. Гонгальскому – за встестороннюю помощь в работе, а также определение мокриц, жесткокрылых и личинок двукрылых, Р.Р. Сейфулиной – за определение пауков. Статистическая обработка данных и определение таксономического состава проведены с использованием программного обеспечения и обрудования, приобретенного за счет гранта РНФ (№ 16-14-00096). Работа выполнена при финансовой поддержке РФФИ (мол_а 18-34-00573). Авторы подтверждают остуствие конфликта интересов.
Список литературы
Collier K.J., Bury S., Gibbs M. A stable isotope study of linkages between stream and terrestrial food webs through spider predation // Freshwater Biology. 2002. V. 47. P. 1651–1659. https://doi.org/10.1046/j.1365-2427.2002.00903.x
Polis G.A., Anderson W.B., Holt R.D. Toward an integration of landscape ecology and food web ecology: the dynamics of spatially subsidized food webs // Ann. Rev. Ecol. Syst. 1997. V. 28. P. 289–316. https://doi.org/10.1146/annurev.ecolsys.28.1.289
Anderson W.B., Polis G.A. Marine subsidies of island communities in the Gulf of California: evidence from stable carbon and nitrogen isotopes // Oikos. 1998. V. 81. P. 75–80. https://doi.org/10.2307/3546469
Polis G.A., Hurd S.D. Allochthonous input across habitats, subsidized consumers, and apparent trophic cascades: examples from the ocean-land interface // Eds. Polis G.A., Winemiller K.O. Food Webs: Integration of Patterns and dynamics. New York: Chapman and Hall., 1996. P. 275–285.
Polis G.A., Hurd S.D. Linking marine and terrestrial food webs: allochthonous input from the ocean supports high secondary productivity on small islands and coastal land communities // Am. Nat. 1996. V. 147. P. 396–423. https://doi.org/10.1086/285858
Havik G., Catenazzi A., Holmgren M. Seabird nutrient subsidies benefit non-nitrogen fixing trees and alter species composition in south American coastal dry forests // PLoS One. 2014. V. 9 (1): e86381. https://doi.org/10.1371/journal.pone.0086381
Kolb G.S., Jerling L., Essenberg C. et al. The impact of nesting cormorants on plant and arthropod diversity // Ecography. 2012. V.35. P.726–740. https://doi.org/10.1111/j.1600-0587.2011.06808.x
Breuning-Madsen H., Ehlers C.B., Borggaard O.K. The impact of perennial cormorant colonies on soil phosphorus status // Geoderma. 2008. V. 148. P. 51–54. https://doi.org/10.1016/j.geoderma.2008.09.002
McGrath D.M., Murphy S.D. Double-crested cormorant (Phalacrocorax auritus) nesting effects on understory composition and diversity on island ecosystems in Lake Erie // Environmental management. 2012. V. 50. P. 304–314. https://doi.org/10.1007/s00267-012-9878-6
Kolb G.S., Palmborg C., Taylor A.R. et al. Effects of nesting cormorants (Phalacrocorax carbo) on soil chemistry, microbial communities and soil fauna // Ecosystems. 2015. V. 18. P. 643–657. https://doi.org/10.1007/s10021-015-9853-1
Balčiauskas L., Balčiauskienė L., Jasiulionis M. Mammals under a colony of great cormorants: Population structure and body condition of yellow-necked mice // Turkish J. of Zoology. 2015. V. 39. № 5. P. 941–948. https://doi.org/10.3906/zoo-1407-27
Balčiauskas L., Skipitytė R., Jasiulionis M. et al. Immediate increase in isotopic enrichment in small mammals following the expansion of a great cormorant colony // Biogeosciences. 2018. V. 15. P. 3883–3891. https://doi.org/10.5194/bg-15-3883-2018
Duffy D. Ants, ticks, and nesting seabirds: dynamic interactions // Bird-Parasite Interactions. Eds. Loye J., Zuk M. New York: Oxford Univ. Press, 1991. P. 242–257.
Zmudczyńska K., Olejniczak I., Zwolicki A. et al. Influence of allochtonous nutrients delivered by colonial seabirds on soil collembolan communities on Spitsbergen // Polar Biology. 2012. V. 35. P. 1233–1245. https://doi.org/10.1007/s00300-012-1169-4
Kolb G.S., Jerling L., Hambäck P.A. The impact of cormorants on plant-arthropod food webs on their nesting islands // Ecosystems. 2010. V. 13. P. 353–366. https://doi.org/10.1007/s10021-010-9323-8
Kanarek G., Sitko J., Rolbiecki L., Rokicki J. Digenean fauna of the great cormorant Phalacrocorax carbo sinensis (Blumenbach, 1798) in the brackish waters of the Vistula Lagoon and the Gulf of Gdansk (Poland) // Wiad Parazytol. 2003. V. 49. P. 293–299.
Чайка К.В. Большой баклан (Phalacrocorax carbo L.) в регуляции биоресурсов экосистемы Куршского залива: Дис. … канд. биол. наук. Калининград, 2017. 190 с.
Джангиров М.Ю., Суворов А.В. Современное состояние фитоценозов сосны пицундской (Pinus pityuosa Steven) на территории заповедника “Утриш” // Охрана биоты в государственном природном заповеднике “Утриш”. Под. ред. Быхаловой О.Н. 2015. Т. 3. С. 129–141.
Серегин А.П., Суслова Е.Г. Флора сосудистых растений окрестностей пос. Малый Утриш // Ландшафтное и биологическое разнообразие Северо-Западного Кавказа. М.: МГУ, 2007. С. 104–174.
Zaitsev A.S., Gongalsky K.B., Bengtsson J., Persson T. Connectivity of litter islands remaining after a fire and unburnt forest determines the recovery of soil fauna // Appl. Soil Ecol. 2014. V. 83. P. 101–108. https://doi.org/10.1016/j.apsoil.2014.01.007
Korobushkin D.I., Gorbunova A.Yu., Zaitsev A.S., Gongalsky K.B. Trait-specific response of soil macrofauna to forest burning along a macrogeographic gradient // Appl. Soil Ecol. 2017. V. 112. P. 97–100. https://doi.org/10.1016/j.apsoil.2016.12.004
Wong M.K.L., Guénard B., Lewis O. Trait-based ecology of terrestrial arthropods. OSF Preprints, 2018. 47 p. https://doi.org/10.31219/osf.io/bvq2j
Benjamini Y., Yekutieli D. The control of the false discovery rate in multiple testing under dependency // Annals of Statistics. 2001. V. 29. P. 1165–1188. https://doi.org/10.1214/aos/1013699998
Sanchez Piñero F., Polis G.A. Bottom-up dynamics of allochthonous input: direct and indirect effects of seabirds on islands // Ecology. 2000. V. 81. P. 3117–3132. https://doi.org/10.1890/0012-9658(2000)081[3117:budoai]2.0.co;2
Daugherty C.H., Towns D.R., Atkinson I.A.E., Gibbs G.W. The significance of the biological resources of New Zealand islands for ecological restoration // Ecological Restoration of the New Zealand Islands. Eds. Towns D.R., Daugherty C.H. IAE Atchinson, 1990. P. 9–21.
Towns D.R., Wardle D.A., Mulder C.P. et al. Predation of seabirds by invasive rats: multiple indirect consequences for invertebrate communities // Oikos. 2009. V. 118. P. 420–430. https://doi.org/10.1111/j.1600-0706.2008.17186.x
Birkhofer K., Schöning I., Alt F. et al. General relationships between abiotic soil properties and soil biota across spatial scales and different land-use types // PLoS One. 2012. V. 7 № 8. P. e43292. https://doi.org/10.1371/journal.pone.0043292
Коробушкин Д.И. Роль аллохтонного углерода в энергетике сообществ наземных беспозвоночных в градиенте удаления от Черного моря и пресноводного водоема (по данным изотопного анализа) // Экология. 2014. № 3. С. 221–229. https://doi.org/10.7868/S0367059714030068
Rial D., Santos-Echeandía J., Álvarez-Salgado X.A. et al. Toxicity of seabird guano to sea urchin embryos and interaction with Cu and Pb // Chemosphere. 2016. V. 145. P. 384–393. https://doi.org/10.1016/j.chemosphere.2015.11.064
Lindsay W.L. Chemical equilibria in soils. New York: Wiley-Interscience, 1979. 449 p.
Стриганова Б.Р. Питание почвенных сапрофагов. М.: Наука, 1980. 244 с.
Berg B., Berg M.P., Bottner P. et al. Litter mass loss rates in pine forests of Europe and eastern United States: some relationship with climate and litter quality // Biogeochemistry. 1993. V. 20. P. 127–159. https://doi.org/10.1007/BF00000785
Wainright S.C., Haney J.C., Kerr C. et al. Utilization of nitrogen derived from seabird guano by terrestrial and marine plants at St. Paul, Pribilof Islands, Bering Sea, Alaska // Marine Biology. 1998. V. 131. P. 63–71. https://doi.org/10.1007/s002270050297
Ellis J.C. Marine birds on land: a review of plant biomass, species richness, and community composition in seabird colonies // Plant Ecology. 2005. V. 181. P. 227–241. https://doi.org/10.1007/s11258-005-7147-y
Дополнительные материалы отсутствуют.


