Экология, 2020, № 1, стр. 43-50
Динамика сообществ эпифитных лишайников в начальный период после снижения выбросов медеплавильного завода
И. Н. Михайлова *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: mikhailova@ipae.uran.ru
Поступила в редакцию 26.04.2019
После доработки 20.05.2019
Принята к публикации 30.05.2019
Аннотация
На основе ежегодных регистраций проанализированы изменения состава и структуры сообществ эпифитных лишайников в течение 5 лет (2014–2018 гг.) на 22 постоянных пробных площадях в елово-пихтовых лесах Среднего Урала после значительного снижения выбросов Среднеуральского медеплавильного завода. Несмотря на почти полное прекращение атмосферного поступления токсикантов, в коре пихты в окрестностях завода сохраняются повышенные концентрации Cu и кислотность коры. На сильно загрязненной территории отмечен стремительный рост числа видов лишайников (на 1–2 вида ежегодно). Заселяются прежде всего виды с высоким колонизирующим потенциалом, обильные в прилегающих биотопах или на других субстратах в пределах сильно загрязненных участков. При этом степень токситолерантности не имеет решающего значения: стволы заселяются как устойчивыми, так и средне- и высокочувствительными видами. Структура сообществ на загрязненной территории в настоящее время принципиально отличается от фоновой: доминирует вид-эксплерент Hypocenomyce caradocensis, отсутствуют или редки типичные для фоновых елово-пихтовых лесов виды.
Способность лишайников реагировать на изменения химического состава окружающей среды хорошо известна. Последствия увеличения содержания токсикантов в среде подробно исследованы на всех уровнях организации – от субталломного (элементный состав, биохимические и физиологические параметры) до ценотического (состав и структура сообществ) [1, 2]. Закономерности реакции на улучшение качества местообитаний изучены менее подробно, причем главным образом для условий городов [3–9]. Однако полученные динамические ряды сложно однозначно интерпретировать из-за специфичности городской среды. Так, уменьшение напряженности одного фактора (содержание соединений серы) может сопровождаться увеличением другого (содержание соединений азота), а снижение выбросов промышленных предприятий “компенсироваться” повышением выбросов автотранспорта и т.д. [5, 10].
Точечные источники эмиссии поллютантов позволяют анализировать градиент стрессового фактора “в чистом виде”. Однако восстановлению лишайников после снижения или прекращения выбросов крупных промышленных предприятий посвящены лишь единичные исследования [11, 12], причем состояние сообществ оценено через относительно длительные промежутки времени после прекращения выбросов (10, 15 или 20 лет). Исследования в меньшем временном масштабе, например ежегодно в течение нескольких лет, не проводились, хотя они позволяют получить более точные оценки скорости изменений и определить последовательность реколонизации видами с различными жизненными стратегиями и разной чувствительностью к нарушениям среды.
Цель настоящей работы – проанализировать на основе ежегодных регистраций изменения видового состава и структуры эпифитных лишайниковых сообществ в елово-пихтовых лесах в начальный период после снижения выбросов крупного медеплавильного завода. Район наших исследований удобен для изучения восстановительной динамики, поскольку для него имеются данные о состоянии лишайниковых сообществ в 1990–1995 гг., т.е. в период высоких выбросов [13–15]. Уже через 10 лет после начала снижения выбросов нами была отмечена реколонизация бывшей “лишайниковой пустыни” (1–2 км от завода), а также документированы первые изменения видового состава сообществ на остальной загрязненной территории [16].
Мы тестировали две гипотезы. Первая заключается в предположении, что реколонизация загрязненной территории осуществляется преимущественно обильными в окружающих биотопах (и соответственно производящими много диаспор) видами. Это предположение базируется на аналогии с постпирогенными сукцессиями [17, 18]. Вторая предполагает, что степень токситолерантности вида не имеет решающего значения для успеха колонизации. Об этом свидетельствуют полученные нами ранее результаты о заселении бывшей “лишайниковой пустыни” не только устойчивыми видами, но и видами средней чувствительности [16], а также данные из района крупного медеплавильного комбината г. Садбери (Канада) [11].
МАТЕРИАЛ И МЕТОДИКА
Исследования проведены в районе Среднеуральского медеплавильного завода, расположенного около г. Ревды Свердловской области, который функционирует с 1940 г. Основные ингредиенты выбросов – оксиды серы и пылевые частицы с сорбированными тяжелыми металлами (Cu, Fe, Cd, Zn, Pb и др.) и металлоидами (As). В 1980 г. выбросы завода составляли 225 тыс. т поллютантов в год, в конце 1980-х – 140 тыс., в 1995–1998 гг. – 71–96 тыс., в 2003–2008 гг. – 24–34 тыс., а после кардинальной реконструкции предприятия в 2010 г. – около 3–5 тыс. [19]. Описания района исследований, степени деградации и восстановительной динамики ряда объектов опубликованы ранее [16, 19–21]. Для анализа долговременной динамики состояния лишайниковых сообществ использовали данные, полученные в ходе исследования сукцессий лишайников на стволах пихты в 1990–1992 гг. в трех зонах нагрузки: 4, 7 и 30 км от завода [14]. В анализ включены деревья старше 40 лет (всего 190 стволов). Территория в непосредственной близости от завода (1–2 км), представлявшая собой в 1990–1992 гг. “лишайниковую пустыню”, была обследована маршрутным методом.
Описания лишайниковых сообществ. Постоянные пробные площади (ПП) были заложены в 2014 г. в елово-пихтовых лесах на расстоянии 1, 2, 4, 7 и 30 км к западу от источника выбросов, т.е. в противоположном господствующим ветрам направлении (две ПП на удалении 1 км и по 5 ПП на остальных удалениях). На каждой ПП были выбраны 5 стволов пихты сибирской (Abies sibirica Ledeb.), на каждом из которых разметили 4 постоянные микроплощадки размером 20 × 20 см (на основании ствола и высоте 1.3 м с северной и южной сторон). Состояние лишайниковых сообществ описывали ежегодно в 2014–2018 гг. (кроме удаления 7 км, где был пропущен 2016 г.). Для каждого ствола регистрировали все присутствующие виды лишайников, а также с помощью палетки оценивали обилие каждого вида на микроплощадках (как количество клеток 2 × 2 см, в которых встречен вид). Обилие видов на стволе вычисляли как долю занятых клеток на всех четырех микроплощадках (в %). Видам, встреченным за пределами микроплощадок, присваивали обилие 0.1. Суммарное обилие лишайников на стволе вычисляли как сумму обилий отдельных видов. Ранее [22] была показана информативность этого показателя для оценки состояния сообществ эпифитных лишайников в градиенте токсической нагрузки.
За период наблюдений из-за ветровалов были утрачены три модельных дерева на фоновых ПП и одно дерево на удалении 2 км. Материал по выпавшим деревьям учитывали при оценке числа видов лишайников, но не включили в анализ динамики обилия видов.
Анализ химического состава коры. В 2015 г. на каждой ПП были отобраны образцы верхнего (1–3 мм) слоя коры с 5 стволов пихты на высоте 1–1.3 м (равномерно по всей окружности ствола). В лаборатории кора была очищена от лишайников и других примесей и измельчена на лабораторной мельнице. Для определения кислотности образцы заливали деионизированной водой (соотношение кора: вода равно 1 : 25) и помещали на 30 мин на встряхиватель. Показатель рН измеряли с помощью ионометра inoLab740 (WTW, Германия) через 1.5 ч отстаивания в закрытых стаканах. Валовое содержание меди определяли на атомно-абсорбционном спектрофотометре AAS 6 Vario (Analytik Jena AG, Германия) с пламенным вариантом атомизации. Подготовку проб к анализу осуществляли методом микроволнового разложения в 65%-ной HNO3 в печи MWS-2 (Berghof, Германия).
Статистический анализ данных реализован в пакетах STATISTICA v. 8.0 и PAST 3.12. Для оценки влияния загрязнения на химические характеристики коры использовали иерархический ANOVA со смешанными эффектами (учетная единица – дерево, случайный фактор – пробная площадь, ПП вложена в зону загрязнения). Множественные сравнения выполнены по критерию Тьюки. Значимость различий обилия видов между началом и концом периода наблюдений оценена с помощью парного критерия Вилкоксона. Для сравнения видового состава сообществ использовали коэффициент Брея-Кертиса для количественных данных.
РЕЗУЛЬТАТЫ
Химический состав коры. В окрестностях завода рН коры понижен на 0.3 ед. по сравнению с фоновой территорией (рис. 1, F4;86 = 25.5, p < 0.001). Значимы и различия между ПП внутри зоны (F17;86 = 2.1, p < 0.05). Множественные сравнения не выявили значимых различий между удалениями 7 и 30 км (р = 0.12), но все остальные удаления значимо отличаются от них (р $ \ll $ 0.001).
Рис. 1.
Кислотность коры пихты (а) и содержание меди в коре пихты (б) в градиенте загрязнения. Показаны медиана, межквартильный размах и 95%-ный интервал.
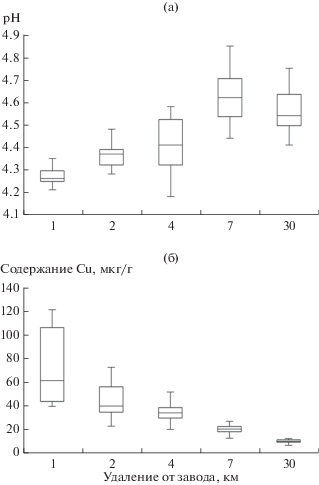
Уровень содержания Cu в коре в окрестностях завода в 7.5 раза превышает фоновый (рис. 1, F4;85 = 35.2, p < 0.001). Как и в случае с рН, случайный фактор – ПП внутри зоны – также оказывает значимое влияние на содержание Cu (F17;85 = 1.92, p < 0.05). Множественные сравнения показывают значимость попарных отличий всех удалений друг от друга, кроме пары 2–4 км.
Видовой состав. Всего на модельных стволах пихты в районе исследования идентифицировано 23 вида лишайников (табл. 1). В группу накипных соредиозных объединены Fuscidea arboricola, F. pusilla, Lecidea nylanderi и Ropalospora viridis, молодые талломы которых не всегда можно идентифицировать в поле. За период с 2014 г. по 2018 г. сообщества модельных стволов пополнились новыми видами (рис. 2). Следует учитывать, что для 1990–1992 гг. приведено общее число видов, обнаруженных на стволах пихты на указанных удалениях [16], а для 2014–2018 гг. – число видов только на модельных деревьях.
Таблица 1.
Обилие эпифитных лишайников на модельных стволах пихты в разных зонах нагрузки
| Виды | Удаление от завода и год учета | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 30 км | 7 км | 4 км | 2 км | 1 км | ||||||
| 2014 | 2018 | 2014 | 2018 | 2014 | 2018 | 2014 | 2018 | 2014 | 2018 | |
| Bryoria nadvornikiana | 0 | 0.011 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Cetraria sepincola | 0 | 0 | 0 | 0 | 0 | 0 | 0.010 | 0.013 | 0 | 0 |
| Chaenotheca ferruginea | 43.330 | 46.117 | 0.360 | 0.730 | 0.110 | 0.230 | 0 | 0 | 0 | 0 |
| Cladonia cenotea | 0.010 | 0.089 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. coniocraea | 6.693 | 12.211** | 7.975 | 13.381** | 3.310 | 12.424*** | 0.076 | 0.384* | 0.010 | 0.025* |
| C. fimbriata | 0.023 | 0.640* | 0 | 0.001 | 0.011 | 0.042 | 0 | 0.010 | 0 | 0.010 |
| Evernia mesomorpha | + | 0.047 | 0 | 0 | 0 | 0.010 | 0 | 0.017 | 0 | 0 |
| Hypocenomyce caradocensis | 16.227 | 17.104 | 60.280 | 58.200 | 31.120 | 32.840 | 12.600 | 17.390* | 3.853 | 10.700** |
| H. scalaris | 0.010 | 0.020 | 0.003 | 0.002 | 0 | 0 | 0 | 0 | 0 | 0 |
| Hypogymnia physodes | 59.227 | 50.913** | 0.511 | 4.480*** | 0.922 | 1.310 | 1.157 | 3.413*** | 0.010 | 0.035* |
| H. tubulosa | 0 | 0.013 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Lepraria elobata | 5.068 | 9.340** | 0.030 | 0.003 | 0 | 0 | 0 | 0 | 0 | 0 |
| Micarea denigrata | 0 | 0 | 0.001 | 0.020 | 0.001 | 0.001 | 0 | 0.018 | 0 | 0 |
| M. prasina + M. micrococca | 0.011 | 0.011 | 0 | 0 | 0 | 0 | 0.001 | 0.011** | 0 | 0 |
| Parmeliopsis ambigua | + | 0.047 | 0 | 0.001 | 0 | 0.010 | 0 | 0 | 0 | 0 |
| Placynthiella uliginosa | 0 | 0 | 0 | 0 | 0 | 0.00 | 0.001 | 0.002 | 0.003 | 0.140* |
| Scoliciosporum chlorococcum | 0.002 | 0.002 | 0.002 | 0.001 | 0.001 | 0.002 | 0.010 | 0.010 | 0.030 | 0.030 |
| Vulpicida pinastri | 0.019 | 0.021 | 0.020 | 0.013 | 0.001 | 0.001 | 0.012 | 0.025 | 0 | 0 |
| Накипные соредиозные | 0.966 | 1.122* | 0.025 | 0.450* | 0.001 | 0.074** | 0 | 0.045 | 0 | 0.025 |
| Неопределенные накипные | 2.561 | 0.230 | 0.020 | 0 | 0 | 0 | 0 | 0.002 | 0 | 0 |
| Сумма встречаемостей | 134.147 | 137.938 | 69.227 | 77.282** | 35.477 | 47.322** | 13.867 | 21.340** | 3.996 | 10.965** |
Рис. 2.
Динамика числа видов эпифитных лишайников на стволах пихты на разном удалении от СУМЗа за исследованный период.
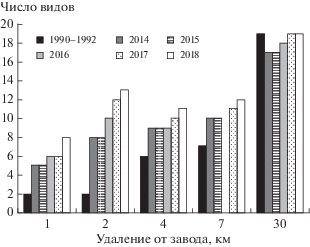
На фоновой территории появились Bryoria nadvornikiana и Hypogymnia tubulosа: первый из них входил в список видов фоновой территории, составленный в 1990–1992 гг. [14, 16], но на модельных деревьях в 2014 г. не был отмечен.
К 2018 г. на загрязненную территорию “продвинулись” 4 вида, которые в 2014 г. были отмечены только на фоновых ПП: Evernia mesomorpha, Fuscidea pusilla, Lecidea nylanderi и Parmeliopsis ambigua. На удалениях 4 и 7 км число видов увеличилось на 2 с 2014 г. по 2018 г. и на 5 по сравнению с периодом высоких выбросов (см. рис. 2). Максимальный прирост видового богатства отмечен на удалении 2 км: за период с 2014 г. по 2018 г. появилось 5 видов, а разница с периодом высоких выбросов составила 11 видов. Заселившиеся виды представляют весь спектр токситолерантности: Micarea denigratа – один из наиболее токситолерантных эпифитов в районе исследования на стволах березы [15], Cladonia fimbriata – среднечувствительный вид [14] и, наконец, E. mesomorpha, F. pusilla и L. nylanderi – виды, которые в 2014 г. были отмечены только на фоновых ПП.
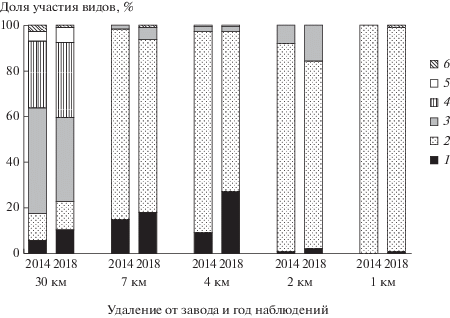
Структура сообществ. На фоновой территории в сообществах доминируют Hypogymnia physodes и Chaenotheca ferruginea, субдоминант – Hypocenomyce caradocensis (табл. 1, рис. 3, 4). За период исследования значимо возросло обилие типичных для оснований стволов видов – Cladonia coniocraea и Lepraria elobata (см. табл. 1), значимо снизилось обилие H. physodes, а суммарное обилие всех видов осталось неизменным.
Рис. 3.
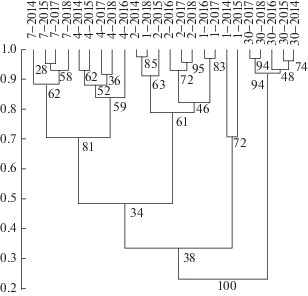
Дендрограмма сходства видового состава сообществ лишайников на разном удалении от завода (1, 2, 4, 7 и 30 км) и в разные периоды наблюдений (2014–2018 гг.). Использован коэффициент Брея-Кертиса и метод UPGMA. В основаниях кластеров показаны цифры бутстреп-поддержки (% от 1000 повторностей).
На загрязненной территории (с 1-го по 7-й км) структура сообществ принципиально отличается от фоновой: повсеместно доминирует H. caradocensis (см. рис. 4), причем его обилие на удалении 4 и 7 км с 2014 г. по 2018 г. осталось неизменным, а на удалениях 1–2 км значимо возросло. Вторую позицию на удалениях 4 и 7 км занимает C. coniocraea, на удалении 2 км – H. physodes. Рост обилия C. coniocraea отмечен на всех ПП (см. табл. 1), причем на удалении 4 км показатель вырос почти в 4 раза. Доля участия остальных видов ничтожно мала.
Отличительной чертой сообществ сильно загрязненной (1–2 км) территории можно считать участие в них видов, не характерных для стволов пихты в фоновых местообитаниях: Placynthiella uliginosa – токситолерантный эпиксильный вид, который в условиях промышленных пустошей часто переходит на обнаженную поверхность почвы и основания стволов деревьев [15]; Cetraria sepincola – вид, встречающийся лишь на ветвях пихты и только на осветленных участках или опушках леса, и уже упоминавшийся токситолерантный вид M. denigrata. Кроме того, в сообществах увеличено по сравнению с фоновой территорией обилие Scoliciosporum chlorococcum, также одного из наиболее токситолерантных видов.
Суммарное обилие лишайников увеличилось с 2014 г. по 2018 г. на всех загрязненных участках, причем наибольший прирост отмечен на удалении 1 км. Вновь заселившиеся виды не вносят весомого вклада: увеличение суммарного обилия обеспечено ранее присутствовавшими видами. Крайне низкое обилие на удалении 1–2 км обусловлено еще и тем, что заселение практически всех видов происходит в нижней части ствола, у поверхности почвы, между выступающих корней, т.е. вне учетных микроплощадок.
Описанные изменения наглядно иллюстрирует дендрограмма сходства (см. рис. 3). Сообщества фоновой территории за период наблюдений остались практически неизменными; сообщества на удалении 4 и 7 км также объединяются в отдельные кластеры. Наибольшие изменения произошли в сообществах на удалении 1 км: если в 2014–2015 гг. они образовывали отдельный кластер, то за два последующих года вплотную “приблизились” к сообществам 2 км.
Показательна также динамика сходства сообществ загрязненных участков с фоновой территорией (табл. 2). Для сообществ 1 км коэффициент сходства к 2018 г. увеличился в 3 раза по сравнению с 2014 г. и сравнялся с показателем для сообществ 2 км в 2014 г. В свою очередь сходство с фоновой территорией сообществ 2 км в 2018 г. сравнялось с таковым сообществ 4 и 7 км в 2014 г.
Таблица 2.
Динамика коэффициентов сходства с контролем сообществ эпифитных лишайников (коэффициенты Брэя-Кертиса для количественных данных, %)
| Год наблюдений | Удаление от завода, км | |||
|---|---|---|---|---|
| 1 | 2 | 4 | 7 | |
| 2014 | 5.6 | 18.7 | 24.4 | 25.7 |
| 2015 | 9.9 | 17.7 | 25.0 | 24.4 |
| 2016 | 19.2 | 27.8 | 33.7 | – |
| 2017 | 21.2 | 25.8 | 30.4 | 28.0 |
| 2018 | 18.6 | 26.5 | 33.7 | 32.4 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сообщества эпифитных лишайников фоновой территории находятся в стабильном состоянии, их динамика заключается во внедрении относительно редких видов, не играющих существенной роли в структуре сообществ. Не ясны причины снижения обилия доминанта лишайниковых сообществ – H. physodes; это явление требует дополнительных исследований.
На загрязненной территории продолжается активный процесс восстановления лишайниковых сообществ, заключающийся как в увеличении числа видов, так и росте суммарного обилия, которое растет преимущественно за счет вида-эксплерента H. caradocensis, захватывающего свободные участки стволов в отсутствие межвидовой конкуренции. Нарушенные сообщества в настоящее время принципиально отличаются от фоновых по составу: в них отсутствуют или редки типичные для ненарушенных елово-пихтовых лесов виды, прежде всего C. ferruginea и L. elobata. Интересно формирование своеобразного “техногенного экотона” в 2 км от завода: здесь присутствуют как виды, характерные для загрязненных участков, так и виды ненарушенных и слабонарушенных территорий. Вполне вероятно, что это временное явление – виды загрязненных участков в дальнейшем будут вытеснены из сообществ в результате межвидовой конкуренции с видами-виолентами ненарушенных и слабонарушенных территорий.
Стремительное увеличение числа видов лишайников в наиболее загрязненной части градиента (на 1–2 вида ежегодно) контрастирует со стабильностью разнообразия для травяно-кустарничкового яруса на тех же участках, число видов которого практически не изменилось со времени высоких выбросов [19]. Крайне медленное восстановление растительных сообществ после прекращения выбросов промышленных предприятий показано и в ряде других исследований [23–25]. Основным фактором, тормозящим восстановление, считают сохранение токсичности среды из-за низкой скорости очищения почвы от тяжелых металлов [21].
Эпифитные лишайники напрямую не связаны с пулом токсикантов в почве, что позволяет предположить более высокие темпы их восстановления по сравнению другими компонентами экосистем, в том числе с лишайниками на других субстратах. Действительно, исследования в окрестностях медеплавильного комбината в г. Садбери (Канада) показали более быстрые темпы восстановления эпифитных лишайниковых сообществ по сравнению с эпигейными и эпилитными [11, 23]. Тем не менее на эпифитные лишайники также оказывает существенное влияние химический состав их субстрата, т.е. коры форофитов. Значимость кислотности субстрата для роста и развития лишайников общеизвестна [26, 27]. Сохраняющуюся повышенную кислотность коры дуба считают одной из причин медленного восстановления лишайниковых сообществ в Лондоне [5]. В лабораторных условиях показано отрицательное влияние содержания металлов и серы в культуральной среде на прорастание соредий [28–30]. Сравнение наших результатов с данными 2004 г. [31] показало, что концентрации Сu в коре существенно снизились: на расстоянии 1 и 2 км содержание в 2004 г. составляло 331.2 и 162.6 мкг/г, что соответствует снижению в 3.7 и 4.5 раза к 2015 г., на расстоянии 7 км – 128.1 мкг/г (снижение в 6 раз). На удалении 30 км в 2004 г. оно составляло 24.3 мкг/г, т.е. даже для фоновых участков зафиксировано двукратное снижение. Тем не менее содержание токсикантов в коре форофитов в окрестностях завода на настоящий момент значимо отличается от фонового уровня (см. рис. 1). Хотя валовому содержанию меди в коре нельзя придавать прямой токсикологический смысл, в сочетании с повышенной кислотностью коры они свидетельствуют о частичном сохранении токсической нагрузки на эпифитные лишайниковые сообщества, несмотря на почти полное прекращение атмосферного поступления токсикантов в экосистемы.
Для развития сообществ до фонового состояния необходимы заселение и успешное развитие видов, которые чувствительны не только к загрязнению среды, но и к микроклимату местообитаний. К таким видам относятся, например, представители калициевых лишайников [32] (в районе исследования – C. ferruginea). В настоящее время микроклимат елово-пихтовых лесов в окрестностях завода существенно изменен вследствие изреженности древостоя и слабого развития травяно-кустарничкового яруса. Индикатором таких изменений служит присутствие видов лишайников, не характерных для стволов пихты: С. sepincola и M. denigratа предпочитают режим повышенной инсоляции [33, 34] и в районе наших исследований чаще встречаются в березовых лесах [14, 35]. Косвенно указывает на ксерофитизацию местообитания низкое обилие на стволах пихты видов рода Cladonia, несмотря на высокое их обилие на почве и гниющей древесине.
Таким образом, как минимум два фактора могут тормозить процесс дальнейшего восстановления эпифитных лишайниковых сообществ: сохранение токсикантов в коре форофитов и измененный микроклимат местообитаний. Вполне вероятно, что отмеченные высокие темпы реколонизации лишайниками характерны только для начальных этапов восстановления, а дальнейшие события будут развиваться по сценарию, описанному для окрестностей г. Садбери. Начало заселения в этом районе “лишайниковой пустыни” было отмечено в течение первого десятилетия после прекращения выбросов [11], но полное восстановление разнообразия лишайников констатировали лишь спустя 40 лет [12]. Впрочем, некоторые чувствительные виды (Usnea hirta и E. mesomorpha) заселяли территорию раньше, чем это можно было предположить исходя из их высокой чувствительности к загрязнению [11].
ЗАКЛЮЧЕНИЕ
Снятие токсической нагрузки на природные сообщества, обусловленное снижением промышленных выбросов, предоставляет исследователям уникальную возможность исследовать феномен эластичности экосистем, т.е. их способности возвращаться в исходное состояние после прекращения воздействия нарушающего фактора.
Результаты наших исследований показали, что успешность реколонизации загрязненных территорий зависит от многих как внутренних (биологические и экологические особенности видов), так и внешних (состояние местообитаний, остаточное загрязнение субстратов) факторов. Обе наши исходные гипотезы подтвердились. Основу пионерных сообществ действительно составляют виды-эксплеренты с высоким колонизирующим потенциалом, обильные в прилегающих биотопах или на других субстратах в пределах сильнозагрязненных участков. Также подтвердилось и предположение о слабой связи скорости заселения со степенью токситолерантности видов: в течение первого десятилетия после существенного снижения выбросов на территории бывшей “лишайниковой пустыни” уже зарегистрированы высокочувствительные виды.
Продолжение исследований с привлечением данных о восстановлении других компонентов экосистем, в первую очередь древесного и травяно-кустарничкового ярусов, а также о динамике содержания токсикантов в субстратах даст возможность соотнести значимость разных факторов для судьбы видов в меняющихся условиях среды.
Выражаю признательность к.б.н. М.Р. Трубиной за всестороннюю помощь на всех этапах работы – от сбора материала до обработки данных и обсуждения результатов, а также д.б.н. Е.Л. Воробейчику за ценные советы при обсуждении рукописи. Сбор материала в 2015–2017 гг. и химический анализ коры были выполнены при поддержке РФФИ (проект № 15-04-06828), сбор материала в 2014 и 2018 г., анализ данных и подготовка рукописи выполнены в рамках Государственного задания ИЭРиЖ УрО РАН.
Список литературы
Бязров Л.Г. Лишайники в экологическом мониторинге. М.: Научный мир, 2002. 336 с.
Monitoring with Lichens – Monitoring Lichens / Eds. Nimis P.L., Scheidegger C., Wolseley P.A. Dordrecht–Boston–London: Kluwer Acad. Publishers, 2002. 408 p.
Rose C.I., Hawksworth D.L. Lichen recolonization in London’s cleaner air // Nature. 1981. V. 289. P. 289–292.
Kandler O. Lichen and conifer recolonisation in Munich’s cleaner air // Air Pollution and Ecosystems. Ed. Mathy P. Dordrecht: D. Reidel, 1987. P. 784–790.
Bates J.W., Bell J.N.B., Farmer A.M. Epiphyte recolonization of oaks along a gradient of air pollution in South-East England, 1979–1990 // Env. Pollut. 1990. V. 68. P. 81–99.
Seaward M.R.D., Letrouit-Galinou M.A. Lichen recolonization of trees in the Jardin du Luxembourg, Paris // Lichenologist. 1991. V. 23. № 2. P. 181–186.
Gilbert O.L. Lichen reinvasion with declining air pollution // Bryophytes and lichens in a changing environment / Eds. Bates J.W., Farmer A.M. Oxford: Clarendon Press, 1992. P. 159–177.
Loppi S., Ivanov D., Boccardi R. Biodiversity of epiphytic lichens and air pollution in the town of Siena (Central Italy) // Environ. Pollut. 2002. V. 116. P. 123–128.
Adamska E. Lichen recolonization in the city of Toruń // Ecological Questions. 2011. V. 15. P. 119–125.
Isocrono D., Matteucci E., Ferrarese A. et al. Lichen colonization in the city of Turin (N Italy) based on current and historical data // Environ. Pollut. 2007. V. 145. P. 258–265.
Beckett P.J. Lichens: sensitive indicators of improving air quality // Restoration and recovery of an industrial region / Ed. Gunn J.M. N.Y., 1995. P. 81–92.
Schram L.J., Wagner C., McMullin R. T., Anand M. Lichen communities along a pollution gradient 40 years after decommissioning of a Cu-Ni smelter // Environ. Sci. Pollut. Res. 2015. V. 22. № 12. P. 9323–9331.
Михайлова И.Н., Воробейчик Е.Л. Эпифитные лихеносинузии в условиях химического загрязнения: зависимости доза–эффект // Экология. 1995. № 6. С. 455–460. [Mikhailova I.N., Vorobeichik E.L. Epiphytic lichenosynusia under conditions of chemical pollution: dose–effect dependencies // Rus. J. Ecol. 1995. V. 26. № 6. P. 425–431.]
Михайлова И.Н. Эпифитные лихеносинузии лесов Среднего Урала в условиях аэротехногенного загрязнения: Автореф. дис. … канд. биол. наук. Екатеринбург, 1996. 24 с.
Scheidegger C., Mikhailova I. Umweltforschung – Flechten als Bioindikatoren für die Luftverschmutzung im Ural: Eindrücke von einem gemeinsamen Forschungsprojekt // Naturwerte in Ost und West. Forschen für eine nachhaltige Entwicklung vom Alpenbogen bis zum Ural / Ed. Landolt R. Birmensdorf: Eidgenossische Forschungsanstalt WSL, 2000. S. 55–59.
Михайлова И.Н. Начальные этапы восстановления сообществ эпифитных лишайников после снижения выбросов медеплавильного завода // Экология. 2017. № 4. С. 277–281. [Mikhailova I.N. Initial stages of recovery of epiphytic lichen communities after reduction of emissions from a copper smelter // Rus. J. Ecol. 2017. V. 48. № 4. P.277–281.]
Eversman S., Horton D. Recolonization of burned substrates by lichens and mosses in Yellowstone National Park // Northwest Sci. 2004. V. 78. P. 85–92.
Kutorga E., Adamonytė G., Iršėnaitė R. et al. Wild fire and post-fire management effects on early fungal succession in Pinus mugo plantations, located in Curonian Spit (Lithuania) // Geoderma. 2012. V. 191. P. 70–79.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobeichik E.L., Trubina M.R., Khantemirova E.V., Bergman I.E. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Rus. J. Ecol. 2014. V. 45. № 6. P. 498–507.]
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: Наука, 1994. 280 с.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. [Voro-beichik E.L., Kaigorodova S.Yu. Long-term dynamics of heavy metals in the upper horizons of soils in the region of a copper smelter impacts during the period of reduced emission // Eurasian Soil Science. 2017. V. 50. № 8. P. 977–990.]
Михайлова И.Н., Микрюков В.С., Фролов И.В. Состояние сообществ эпифитных лишайников в условиях антропогенных нагрузок: влияние методов учета обилия на информативность показателей // Экология. 2015. № 6. С. 427–433. [Mikhailova I.N., Mikryukov V.S., Frolov I.V. State of epiphytic lichen communities under anthropogenic impact: Effect of abundance assessment methods on the informativity of indices // Rus. J. Ecol. V. 46. № 6. P. 531–536.]
Gunn J., Keller W., Negusanti J. et al. Ecosystem recovery after emission reductions: Sudbury, Canada // Water, Air, Soil Pollut. 1995. V. 85. № 3. P. 1783–1788.
Черненькова Т.В., Кабиров Р.Р., Басова Е.В. Восстановительные сукцессии северотаежных ельников при снижении аэротехногенной нагрузки // Лесоведение. 2011. № 6. С. 49–66.
Ярмишко В.Т., Горшков В.В., Лянгузова И.В., Баккал И.Ю. Экологический мониторинг лесных экосистем Кольского полуострова в условиях аэротехногенного загрязнения // Региональная экология. 2011. Т. 31. № 1–2. С. 21–29.
Skye E. Lichens and air pollution // Acta Phytogeographica Suecica. 1968. V. 52. P. 1–138.
Brodo I. Substrate ecology // The Lichens / Ed. Ahmadjan V. N.Y.–London: Acad. Press, 1973. P. 401–441.
Marti J. Die Toxizität von Zink, Schwefel- und Stickstoffverbindungen auf Flechten Symbionten // Bibliotheca Lichenologica. 1985. V. 21. P. 1–129.
Hauck M., Zöller T. Copper sensitivity of soredia of the epiphytic lichen Hypogymnia physodes // The Lichenologist. 2003. V. 35. № 3. P. 271–274.
Михайлова И.Н., Булдаков М.С. Влияние условий произрастания лишайников на токситолерантность вегетативных диаспор и успешность их ювенильного развития // Особь и популяция – стратегия жизни: Мат-лы 9-го Всеросс. популяционного семинара. Ч. 1. Уфа: Изд. дом ООО “Вилли Окслер”, 2006. С. 385–390.
Шарунова И.П. Межвидовая и внутривидовая изменчивость накопления тяжелых металлов эпифитными лишайниками в градиенте токсической нагрузки: Автореф. дис. … канд. биол. наук. Екатеринбург, 2008. 24 с.
Selva S.B. Indicator species –restricted taxa approach in coniferous and hardwood forests of Northeastern America // Monitoring with Lichens – Monitoring Lichens / Eds. Nimis P.L., Scheidegger C., Wolseley P.A. Dordrecht–Boston–London: Kluwer Acad. Publishers, 2002. P. 349–352.
The Lichen Flora of Great Britain and Ireland / Eds. Purvis O.W., Coppins B.J., Hawksworth D.L. et al. Natural History Museum Publications & The British Lichen Society. London, 1992. 710 p.
Coppins B.J. A taxonomic study of the lichen genus Micarea in Europe // Bulletin of the British Museum of Natural History, Botany. 1983. V. 11. P. 17–214.
Mikhailova I. Populations of epiphytic lichens under stress conditions: survival strategies // Lichenologist. 2007. V. 39. № 1. V. P. 83–89.
Дополнительные материалы отсутствуют.