Экология, 2020, № 2, стр. 119-124
Репродуктивные характеристики обыкновенной слепушонки на северо-восточной периферии видового ареала
И. В. Задубровская a, b, П. А. Задубровский a, Е. А. Новиков a, c, *
a Институт систематики и экологии животных СО РАН
630091 Новосибирск, ул. Фрунзе, 11, Россия
b Новосибирский государственный педагогический университет
630126 Новосибирск, ул. Вилюйская, 28, Россия
c Новосибирский государственный аграрный университет
630039 Новосибирск, ул. Добролюбова, 160, Россия
* E-mail: eug_nov@ngs.ru
Поступила в редакцию 19.12.2018
После доработки 20.04.2019
Принята к публикации 20.05.2019
Аннотация
Обитание популяции на периферии видового ареала приводит к увеличению естественной смертности животных, что в свою очередь сказывается на характере популяционной динамики и репродуктивном потенциале особей. Однако закономерности изменчивости репродуктивных характеристик в экологических градиентах до сих пор не ясны. Анализ возраста вступления в размножение, сроков беременности и темпов постнатального развития у содержащихся в лаборатории репродуктивных пар обыкновенной слепушонки (Ellobius talpinus) показал, что в популяции, обитающей на северо-восточной периферии ареала вида (Новосибирская область), эти сроки отличны от популяции из оптимума ареала.
Современная эколого-эволюционная теория предполагает наличие компромиссных отношений в распределении ресурсов между размножением и соматическими функциями организма, выражающихся, в частности, в коррелятивной зависимости между продолжительностью различных этапов онтогенеза животных. Для разных таксонов позвоночных животных известно существование положительной корреляции между возрастом достижения половой зрелости и продолжительностью репродуктивно-активного периода на видовом уровне [1]. Для грызунов показано наличие коррелятивных связей между скоростью полового созревания, интенсивностью размножения и продолжительностью жизни, а также иммунореактивностью особей [2].
Помимо таксономической принадлежности, течение онтогенеза во многом определяется и особенностями среды обитания видов. В соответствии с положениями теории одноразовой сомы считается, что эволюционная тенденция к увеличению продолжительности жизни обусловлена риском гибели от случайных, не зависящих от возраста причин. Компромиссные отношения между соматическими и репродуктивными затратами выражаются в более высокой плодовитости короткоживущих видов [3]. Поэтому животные, обитающие в хорошо защищенной среде, например древесные и летающие виды, имеют в целом более высокую продолжительность жизни и меньшую плодовитость, чем родственные наземные виды, более подверженные риску хищничества [4]. Виды, обитающие в подземной среде, живут значительно дольше филогенетически близких наземных животных [5, 6]. Так, социальные подземные грызуны семейства землекоповых (Bathyergidae) обладают уникальной для животных такого размера продолжительностью жизни – свыше 30 лет у голого землекопа и более 20 лет у других социальных видов этого семейства [5]. Репродуктивное “разделение труда”, когда в размножении участвует лишь одна пара (или небольшая полиандрическая группа), и относительно быстрое (в возрасте нескольких месяцев) половое созревание позволяют социальным подземным грызунам сочетать аномально высокую продолжительность жизни с аномальной плодовитостью [7], несмотря на свойственную представителям Hystricognatha длительную беременность и лактацию.
Значительно меньше известно об особенностях размножения других социальных подземных грызунов. Исследования, выполненные на восточной (Ellobius tancrei), обыкновенной и закавказской (E. lutestens) слепушонках [8–13], показывают, что по сравнению с наземными видами подсемейства Arvicolinae слепушонки отличаются более поздним половым созреванием, относительно низкой плодовитостью, продолжительными беременностью и лактацией. Продолжительность жизни слепушонок как в неволе, так и в лаборатории может достигать 6 лет [14–16].
Литературные данные о размножении обыкновенной слепушонки получены преимущественно при изучении природных популяций [11, 17]. При этом для популяций из центра ареала (Южное Зауралье) и его периферии (юг Западной Сибири) выявлены значительные межпопуляционные различия по ряду популяционно-демографических показателей, в частности по продолжительности жизни особей и доле размножающихся самок [18]. Можно предполагать, что наблюдаемая в природе изменчивость демографических показателей затрагивает и такие аспекты репродуктивной биологии, как величина выводка, масса детенышей при рождении, возраст вступления в размножение, продолжительность периода репродуктивно-активной жизни и степень выраженности репродуктивной асимметрии. В связи с тем, что большая часть жизни слепушонок проходит под землей, эти процессы остаются скрытыми от глаз исследователя, и отследить их течение, а также провести необходимые измерения можно лишь в условиях непрерывного лабораторного мониторинга. В настоящей работе приводятся результаты многолетних наблюдений за размножением обыкновенной слепушонки в условиях лаборатории. Данные получены на животных, отловленных в популяции, обитающей в северной лесостепи правобережья Оби – на крайней северо-восточной периферии видового ареала.
МАТЕРИАЛ И МЕТОДЫ
Животных отлавливали в Искитимском районе Новосибирской области в долине р. Черная (54° с.ш., 83° в.д.) в октябре 2010 и 2012 гг. Для отловов использовали специализированные живоловушки конструкции Б.А. Голова [19], модифицированные Н.Г. Евдокимовым [14]. После обнаружения ходов со свежими выбросами земли в них устанавливали ловушки, которые проверяли каждые 5 мин. Всего было отловлено 153 зверька.
Слепушонок содержали в лаборатории ИСиЭЖ СО РАН в круглых клетках диаметром 60 см и высотой стенки 30 см, в качестве подстилки использовали древесные опилки, в качестве гнездового материала – вату. Зверькам регулярно предоставляли влажный корм (надземные и подземные части моркови, свеклы и одуванчиков) ad libitum и фабричные гранулированные корма, предназначенные для питания разводимых в лаборатории мелких животных (Chara © Assortiment AGRO LTD).
Из отловленных животных формировали группы, состоящие из 4–6 особей с равным соотношением полов. Регистрировали время от формирования группы до рождения первого выводка, количество новорожденных детенышей, их массу, длительность межродовых интервалов каждой самки как косвенный показатель продолжительности беременности, а также количество размножающихся самок в группах. Характер статистического распределения количества выводков, приносимых самками в течение жизни, позволил получить репрезентативные выборки для оценки средних значений только для 6 первых выводков. В случае, если размножение самок в группах прекращалось раньше гибели всех самцов, время, прошедшее от рождения последнего выводка до гибели самки, рассматривали как продолжительность менопаузы.
Родившихся в лаборатории зверьков после достижения ими возраста половой зрелости, т.е. в двухмесячном возрасте, отсаживали от родителей, а затем использовали в экспериментах по оценке запаховой привлекательности особей противоположного пола в зависимости от степени родства с реципиентом. При этом у самок, влагалищная щель которых открывается именно в возрасте двух месяцев, брали мазки для определения цитологической картины. У большинства видов грызунов, а также хищных зверей их содержимое хорошо отражает циклические изменения в организме самки [20].
Для оценки ольфакторных предпочтений применяли экспериментальную установку (ольфактометр), состоящую из трех отделений (13 × 13 × 13 см каждое), последовательно соединяющихся проходами 4 × 4 см. Образцы подстилки помещали в крайние отделения ольфактометра, а тестируемую особь – в среднее. В течение 10-минутного теста регистрировали время пребывания особи в каждом из отсеков, содержащих запаховые стимулы доноров запаха [21]. Время, проведенное в отсеке с запахом, выражали в виде натурального логарифма для приведения данных к нормальному распределению.
РЕЗУЛЬТАТЫ
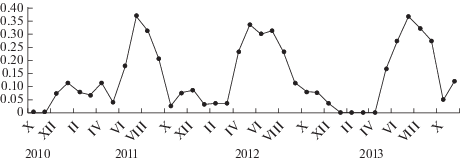
При размножении слепушонки в условиях лаборатории сохраняется его сезонный характер: большинство родов приходилось на летние месяцы, преимущественно июль и август. В год, когда животных привезли из естественных условий в лабораторные, отмечен небольшой пик рождаемости в зимние месяцы (рис. 1).
Рис. 1.
Отношение количества пометов к общему числу самок в зависимости от времени рождения детенышей.
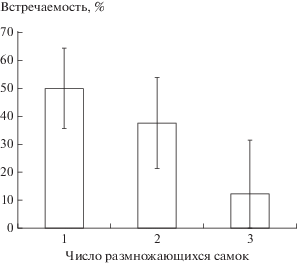
Из 24 репродуктивных групп в 12 (50%) размножалась лишь одна самка, в 9 (37.5%) группах – две, в 3 (12.5%) – три (рис. 2). В вагинальных мазках самок разного возраста, вне зависимости от репродуктивного опыта, как правило, наблюдали картину, характерную для фазы метаэструса. При этом размножаться самки начинали не ранее 4.5‑месячного возраста.
Рис. 2.
Доля репродуктивных групп, в которых размножались 1, 2 и 3 самки соответственно (% ± стандартная ошибка).
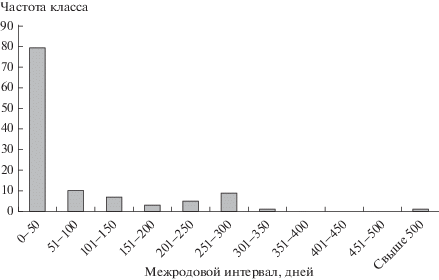
Длительность межродовых интервалов варьировала в широких пределах (рис. 3): наименьшее число дней между родами составляло 28 дней, а наиболее частое – 30. Среднее количество выводков, приносимых самкой за все время жизни, равнялось 4.0 ± 0.4 (n = 40). Максимальное количество выводков, принесенных одной самкой, достигало 12, общее количество рожденных ею детенышей – 39, максимальная продолжительность периода репродуктивной активности – 27 мес. Средний вес новорожденного детеныша – 4.2 ± 0.1 г (n = 14).
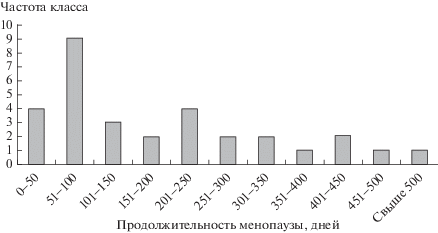
Однофакторный дисперсионный анализ показал, что порядковый номер выводка, приносимого самкой, не оказывал статистически значимого влияния на его размер (F5, 152 = 0.07; P > 0.05). Медианная продолжительность пост-репродуктивного периода составляла 146 ± 26 дней, максимальная – 544 дня (рис. 4).
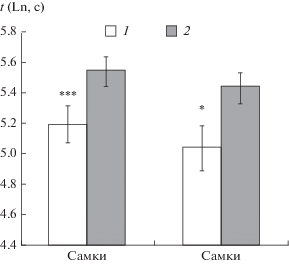
Предъявление животным альтернативных ольфакторных стимулов показало, что особи обоих полов значимо больше времени проводили в отсеках с запахом неродственной особи противоположного пола по сравнению с запахом братьев и сестер (t-test, P < 0.05 для самок и P < 0.01 для самцов) (рис. 5).
ОБСУЖДЕНИЕ
У особей обыкновенной слепушонки, отловленных в природе и разводимых в лаборатории, сохраняется сезонный характер размножения, однако его сроки смещены по сравнению с естественными условиями: пик рождаемости из года в год приходится на летние месяцы, в то время как в природе размножение начинается в марте и практически прекращается к июню [22]. Первые пометы у зверьков, отловленных в природе в октябре 2010 г., появились в декабре–январе, т.е. через 2–3 мес. после отлова. В природе первые выводки у слепушонки появляются не раньше конца февраля [14, 23]. Можно предполагать, что десинхронизация репродуктивных циклов при перемещении слепушонок в лабораторию связана как с повышением доступности корма, так и изменениями температурного режима.
В 50% репродуктивных групп, исходно состоявших из 2–3 самок, изначально размножалась только одна из них, а другие вступали в размножение после ее гибели. Как было отмечено ранее [16], невозможность вступления в размножение одной из самок не обязательно сопровождалось прямой конкуренцией между самками. Более того, часть самок не вступала в размножение и после гибели потенциальной конкурентки. Таким образом, при содержании в лаборатории у обыкновенной слепушонки сохраняется репродуктивная асимметрия. Однако, как и в природной популяции, из которой были отловлены особи [18], она не имеет такого жесткого характера, как в популяциях из центральной части ареала вида, где в каждой семье размножается только одна самка, а остальные вступают в размножение лишь после расселения или гибели “матки” [17, 22, 24].
Репродуктивная асимметрия характерна для большинства видов социальных подземных грызунов [25]. Неразмножающиеся зверьки участвуют в фуражировке, охраняют колонии и заботятся о детях родственных особей [26–28]. Репродуктивная асимметрия может достигаться различными способами. Жесткая внутрисемейная иерархия голых землекопов (Heterocephalus glaber) препятствует размножению субординатных особей, но не исключает возможности инбридинга. У пескороев (роды Criptomys и Fukomys) репродуктивная асимметрия достигается за счет “самоограничения” – избегания скрещивания с близкородственными особями [25]. Слепушонки, содержащиеся в неволе, также предпочитают скрещиваться с неродственными особями [10]. Нами показано, что в ольфакторных тестах слепушонки обоего пола значимо больше времени проводили в отсеках с запахом неродственных особей. Однако если возможности выбора неродственного партнера нет, то зверьки способны к инбредному скрещиванию, что мы несколько раз наблюдали в группах, состоящих из членов одной семьи (неопубликованные данные).
Таким образом, имеющиеся в нашем распоряжении данные позволяют предполагать, что механизм формирования репродуктивной асимметрии у слепушонки не соответствует моделям, предложенным для африканских землекоповых. Низкая агрессивность животных ставит под сомнение возможность контроля со стороны размножающейся самки, а отсутствие “инцест-табу” исключает возможность контроля по принципу самоограничения.
Клеточный состав вагинальных мазков не отличался у размножающихся и неразмножающихся самок и практически не менялся в течение онтогенеза. Отсутствие изменений цитологической картины вагинального мазка – достаточно редкое явление среди грызунов, однако его наблюдали и у самок родственного вида – восточной (E. tanscrei) слепушонки [12]. Вероятно, у представителей этого рода состав влагалищных мазков не может быть показателем стадии эстрального цикла.
Возраст вступления в размножение обыкновенной слепушонки в целом относительно большой для представителей подсемейства Arvicolinae. Так, например, молодые самки из весенних пометов узкочерепной полевки способны приступить к репродукции уже в мае–июне [29, 30]. В то же время для обыкновенной слепушонки отмеченный нами возраст полового созревания и начала размножения можно считать достаточно ранним. В природных популяциях центральной части видового ареала обыкновенные слепушонки начинают размножаться не ранее второго – третьего года жизни [17, 22, 24], однако в популяции северо-восточной периферии видового ареала, из которой были отловлены рассматриваемые животные, отмечались случаи размножения особей-сеголеток. Возможно, более ранние сроки созревания самок из исследованной нами популяции, обитающей на периферии видового ареала, – один из компенсаторных механизмов наряду со снижением продолжительности жизни и изменением состава семей, обеспечивающих поддержание стабильной численности популяции [18].
Е.П. Летицкая (1984) отмечает противоречивость данных о продолжительности беременности слепушонок, приводимых разными авторами, – от 20 дней до месяца. При содержании животных в неволе минимальный межродовой интервал, который можно рассматривать в качестве показателя продолжительности беременности, у восточной слепушонки (E. tancrei) был равен 32 дням [12], у горной слепушонки (E. lutescens) – 28 [13]. У обыкновенной слепушонки, судя по нашим данным, беременность длится около 30 дней. Эти же сроки указывает и Н.Г. Евдокимов [31]. Таким образом, продолжительность беременности у слепушонок оказывается значительно больше, чем у наземных полевочьих, что является, очевидно, одной из адаптаций к подземному образу жизни. Незначительно варьируя у разных видов рода, она оказывается достаточно стабильной на внутривидовом уровне.
Наши наблюдения показывают, что у обыкновенной слепушонки, в отличие от наземных грызунов [32], количество детенышей в помете значимо не меняется с возрастом. Можно предполагать, что при наличии репродуктивной асимметрии и малой величине помета размножение не требует от слепушонок таких значительных затрат, как у наземных видов. Возможно, этим же объясняется и более продолжительная, чем у наземных видов, менопауза.
Сравнение данных, полученных при изучении лабораторных популяций слепушонок и наземных видов полевочьих, показывает, что подземные виды имеют растянутые по времени сроки размножения, беременности, лактации и препубертатной стадии онтогенеза. Поскольку данная тенденция проявляется и у представителей семейства землекоповых, относящихся к другой филетической линии грызунов (Hystricomorpha), можно предполагать, что она связана с подземным образом жизни, спецификой которого является низкая смертность животных от не связанных с возрастом причин [4, 5]. Репродуктивная асимметрия, низкая плодовитость и замедленные темпы развития у социальных подземных грызунов снижают текущие затраты ресурсов на размножение, но благодаря высокой продолжительности жизни позволяют достигать им более высокого, чем у наземных видов, общего репродуктивного выхода.
Вместе с тем сроки полового созревания, возраст вступления в размножение, сроки его начала и окончания у обыкновенной слепушонки достаточно лабильны и могут меняться в зависимости от положения популяции в ареале. Лабильность физиологических показателей является, очевидно, одним из факторов, позволяющих виду занимать обширный ареал и приспосабливаться к различным климатическим условиям – от северной лесостепи до полупустынь.
Работа выполнена при финансовой поддержке Федеральной программы фундаментальных научных исследований на 2013–2020 гг. (VI.51.1.6) и РФФИ (гранты № 13-04-01045, 19-04-00929).
Авторы выражают признательность за помощь в проведении данного исследования Т.В. Титовой.
Список литературы
De Magalhaes J.P., Costa J., Church, G.M. An analysis of the relationship between metabolism, developmental schedules, and longevity using phylogenetic independent contrasts // J. Gerontol. A Biol. Sci. Med. Sci. 2007. V. 62. P. 149–160.
Роговин К.А., Мошкин М.П. Авторегуляция численности в популяциях млекопитающих и стресс (штрихи к давно написанной картине) // Журн. общ. биол. 2007. Т. 68. № 4. С. 244–267.
Kirkwood T.B.L. Evolution of ageing // Nature. 1977. V. 270. P. 301–304.
Gorbunova V., Bozzella M.J., Seluanov A. Rodents for comparative aging studies: from mice to beavers // Age (Dordr). 2008. V. 30. P. 111–119.
Dammann P., Burda H. Senescence patterns in African mole-rats (Bathyergidae, Rodentia) // Subterranean rodents: news from underground. Begall S., Burda H., Schleich C.E. Eds. Berlin: Springer, 2007. P. 49–60.
Novikov E.A., Burda H. Ecological and evolutionary preconditions of extended longevity in subterranean rodents // Biol. Bull. Rev. 2013. V. 3. P. 325–333.
Buffenstein R. The naked mole-rat: a new long-living model for human aging research // J. Gerontol. A Biol. Sci. Med. Sci. 2005. V. 60. P. 1369–1377.
Летицкая Е.П. Материалы по размножению и постнатальному развитию обыкновенной слепушонки Ellobius talpinus (Rodentia, Cricetidae) // Зоол. журн. 1984. Т. 63. № 7. С. 1084–1089.
Якименко Л.B., Ляпунова E.A. Цитогенетическое подтверждение принадлежности обыкновенных слепушонок из Туркмении к виду Ellobius talpinus S. Str. // Зоол. журн. 1986. Т. 65. Вып. 6. С. 946–949.
Чепраков М.И., Евдокимов Н.Г., Глотов Н.В. Наследование окраски меха у обыкновенной слепушонки (Ellobius talpinus Pall.) // Генетика. 2005. Т. 41. № 11. С. 1552–1558.
Шевлюк Н.Н., Елина Е.Е. Биология размножения обыкновенной слепушонки Ellobius talpinus. Оренбург: Изд-во ОГПУ, 2008. 128 с.
Smorkatcheva A. Make haste slowly: the reproductive features of the Zaisan mole-vole, Ellobius tancrei // 14th Rodens et Spatium International Conference on Rodent Biology. Lisbon, 2014. P. 18.
Kaya A., Coskun Y. Reproduction, postnatal development and social beahavior of Ellobius lutescens Thomas, 1897 (Mammalia: Rodentia) in captivity // Turk. J. Zool. 2015. V. 39. P. 425–431.
Евдокимов Н.Г. Популяционная экология обыкновенной слепушонки. Екатеринбург: Изд-во “Екатеринбург”, 2001. 144 с.
Anisimov V.N., Egorov M.V., Krasilshchikova M.S. et al. Effects of the mitochondria-targeted antioxidant SkQ1 on lifespan of rodents // Aging (Albany NY). 2011. V. 3. P. 1110–1119.
Novikov E., Kondratyuk E., Petrovski D. et al. Reproduction, aging and mortality rate in social subterranean mole voles (Ellobius talpinus Pall.) // Biogerontology. 2015. V. 16(6). P. 723–32.
Евдокимов Н.Г., Позмогова В.П. Структура популяций обыкновенной слепушонки (Ellobius talpinus Pall.) в Зауралье // Экология. 1993. № 5. С. 53–60.
Новиков Е.А., Петровский Д.В., Мошкин М.П. Особенности популяционной структуры обыкновенной слепушонки на северо-восточной периферии видового ареала // Сибирский экологич. журн. 2007. Т. 14. № 4. С. 669–676.
Голов Б.А. Ловушка-живоловка на слепушонку // Бюл. МОИП. Отд. Биол. 1954. Т. 59. Вып. 5. С. 95–96.
Тупикова Н.В. Изучение размножения и возрастного состава популяций мелких млекопитающих // Методы изучения природных очагов болезней человека. М.: Медиздат, 1964. С. 154 –191.
Евсиков В.И., Потапов М.А., Потапова О.Ф. Эффекты отбора по запаховым предпочтениям в инбредной линии мышей // Докл. РАН. 2001. Т. 380. № 6. С. 844–846.
Елина Е.Е. Эколого-морфологическая характеристика размножения обыкновенной слепушонки Ellobius talpinus в степной зоне Южного Урала: Дис. ... канд. биол. наук. Оренбург, 2006. 174 с.
Novikov E., Petrovski D. Seasonal phenomena in the biology of mole voles // Rodents et Spatium: 11-th International conference on rodent biology. Myshkin, 2008. Abstracts. P. 122.
Евдокимов Н.Г. Динамика популяционной структуры обыкновенной слепушонки (Ellobius talpinus Pall.) // Экология. 1997. № 2. С. 108–114.
Jarvis J.U.M., Bennett N.C. Eusociality has evolved independently in two genera of bathyergid mole-rats – but occurs in other subterranean mammal // Behavioral Ecology and Sociobiology. 1993. V. 33. Is. 4. P. 253–260.
Lacey E.A., Sherman P.W. Social organization of naked mole-rat colonies: evidence for a division of labor // N.Y.: Princeton University Press, 1991. P. 384–425.
Hayes L.D., Solomon N.G. Costs and benefits of communal rearing for female prairie voles (Microtus ochrogaster) // Behav. Ecol. Sociobiol. 2004. V 56. P. 585–593.
Silk J.B. The adaptive value of sociality in mammalian groups. Philosophical Transactions of the Royal Society // Philosophical Transactions of the Royal Society. 2007. B 362. P. 539–559.
Флинт В.Е., Чугунов Ю.Д., Смирин В.М. Млекопитающие СССР. М.: Мысль, 1965. 438 с.
Громов И.М., Поляков И.Я. Фауна СССР. Млекопитающие. Полевки. Т. III. Вып. 8. Л.: Наука, 1977. 504 с.
Евдокимов Н.Г. Обыкновенная слепушонка – зимоспящий грызун? // Экология. 2002. № 1. С. 36–41.
Novikov E., Zadubrovskaya I., Zadubrovskiy P., Titova T. Reproduction, ageing, and longevity in two species of laboratory rodents with different life histories // Biogerontology. 2017. V. 18(5). P. 803–809.
Дополнительные материалы отсутствуют.