Экология, 2020, № 3, стр. 230-235
Пищевая дифференциация молоди кумжи Salmo trutta L. как механизм расширения кормовой базы популяции
И. А. Барышев a, *, А. Е. Веселов a, Д. А. Ефремов a, М. А. Ручьев a
a Институт биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: baryshev@bio.krc.karelia.ru
Поступила в редакцию 19.09.2019
После доработки 14.10.2019
Принята к публикации 13.11.2019
Аннотация
Проанализированы особенности питания кумжи (возраст 2+ и 3+ лет) в малой реке Орзега (бассейн Онежского озера) при осеннем снижении количества доступных пищевых объектов. Наряду с установленными ранее механизмами компенсации этого явления (питание непосредственно с грунта, потребление крупных объектов) в октябре выявлено резкое увеличение изменчивости индивидуальных особенностей питания кумжи как по составу содержимого желудков, так и по количеству потребленного корма. Пищевая дифференциация особей позволяет расширить кормовую базу популяции кумжи в реке и эффективно использовать кормовые ресурсы малого водотока, что особенно важно в периоды снижения их доступности.
Кумжа Salmo trutta L. – ценный вид лососевых рыб, распространенный на достаточно обширной территории: Европа, Малая Азия, Африка [1, 2]. Во многих частях ареала кумжа находится на грани исчезновении и включена в списки охраняемых видов, в частности в “Красную книгу России”. При исследованиях питания молоди лососевых рыб рода Salmo основное внимание исследователи уделяли атлантическому лососю [3–8]. Данных по питанию кумжи значительно меньше. Известно, что этот вид экологически пластичен, способен заселять малые и сверхмалые водотоки [9–11]. Установлено, что основу его пищи в реке составляют беспозвоночные организмы – как бентосные, так и случайно попавшие в воду наземные, преимущественно выедаемые из дрифта [4, 12–17 и др.].
Ранее было показано [18, 19], что кумжа в реке продолжает активно питаться осенью при снижении температуры воды. Вместе с тем для рек многих регионов, в том числе и Фенноскандии, выявлено резкое уменьшение количества беспозвоночных в дрифте в осенний период, что значительно сокращает доступную для кумжи кормовую базу [20–22]. В литературе имеются сведения [18, 19, 23] о том, что основными механизмами компенсации снижения количества доступного корма осенью можно считать переход на выедание беспозвоночных непосредственно со дна и предпочтение крупных организмов. Однако роль каждого из этих механизмов недостаточно изучена, что обусловливает цель настоящей работы – выявить особенности питания молоди кумжи в осенний период, которые позволяют ей продолжать активно питаться при сокращении числа доступных кормовых объектов в составе дрифта.
МАТЕРИАЛ И МЕТОДЫ
Работу проводили на малой реке Орзега (бассейн Онежского озера) в среднем течении (61°38.18′ с.ш., 34°30.66′ в.д.). Длина реки составляет 11 км, ширина русла 3–5 м. В 2015 г. проанализировано питание 55 особей кумжи. Рыб отлавливали при помощи электролова в дневное время летом 29.06.2016 (27 особей в возрасте 2+ лет и 3 особи в возрасте 3+ лет) и осенью 14.10.2016 (15 особей в возрасте 2+ лет и 10 особей в возрасте 3+ лет). Прижизненный размер рыб – длина AB (от кончика рыла до конца лучей хвостового плавника) и масса составили в среднем: в июне – 12.0 ± 0.15 см и 16.8 ± 0.54 г для особей в возрасте 2+ и 13.4 ± ± 0.21 см и 24.1 ± 0.55 г для 3+; в октябре –12.8 ± ± 0.19 см и 21.3 ± 1.03 см для особей в возрасте 2+ и 14.0 ± 0.54 см и 28.2 ± 3.58 г для особей в возрасте 3+. Состав и обилие кормовых объектов в желудках определяли в лаборатории. Индекс наполнения желудка (‱) рассчитывали как отношение массы пищи (мг) к массе рыбы (г), умноженное на 10 000 [3]. Для расчета индекса использовали массу фиксированной рыбы и массу фиксированного пищевого комка. Для характеристики кормовой базы на участках обитания молоди кумжи было собрано и обработано 7 количественных проб макрозообентоса в сроки, совпадающие с выловом молоди кумжи (3 – 27.06.2015; 4 – 19.10.2015). Использовали бентосную рамку площадью 0.04 м2 [24]. Отобранный материал фиксировали этиловым спиртом. Дневная температура воды в период исследований составила 13–14°С в июне и 8–9°С в октябре.
Анализ соответствия с удаленным трендом (DCA) и расчет критерия Манна-Уитни проводили при помощи программы PAST v. 3.18 [25]. Многооткликовую пермутационную процедуру (MRPP) выполняли в программе PC-ORD 6.19: при экологических исследованиях значение A < 0.1 считается указывающим на сходство объектов, а 0.3 и более – на значительную разницу [26]. Расчет коэффициентов корреляции производили по методу Пирсона. После знака “±” приведена стандартная ошибка (ошибка средней). Сходство состава макрозообентоса и спектра питания оценено на основе коэффициента Чекановского с учетом обилия, рассчитанного по формуле [27]
РЕЗУЛЬТАТЫ
В составе макрозообентоса выявлено 20 таксонов беспозвоночных, 17 из которых относятся к амфибиотическим насекомым. За период с июня по октябрь произошло замещение доминирующих таксонов в макрозообентосе и увеличение биомассы (табл. 1).
Таблица 1.
Основные характеристики макрозообентоса и питания молоди кумжи 2+ и 3+ в р. Орзега (2015 г.)
| Характеристика | Июнь | Октябрь |
|---|---|---|
| Численность макрозообентоса, экз/м2 | 2.0 (1.72–2.22)* | 1.5 (0.52–2.57) |
| Биомасса макрозообентоса, г/м2 | 2.8 (2.21–3.36) | 6.4 (0.40–20.43) |
| Доминанты в макрозообентосе, %: | ||
| по численности | Cnetha sp. (40.0), Baetis sp. (30.4), Oligochaeta spp. (12.9) | Leuctra sp. (50.3), Cnetha sp. (17.1), Nemoura sp. (9.4) |
| по биомассе | Baetis sp. (28.0), Rhyacophila nubila (27.6), Cnetha sp. (18.9), Oligochaeta spp. (13.4) | Prionocera sp. (55.7), Leuctra sp. (13.3), Taeniopteryx nebulosa (9.6), Rh. nubila (8.8) |
| Индекс наполнения желудков кумжи, ‱ | 261 ± 15 | 175 ± 34 |
| Преобладающие в желудках организмы, %: | ||
| по численности | Simuliidae (44.3, Cnetha sp.), Ephemeroptera (28.6, Baetis sp.), наземные беспозвоночные (12.3) | Plecoptera (54.2, Leuctra sp., T. nebulosa), Trichoptera (35.4, Rh. nubila) |
| по биомассе | Simuliidae (30.4, Cnetha sp.), Ephemeroptera (21.8, Baetis sp.), наземные беспозвоночные (31.1), Trichoptera (11.6, Rh. nubila) | Plecoptera (36.8, T. nebulosa, Leuctra sp.), Amphibia (31.6, Rana temporaria), Trichoptera (22.3, Rh. nubila, Silo pallipes, Halesus sp.) |
В ходе исследования отмечено достаточно активное питание кумжи. Различия в характеристиках питания рыб (количество и масса пищевых объектов разных таксонов в желудках) в возрасте 2+ и 3+ лет оказались незначительны (MRPP, A = 0.029, p = 0.004), что позволило нам рассматривать эти возрастные группы вместе. За период с июня по октябрь произошло снижение индексов наполнения желудков и сокращение числа ведущих кормовых объектов у молоди кумжи (см. табл. 1). Несмотря на некоторое снижение индекса наполнения желудка осенью, выявленное значение (175‱) указывает на достаточно активное питание. Сравнение содержимого желудков летом и осенью (по численности и биомассе кормовых объектов разных таксонов) показало существенное и статистически значимое отличие (MRPP, А = 0.291, p < 0.001). В составе пищевого комка осенью возросла доля личинок ручейников (Trichoptera), веснянок (Plecoptera) и мелких позвоночных животных – лягушек и рыб. Также осенью возрастает роль организмов макрозообентоса в питании, поскольку в это время сокращается число попадающих в реку наземных членистоногих. Так, доля кормовых объектов, не относящихся к макрозообентосу, снизилась с 12 ± 2.6% в июне до 7 ± 2.2% в октябре по численности и с 32 ± 3.9 до 7 ± 2.6% по биомассе соответственно.
Сопоставление содержимого желудков и макрозообентоса (средние значения по рыбам и пробам бентоса для исследуемых периодов) по составу (8 таксономических групп без учета наземных насекомых и позвоночных) показало, что в питании молоди кумжи преобладают доминирующие в донных сообществах организмы как летом, так и осенью (табл. 2).
Таблица 2.
Сравнение содержимого желудков кумжи с составом макрозообентоса
| Содержимое желудков кумжи | Состав макрозообентоса | ||||
|---|---|---|---|---|---|
| июнь | октябрь | ||||
| численность | биомасса | численность | биомасса | ||
| Июнь | Индекс Чекановского | 0.78 | 0.54 | 0.27 | 0.13 |
| Корреляция по Пирсону | 0.95 | 0.70 | –0.10 | –0.40 | |
| p, значимость корреляции | <0.001 | 0.051 | 0.812 | 0.320 | |
| Октябрь | Индекс Чекановского | 0.09 | 0.25 | 0.63 | 0.43 |
| Корреляция по Пирсону | –0.41 | –0.08 | 0.80 | 0.32 | |
| p, значимость корреляции | 0.310 | 0.839 | 0.019 | 0.434 | |
Анализ размерно-массовых характеристик жертв в питании показал, что осенью кумжа чаще потребляет в пищу животных крупного размера. Так, в течение сезона многократно возросла средняя масса одного кормового объекта в желудке – с 1.7 до 29.0 мг (различия выборок статистически значимы, критерий Манна-Уитни, U = 2, p < 0.001), хотя средние размеры беспозвоночных в бентосе увеличились не так существенно (с 1.4 до 5.0 мг).
Сравнение состава питания и индексов наполненности желудков отдельных особей кумжи выявило их высокую индивидуальную изменчивость осенью. Так, по результатам анализа соответствия с удаленным трендом (DCA) обнаружены две значащие оси (см. рис. 1). Первая ось (нагрузка 27%) отражает сезонные изменения условий обитания рыб в реке (r = 0.92), и в первую очередь, вероятно, состав и обилие кормовых объектов. Вторая ось (нагрузка 7%) коррелирует с индексом наполнения желудка (r = 0.46).
Рис. 1.
Ординационная диаграмма данных по питанию молоди кумжи (1 – июнь, 2 – октябрь) в осях с наибольшей факторной нагрузкой.
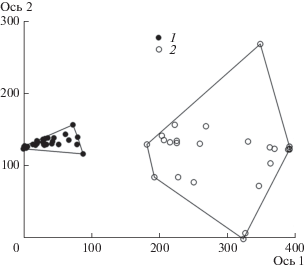
На ординационной диаграмме пробы питания рыб, отобранные в июне и октябре, сформировали неперекрывающиеся поля, что указывает на значительные отличия в содержимом желудков. Пробы, отобранные в июне, расположились плотной группой, из чего можно сделать вывод, что индивидуальные различия в питании были малы. Напротив, пробы осеннего питания образуют широкое поле, что отражает неоднородность материала и значительные различия в составе и количестве пищевых объектов. Вместе с тем содержимое каждого конкретного желудка осенью стало более однородным – индекс Шеннона по биомассе изменился с 1.3 ± 0.04 в июне до 0.5 ± 0.09 в октябре. Это свидетельствует о том, что в октябре каждая особь питалась однообразно, несмотря на значительные различия в составе пищи и индексах наполнения желудков между рыбами в популяции.
ОБСУЖДЕНИЕ
Ранее неоднократно сообщалось [8, 28, 29], что скорость роста молоди кумжи во многом зависит от условий в реке. Сравнение размерно-массовых характеристик кумжи р. Орзега с таковыми в других водотоках бассейна Онежского озера (Большая Уя, Шокша, Деревянка и др.) показало, что размер молоди значительно отстает от средних по региону значений – на 10% по длине и 30% по массе [8, 15, 30]. Исходя из относительно низких темпов роста можно предположить, что в р. Орзега условия обитания и питания молоди кумжи менее благоприятны, чем в соседних водотоках. Значения индекса наполнения желудка кумжи указывают на активное питание рыб, однако не превышают установленных ранее. Так, в 2006 г. в этой реке значения составляли 15–193‱ в июне и 12–200‱ в конце августа [31], а в р. Шипот (Закарпатский регион, Украина) этот индекс достигал 337‱ [23].
Выявленные нами характеристики макрозообентоса – таксономический состав, численность и биомасса (см. табл. 1), вполне соответствуют установленным ранее для пороговых участков рек бассейна Онежского озера [21, 32]. Для оценки обилия корма может быть применена градация Ю.А. Шустова [3]. Значения обилия макрозообентоса более 1 тыс. экз/м2 и 2 г/м2 и менее 10 тыс. экз/м2 и 10 г/м2 указывают на средний уровень кормности р. Орзега как летом, так и осенью. В литературе есть указания на значительно более благоприятные кормовые условия для молоди лососевых рыб: так, в р. Шипот в Закарпатье уровень развития зообентоса гораздо выше – от 972 до 2576 экз/м2 при биомассе от 6.3 до 121.8 г/м2 [23], а в р. Кедровая (Дальний Восток) выявлена биомасса зообентоса 34.3 ± 6.2 г/м2, что существенно выше, чем в р. Орзега [33]. В реках Камчатки установлена биомасса зообентоса в пределах 15–25 г/м2 в зависимости от биотопа [22].
Ранее многократно отмечалось [3, 16, 17 и др.], что основу пищи молоди рыб рода Salmo в реках составляют организмы зообентоса (преимущественно личинки амфибиотических насекомых) и наземные беспозвоночные, упавшие в реку. Таким образом, выявленный нами состав кормовых объектов кумжи в целом обычен для этого вида.
Нами установлены значительные изменения состава и обилия макрозообентоса в течение летне-осеннего периода, что в целом соответствует общей динамике структуры сообществ донных беспозвоночных в реках бассейна Онежского озера [21]. Сезонными изменениями состава макрозообентоса в значительной степени могут быть объяснены наблюдаемые отличия в питании молоди кумжи в октябре по сравнению с июнем (см. табл. 1). В частности, увеличение доли Trichoptera и Plecoptera, а также снижение доли Ephemeroptera и Simuliidae произошли как в составе зообентоса, так и в питании рыб. Ранее высокое соответствие содержимого желудков кумжи и состава беспозвоночных организмов в дрифте и бентосе отмечали во Франции [19] и Закарпатье [23]. Наши данные, таким образом, подтверждают полученные ранее выводы о высокой способности кумжи приспосабливаться к изменению состава кормовых объектов.
Вместе с тем пища молоди кумжи не полностью соответствует составу макрозообентоса. Поскольку эта рыба в первую очередь потребляет кормовые объекты, массово вовлекаемые в дрифт (Ephemeroptera, Plecoptera, Trichoptera, Simuliidae), то именно они и формируют наполнение желудка. Напротив, личинки Prinocera sp., имеющие в осенний период большую биомассу, но обитающие в толще грунта и недоступные для рыб, не выявлены нами в питании молоди кумжи.
Возрастание биомассы макрозообентоса в октябре по сравнению с июнем (см. табл. 1), очевидно, способствует сохранению кумжей пищевой активности осенью. Однако необходимо отметить, что в сезонной динамике дрифта беспозвоночных наблюдается существенное снижение обилия в осенний период как в реках Фенноскандии, так и других регионов [20–22, 34]. В совокупности со снижением количества попадающих в реку наземных насекомых это может обусловливать низкую доступность кормовых объектов для кумжи. Снижение индексов наполнения желудков (см. табл. 1) в октябре подтверждает это предположение.
В реке Орзега нами прослежены уже известные механизмы расширения кормовой базы молоди кумжи осенью. Так, известно, что мелкие организмы (личинки поденок и хирономид) молодь кумжи потребляет в меньшей степени, чем крупные [18, 35]. Установлено, что тенденция к выбору крупных объектов многократно усиливается в осенний период. Ранее переход на питание крупными объектами в осенний период отмечали для молоди атлантического лосося [36, 37]. Близкие результаты, указывающие на достаточно «гибкий» состав питания молоди лососевых рыб в реках и эффективное использование разных источников пищи в течение года, были получены на примере дальневосточных лососевых родов Oncorhynchus, Salvelinus и Parasalmo [38, 39].
Кроме того, в р. Орзега нами выявлена пищевая дифференциация кумжи, вероятно, также являющаяся механизмом, позволяющим популяции эффективно использовать кормовые ресурсы малого водотока. Проведенный анализ позволил установить значительный “разброс” индивидуальных показателей питания молоди кумжи осенью. Так, в этот период индекс наполнения, количество пищевых объектов и средняя масса одного объекта в желудке варьировали в широких пределах по сравнению с июнем. В октябре часть рыб снизила активность питания, в то время как другая часть продолжила интенсивно кормиться. Выявлены также существенные отличия состава пищевого комка между особями. Ранее было показано, что при ухудшении кормовых условий особи одного вида могут переходить на питание разными кормами, хотя при достатке еды питались одинаково, что может вести к расширению кормовой базы популяции [40]. Выявленная нами пищевая дифференциация в осенний период может являться одним из механизмов, позволяющим молоди кумжи расширять кормовую базу популяции при снижении доступности пищевых объектов и способствовать обитанию этого вида в малых водотоках.
Таким образом, полученные нами результаты подтвердили, что в осенний период при снижении количества доступных кормовых объектов молодь кумжи продолжает активно питаться. Наряду с переходом на питание непосредственно с грунта и возрастанием доли крупных жертв, что было показано и ранее, выявлена значительная роль пищевой дифференциации особей, вероятно, позволяющая существенно расширить кормовую базу популяции и эффективно использовать кормовые ресурсы малого водотока.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственного задания КарНЦ РАН (0218-2019-0081). Авторы выражают признательность С.Р. Знаменскому (ИБ КарНЦ РАН) за консультации по частным вопросам статистического анализа.
Список литературы
Атлас пресноводных рыб России: В 2 т. Т. 1. Под ред. Решетникова Ю.С. М.: Наука, 2002. 379 с.
Jonsson B., Jonsson N. Ecology of Atlantic salmon and Brown trout. Habitat as a template for life histories. Dordrecht: Springer, 2011. 708 p.
Шустов Ю.А. Экология молоди атлантического лосося. Петрозаводск: “Карелия”, 1983. 152 с.
Шустов Ю.А. Экологические аспекты поведения молоди лососевых рыб в речных условиях. СПб.: Наука, 1995. 161 с.
Щуров И.Л., Смирнов Ю.А., Шустов Ю.А. Особенности адаптации заводской молоди семги Salmo salar L. к речным условиям. II. Поведение и питание тренированной заводской молоди семги в реке // Вопросы ихтиологии. 1986. Т. 26. Вып. 5. С. 871–874.
Orlov A.V., Gerasimov Y.V., Lapshin O.M. The feeding behavior of cultured and wild Atlantic salmon, Salmo salar L., in the Louvenga River, Kola Peninsula, Russia // ICES Journal of Marine Science. 2006. V. 63. P. 1297–1303.
Зубченко А.В., Калюжин С.М., Алексеев М.Ю. и др. Особенности воспроизводства атлантического лосося (Salmo salar L.) в реке Умба (Кольский полуостров). Петрозаводск: “Скандинавия”, 2007. 163 с.
Shustov Y.A., Baryshev I.A., Belyakova E.N. Specific features of the feeding of juvenile Atlantic salmon (Salmo salar L.) in the subarctic Varzuga River and its small tributaries (Kola Peninsula) // Inland Water Biology. 2012. V. 5. Is. 3. P. 288–292. https://doi.org/10.1134/S1995082912030121
Кузищин К.В., Новиков Г.Г. Морфоэкологическая дифференциация молоди семги Salmo salar и кумжи S. trutta в небольших потоках (Северная Карелия) // Вопросы ихтиологии. 1994. Т. 34. № 4. С. 479–485.
Махров А.А. Кумжа Salmo trutta L. бассейнов Белого и Баренцева морей // Адаптация и эволюция живого населения полярных морей в условиях океанического перигляциала. Апатиты: Изд-во КНЦ РАН, 1999. С. 110–120.
Веселов Е.А., Калюжин С.М. Экология, поведение и распределение молоди атлантического лосося. Петрозаводск: “Карелия”, 2001. 160 с.
Парфенчик А.Н. Питание форели в реках КБ АССР // Уч. зап. КБ АССР. Серия с.-х. и биол. Нальчик, 1964. Вып. 21. С. 125–131.
Elliot J.M. The food of trout (Salmo trutta L.) in a Darmoor stream // J. Appl. Ecol. 1967. V. 4. P. 59–71.
Frost W.E., Brown M.E. The trout. The natural history of the brown trout in the British Isles. Collins. The Fontana New Naturalist, 1970. 316 p.
Шустов Ю.А., Веселов Е.А. Питание и рост молоди озерной кумжи Salmo trutta L. morpha lacustris в водоемах национального парка “Паанаярви” // Труды Карельского НЦ РАН. 2007. Вып. 11. С. 142–146.
Задорина В.М. Значение взрослых насекомых в питании молоди лососевых рыб // Вопросы ихтиологии. 1988. Т. 28. Вып. 2. С. 259–265.
Dahl J., Greenberg L.A. Effects of fish predation and habitat type on stream benthic communities // Hydrobiologia. 1998. V. 361. P. 67–76.
Shustov Yu.A., Veselov A.E., Baryshev I.A. The diet of juvenile lake trout Salmo trutta L. in rivers of the Onega basin in autumn // Rus. J. of Ecology. 2008. V. 39. Is. 2. P. 119–122.
Lagarrigue T., Céréghinob R., Limc P. et al. Diel and seasonal variations in brown trout (Salmo trutta) feeding patterns and relationship with invertebrate drift under natural and hydropeaking conditions in a mountain stream // Aquatic Living Resources. 2002. V. 15. Is. 2. P. 129–137.
Шубина В.Н. Бентос лососевых рек Урала и Тимана. СПб.: Наука, 2006. 401 с.
Baryshev I.A., Veselov A.E. Seasonal dynamics of benthos and drift invertebrates in some tributaries of Lake Onega // Biol. Inland Waters. 2007. № 1. P. 74–80.
Чебанова В.В. Бентос лососевых рек Камчатки. М.: Изд-во ВНИРО, 2009. 172 с.
Кружилина С.В., Диденко А.В., Великопольский И.И. Кормовая база и особенности питания ручьевой и радужной форелей и хариуса на разных биотопах реки Шипот Закарпатского региона // Ribogospod. nauka Ukr. 2016. V. 4(38). P. 76–94. https://doi.org/10.15407/fsu2016.04.076
Методические рекомендации по изучению гидробиологического режима малых рек. Петрозаводск: Ин-т биол. КНЦ АН СССР, 1989. 42 с.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4(1). 9 p.
McCune B., Mefford M.J. PC-ORD. Multivariate analysis of ecological data. Version 6.22. MjM Software, Gleneden Beach, Oregon, U.S.A, 2011.
Czekanowski J. Zur differential Diagnose der Neandertalgruppe // Korrespbl. Dtsch. Ges. Anthropol. 1909. Bd 40. S. 44–47.
Дирин Д.К. К изучению экологии и размерно-возрастной изменчивости озерной кумжи в Карелии // Исследования популяционной биологии и экологии лососевых рыб водоемов Севера. Л.: ЗИН АН СССР, 1985. С. 61–93.
Махров А.А. Кумжа (Salmo trutta L.) на северо-восточном краю ареала // Принципы экологии. 2013. № 1(5). С. 5–20.
Барская Ю.Ю., Иешко Е.П., Каукоранта М., Шус-тов Ю.А. Особенности биологии и паразитофауны молоди лососевых рыб рода Salmo системы реки Торнио (бассейн Балтийского моря) // Вопросы ихтиологии. 2009. Т. 49. № 4. С. 488–494.
Шустов Ю.А., Белякова Е.Н., Веселов А.Е. Сезонные особенности питания рыб в кумжевой реке Большая Уя (бас. Онежского озера) // Принципы экологии. 2013. № 4. С. 57–69. https://doi.org/10.15393/j1.art.2013.3123
Baryshev I.A. Taxonomic composition and trophic structure of benthic fauna in rocky rapids and riffles in rivers of the Republic of Karelia and Murmansk Oblast // Inland Water Biology. 2017. V. 10. № 4. P. 405–414. https://doi.org/10.1134/S1995082917040034
Кочарина С.Л., Макарченко Е.А., Макарченко М.А. и др. Донные беспозвоночные в экосистеме малой реки юга Дальнего Востока СССР // Фауна, систематика и биология пресноводных беспозвоночных. Владивосток: ДВО АН СССР, 1988. С. 86–108.
Чебанова В.В. Динамика дрифта беспозвоночных в лососевых реках разного типа (юго-восток Камчатки) // Гидробиол. журн. 1992. Т. 28. № 4. С. 31–39.
Allan J.D. Diet of brook trout (Salvelinus fontinalis Mitchill) and brown trout (Salmo trutta L.) in an alpine stream // Verh. Intern. Vereinig. theor. und angew. Limnol. 1978. V. 20. № 3. P. 2045–2050.
Мартынов В.Г., Кулида С.В. Летне-осеннее питание молоди семги в бассейне Верхней Печоры // Тез. докл. 10-й сессии Ученого совета по проблеме “Биологические ресурсы Белого моря и внутренних водоемов Европейского Севера”. Сыктывкар, 1977. С. 56–57.
Сидоров Г.П., Шубина В.Н., Мартынов В.Г., Рубан А.К. Биология атлантического лосося (Salmo salar L.) на этапе речной жизни / Научные докл. Коми фил. АН СССР. Сыктывкар, 1977. Вып. 35. 47 с.
Kuzishchin K.V., Malyutina A.M., Gruzdeva M.A. Seasonal dynamics of feeding and food relationships of juveniles of Salmonidae in the basin of the Kol River (Western Kamchatka) // Journal of Ichthyology. 2015. V. 55. № 3. P. 323–350.
Есин Е.В., Чебанова В.В., Леман В.Н. Экосистема малой лососевой реки западной Камчатки (среда обитания, донное население и ихтиофауна). М.: Тов-во науч. изд. КМК, 2009. 171 с.
Никольский Г.В. Экология рыб. М.: Высшая школа, 1963. 368 с.
Дополнительные материалы отсутствуют.


