Экология, 2020, № 3, стр. 199-208
Пространственные тренды размерной структуры лесной куницы Martes martes Linnaeus, 1756 (Mammalia: Mustelidae) в ареале
В. Г. Монахов a, *, М. Дж. Хамильтон b
a Институт экологии растений и животных УрО РАН
Екатеринбург, ул. 8 Марта, 202, Россия
b Oklahoma State University, Department of Integrative Biology
OK 74078 Stillwater, Life Sciences West, 501, USA
* E-mail: mon@ipae.uran.ru
Поступила в редакцию 25.07.2019
После доработки 06.09.2019
Принята к публикации 20.09.2019
Аннотация
Краниометрическая структура и закономерности ее распределения в ареале были изучены по четырем признакам в 37 популяциях Martes martes. Группировки самых мелких куниц обитают в северо-восточной части Европейской России (бассейны рек Сухона, Вятка, Кама, Сылва и Чусовая) между 55° и 62° в.д. и 48° и 58° с.ш. Максимальное среднее значение кондилобазальной длины (КБД) среди самцов наблюдалось в южной части Швеции и на острове Менорка, а среди самок – в северной части Швеции и Бельгии. Изменение средневыборочного значения КБД составляло 80.42–88.00 мм у самцов и 73.58–80.10 мм у самок. Размеры черепа тесно и значимо отрицательно связаны с долготой. Связь КБД с широтой была более слабой, но также отрицательной и статистически значимой. Эта зависимость не согласуется с правилом Бергмана. Среди M. martes восточной части географического ареала, где живут крупные куницы, наблюдается обратная тенденция изменения размера. В целом вариабельность по размерам проявляет поликлинальность. Возможно, что современная размерная структура М. martes по всему ареалу отражает ход первичной видовой экспансии по Европе предков миоценовых Martes laevidens, которые имели малые размеры. Полученные нами результаты согласуются с гипотезой о том, что предки M. martes происходили из Восточной Европы и распространялись на запад, северо-запад и восток.
Морфологические свойства животного часто связаны со специфическими характеристиками его среды обитания [1, 2]. Евразийские виды хищных млекопитающих, которые имеют широкий географический диапазон распространения, часто демонстрируют значительный фенотипический полиморфизм. К ним несомненно относится и куница Martes martes – типичный лесной вид рода Martes; однако, в отличие от соболя Martes zibellina, с которым ее распространение пересекается в Уральском регионе, куница встречается главным образом в лиственных и хвойных лесах Европы [3, 4].
Вид демонстрирует широкую географическую изменчивость, и разные авторы предложили до 13 подвидов M. martes [5]. Это один из наиболее распространенных видов многих европейских экосистем, имеющий практическое значение как охотничий вид. Происхождение представителей рода Martes и возможные закономерности их распространения [2, 6] в настоящее время выявлены не полностью.
Широкий ареал M. martes делает его подходящей моделью для изучения биогеографии, а методическим подходом является сравнительное изучение краниометрической изменчивости вида. Чтобы продемонстрировать размерную структуру M. martes и ожидаемые географические различия, мы изучили животных с территории России с использованием новых выборок. Кроме того, провели сравнение куниц из восточной части географического ареала вида с животными западной части ареала с использованием данных из имеющихся публикаций. Мы охарактеризовали размерную структуру популяций в ареале, а также провели тестирование на соответствие правилу Бергмана, согласно которому размер тела у теплокровных растет с увеличением широты.
Немногие исследователи ранее пытались отразить картину фенотипической изменчивости M. martes, используя один из основных ее показателей – размеры черепа. Наибольших результатов в этом достигли Э. Андерсон [2] и позднее С. Рейг [7]. Последний описал размерную структуру 15 популяций в основном для западной части ареала, но восточная (российская) часть была представлена фрагментарно, а данные были взяты из монографии Э. Андерсон [2] и некоторых других источников.
Около половины ареала вида приходится на Россию. В ходе исследований по биологии видов рода Martes в уральской зоне симпатрии нами был получен новый материал о многих популяциях лесной куницы в России. Поэтому мы имеем возможность оценить краниометрическую структуру уральских и сибирских популяций M. martes и сравнить их с таковыми в центральной и западной Европе, для которых данные о размерах доступны в литературе. Цель нашей работы – определить пространственные тренды и направления изменений размеров черепа в пределах ареала вида и попытаться объяснить их с эволюционно-экологических позиций. Задачи исследования были следующими:
1. Пополнить знания о распределении куниц разных размеров в Западной Евразии. Это обновление стало возможным благодаря сбору новых материалов для Восточной Европы и Зауралья, недостаток которых ощущается и сейчас.
2. Провести сравнительные тесты в целях выявления сходства и различия популяций по размерной структуре для всего ареала вида.
3. Оценить корреляционные связи размеров куниц с градиентами окружающей среды в пределах ареала вида.
МАТЕРИАЛ И МЕТОДЫ
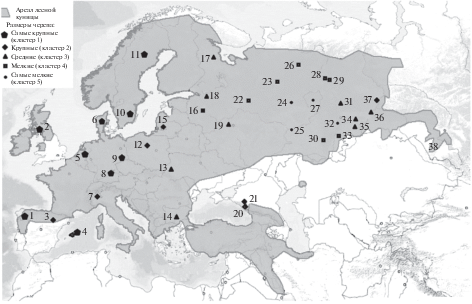
Изучены коллекции российских музеев объемом в общей сложности 1369 черепов M. martes, в том числе 760 самцов. Сводка выборок и их музейная принадлежность приведены в табл. 1. Всего, включая литературные данные, было исследовано 2606 черепов (1507 самцов и 1099 самок; табл. 1, рис. 1). По изученным нами коллекциям делали 17 измерений черепа (табл. 2) только взрослых животных старше 1 года (с определением по методу В.В. Тимофеева и В.Н. Надеева [8]). С каждого черепа штангенциркулем снимали следующие промеры: 1) основная длина (ОД); 2) кондилобазальная длина (КБД); 3) общая (наибольшая) длина (НД); 4) длина мозговой части (МД); 5) длина лицевой части (ЛД); 6) длина зубного ряда (ЗД); 7) длина ряда коренных (ДК); 8) длина слухового барабана (СБД); 9) ширина мозговой капсулы (ШМК); 10) мастоидная ширина (МШ); 11) ширина мыщелков (ШМ); 12) ширина хоан (ШХ); 13) ширина между скуловыми отверстиями (ШСО); 14) ширина верхних резцов (РШ); 15) ширина слухового барабана (СБШ); 16) наибольшая высота черепа (НВ); 17) высота в области межглазничного сужения (МВ). Средние значения признаков и описательная статистика для каждого из 20 локалитетов приведены в табл. S1 и S2 Приложения.
Таблица 1.
Географическое положение и характеристика музейных образцов Martes martes
| № и наименование выборки | Аббревиатура | Количество животных | Георгаф. положение, град. | ||
|---|---|---|---|---|---|
| самцов | самок | в.д. | с.ш. | ||
| 1. Кантабрийские горы | CANT | 113 | 46 | –6 | 43 |
| 2. Великобритания | GB | 15 | 8 | –4 | 55 |
| 3. Испания | ESP | 67 | 27 | –2 | 42 |
| 4. О-в Менорка | MEN | 21 | 17 | 4 | 39 |
| 5. Бельгия | BEL | 23 | 18 | 5 | 51 |
| 6. Дания | DEN | 28 | 20 | 9 | 56 |
| 7. Альпы | ALP | 40 | 21 | 9 | 44 |
| 8. Европа (центральная) | EUC | 53 | 21 | 10 | 49 |
| 9. Германия (восток) | GERG | 38 | 15 | 14 | 51 |
| 10. Швеция (юг) | SWES | 16 | 14 | 14 | 57 |
| 11. Швеция (север) | SWEN | 11 | 9 | 17 | 65 |
| 12. Польша | POL | 57 | 25 | 21 | 51 |
| 13. Украина (запад) | UKR | 38 | 17 | 24 | 49 |
| 14. Болгария | BUL | 17 | 10 | 24 | 42 |
| 15. Литва | LIT | 102 | 101 | 27 | 54 |
| 16. Новгородская обл. | NOVV | 43 | 29 | 30 | 59 |
| 17. Карелия | KARV | 38 | 32 | 32 | 66 |
| 18. Санкт-Петербург (окрестности) | SPBV | 35 | 32 | 32 | 59 |
| 19. Московская обл. | MOSM | 21 | 16 | 38 | 57 |
| 20. Кавказ | CAUM | 33 | 34 | 40 | 43 |
| 21. Краснодарский край | KRD | 53 | 73 | 40 | 44 |
| 22. Вологодская обл. | VOLV | 28 | 24 | 42 | 60 |
| 23. Архангельская обл. | ARHV | 29 | 31 | 46 | 64 |
| 24. Кировская обл. | KIRV | 32 | 31 | 50 | 59 |
| 25. Татарстан | TATK | 35 | 25 | 50 | 55 |
| 26. Коми (запад) | KOMW | 23 | 26 | 52 | 65 |
| 27. Пермский край | PERV | 32 | 23 | 55 | 60 |
| 28. Коми (восток) | KOME | 69 | 38 | 56 | 63 |
| 29. Р. Печора | PECM | 79 | 67 | 57 | 62 |
| 30. Башкортостан | BASE | 55 | 37 | 57 | 54 |
| 31. Свердловская обл. (север) | NSVE | 21 | 16 | 59 | 60 |
| 32. Свердловская обл. (запад) | WSVE | 84 | 64 | 59 | 57 |
| 33. Миасс (окрестности) | MIAI | 31 | 20 | 61 | 55 |
| 34. Свердловская обл. (восток) | ESVE | 27 | 25 | 64 | 58 |
| 35. Курганская обл. | KURE | 48 | 38 | 64 | 56 |
| 36. Тобольский р-н, Тюменская обл. | TOBE | 23 | 26 | 67 | 58 |
| 37. Уват (окрестности) | UVAE | 29 | 23 | 69 | 59 |
| 1507 | 1099 | ||||
Примечание. Принадлежность музейных коллекций: G – Институт лесной ботаники и зоологии (Тарандт) и Музей естественной истории Senkenberg (Gorlitz); E – Институт экологии растений и животных УрО РАН (Екатеринбург), I – Музей природы Ильменского государственного заповедника РАН (Миасс), К – Казанский государственный университет (Казань), М – Зоологический музей МГУ (Москва), V – Всероссийский НИИ охотничьего хозяйства и звероводства (Киров). Нумерация образцов такая же, как на рис. 1.
Таблица 2.
Результаты анализа размеров черепа Martes martes методом главных компонент: значения ГК1 для самцов и самок из 20 популяций восточной части ареала вида
| № выборки (см. табл. 1) |
Средние значения ГК1 | |
|---|---|---|
| самцы | самки | |
| 9. GER | 1.97 | 2.28 |
| 16. NOV | –0.35 | –0.12 |
| 17. KAR | 0.37 | 0.21 |
| 18. SPB | 0.44 | 0.15 |
| 19. MOS | 0.09 | 0.20 |
| 20. CAU | 1.32 | 1.30 |
| 22. VOL | –0.51 | –0.38 |
| 23. ARH | –0.20 | –0.12 |
| 24. KIR | –0.67 | –1.11 |
| 25. TAT | –0.37 | –0.77 |
| 27. PER | –0.91 | –1.02 |
| 29. PEC | –0.51 | –0.30 |
| 30. BAS | –0.07 | –0.21 |
| 31. NSV | –0.18 | 0.19 |
| 32. WSV | –0.56 | –0.53 |
| 33. MIA | –0.24 | –0.07 |
| 34. ESV | 0.08 | 0.45 |
| 35. KUR | 0.49 | 0.51 |
| 36. TOB | 0.06 | 0.29 |
| 37. UVA | 0.86 | 0.84 |
Средние значения признаков для сравнения с нашими данными были взяты из следующих источников (нумерация в соответствии с табл. 1): 1, 2, 5, 6, 7, 8, 10, 11, 12 – [7]; 3, 4 – [9]; 13 – [10]; 14 – [11]; 15 – [12]; 21 – [13]; 26, 28 – [14]. Так как эти источники не включали все используемые нами признаки, то мы сравнивали только те из них, которые были совместимы с нашим набором. Поэтому из указанных выше публикаций были использованы только четыре признака: КБД (2), НД (3), МШ (10), НВ (16). Средние значения признаков и описательная статистика для каждого из 37 локалитетов для 4 признаков приведены в табл. S3 Приложения. Сведения по климатическим параметрам взяты из двух источников: с сайта World Weather Records (https://www.ncdc.noaa.gov) – для локалитетов Западной Европы и СНИП “Строительная климатология” 23-01-99 (2015) – для российских регионов.
Для каждой популяции, а также для обоих полов были рассчитаны стандартные статистики: групповые средние значения и их стандартные ошибки, стандартные отклонения и т.д. Все расчеты произведены в пакете Statistica 6 (Statsoft). C его помощью также проводили дисперсионный и корреляционный анализы. Для получения одномерной характеристики размеров применили метод главных компонент, а для поиска сходства и различия, а также классификации выборок куницы – кластерный анализ (метод k-средних).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ размерной структуры куницы в Восточной Европе
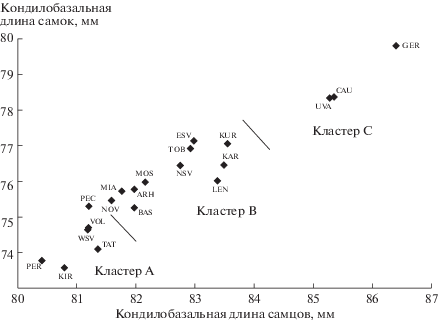
Однофакторный анализ (ANOVA) был выполнен для проверки различий между 20 популяциями M. martes, для которых мы получили данные из музейных коллекций. Результат теста ANOVA (табл. S4 Приложения) показал, что эти популяции различаются по выбранному набору признаков и выборки репрезентативны. Различия были статистически значимыми для всех признаков. Выборка куниц из восточной Германии была добавлена к нашему анализу как внешний контрастирующий объект, представляющий группировки западной части ареала вида. Наиболее часто используемый размерный признак – кондилобазальная длина КБД, распределение которого показано на рис. 2, иллюстрирует изменчивость размера куниц восточной половины ареала вида. Для большинства выборок характерны небольшие размеры черепа, и только у двух популяций КБД > 84 мм у самцов и 77.5 мм у самок и приближаются к значению выборки из восточной Германии.
Поскольку в анализе присутствует большое количество измерений для самок и самцов отдельно (с учетом выраженного полового диморфизма), был проведен анализ данных 20 популяций куницы по методу главных компонент – он значительно уменьшает размерность анализируемого массива данных и учитывает вклад каждого признака в общую дисперсию.
Выявлено, что первая главная компонента (ГК) аккумулирует 57.1 и 54.9% объясняемой дисперсии размеров для самцов и самок соответственно и представляет собой характеристику общих размеров черепа. Вторая ГК включает 8.1% объясняемой дисперсии у самцов (МШ) и 10.0% у самок (МШ, НВ). Значение ГК1 можно правомерно использовать в качестве интегральной меры размера черепа для животных обоих полов. Почти все признаки (16 у самцов и 14 у самок), включенные в ГК1, имели факторные нагрузки 0.6 или выше.
Средние значения ГК1 для самцов и самок из 20 популяций куниц приведены в табл. 2. Мы сравнили их с соответствующими средними значениями КБД всех 20 выборок, и коэффициенты корреляции оказались высокими и положительными: r♂ = 0.932; F1.16 = 5015.7 (p <0.000001), r♀ = 0.93; F1.16 = = 3911.6 (p < 0.000001). Это позволяет сделать вывод о том, что как значение ГК1, так и КБД можно использовать в качестве независимых характеристик размера черепа особей в популяциях ареала вида.
На рис. 2 показаны пространственные отношения популяций M. martes в Восточной Европе. Хорошо видно, что кластерный анализ методом k-средних (k = 3) классифицировал образцы на группы мелких, средних и крупных черепов (соответственно кластеры A–C) на основе КБД. В табл. 3 приведены характеристики кластеров для российских M. martes по размерам черепа (часть признаков и значения ГК1 для изученных популяций).
Таблица 3.
Классификация 20 популяций Martes martes Восточной Европы по размерам черепа методом кластерного анализа (k-средних, k = 3): средние значения кластеров (КБД, мм) для самцов (в числителе) и самок (в знаменателе)
| Признак | Кластер A, мелкие |
Кластер B, средние |
Кластер C, крупные |
Межгрупповая дисперсия | pmax |
|---|---|---|---|---|---|
| KIR; PEC; PER; TAT; VOL; WSV |
ARH; BAS; ESV; KAR; KUR; LEN; MIA; MOS; NOV; NSV; TOB |
CAU; GER; UVA |
|||
| КБД | 81.03/74.35 | 82.60/76.20 | 85.69/78.85 | 43.3/41.2 | 0.01 |
| НД | 83.56/76.46 | 85.18/78.11 | 88.44/80.61 | 47.7/34.9 | 0.01 |
| МШ | 35.29/33.56 | 35.88/33.97 | 38.99/36.44 | 29.4/18.1 | 0.01 |
| НВ | 30.98/28.70 | 31.43/29.15 | 32.45/30.03 | 4.3/3.5 | 0.01 |
| Значение ГК1 | –0.59/–0.68 | 0.05/0.13 | 1.38/1.48 | 7.8/9.4 | 0.01 |
| n | 290/234 | 371/302 | 100/72 |
Мелкие куницы обитают в популяции Вологда и районах, восточнее от нее (см. табл. 3, рис. 2) до широты 60° с.ш. с минимальными значениями показателя ГК1: от –0.91 до –0.37 у самцов и от –1.11 до –0.38 у самок. Регион, населенный этими мелкими особями, со всех сторон окружен популяциями куницы со средними размерами черепа (значение ГК1 от –0.35 до 0.49 для самцов и от –0.21 до 0.51 для самок). Крупный размер черепа характерен для куниц, обитающих к западу от 23° в.д., а также на Кавказе и западном берегу р. Иртыш у устья р. Демянка (вблизи г. Уват), – значение ГК1 более 0.84.
Различия между кластерами, например по КБД, высоко статистически значимы (10.39 < td < 21.49; p < 0.0001 для самцов и 11.54 < td < 19.6; p < 0.0001 для самок). Межгрупповая дисперсия (SSb) была значительно выше, чем внутригрупповая (SSw): для самцов – SSb = 43.3, SSw = 6.7 при F1,17 = 55.0 (р < 0.00001), для самок – SSb = 41.2, SSw = 7.7 при F1,17 = 45.5 (р < 0.00001).
Таким образом, на востоке европейской части России находится группа популяций M. martes с минимальными размерами черепа. Они характерны для популяций Перми (ГК1 –0.905 у самцов и –1.021 у самок) и Кирова (–0.674 у самцов и –1.111 у самок). Самые крупные куницы обитают на Кавказе (1.319 у самцов и 1.303 у самок).
При описании подвидов M. martes в Советском Союзе [15–17] приведены средние значения КБД для некоторых из них. В частности, они существенно ниже (для M. m. lorenzi и M. m. ruthena) или выше (для M. m. uralensis), чем выявлены нами. Следовательно, наши данные противоречат сведениям авторов [15–17]. Исследованные этими авторами выборки были очень малы (в случаях с M. m. uralensis), в других, вероятно, было много молодых животных, которые не достигли своего максимального размера, и, следовательно, оценки могли быть искажены.
Размеры черепа у M. martes в Восточной Европе ранее были исследованы для двух группировок [2, 18]. S.Reig [7] проанализировал три восточноевропейские популяции (331 образец) на музейных образцах Москвы и Санкт-Петербурга: Кавказ, центрально-западная и северо-западная части европейской территории СССР.
В нашем исследовании объем выборок позволил получить более точную оценку [19] по сравнению с данными [7] размеров черепа M. martes в Восточной Европе. Размерная хорологическая структура вида имеет следующие основные особенности: у центральной группы (см. рис. 1, 2) череп наименьшего размера; эта популяция окружена популяциями со средним размером черепа, а животные с крупным черепом (Кавказ и Уват) обитают на востоке и западе и оказались сопоставимы по размерам с животными Центральной Европы.
Размеры черепа Martes martes в ареале
В литературе обнаружены краниометрические данные для 17 группировок M. martes (источники перечислены в разделе “Материал и методы”). В совокупности с нашими данными это касается 37 локалитетов, характеризующих значительную часть ареала вида. В результате мы можем дать более четкую картину распределения форм M. martes разных размеров по всему видовому ареалу.
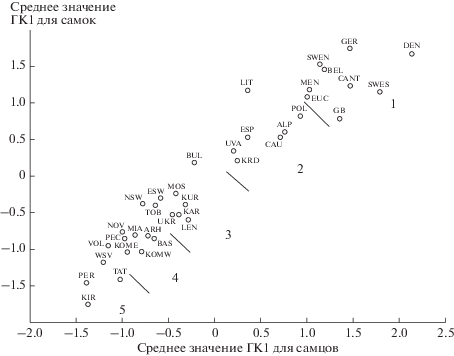
Выявление размерной структуры M. martes по всему ареалу проведено с привлечением литературных данных. Анализ включал группировки 1–8, 10–15, 21, 26, 28 (см. табл. 1). Из всех этих источников (а также из нашего набора краниометрических признаков для 20 популяций) были использованы в анализах промеры 2, 3, 10, 16. Средние значения признаков для самцов и самок были подвергнуты кластерному анализу методом k-средних (k = 5) с разделением всех 37 локалитетов на следующие категории: самые крупные, крупные, средние, мелкие, самые мелкие (кластеры 1–5, табл. 4).
Таблица 4.
Классификация 37 выборок Martes martes по итогам кластерного анализа (k-средних, k = 5): средние значения кластеров (КБД, мм) для самцов (в числителе) и самок (в знаменателе)
| Признак | Кластер 1, самые крупные | Кластер 2, крупные | Кластер 3, средние | Кластер 4, мелкие | Кластер 5, самые мелкие |
| GER; CANT; GB; MEN; BEL; DEN; EUC; SWES; SWEN | CAU; UVA; ESP; ALP; POL; LIT; KRD |
KAR; LEN; MOS; NSV; ESV; TOB; KUR; UKR; BUL | NOV; VOL; ARH; PEC; BAS; MIA; KOMW; KOME | KIR; PER; TAT; WSV |
|
| КБД | 86.72/79.37 | 85.28/78.41 | 83.02/76.56 | 81.79/75.42 | 80.95/74.03 |
| НД | 89.94/81.79 | 87.86/80.32 | 85.44/78.39 | 84.55/77.62 | 83.42/76.12 |
| МШ | 40.42/37.41 | 38.34/36.00 | 36.49/34.39 | 35.59/33.71 | 35.16/33.30 |
| НВ | 32.95/30.20 | 32.14/29.76 | 31.45/29.27 | 31.18/28.83 | 30.91/28.57 |
| Значение ГК1 | 1.40/1.32 | 0.51/0.60 | –0.46/–0.35 | –0.89/–0.89 | –1.25/–1.45 |
| n | 318/168 | 381/304 | 268/212 | 357/272 | 183/143 |
Животные самых мелких размеров занимают восточную часть Европы: между 40° и 60° с.ш. и 54° и 64° в.д. (кластер 5, см. табл. 4, рис. 1, 3). Куницы с черепами среднего размера встречаются в 9 популяциях и отнесены программой к кластеру 3 (табл. 4, рис. 1, 3). Они расположены в областях, окружающих популяции с наименьшими размерами черепа (24–38° и 52–67° в.д.). Крупные M. martes (кластер 2, семь популяций) населяют среднюю часть географического ареала (регион от Испании до Кавказа). Девять популяций самых крупных M. martes (кластер 1) обитают в западной части Европы, до 27° в.д., и имеют КБД более 85.6 мм у самцов и 78.4 у самок (значение ГК1 более 1.00 у самцов и 0.8 у самок). Полученные статистические параметры кластеров показали существенные различия между ними (р < 0.0001).
Из всех изученных группировок минимальные средние значения КБД отмечены для самцов Пермской области – 80.42 мм (значение ГК1 –1.39) и для самок Кировской области – 73.58 мм (значение ГК1 –1.76, табл. S1 и S2 Приложения). Максимальные средние значения КБД для вида среди самцов (87.8–88.0 мм) характерны для зверьков из популяций Южной Швеции и о-ва Менорка, а среди самок – для куниц Бельгии и Северной Швеции (80.1 мм, табл. S3 и S4 Приложения). По показателю ГК1 наибольшими размерами обладают самцы Дании (2.14) и самки Германии (1.75, рис. 3). Колебания среднего значения КБД для всего пула данных по 37 анализируемым популяциям составили 80.42–88.00 мм (амплитуда 7.58 мм, 9.43%) для самцов и 73.58–80.10 мм (амплитуда 6.52 мм, 8.86%) для самок, а средневидовое значение КБД было 84.2 мм у самцов и 77.3 мм у самок.Таким образом, изменчивость размеров черепа куницы проявляет поликлинальность.
Известно, что вид M. martes в последние годы расширил свое распространение на восток [4, 20], в Западной Сибири и на Алтае и заселил ранее необитаемые ленточные сосновые боры и степные колки. В сезоне 2016/2017 гг. из этой популяции (№ 38 на рис. 1) была собрана выборка (12 самцов и 10 самок, 52° с.ш. и 81° в.д.) для музея Томского государственного университета. Среднее значение КБД для самцов составило 83.82 и для самок 78.11 мм, т.е. они должны классифицироваться как крупные животные в кластер 2 (см. табл. 4). Однако эта новая популяция требует более тщательного изучения с привлечением выборки большего объема.
Корреляционные связи размеров куниц с градиентами окружающей среды
Для оценки соответствия выборки M. martes ее географическому положению использовался корреляционный анализ. Обнаружено, что размер черепа (значение ГК1) тесно отрицательно коррелирует с долготой местоположения. Так, у самцов коэффициент корреляции r♂ = –0.783; F1,35 = 55.3 (p = 0.000001), r♀ = – 0.746; F1,35 = 44.0 (p = 0.000001). Это подтверждает клинальность пространственного распределения размеров по КБД и ГК1 и увеличения размеров с востока на запад в географическом ареале вида.
Однако в восточной части ареала наблюдается обратная тенденция, демонстрирующая увеличение размеров M. martes к восточной границе обитания. Таким образом, связь КБД с долготой в диапазоне от 46 до 70° в.д. была обнаружена с коэффициентом корреляции: r♂ = 0.680; F1,13 = 11.2 (p = 0.0053), r♀ = 0.758; F1,13 = 17.5 (p = 0.0011), а для интегральной характеристики – значения ГК1: r♂ = 0.633; F1,13 = 8.7 (p = 0.0113), r♀ = 0.773; F1,13 = 19.3 (p = 0.0007), т.е. распределение размеров черепа M. martes в пределах географического ареала вида демонстрирует поликлинальность.
Эта поликлинальность также подтверждается при тестировании распределения по размерам в направлении с юга на север для проверки действия правила Бергмана [21]. Соотношение интегральной меры размера черепа (значение ГК1) и широты местности было проверено путем деления арала M. martes на восемь вертикальных трансект “юг–север” с шириной 10° для каждой. В большинстве трансект размеры черепа положительно коррелировали с увеличением градуса широты: r♂ = минимум 0.032 – среднее 0.39 – максимум 0.81, r♀ = минимум 0.210 – среднее 0.30 – максимум 0.84, но никогда не были статистически значимыми (p > 0.05). Однако в трансекте 40–49° в.д. коэффициенты корреляции имели очень высокие отрицательные значения: r♂ = –0.921, p = 0.08, r♀ = = –0.965, p = 0.03, т.е. размеры M. martes на юге (Кавказ) больше, чем в северной части этого трансекта (Вологодская и Архангельская обл.). Почти во всех трансектах “юг–север” изменения в размерах носят сложный и разнонаправленный характер.
В целом для всех 37 локалитетов соотношение между размером черепа и градиентом “юг–север” оказалось отрицательным: r♂ = –0.465; p = 0.0037, r♀ = –0.482; p = 0.0025, и, следовательно, распределение размеров черепа в ареале вида в направлении с юга на север не согласуется с правилом Бергмана. Это связано с наличием в южной части географического ареала таких популяций, как Кавказ, Кантабрия, Менорка, Уват, Тобольск, Курган и Восточный Свердловск, где куницы имеют более крупные размеры черепа, чем в северной части ареала. Подобный эффект был описан и ранее [16, 22].
С. Рейг [7], который изучал 15 преимущественно западных популяций M. martes, сообщал о тенденции увеличения размеров черепа в направлении с севера на юг (со статистически незначимой корреляцией) и тенденции несоблюдения правила Бергмана. Это было подтверждено и нами, однако со статистически значимым эффектом. С. Рейг [7] также отметил общую тенденцию уменьшения размера M. martes с запада на восток (КБД в градиенте долготы) с r = –0.75; p < 0.05, а также общих размеров черепа (ГК1) с долготой местности с r = –0.76. Однако малое количество материала из Восточной Европы не позволило ему охарактеризовать распределение размеров черепа и обнаружить обратную тенденцию увеличения размера к востоку в этой части ареала. Тенденция, сходная с распределением размеров (увеличение с востока на запад) у M. martes, также обнаружена для американской куницы M. americana [2], ласки Mustela nivalis [16] и хоря Mustela putorius [23].
Наиболее значимая связь между климатическими характеристиками местности и размером черепа была выявлена С. Рейгом [7] только для средней минимальной температуры января (18 сравнений из 25 с коэффициентами корреляции от 0.58 до 0.91). Мы также оценили взаимосвязь различных температурных индексов с размерами черепа M. martes в целом по географическому ареалу вида в западной и восточной частях ареала (табл. 5). Для всего ареала M. martes корреляции со среднегодовой, средней температурой января и минимальной среднегодовой температурой оказались положительными. Наибольшие коэффициенты корреляции наблюдались для средней минимальной январской температуры: r = 0.63–0.73, p < 0.001 (тренд “чем теплее зима, тем больше размеры”). Средняя температура июля не показала значительной корреляции с размерами куницы.
Таблица 5.
Коэффиценты корреляции r между средневыборочными значениями размеров черепа и средовыми переменными для 37 популяций Martes martes
| Переменные | Весь ареал | 23 западные популяции | 14 восточных популяций | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| КБД | ГК1 | КБД | ГК1 | КБД | ГК1 | |||||||
| ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | |
| Температура, °С: | ||||||||||||
| среднегодовая | 0.63 | 0.59 | 0.64 | 0.63 | 0.52 | 0.52 | 0.46 | 0.48 | –0.39 | –0.47 | –0.31 | –0.41 |
| среднеянварская | 0.61 | 0.57 | 0.61 | 0.63 | 0.69 | 0.67 | 0.65 | 0.67 | –0.06 | –0.07 | –0.16 | 0.01 |
| среднеиюльская | 0.21 | 0.21 | 0.15 | 0.18 | 0.12 | 0.14 | 0.01 | 0.06 | 0.01 | –0.05 | 0.12 | 0.02 |
| средняя минимальная января | 0.69 | 0.63 | 0.73 | 0.71 | 0.66 | 0.64 | 0.64 | 0.65 | –0.63 | –0.77 | –0.60 | –0.76 |
| cреднегодовая минимальная | 0.62 | 0.56 | 0.63 | 0.60 | 0.49 | 0.46 | 0.43 | 0.43 | –0.30 | –0.39 | –0.24 | –0.39 |
| Географический градиент: | ||||||||||||
| в.д. | –0.73 | –0.67 | –0.78 | –0.75 | –0.75 | –0.74 | –0.76 | –0.74 | 0.76 | 0.88 | 0.76 | 0.89 |
| с.ш. | –0.49 | –0.48 | –0.47 | –0.48 | –0.40 | –0.42 | –0.33 | –0.37 | 0.00 | 0.00 | –0.13 | –0.07 |
Значительные корреляции были обнаружены для 14 популяций M. martes в восточной части ареала (p < 0.05–0.01) для средней минимальной температуры в январе, но они были отрицательными (“чем холоднее зима, тем больше размеры”), т.е. эта тенденция противоположна выявленной для всего ареала вида (см. табл. 5).
ЗАКЛЮЧЕНИЕ
Правомерен вопрос, чем обусловлена выявленная картина размерной структуры M. martes в ареале? R. Sommer и N. Benecke [24] связывают формирование территории, населенной лесной куницей, с послеледниковым распространением березовых и сосновых лесов и эмиграцией вида из южных рефугий (Карпаты, Балканы, Апеннины, Пиренеи). В то же время они отмечают, что куница пришла в Европу раньше – уже в период аллередского потепления (11–10 тыс. лет назад). Основным направлением реколонизации было северо-западное [24]. Самые крупные куницы в настоящее время населяют в основном территории, ранее занимаемые льдом (север Европы). Однако это не всегда так: очень крупные M. martes также живут в Испании, где не было ледника, и наоборот, небольшие куницы в Восточной Европе населяют территории, которые были подо льдом в эпоху Валдая. Следовательно, голоценовые события не полностью объясняют феномен размерной структуры M. martes в пределах ареала.
Объяснение может лежать в более глубокой истории вида. Известно, что в миоцене и плиоцене вид М. martes (или его родовые предки) уже жили как в Европе, так и в Америке, поскольку они описаны для гиппарионовой фауны [25]. По нашему мнению, размерная структура M. martes (см. рис. 1) отражает ход первичного расселения предков современных M. martes по Европе. Последующие реверсивные и прогрессивные движения ареала в ледниковые эпохи имеют лишь второстепенное значение и не определяют фенотипы современных куниц.
В восточной части своего ареала куница была распространена на юге лесной зоны Западной Сибири и лесостепи до р. Енисей. К концу XVIII в. ареал M. martes сократился до Уральских гор, а в начале ХХ в. расширился на восток до северной границы лесостепной зоны. В начале XXI в. куница заселила реликтовые (ленточные) сосновые леса на юге Западной Сибири и достигла Алтайского предгорья и Чулым-Енисейского междуречья [4, 20, 26].
Древнейшая куница, миоценовая Martes laevidens Dehm 1950, возможно, была (из известных) самым мелким [2] предком вида, от которого произошли современные европейские M. martes. Отсюда логично заключить, что дальнейшая дифференциация и расселение форм происходили с увеличением размера тела, т.е. в соответствии с известным правилом Копа-Депере [1, 27] об увеличении животных в филогенетических ветвях, хотя Э. Андерсон [6] отмечала как прогрессивные, так и регрессивные тенденции размеров куниц в голоцене. Дивергенция в роде Martes является ярким примером географического видообразования при колонизации новых территорий. Большинство субарктических видов являются представителями миграционных фаун, и неслучайно Э. Андерсон также причисляет к ним виды Martes, замечая, что западно-европейские M. martes произошли из восточно-европейских.
Ряд современных северных видов [28, 29] могли выжить не только в известных полуостровных рефугиумах (Балканы, Апеннины и Иберия), но и в других районах Центральной (Восточной) [30, 31] или Северной Европы [32, 33]. К сожалению, отсутствие ископаемых останков не позволяет это подтвердить. Тем не менее на основе генетических данных и палеонтологических находок у ряда видов имеются примеры сохранения и широкого распространения по Европе древесных растений и лесных животных предположительно из одного или нескольких неизвестных рефугиумов [28], включая M. martes. Эти же авторы указывают на доказательства не только выживания M. martes в южных, но и северных рефугиях и предполагают, что северные рефугиумы могли быть неоднородными, хотя и с подходящей средой обитания для вида, но недостаточно большими, чтобы поддерживать позвоночных с крупными размерами тела и большим ареалом [28].
В литературе выдвигались предположения об увеличении размеров в филогенетических ветвях [1, 27], а направление клинальной изменчивости согласуется с путями расселения видов [34], что могло бы объяснить картину географической изменчивости куницы в ареале. Поэтому мы предполагаем, что первичное расселение предка M. martes по Евразии происходило из Восточной Европы на запад, северо-запад и восток.
Выражаем признательность за помощь в работе с коллекционными материалами Н.Г. Ерохину, А.Г. Васильеву, Т.П. Коуровой, М.Н. Ранюк (г. Екатеринбург), О.Ю. Тютенькову (г. Томск), И.Л. Туманову (г. Санкт-Петербург), П.В. Чащину (г. Миасс), О.Л. Россолимо и И.Я. Павлинову (г. Москва), А.А. Синицыну (г. Киров). Работа выполнена согласно госконтракту Института экологии растений и животных УрО РАН.
Список литературы
Rensh B. Evolution above the species level. N.Y.: Columbia Univ. Press, 1960. 420 p.
Anderson E. Quaternary evolution of the genus Martes (Carnivora, Mustelidae) // Acta Zoologica Fennica. 1970. V. 130. P. 1–132.
Граков Н.Н. Лесная куница. М.: Наука, 1981. 107 с.
Herrero J., Kranz A., Skumatov D. et al. Martes martes. The IUCN Red List of Threatened Species 2016: e.T12848A45199169.https://doi.org/10.2305/IUCN.UK.2016-1.RLTS. T12848A45199169.en
Wozencraft W.C. Order Carnivora // Mammal species of the world: a taxonomic and geographic reference / Wilson D.E., Reeder D.M. Eds. Baltimore, Maryland: Johns Hopkins University Press, 2005. P. 532–628.
Anderson E. Evolution, prehistoric distribution and systematics of Martes // Martens, sables, and fishers: biology and conservation / Buskirk S.W. et al. Eds. Ithaca, New York: Comstock Publishing Associates, 1994. P. 13–25.
Reig S. Morphological variability of Martes martes and and Martes foina in Europe. PhD. Thesis, Mammal Research Institute, Bialowieza, Poland, 1989. 128 p.
Тимофеев В.В., Надеев В.Н. Соболь. М.: Заготиздат, 1955. 404 с.
Lopez-Martin J.M., Ruiz-Olmo J., Padro I. Comparison of skull measurements and sexual dimorphism between the Minorcan pine marten (Martes martes minoricensis) and the Iberian pine marten (M. m. martes): A case of insularity // Mammalian Biology. 2006. V. 71(1). P. 13–24.
Абеленцев В.И. Куниця лiсова Martes martes L. // Фауна Украiни. Т. 1. Вип. 3. Киiв: Наукова думка, 1968. С. 91–128.
Gerasimov S. Specific peculiarities and sexual dimorphism of the cranial meristics of Martes martes L. and Martes foina Exrl. (Mammalia, Mustelidae) from Bulgaria // Acta Zoologica Bulgarica. 1983. V. 22. P. 9–25.
Мальджюнайте С.А. Куницеобразные хищники Литовской ССР, их биология, численность и хозяйственное значение: Автореф. дис. … канд. биол. наук. Вильнюс, 1963. 26 с.
Рябов Л.С. Некоторые возрастные особенности морфологии кавказских лесных куниц // Зоол. журн. 1962. Т. 41. Вып. 1. С. 1731–1737.
Полежаев Н.М. Martes martes Linnaeus 1758 – Куница лесная // Фауна Европейского Северо-Востока России. 1988. Т. 2(2). С. 104–123.
Кузнецов Б.А. Географическая изменчивость соболей и куниц фауны СССР // Тр. Моск. зоотехн. ин-та. 1941. Т. 1. С. 113–133.
Юргенсон П.Б. Очерки по сравнительному изучению соболя и куниц // Сборник материалов по результатам изучения млекопитающих в государственных заповедниках. М., 1956. С. 33–71.
Гептнер В.Г., Наумов Н.П., Юргенсон П.Б. и др. Млекопитающие Советского Союза. Т. 2. Ч. 1. М.: Высш. школа, 1967. 1004 с.
Огнев С.И. Звери Восточной Европы и Северной Азии. Т. 2. М., Л.: ГОИЗ, 1931. 776 с.
Asiamah N., Mensah H.K., Oteng-Abayie E.F. Do Larger Samples Really Lead to More Precise Estimates? A Simulation Study // Amer. J. of Educational Research. 2017. V. 5. P. 9–17.
Девяшин М.М., Косинцев П.А., Тютеньков О.Ю. и др. Формирование современных ареалов куниц (род Martes Pinel 1792) на юго-востоке Западной Сибири // Зоол. журн. 2016. Т. 95(6). С. 728–738.
Meiri Sh. Bergmann’s Rule — what’s in a name? // Global Ecology and Biogeography. 2011. V. 2. P. 203–207.
Geist V. Bergmann’s rule is invalid // Canadian J. of Zoology. 1987. V. 65. P. 1035–1038.
De Marinis A. Craniometric variability of polecat Mustela putorius l. 1758 from north-central Italy // Hystrix. 1995. V. 7(1–2). P. 57–68.
Sommer R., Benecke N. Late- and Post-Glacial history of the Mustelidae in Europe // Mammal Review. 2004. V. 34(4). P. 249–284.
Свистун В.И., Давид А.И., Несин В.А. Череп верблюда из среднеплейсто-ценовых отложений Молдавии // Четвертичный период: Палеонтология и археология. Кишинев: Штиинца, 1989. С. 52–61.
Kisagulov A.V., Kosintsev P.A., Gimranov D.O. Species of genus Martes in the Southern Urals and Trans-Urals during the Holocene // Russ J. of Theriology. 2017. V. 16. P. 139–148.
Stanley S.M. An Explanation for Cope’s Rule // Evolution. 1973. V. 27. P. 1–26.
Bhagwat S.A., Willis K.J. Species persistence in northerly glacial refugia of Europe: a matter of chance or biogeographical traits? // J. of Biogeography. 2008. V. 35. P. 464–482.
Ruiz-González A., Madeira M.J., Randi E. et al. Phylogeography of the forest-dwelling European pine marten (Martes martes): new insights into cryptic northern glacial refugia // Biological J. of Linn. Soc. 2013. V. 109. P. 1–18.
Stewart J.R., Lister A.M. Cryptic northern refugia and the origins of the modern biota // Trends in Ecology and Evolution. 2001. V. 16. P. 608–613.
Sommer R.S., Zachos F.E. Fossil evidence and phylogeography of temperate species: ‘glacial refugia’ and post-glacial recolonization // J. of Biogeography. 2009. V. 36. P. 2013–2020.
Lebarbenchon C., Poitevin F., Arnal V. et al. Phylogeography of the weasel (Mustela nivalis) in the Western-Palaearctic region: combined effects of glacial events and human movements // Heredity. 2010. V. 105. P. 449–462.
Pertoldi C., Elschot K., Ruiz-Gonzalez A. et al. Genetic variability of central–western European pine marten (Martes martes) populations // Acta Theriologica. 2014. V. 59. P. 503–510.
Чернов Ю.И. Природная зональность и животный мир суши. М.: Мысль, 1975. 222 с.
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Средневыборочные значения краниометрических признаков самцов Martes martes для 20 популяций, мм