Экология, 2020, № 4, стр. 284-297
Сопряженная хронографическая изменчивость морфофункциональных признаков в ценопопуляциях двух симпатрических видов грызунов
А. Г. Васильев a, *, И. А. Васильева a, Ю. В. Городилова a, М. В. Чибиряк a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: vag@ipae.uran.ru
Поступила в редакцию 17.12.2019
После доработки 22.01.2020
Принята к публикации 24.01.2020
Аннотация
Методами геометрической морфометрии анализировали хронографическую изменчивость морфофункциональных признаков в одних и тех же ценопопуляциях рыжей полевки (Clethrionomys glareolus) и малой лесной мыши (Sylvaemus uralensis) в Оренбургской области. Изучены произошедшие за 30 лет (1986 –2016 гг.) изменения размеров и формы нижней челюсти, а также морфофункциональных мандибулярных индексов. Выявлены направленные хронографические изменения морфогенеза нижней челюсти и ее морфофункциональные перестройки, связанные с изменением трофических предпочтений как у полевок, так и у мышей. В ценопопуляции рыжей полевки конфигурация мандибул значимо изменилась в направлении специализации к грызению, а у малой лесной мыши – к поперечному перетиранию кормовых объектов. У обоих видов в XXI в. усилился половой диморфизм по центроидным размерам (CS) нижней челюсти. Показатель морфоразнообразия (MNND) мандибул в ценопопуляциях обоих видов значимо уменьшился от XX к XXI в., что косвенно указывает на повышение стабильности развития. Несмотря на смену климатического режима и связанного с этим изменения растительности, а также таксономическую разобщенность видов, у них выявлен параллелизм хронографической изменчивости, отражающий высокий положительный коэволюционный потенциал – сходную морфогенетическую реакцию на изменение условий среды в разные годы. Полученные данные прямо свидетельствуют о реальности быстрых направленных перестроек морфогенеза в ценопопуляциях симпатрических видов грызунов при изменении климата.
Морфофункциональные изменения в популяциях животных, происходящие за короткие исторические времена, представляют большой интерес для понимания эволюционно-экологических процессов быстрых микроэволюционных перестроек и изменения функционирования сообществ [1–5]. Существенное изменение экологических условий обитания видов в результате климатических и антропогенных воздействий неизбежно должно приводить либо к быстрой перестройке их морфогенеза (за счет модификаций и/или направленного отбора), либо к деградации и вымиранию. С другой стороны, принципиально важны, но пока еще слабо изучены коэволюционные сопряженные изменения совместно обитающих симпатрических видов [6, 7]. Ранее нами были показаны примеры проявления положительного коэволюционного потенциала – сходной морфогенетический реакции на одни и те же факторы среды в природных ценопопуляциях симпатрических видов как у насекомоядных млекопитающих, так и грызунов [8, 9].
Изучение сопряженной морфологической изменчивости и разнообразия популяций симпатрических видов представляет особый интерес при рассмотрении исторически протяженных отрезков времени. В относительно короткие периоды времени – смежные годы или несколько лет – хронографическая изменчивость отражает главным образом модификационные изменения и флуктуации. Они обычно связаны с ежегодными климатическими колебаниями и циклами динамики численности, приводящими к морфогенетическим эффектам, во многом зависимым от изменения плотности населения. При этом до сих пор слабо изучены взаимовлияния плотности ценопопуляций симпатрических видов на их морфогенез. Отдаленные морфогенетические перестройки в продолжительные исторические отрезки времени также изучены недостаточно, поскольку длительное слежение за одними и теми же ценопопуляциями представляет большую редкость [10]. Тем не менее именно продолжительный мониторинг в таких случаях может выявить не только прямые модификационные изменения, но одновременно и эволюционно-экологические процессы, обусловленные явлениями взаимной диффузной коэволюции симпатрических видов в сообществе (таксоцене). Особый интерес при этом представляет оценка направленности взаимных морфогенетических перестроек в ценопопуляциях сопоставляемых видов, позволяющая определить проявление у них положительного или отрицательного коэволюционного потенциала [9].
В случае положительного коэволюционного потенциала морфогенетические реакции ценопопуляций симпатрических видов будут носить сходный характер, указывающий на слабые конкурентные взаимодействия или их отсутствие. При отрицательном коэволюционном потенциале, напротив, между ними весьма вероятны сильные конкурентные взаимодействия, приводящие к необходимости реализации разных морфогенетических программ, способствующих снижению негативного взаимовлияния синтопных ценопопуляций.
В Музее ИЭРиЖ УрО РАН имеются коллекционные материалы по двум симпатрическим видам грызунов – рыжей полевке (Clethrionomys glareolus) и малой лесной мыши (Sylvaemus uralensis), целенаправленно собранные ранее в Оренбургской области в XX в. и начале XXI в., которые могут служить моделью для попытки решения обсуждаемых нами задач.
Использование методов геометрической морфометрии [11–13], нацеленных на раздельное изучение изменчивости формы и размеров объектов, допускает возможность морфогенетической интерпретации выявляемых с их помощью морфологических различий [14] и позволяет применить их для решения рассмотренных выше эволюционно-экологических проблем [13, 15, 16].
В этой связи цель работы состояла в анализе сопряженной хронографической изменчивости и внутригруппового морфологического разнообразия формы нижней челюсти в ценопопуляциях двух симпатрических видов грызунов – рыжей полевки и малой лесной мыши в Оренбургской области на длительном тридцатилетнем историческом отрезке времени – от 1986 г. до 2016 г. – с помощью методов геометрической морфометрии. Особый интерес в этом случае представляла оценка возможных изменений морфофункциональных мандибулярных индексов, характеризующих трофические предпочтения зверьков синтопных ценопопуляций сравниваемых видов в природно-климатических условиях конца XX в. и второго десятилетия XXI в.
МАТЕРИАЛ И МЕТОДЫ
Материалом для работы послужили краниологические коллекции Музея Института экологии растений и животных УрО РАН, представленные выборками рыжей полевки (Clethrionomys glareolus Schreb. 1780) и малой лесной мыши (Sylvaemus uralensis Pall. 1811), добытыми летом (июль–август) на Южном Урале (Оренбургская область, пос. Черный Отрог: 51°53′59″ с.ш., 56°01′37″ в.д.). Материал собран в 1986–1987 гг. (коллекторы А.Г. Васильев, И.А. Васильева) и 2015–2016 гг. (коллекторы А.Г. Васильев, М.В. Чибиряк). Климатические среднегодовые характеристики – температуру и количество осадков – учитывали с 1986 г. по 2016 г. по данным метеостанции г. Оренбурга, ближайшей от пос. Черный Отрог.
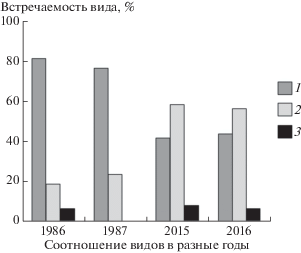
Отлов грызунов обоих видов проводили синхронно и синтопно в пойменном лесу правого берега р. Сакмары линиями ловушек-плашек. Оценка долевого соотношения трех фоновых видов грызунов – рыжей полевки, малой лесной и желтогорлой (S. flavicollis) мышей – в уловах разных лет показала, что в данном сообществе грызунов оба модельных вида являются кодоминантами, однако в 80-е годы XX в. доминировала рыжая полевка, а в 2015–2016 гг. – малая лесная мышь. Желтогорлую мышь можно отнести к категории вида-субдоминанта (по классификации В. Тишлера [17]), хотя в 1987 г. она и не была зарегистрирована в отловах (рис. 1).
Рис. 1.
Соотношение долей встречаемости в уловах трех видов грызунов в разные годы в пойменном лесу р. Сакмары в окрестностях пос. Черный Отрог (Оренбургская область): 1 – рыжая полевка, 2 – малая лесная мышь, 3 – желтогорлая мышь.
В работе использовали материалы только по группе однородных в возрастном отношении сеголеток рыжей полевки и малой лесной мыши обоих полов (ювенильных и зимовавших зверьков из анализа исключили). Общее число изученных особей двух видов составило 204 экз. Соотношение числа самцов и самок в выборках, собранных в разные годы, указано в табл. 1.
Таблица 1.
Сравнение центроидных размеров CS (с учетом стандартных ошибок, ± SE) нижней челюсти рыжей полевки и малой лесной мыши в аллохронных синтопных выборках самцов и самок из ценопопуляций пойменного леса р. Сакмара (Оренбургская обл., пос. Черный Отрог) в конце XX в. (1986–1987 гг.) и начале XXI в. (2015–2016 гг.)
| Год, пол | Центроидный размер (число экз.) | |
|---|---|---|
| рыжая полевка | малая лесная мышь | |
| 1986 | 931.79 ± 6.05 (26) | 880.64 ± 7.57 (18) |
| Самцы | 931.15 ± 7.04 (15) | 878.98 ±10.97 (8) |
| Самки | 932.66 ±11.01 (11) | 881.97 ± 10.94 (10) |
| 1987 | 885.83 ± 4.59 (22) | 848.87 ± 8.77 (11) |
| Самцы | 882.91 ± 5.22 (13) | 848.57 ± 9.51 (9) |
| Самки | 890.05 ± 8.50 (9) | 849.20 (2) |
| 2015 | 904.85 ± 7.21 (23) | 852.85 ± 5.48 (28) |
| Самцы | 884.55 ± 4.94 (13) | 842.18 ± 8.86 (14) |
| Самки | 931.25 ± 10.63 (10) | 862.73 ± 6.44 (14) |
| 2016 | 917.64 ± 4.88 (34) | 837.19 ± 4.57 (42) |
| Самцы | 905.64 ± 5.28 (17) | 829.78 ± 6.06 (20) |
| Самки | 929.65 ± 7.23 (17) | 843.92 ± 6.55 (22) |
При анализе хронографической изменчивости материал изучали в разных вариантах: 1 – сравнили выборки разных лет отдельно по каждому виду; 2 – сопоставили те же выборки в общем морфопространстве; 3 – объединяли выборки каждого вида по принадлежности к XX и XXI вв., нивелируя межгодовые различия смежных лет; 4 – использовали предыдущий вариант, но при этом выборки подразделили по полу.
Для характеристики изменчивости формы нижней челюсти применили методы геометрической морфометрии [11–13, 18]. Выбор в качестве объекта исследований нижней челюсти обусловлен необходимостью изучения морфофункциональных трофических особенностей видов в разные годы и тем, что мандибула является плоским объектом, который можно эффективно анализировать методами геометрической морфометрии по цифровым фотографиям. Изучили 204 фотографии правых мандибул, полученных с помощью планшетного сканера с разрешением 1200 dpi. На изображениях с помощью программ tpsUtil [19] и tpsDig2 [20] разместили конфигурации 16 меток-ландмарок (landmarks), позволяющие характеризовать изменчивость формы нижней челюсти (рис. 2).
Рис. 2.
Размещение конфигурации меток-ландмарок (landmarks) 1–16 и промеров (A, B, C, D, E), необходимых для вычисления морфофункциональных мандибулярных индексов, на лингвальной стороне нижней челюсти (на примере малой лесной мыши).
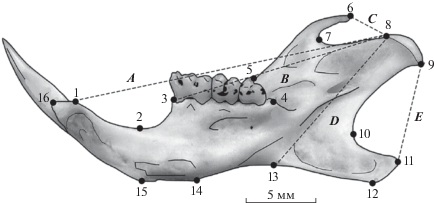
Для оценки функциональных особенностей конфигураций нижней челюсти использовали пять промеров: A – сочленовно-резцовый, B – сочленовно-молярный, C – темпорально-сочленовный, D – сочленовно-массетерный и E – сочленовно-угловой (см. рис. 2). По данным промерам вычислили морфофункциональные мандибулярные индексы [см. 21]: TI – темпорально-резцовый, TM – темпорально-молярный, MI – массетерно-резцовый, MM – массетерно-молярный и AM – ангулярно-массетерный. Расчет индексов провели по следующим формулам: TI = C/A; TM = C/B; MI = D/A; MM = D/B и AM = E/D [21, 22]. Индексы TI и TM характеризуют интенсивность продольных режуще-жевательных движений, а индексы MI и MM – интенсивность движений, связанных с грызением и дроблением пищевых объектов. Предложенный нами индекс AM косвенно характеризует интенсивность поперечных жевательных движений, связанных с перетиранием корма [22].
Прокрустову суперимпозицию (Procrustes superimposition) выполнили методом генерализованного Прокрустова анализа – GPA [11] с использованием метода наименьших квадратов и расчетом прокрустовых координат (Procrustes coordinates). Центроидный размер (centroid size – CS), характеризующий общий размер оцифрованных объектов, вычисляли как квадратный корень из суммы квадратов расстояний от центра конфигурации до каждой метки [11]. Предварительная двукратная повторная расстановка ландмарок не выявила значимых смещений оценок, связанных с ошибками оператора [23].
Сравнение межгрупповых различий формы нижней челюсти провели с помощью канонического анализа прокрустовых координат. Оценку множественных межгрупповых различий по отдельным переменным получили методом однофакторного дисперсионного анализа (One-Way ANOVA). Значимость межгрупповых различий по факторам вид (S) и год (Y) с учетом их взаимодействия оценили на основе двухфакторного анализа (Two-Way ANOVA). Оценку иерархии межгрупповых различий по итогам канонического анализа выполнили методом кластерного анализа (UPGMA) по матрице квадратов обобщенных расстояний Махаланобиса (D2). Адекватную метрику дистанций для кластерного анализа определили по наибольшему значению коэффициента кофенетической корреляции (Rcoph).
Индекс полового диморфизма оценили по формуле ISD = [(Xf/Xm) – 1] × 100, где Xf – среднее значение показателя у самок, а Xm – у самцов [24]. При многомерном анализе для этой цели использовали обобщенные расстояния Махала-нобиса (D2) с оценкой уровней значимости.
Показатель внутригруппового морфоразнообразия (morphological disparity) рассчитали методом анализа паттерна ближайших соседних ординат (nearest neighbour point pattern analysis) в пределах выборочных полигонов изменчивости (convex hulls) [25, 26] для первых двух канонических переменных (CV1–CV2). В соответствии с методом оценили показатель R, вычисляемый как отношение наблюдаемой средней дистанции между ближайшими соседними ординатами (MNND – mean nearest neighbor distance) к величине теоретически ожидаемой средней дистанции (ExpNND – expected nearest neighbor distance), полученной на основе распределения Пуассона. При условии R < 1 наблюдается кластеризация ординат, при R = 1 – пуассоновский тип рассеивания, а в случае R > 1 – сверхрассеивание (overdispersion). Последний случай при одновременном увеличении значения MNND следует интерпретировать как возрастание внутригруппового морфоразнообразия [26], а в геометрической морфометрии как увеличение веера траекторий морфогенеза в общем морфопространстве [8, 22]. Для проверки нулевой гипотезы о том, что наблюдаемое MNND равно значению ExpNND для случайного рассеивания точек при той же плотности ординат в пределах полигона изменчивости, использовали Z-критерий ближайшего соседа [25]. Краевые эффекты рассеивания ординат в пределах полигонов нивелировали методом К.П. Доннелли [27].
Статистические расчеты, включая использование методов геометрической морфометрии, выполняли с использованием пакетов прикладных программ TPS [19, 20], MorphoJ 1.6d [18] и PAST 3.26 [28].
РЕЗУЛЬТАТЫ
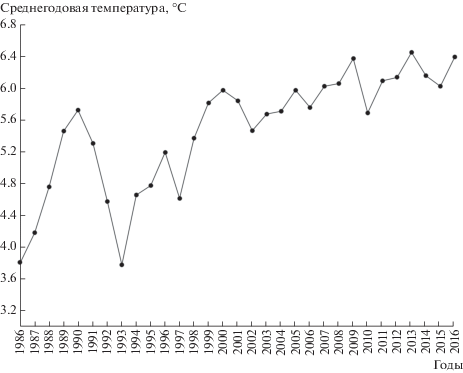
Сравнение средних значений среднегодовых температур на трех временных отрезках выявило отчетливый тренд в направлении возрастания показателя от 1986 г. к 2016 г.: 1 (1986–1999) – 4.58 ± 0.35; 2 (2000–2010) – 5.62 ± 0.30; 3 (2011–2016) – 6.09 ± ± 0.21. Однофакторный дисперсионный анализ (One-Way ANOVA) в данном случае выявил значимые различия среднегодовой температуры (табл. 2). Значение показателя ω2, используемого для оценки размера эффекта (effect size), судя по пороговым значениям, предложенным Дж. Коэном [29], оказалось выше среднего уровня, что указывает на значительный характер изменений локальной среднегодовой температуры за изученный период. В смежные годы XX в. (1986–1987) среднегодовая температура была близка по значениям (соответственно 4.0 и 3.4°С), а в начале XXI в. (2015–2016) соответственно 6.2 и 6.5°С, т.е. возросла в среднем примерно на 2.5°, что прямо указывает на общее потепление климата за прошедшие три десятилетия. На графике последовательных значений среднегодовой температуры, сглаженных по трем смежным годам, тренд четко прослеживается (рис. 3). Первоначально крупные флуктуации значений средних годовых температур, типичные для конца XX в., сменились во втором десятилетии XXI в. мелкими колебаниями небольшой амплитуды, но на более высоком уровне значений. Величина годовых осадков между крайними годами наблюдений возросла приблизительно на 100 (в 1986 г. – 348 мм, а в 2016 г. – 456 мм), однако различия между временными отрезками по средним уровням осадков статистически подтвердить не удалось (p > 0.05). Таким образом, во втором десятилетии XXI в. среднегодовая температура стала значимо выше, а уровень годовых осадков возрос, но незначительно, что проявляется лишь как слабая тенденция.
Таблица 2.
Результаты однофакторного дисперсионного анализа (One-Way ANOVA) значений средней годовой температуры за три десятилетия (1 – 1986–1999 гг.; 2 – 2000–2010 гг.; 3 – 2011–2016 гг.) вблизи г. Оренбурга (пос. Черный Отрог)
| Источник изменчивости | Сумма квадратов (SS) | Число степеней свободы (d.f.) | Средний квадрат (MS) | F | Уровень значимости (p) |
|---|---|---|---|---|---|
| Межгрупповая | 11.999 | 2 | 5.999 | 7.37 | 0.0027 |
| Внутригрупповая | 22.781 | 28 | 0.814 | ||
| Общая | 34.780 | 30 | |||
| Размер эффекта, ω2 (effect size) | 0.291 |
Рис. 3.
Сглаженная по трем смежным годам кривая динамики значений среднегодовых температур в окрестностях г. Оренбург с 1986 г. по 2016 г.
Изменение средних значений CS у обоих видов по годам происходит однонаправленно (см. табл. 1). Коэффициент ранговой корреляции Спирмена между значениями CS синхронно взятых выборок обоих видов оказался достаточно высоким и статистически значимым (RS = 0.61; p = 0.036). Средние центроидные размеры (centroid size – CS) мандибул в выборках самок у обоих видов практически во всех случаях превысили таковые у параллельно отловленных самцов (см. табл. 1). При сравнении средних индексов полового диморфизма (ISD) по величине CS установлено, что у обоих видов в конце XX в. (1986 и 1987 гг.) эти показатели были ниже 1.0%, а во втором десятилетии XXI в. (2015 и 2016 гг.) увеличились и колебались от 1.9 до 5.7%.
В результате двухфакторного дисперсионного анализа (Two-Way ANOVA) значений CS аллохронных синтопных выборок (1986, 1987, 2015, 2016 гг.) сравниваемых видов (табл. 3) установлено, что межвидовые и межгодовые различия, а также взаимодействие факторов “вид (S) × год (Y)” статистически значимы. Доля межвидовой дисперсии составила 44.53% от общей, а межгодовой – 11.00%. На долю дисперсии взаимодействия факторов (S × Y) пришлось лишь 4.37%. Другими словами, взаимодействие факторов выражено относительно слабо, хотя и статистически значимо (p = 0.0002). Поэтому хронографическая изменчивость CS у сравниваемых видов действительно во многом согласуется по направлениям изменения значений.
Таблица 3.
Результаты двухфакторного дисперсионного анализа (Two-Way ANOVA) значений центроидных размеров (CS) нижней челюсти сеголеток рыжей полевки и малой лесной мыши из аллохронных синтопных выборок (1986, 1987, 2015, 2016 гг.) пойменного леса р. Сакмары (Оренбургская область, пос. Черный Отрог)
| Источник изменчивости (факторы) | Сумма квадратов (SS) | Число степеней свободы (d.f.) | Средний квадрат (MS) | F | Уровень значимости (p) |
|---|---|---|---|---|---|
| Вид (S) | 190 000 | 1 | 190 000 | 217.65 | <0.0001 |
| Год (Y) | 46 950 | 3 | 15 650 | 17.93 | <0.0001 |
| Взаимодействие (S × Y) | 18 650 | 3 | 6217 | 7.12 | 0.0002 |
| Внутригрупповая | 171 100 | 196 | 873 | ||
| Общая | 426 700 | 203 |
При наличии аллометрических зависимостей изменение формы может объясняться изменением размеров объекта. Для проверки аллометрического эффекта в соответствии с существующими рекомендациями [12] по каждой выборке провели оценку линейной регрессионной зависимости между центроидными размерами (CS) и значениями первой главной компоненты формы (PC1). На основе перестановочного теста (Permutation test) установлено, что в большинстве выборок регрессии статистически незначимы (p от 0.278 до 0.619). Лишь в одном случае в небольшой выборке самцов малой лесной мыши 1986 г. проявилась слабая зависимость (p = 0.047), которой, по-видимому, можно пренебречь. Поэтому следует принять, что аллометрия нижней челюсти у обоих видов не проявилась или выражена в минимальной степени, поэтому ее можно исключить из вероятных факторов, определяющих основные морфогенетические перестройки.
Хронографическую изменчивость формы нижней челюсти предварительно проанализировали отдельно для каждого вида по выборкам четырех лет с помощью канонического анализа прокрустовых координат. В итоге расчетов для каждого вида были получены матрицы обобщенных расстояний Махаланобиса (D2). В обоих случаях были выявлены сходные и во многом параллельные эффекты изменений формы мандибул во времени: относительно небольшие изменения выборок ближайших лет и существенные сдвиги между более разобщенными во времени. В этой связи представляло большой интерес оценить пропорциональность межгрупповых хронографических различий формы нижней челюсти у обоих видов по полученным матрицам парных обобщенных расстояний Махаланобиса (D2). Поскольку был проведен независимый анализ межгрупповых различий каждого вида, то матрицы расстояний Махаланобиса не содержат собственно межвидовые различия в строении мандибул, если бы такое сравнение проводили по всем выборкам обоих видов одновременно. При оценке корреляции обеих видовых матриц D2 методом Мантеля (Mantel test) выявили между ними значимую связь Rm = 0.47 (p = 0.019). Затем провели кластерный анализ (UPGMA) матриц дистанций D2 обоих видов в одном общем сравнении, т.е. заведомо исключая собственно межвидовые различия и анализируя только иерархию межвыборочных различий (рис. 4).
Рис. 4.
Результаты обобщающего кластерного анализа (UPGMA) двух матриц обобщенных расстояний Махаланобиса (D2) между аллохронными выборками из синтопных ценопопуляций рыжей полевки (C. glareolus) и малой лесной мыши (S. uralensis) по результатам двух независимых канонических анализов формы нижней челюсти этих видов.

В результате кластерного анализа выделились два крупных кластера, включающих выборки прошлого XX в. и настоящего XXI в., а в пределах каждого их них – субкластеры, соответствующие ближайшим смежным годам. В XX в. эти субкластеры соответствуют выборкам 1986 и 1987 гг., а в XXI в. – 2015 и 2016 гг. Примечательно, что выборки обоих видов оказались строго распределены парами в одноименных группах и субкластерах (см. рис. 4). Другими словами, структура кластера строго отобразила полный параллелизм межгрупповой изменчивости формы нижней челюсти сравниваемых симпатрических видов во времени.
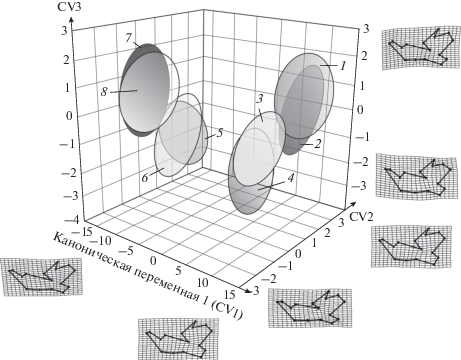
Для сравнения представим результаты канонического анализа прокрустовых координат, характеризующих изменчивость формы мандибул при включении полного набора из четырех выборок каждого вида, объединенных по полу, в общий анализ. На рис. 5 в общем морфопространстве представлены эллипсоиды изменчивости аллохронных синтопных ценопопуляций рыжей полевки и малой лесной мыши, каждый из которых характеризует 95% внутригрупповой дисперсии. Межгрупповая изменчивость вдоль всех трех канонических переменных оказалась статистически достоверной. На рисунке хорошо видно, что наибольшие различия проявились вдоль первой канонической переменной (CV1), на которую приходится 41.3% от общей межгрупповой дисперсии. Вдоль второй канонической оси (CV2), характеризующей 23.0% дисперсии, отчетливо проявились хронографические различия между выборками разных веков. На третью ось (CV3) пришелся эффект взаимодействия факторов “вид × год”, включающий 16.1% общей дисперсии и отражающий некоторую видовую специфику морфогенетической реакции на условия обитания разных видов в разных веках. Интересно отметить, что эллипсоиды изменчивости выборок ближайших смежных лет у каждого вида чрезвычайно близки друг к другу в морфопространстве. Таким образом, и в данном случае проявился параллелизм межгрупповой изменчивости, но дополнительно выявилось взаимодействие факторов, которое нельзя было обнаружить в предыдущем сравнении из-за исходного раздельного сравнения выборок разных видов.
Рис. 5.
Результаты канонического анализа прокрустовых координат, характеризующих изменчивость формы нижней челюсти в аллохронных синтопных ценопопуляциях рыжей полевки (1–4) и малой лесной мыши (5–8) в общем морфопространстве. Эллипсоиды изменчивости объединяют 95% особей, а их нумерация соответствует четырем годам: 1, 5 – 1986; 2, 6 – 1987; 3, 7 – 2015; 4, 8 – 2016. Конфигурации ландмарок в виде деформационных решеток соответствуют крайним (максимальным и минимальным) значениям вдоль трех канонических переменных.
Дальнейшее сравнение было основано на объединении выборок каждого вида по принадлежности к XX и XXI вв., позволяющее нивелировать частные межгодовые различия ближайших смежных лет и оценить величину хронографических изменений (протяженностью до 30 лет) формы мандибул у каждого вида. Результаты канонического анализа в данном варианте сравнения приведены в табл. 4. Вдоль всех осей и в данном случае выявлены значимые межгрупповые различия, однако на долю первых двух канонических переменных приходится большая часть общей дисперсии. Корректность установления принадлежности объектов к собственным выборкам при этом достаточно высока (94.6%), причем после перекрестной проверки с помощью кросс-валидационного теста методом джеккнайфинга (jackknife) она подтвердилась почти на том же уровне (89.2%).
Таблица 4.
Результаты канонического анализа прокрустовых координат, характеризующих изменчивость формы нижней челюсти рыжей полевки и малой лесной мыши в выборках из ценопопуляций пойменного леса р. Сакмары вблизи пос. Черный Отрог (Оренбургская обл.), объединенных по смежным годам в конце XX в. и начале XXI в.
| Выборка | Каноническая переменная | ||
|---|---|---|---|
| CV1 | CV2 | CV3 | |
| Центроиды выборок (± SE) | |||
| Рыжая полевка (1986–1987 гг.) | 1.544 ± 0.167 | 0.425 ± 0.199 | 0.361 ± 0.184 |
| Рыжая полевка (2015–2016 гг.) | 0.798 ± 0.148 | 0.234 ± 0.130 | –0.497 ± 0.150 |
| Малая лесная мышь (1986–1987 гг.) | –0.176 ± 0.154 | –1.045 ± 0.143 | –0.246 ± 0.149 |
| Малая лесная мышь (2015–2016 гг.) | –0.378 ± 0.135 | –0.807 ± 0.126 | 0.371 ± 0.150 |
| Итоги канонического анализа | |||
| Λ Уилкса (Wilks’ Λ) | 0.0930 | 0.2137 | 0.4322 |
| Собственные числа | 1.2981 | 1.0220 | 0.4692 |
| Каноническая корреляция | 0.75 | 0.71 | 0.57 |
| Доля дисперсии, % | 39.28 | 30.92 | 14.20 |
| Критерий χ2 | 533.22 | 346.41 | 188.34 |
| Число степеней свободы (d.f.) | 205 | 160 | 117 |
| Уровень значимости, p | <0.0001 | <0.0001 | 0.00003 |
На изменчивость вдоль первой оси (CV1), характеризующую межвидовые функциональные различия формы мандибул, пришлось 39%, а вдоль второй переменной (CV2), отражающей перестройку морфогенеза ценопопуляций за почти 30-летний отрезок времени, – почти 31% от всех межгрупповых различий (см. табл. 4). Вдоль третьей оси, как и в предыдущем варианте сравнения, проявилось взаимодействие факторов “вид × год (век)”, причем на нее приходится приблизительно 14% межгрупповой изменчивости. В данном варианте сравнения выборок, судя по величине и знакам координат центроидов, вдоль первых двух канонических осей (см. табл. 4) также проявляется параллелизм межгрупповых изменений формы нижней челюсти у обоих видов.
В дальнейшем варианте сравнения синтопных ценопопуляций двух видов мы подразделили объединенные аллохронные выборки каждого века по полу, т.е. провели аналогичный канонический анализ прокрустовых координат между 8 выборками. Половые различия по форме нижней челюсти во всех парах сравнений оказались статистически значимыми (p от 0.0006 до 0.008). Однако в объединенных выборках XX в. у обоих видов они были больше, чем в выборках XXI в. (у рыжей полевки D2 = 5.37 и 3.53, у малой лесной мыши D2 = 8.08 и 2.62). В наибольшей степени проявление полового диморфизма по конфигурации мандибул уменьшилось в XXI в. у мыши. При этом хронографические различия (по величине обобщенных расстояний Махаланобиса – D2) между объединенными выборками XX и XXI вв. у полевки и мыши в среднем в 2.5 раза превысили уровень половых различий (12.51 и 4.91).
Поскольку направленное и почти параллельное преобразование формы нижней челюсти у сравниваемых видов грызунов могло быть связано с новыми функциональными трофическими требованиями при климатических изменениях в регионе, необходимо было провести сравнение аллохронных выборок по значениям морфофункциональных мандибулярных индексов, косвенно характеризующих смену способов первичной механической обработки кормов и трофических предпочтений у грызунов.
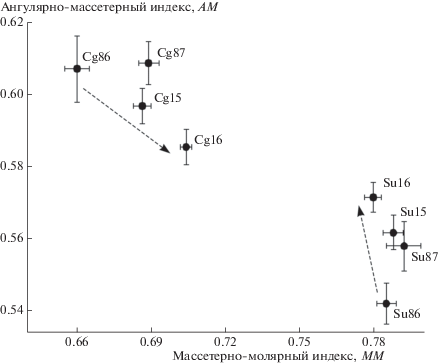
Средние величины соответствующих мандибулярных индексов у обоих видов приведены в табл. 5. Наиболее выражены межгрупповые различия по величинам массетерно-молярного (MM) и ангулярно-массетерного (AM) индексов. Из рис. 6 следует, что за последние 30 лет как у рыжей полевки, так и у малой лесной мыши существенно изменились пропорции нижней челюсти, отражая ее функциональные изменения и кормовые предпочтения [21, 22]. Если у рыжей полевки возросло значение массетерно-молярного индекса (MM), указывающее на усиление функции грызения, и немного уменьшилась величина ангулярно-массетерного индекса (AM), отражающего возможность поперечного перетирания кормовых объектов, то у малой лесной мыши, напротив, последний индекс значительно увеличился, а первый почти не изменился (на рисунке стрелками указаны направления изменения индексов во времени). Видно, что величины индексов постепенно сближаются от XX в. к XXI в., что можно определить как усиление свойств “муридизации” в строении нижней челюсти рыжей полевки и тенденцию к дополнению свойств грызения возможностью поперечного давящего перетирания корма у малой лесной мыши.
Таблица 5.
Значения морфофункциональных мандибулярных индексов с учетом их стандартных ошибок (± SE) в аллохронных синтопных выборках рыжей полевки и малой лесной мыши (Оренбургская область, пос. Черный Отрог, пойменный лес р. Сакмары)
| Год (экз.) | Морфофункциональные мандибулярные индексы | ||||
|---|---|---|---|---|---|
| TI ± SE | TM ± SE | MI ± SE | MM ± SE | AM ± SE | |
| Рыжая полевка | |||||
| 1986 (26) | 0.205 ± 0.004 | 0.262 ± 0.005 | 0.515 ± 0.004 | 0.660 ± 0.005 | 0.607 ± 0.009 |
| 1987 (22) | 0.212 ± 0.006 | 0.269 ± 0.007 | 0.542 ± 0.003 | 0.689 ± 0.004 | 0.609 ± 0.006 |
| 2015 (23) | 0.217 ± 0.004 | 0.280 ± 0.006 | 0.532 ± 0.003 | 0.687 ± 0.004 | 0.597 ± 0.005 |
| 2016 (34) | 0.213 ± 0.004 | 0.273 ± 0.004 | 0.550 ± 0.002 | 0.704 ± 0.002 | 0.585 ± 0.005 |
| Малая лесная мышь | |||||
| 1986 (18) | 0.171 ± 0.005 | 0.237 ± 0.007 | 0.567 ± 0.003 | 0.785 ± 0.004 | 0.542 ± 0.006 |
| 1987 (8) | 0.157 ± 0.006 | 0.220 ± 0.009 | 0.568 ± 0.006 | 0.792 ± 0.007 | 0.558 ± 0.007 |
| 2015 (28) | 0.160 ± 0.005 | 0.222 ± 0.007 | 0.569 ± 0.003 | 0.788 ± 0.004 | 0.562 ± 0.005 |
| 2016 (42) | 0.164 ± 0.004 | 0.229 ± 0.005 | 0.559 ± 0.003 | 0.780 ± 0.003 | 0.571 ± 0.004 |
Рис. 6.
Хронографические изменения средних значений (с учетом стандартных ошибок ± SE) массетерно-молярного (MM) и ангулярно-массетерного (AM) морфофункциональных мандибулярных индексов в аллохронных выборках (86 – 1986 г., 87 – 1987 г., 15 – 2015 г., 16 – 2016 г.) из ценопопуляций рыжей полевки (Cg) и малой лесной мыши (Su).
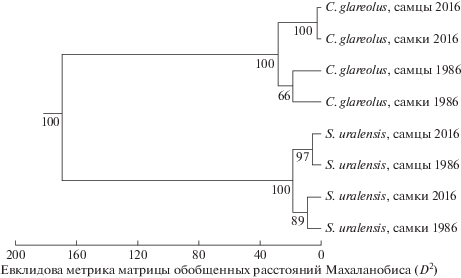
Между наиболее удаленными во времени выборками 1986 и 2016 гг. обоих видов (с учетом половой принадлежности) по величинам пяти мандибулярных индексов: TI, TM, MI, MM, AM – мы провели канонический анализ, а по полученной в итоге матрице D2 – кластерный (UPGMA) анализ (рис. 7). В результате расчета выделились два кластера, объединяющие видовые выборки, что неудивительно, поскольку пропорции нижней челюсти полевки и мыши априори значительно различаются. Однако если кластер, содержащий выборки рыжей полевки, четко подразделился на два субкластера 1986 и 2016 гг., объединяющих самцов и самок, соответствующих этим годам, то структура кластера выборок малой лесной мыши отличается. В этом случае субкластеры содержат выборки разных полов, относящихся не к одному и тому же, а к разным годам. Таким образом, у рыжей полевки в большей мере выражены хронографические морфофункциональные различия, а не половые. У малой лесной мыши, напротив, по мандибулярным индексам в большей степени проявился половой диморфизм, тогда как хронографические изменения выражены в меньшей степени.
Рис. 7.
Результаты кластерного анализа (UPGMA) матрицы обобщенных расстояний Махаланобиса (D2) на основе метрики евклидовой дистанции между крайними аллохронными выборками (1986, 2016 гг.) самцов и самок из синтопных ценопопуляций этих видов по итогам канонического анализа значений морфофункциональных мандибулярных индексов (TI, TM, MI, MM, AM).
В заключение рассмотрим изменение внутригруппового морфоразнообразия по показателю MNND у обоих видов по выборкам, объединяющим смежные годы в XX и XXI вв. Установлено, что как у рыжей полевки, так и у малой лесной мыши в XX в. уровень MNND был значимо выше, чем в XXI в. (табл. 6). Значение показателя R у обоих видов в XX в. превысило 1.0, причем по критерию Z эти отклонения были статистически достоверными, т.е. наблюдались эффекты сверхрассеивания (overdispersion) ординат. В соответствующих выборках XXI в. R был близок к 1.0, а по критерию Z эти эффекты были статистически незначимы, что указывает на случайный характер рассеивания ординат обоих видов.
Таблица 6.
Сравнение показателей внутригруппового морфоразнообразия (MNND) и его теоретически ожидаемой величины (ExpNND) с учетом стандартных ошибок (± SE) между объединенными выборками из синтопных ценопопуляций рыжей полевки (С. glareolus) и малой лесной мыши (S. uralensis) конца XX в. (1986–1987 гг.) и начала XXI в. (2015–2016 гг.) (Оренбургская область, пос. Черный Отрог, пойменный лес р. Сакмары)
| Выборка | MNND ± SE | ExpNND ± SE | R (N экз.) | Z | Уровень значимости, p |
|---|---|---|---|---|---|
| С. glareolus, XX в. | 0.379 ± 0.039 | 0.313 ± 0.022 | 1.21 (49) | 2.56 | 0.0105 |
| С. glareolus, XXI в. | 0.227 ± 0.027 | 0.216 ± 0.014 | 1.04 (56) | 0.52 | 0.6028 |
| S. uralensis, XX в. | 0.471 ± 0.049 | 0.344 ± 0.030 | 1.37 (29) | 3.43 | 0.0006 |
| S. uralensis, XXI в. | 0.234 ± 0.019 | 0.230 ± 0.014 | 1.02 (69) | 0.27 | 0.7892 |
ОБСУЖДЕНИЕ
Изменение климатического режима в направлении повышения среднегодовой температуры почти на 2.5°C, отмеченное нами для данного региона, могло привести к некоторому изменению состава и продуктивности растительности, а следовательно, прямо или косвенно отразиться на необходимых для грызунов трофических ресурсах, включая используемых при питании беспозвоночных животных, и наличии пригодных для них биотопов. Смена кормовой базы могла привести у рыжей полевки и малой лесной мыши к необходимости формирования за тридцатилетний период выявленных нами перестроек морфогенеза.
В нашем случае во втором десятилетии XXI в. численность и доля рыжей полевки в сообществе грызунов существенно снизилась и произошла смена вида-доминанта за счет малой лесной мыши, ранее бывшей видом-субдоминантом. Индекс разнообразия Шеннона (H) в сообществе грызунов значимо возрос – от 0.650 в XX в. до 0.880 в XXI в. (t = 4.31; p = 0.000021), индекс доминирования Симпсона (D) снизился (соответственно 0.624 и 0.449 (p < 0.001)), а индекс видового богатства Маргалефа (Mg) практически не изменился (0.362 и 0.327 (p = 0.999)).
Проведенный анализ показал, что у обоих видов имеется общая тенденция к проявлению полового диморфизма, состоящая в превышении размеров нижней челюсти у самок по сравнению с самцами. Индекс полового диморфизма (ISD) по размерам мандибул (CS) в выборках XXI в. у обоих видов кратно возрос. В то же время по форме нижней челюсти половые различия в выборках обоих видов от XX в. к XXI в., напротив, несколько уменьшились. У малой лесной мыши по форме мандибул половые различия на первом этапе сравнения в XX в. проявляются в большей степени, чем у рыжей полевки, но в XXI в. у мыши они стали выражены даже меньше, чем у полевки. Ранее нами было установлено [22, 30], что половые различия по форме нижней челюсти у рыжей полевки как вида-доминанта возрастают в неблагоприятные годы при общей низкой численности популяции, а также при относительно низкой численности других видов в сообществе грызунов.
Малая лесная мышь в XXI в. начинает выполнять в сообществе роль вида-доминанта. У нее возрастает численность, но параллельно несколько уменьшаются размеры (судя по CS) по сравнению с XX в., что косвенно указывает на угнетение роста, возможно, за счет некоторого ухудшения традиционных трофических условий. При этом у вида на фазе высокой численности теоретически возможно ожидать усиление конкурентных отношений с более крупными желтогорлой мышью и рыжей полевкой. Напомним, что у рыжей полевки, судя по величинам мандибулярных индексов, к XXI в. наблюдается усиление свойств муридизации конфигурации челюсти и соответственно морфофункциональных свойств, благодаря которым полевка может частично использовать в пищу ресурсы, характерные для мышей. Последнее особенно проявилось в увеличении индекса MM (см. рис. 6), т.е. усилении грызущей способности по отношению к кормовым объектам, как и у мыши. Конкурентным межвидовым отношениям грызунов в XXI в. может способствовать и почти полное исчезновение в пойменном лесу р. Сакмары насаждений дуба, желуди которого составляли в XX в. существенную часть кормовой базы для всех видов. Пойменный лес здесь испытал несколько пожаров в конце XX в. и начале XXI в., что привело к почти полному исчезновению дуба черешчатого (Quercus robur) и замещению его инвазионным видом – кленом американским (Acer negundo). Семена клена и желтой акации (Caragana arborescens), а также ягоды ежевики теперь в наибольшей степени используются доминирующими видами грызунов в качестве сезонных кормов. Можно поэтому предположить, что как у рыжей полевки, так и у малой лесной мыши для снижения возможной, в том числе внутривидовой, конкуренции, вызванной ограничением традиционных пищевых ресурсов, произошла перестройка морфогенеза мандибул, что усилило морфофункциональные возможности нижней челюсти за счет изменений ее формы.
Ранее в работе П. Андерсона с соавт. [21] была экспериментально доказана возможность быстрой морфофункциональной перестройки нижней челюсти грызунов при длительном питании молодых зверьков твердым или мягким кормом. Поэтому сравнительно быстрое модификационное переключение программы морфогенеза мандибул, а затем фиксация этого отбором в последующих поколениях вполне вероятны.
В последние годы показана возможность быстрых микроэволюционных изменений, происходящих за исторические, а не геологические отрезки времени, в основе которых могут лежать стресс-индуцированные эпигенетические перестройки (изменение профиля метилирования ДНК, перемещение мобильных элементов генома и др.), которые тесно связаны с определенными изменениями морфогенеза и способны длительное время трансгенерационно наследоваться [5, 31–33]. Поэтому в качестве основы наблюдаемых быстрых морфогенетических перестроек можно предполагать эффекты эпигенетических изменений, фиксируемых в дальнейшем отбором.
Изменение соотношения видов в направлении полного доминирования малой лесной мыши и снижения доли и численности рыжей полевки косвенно указывают на усиление процесса аридизации и ксерофитизации местообитаний обоих видов. Условия становятся более пригодными для мышей, чем для полевок. Тем не менее, согласно полученным нами данным, в конце XX в. у обоих видов, судя по относительно высоким показателям MNND и проявившимся эффектам неслучайного и значимого сверхрассеивания ординат, наблюдали стрессирование морфогенеза и проявление признаков нестабильности процесса развития. У малой лесной мыши уровень нестабильности развития в этот период выражен сильнее, чем у рыжей полевки, поскольку только у нее достоверно выше значение MNND по сравнению с теоретически ожидаемой величиной ExpNND (t = 2.24; p = 0.027). Напротив, в ценопопуляциях обоих видов от XX в. к XXI в. произошло значимое снижение внутригруппового морфоразнообразия (MNND), а внутригрупповое рассеивание ординат приобрело случайный характер. Последнее указывает на снижение стрессированности морфогенеза и проявление в ценопопуляциях мыши и полевки признаков стабильности развития.
Размах изменений морфогенеза, выявленных при сравнении объединенных выборок, собранных в конце XX в. и втором десятилетии XXI в., достаточно велик, и хронографическая межгрупповая дисперсия формы мандибул почти сопоставима по величине с межвидовой (см. табл. 4). Все это указывает на существенную перестройку морфогенеза у видов за данный исторический отрезок времени. У рыжей полевки хронографические изменения выражены несколько больше, чем у малой лесной мыши, для которой новые экологические условия, сложившиеся во втором десятилетии XXI в., по-видимому, более благоприятны, чем те, которые наблюдались в данном локалитете в XX в. У мыши и морфофункциональные изменения мандибул выражены в меньшей степени. Тем не менее за счет морфофункциональных мандибулярных различий между самцами и самками (см. рис. 7) у мыши имеется возможность расширить спектр трофических ресурсов, так как представители разных полов выступают как своеобразные инструментальные морфы, способные по-разному осуществлять первичную обработку кормовых объектов, используя костно-мышечную систему нижней челюсти в качестве “инструмента”. У рыжей полевки, судя по изменению морфофункциональных индексов, произошли общие для самок и самцов перестройки конфигураций нижней челюсти, расширяющие их трофические возможности (см. рис. 6).
Особый интерес представляют результаты кластерного сопоставления независимо полученных для каждого вида матриц обобщенных расстояний Махаланобиса (D2). Установлена высокая конгруэнтность морфогенетических перестроек в ценопопуляциях мыши и полевки на изученном историческом отрезке времени от конца XX в. до второго десятилетия XXI в. В изменениях формы нижней челюсти наблюдается почти полный параллелизм, что указывает на высокий положительный коэволюционный потенциал этих видов [9]. Из кластерного анализа следует, что неизбежная межвидовая конкуренция в данном случае снижена до минимума, поскольку, как уже отмечалось, после параллельных морфогенетических перестроек в выборках XXI в. в ценопопуляциях обоих видов проявились явные признаки стабильности развития.
В XXI в. при определенной многолетней стабилизации климатических показателей на определенном новом уровне (см. рис. 3), вероятно, в ценопопуляциях рыжей полевки и малой лесной мыши произошла фиксация адаптивных морфофункциональных мандибулярных перестроек, минимизирующих возможные конкурентные отношения как внутри видов (проявление полового диморфизма по размерам мандибул, изменения формы и пропорций мандибул, связанные с их функциональными возможностями), так и между видами (см. табл. 4). Поэтому, несмотря на климатогенное и антропогенное (пожары, рекреация, вырубка леса, появление лесного охотничьего заказника) изменение среды обитания, наблюдается высокая степень адаптированности и коадаптированности обоих видов в изменившихся условиях среды XXI в.
ЗАКЛЮЧЕНИЕ
В итоге проведенного исследования получено подтверждение возможности быстрых перестроек морфогенеза у симпатрических видов грызунов за исторический период времени продолжительностью 30 лет. На фоне климатических изменений, главным образом среднегодовой температуры и связанной с этим трансформации растительного покрова и его продуктивности, изменилась среда обитания модельных видов. Установлено, что у обоих видов-кодоминантов – рыжей полевки и малой лесной мыши – произошли почти параллельные перестройки формы нижней челюсти, т.е. морфоструктуры, которая играет существенную инструментальную и функциональную роль в трофическом обеспечении животных. Тем не менее видоспецифичное изменение величин морфофункциональных мандибулярных индексов связано с некоторым сближением их значений у обоих видов, что позволяет такой процесс у рыжей полевки определить как муридизацию строения мандибул. Возможно, это позволяет рыжей полевке несколько расширить спектр используемых трофических ресурсов и способов обработки кормовых объектов. Быстрые перестройки морфогенеза, обеспечившие почти параллельное изменение структуры и формы мандибул у сравниваемых видов за исторически относительно короткий период времени – 30 лет, отражают их высокий положительный коэволюционный потенциал [9]. За эти годы сменились около 90 поколений грызунов, т.е., вероятно, достаточное число для исторической фиксации морфогенетических перестроек.
Таким образом, предложенный нами эколого-морфологический подход к изучению многолетних коллекционных материалов с использованием методов геометрической морфометрии позволяет выявить перестройки морфогенеза и связанные с ними морфофункциональные изменения в ценопопуляциях модельных симпатрических видов за относительно короткие исторические периоды, а также оценить стабильность развития и эволюционно-экологическое состояние ценопопуляций в разные годы. Представляется, что данный подход может быть перспективен для осуществления регионального экологического мониторинга популяций и сообществ.
Работа по изучению закономерностей хронографической изменчивости грызунов выполнена в рамках государственного задания Института экологии растений и животных УрО РАН (АААА-А19-119031890087-7). Влияние на изменчивость климатических изменений изучено при поддержке Комплексной программы фундаментальных исследований Уральского отделения РАН (проект № 18-4-4-28).
Авторы благодарят к.б.н. Е.Ю. Захарову, к.б.н. А.О. Шкурихина, к.б.н. Т.С. Ослину и Ю.М. Чибиряка за неоценимую помощь в сборе и камеральной обработке материала.
Список литературы
Шварц С.С., Смирнов В.С., Добринский Л.Н. Метод морфофизиологических индикаторов в экологии наземных позвоночных. Свердловск: УФАН СССР, 1968. 387 с.
Hendry A.P., Kinnison M.T. Perspective: the pace of modern life: measuring rates of contemporary microevolution // Evolution. 1999. V. 53. P. 1637–1653.
Parmesan C. Ecological and evolutionary responses to recent climate change // The Annual Review of Ecology, Evolution, and Systematics. 2006. V. 37. P. 637–669.
Cavender-Bares J., Kozak K.H., Fine P.V.A., Kembel S.W. The merging of community ecology and phylogenetic biology // Ecology Letters. 2009. V. 12. P. 693–715.
Bonduriansky R., Crean A.J., Day T. The implications of nongenetic inheritance for evolution in changing environments // Evol. Appl. 2012. V. 5. P. 192–201.
Thompson J.N. Rapid evolution as an ecological process // Trends Ecol. and Evol. 1998. V. 13. P. 329–332.
Adams D.C., West M.E., Collyer M.L. Location-specific sympatric morphological divergence as a possible response to species interactions in West Virginia Plethodon salamander communities // J. of Animal Ecology. 2007. V. 76. P. 289–295.
Vasil’ev A.G., Vasil’eva I.A., Kourova T.P. Analysis of coupled geographic variation of three shrew species from Southern and Northern Ural taxocenes // Rus. J. of Ecology. 2015. V. 46. № 6. P. 552–558.
Большаков В.Н., Васильев А.Г., Васильева И.А. и др. Сопряженная биотопическая изменчивость ценопопуляций симпатрических видов грызунов на Южном Урале // Экология. 2015. № 4. С. 265–271. [Bol’shakov V.N., Vasil’ev A.G., Vasil’eva I.A. et al. Coupled biotopic variation in populations of sympatric rodent species in the Southern Urals // Rus. J. of Ecology. 2015. V. 46. № 4. P. 339–344.]
Васильев А.Г., Большаков В.Н., Васильева И.А. и др. Соотношение хронографической и географической изменчивости морфофункциональных признаков рыжей полевки (Clethrionomys glareolus Shreb.) на юге ареала // Экология. 2019. № 4. С. 286–296. [Vasil’ev A.G., Bol’shakov V.N., Vasil’eva I.A. et al. The ratio between chronographic and geographic variation in the morphofunctional features of Bank Vole (Clethrionomys glareolus Shreb.) in the south of its range // Rus. J. of Ecology. 2019. V. 50. № 4. P. 361–371.]
Rohlf F.J., Slice D. Extension of the Procrustes method for the optimal superimposition of landmarks // Syst. Zoology. 1990. V. 39. № 1. P. 40–59.
Zelditch M.L., Swiderski D.L., Sheets H.D., Fink W.L. Geometric morphometrics for biologists: a primer. New York and London: Elsevier Acad. Press, 2004. 443 p.
Васильев А.Г., Васильева И.А., Шкурихин А.О. Геометрическая морфометрия: от теории к практике. М.: Тов-во научн. изд. КМК, 2018. 471 с.
Sheets H.D., Zelditch M.L. Studying ontogenetic trajectories using resampling methods and landmark data // Histrix. The Italian J. of Mammalogy. 2013. V. 24. № 1. P. 67–73.
Drake A.G., Klingenberg C.P. Large-scale diversification of skull shape in domestic dogs: disparity and modularity // Amer. Nat. 2010. V. 175. P. 289–301.
Fontaneto D., Panisi M., Mandrioli M. et al. Estimating the magnitude of morphoscapes: how to measure the morphological component of biodiversity in relation to habitats using geometric morphometrics // Sci. Nat. 2017. V. 104. № 55. P.1–11.https://doi.org/10.1007/s00114-017-1475-3
Tischler W. Grundzüge der terrestrischenTierökologie. Braunschweig: Friedrich Vieweg und Sohn, 1949. 220 S.
Klingenberg C.P. MorphoJ: an integrated software package for geometric morphometrics // Mol. Ecol. Resour. 2011. V. 11. P. 353–357.
Rohlf F.J. TpsUtil, file utility program, version 1.60. Department of Ecology and Evolution, State University of New York at Stony Brook, 2013a (program). URL: http://life.bio.sunysb.edu/morph/.
Rohlf F.J. TpsDig2, digitize landmarks and outlines, version 2.17. Department of Ecology and Evolution, State University of New York at Stony Brook, 2013b (program). URL: http://life.bio.sunysb.edu/morph/.
Anderson P.S.L., Renaud S., Rayfield E.J. Adaptive plasticity in the mouse mandible // BMC Evolutionary Biology. 2014. V. 14. № 85. P. 2–9. https://doi.org/10.1186/1471-2148-14-85
Васильев А.Г., Большаков В.Н., Евдокимов Н.Г., Синева Н.В. Морфоразнообразие моно- и полиморфных популяций обыкновенной слепушонки: реализуется ли “принцип компенсации” Ю.И. Чернова внутри популяции? // Докл. РАН. 2016. Т. 468. № 1. С. 118–121. [Vasil’ev A.G., Bolshakov V.N., Evdokimov N.G., Sineva N.V. Morphological diversity of mole vole mono- and polymorphic populations: Does Chernov’s “compensation principle” work within a population? // Dokl. Biol. Sci. 2016. V. 468. P. 118–121.]
Fruciano C. Measurement error in geometric morphometrics // Develop., Genes and Evol. 2016. V. 3. P. 139–158.
Lovich J.E., Gibbons J.W. A review of techniques for quantifying sexual size dimorphism // Growth, Development and Aging. 1992. V. 56. P. 269–281.
Дэвис Д.С. Статистический анализ данных в геологии. Кн. 2. М.: Недра, 1990. 427 с.
Hammer Ø. New methods for the statistical analysis of point alignments // Computers and Geosciences. 2009. V. 35. P. 659–666.
Donnelly K.P. Simulations to determine the variance and edge effect of total nearest neighbor distance // Simulation studies to archeology / Ed. by Hodder I. Cambridge: Cambridge Univ. Press, 1978. P. 91–95.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological Statistics Software Package for Education and Data Analysis // Palaeontologia Electronica. 2001. V. 4. № 1. 9 p.
Cohen J. A power primer // Psychological Bull. 1992. V. 112. № 1. P. 155–159. https://doi.org/10.1037/0033-2909.112.1.155
Васильев А.Г., Васильева И.А., Городилова Ю.В., Добринский Н.Л. Принцип компенсации Ю.И. Чернова и влияние полноты состава сообщества грызунов на изменчивость популяции рыжей полевки (Clethrionomys glareolus) на Среднем Урале // Экология. 2017. № 2. С. 116–125. [Vasil’ev A.G., Vasil’eva I.A., Gorodilova Yu.V., Dobrinskii N.L. Chernov’s compensation principle and the effect of rodent community completeness on the variability of Bank Vole (Clethrionomys glareolus) population in the Middle Urals // Rus. J. of Ecology. 2017. V. 48. № 2. P. 161–169.]
Jablonka E., Raz G. Transgenerational epigenetic inheritance: prevalence, mechanisms, and implications for the study of heredity and evolution // Qvart. Rev. Biol. 2009. V. 84. P. 131–176.
Duncan E.J., Gluckman P.D., Dearden P.K. Epigenetics, plasticity and evolution: How do we link epigenetic change to phenotype? // J. Exp. Zool. Part B. Molecular and Developmental Evolution. 2014. V. 322B. P. 208–220.
Васильев А.Г., Большаков В.Н., Васильева И.А., Синева Н.В. Последствия интродукции ондатры в Западной Сибири: морфофункциональный аспект // Российский журн. биол. инвазий. 2016. № 4. С. 2–13. [Vasil’ev A.G., Bol’shakov V.N., Vasil’eva I.A., Sineva N.V. Aftereffects of Muskrat introduction in Western Siberia: morphological and functional aspects// Rus. J. of Biological Invasions. 2017. V. 8. № 1. P. 1–9.]
Дополнительные материалы отсутствуют.


