Экология, 2020, № 5, стр. 377-385
Пространственное распределение олигохет (Annelida: Clitellata: Oligochaeta) в озерах Нарочанской системы (Беларусь) с разным трофическим статусом
М. А. Батурина a, *, О. А. Макаревич b, Т. В. Жукова b, Б. В. Адамович b
a Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
b Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Беларусь
* E-mail: baturina@ib.komisc.ru
Поступила в редакцию 01.10.2019
После доработки 06.12.2019
Принята к публикации 11.12.2019
Аннотация
Приведены сведения о видовом разнообразии олигохет в трех озерах Нарочанской системы (Беларусь), имеющих разный трофический статус. Дана характеристика пространственного распределения червей. Показано, что независимо от трофического статуса озера численность и биомасса олигохет уменьшаются к зоне профундали, снижается их видовое разнообразие. Наиболее разнообразный состав видов установлен в литорали олиго-мезотрофного озера. Выявлена приуроченность доминирующих видов подсем. Tubificinae к определенным типам биотопов в озерах.
Особенности пространственного распределения видов зависят от географических и экологических факторов среды, биологических характеристик видов и их возможностей [1]. К естественным абиотическим факторам, оказывающим влияние на разнообразие и распределение беспозвоночных в бентали, относят морфометрические характеристики водоема: размер, глубину и тип грунта [2–5], а также распределение органического вещества, составляющего доступный кормовой ресурс [6].
Олигохеты являются одной из самых обильных и разнообразных групп в донных сообществах различных типов водоемов [7–9]. Биомасса этих организмов – важное звено в трофической сети, так как они представляют собой пищу для рыб и беспозвоночных [10]. Их низкая мобильность, длительный жизненный цикл и зависимость от субстрата определяют влияние на них условий окружающей среды, в основном донных отложений [11]. В связи с этим олигохет считают наиболее информативной группой при исследовании загрязнения водоемов [12]. Изменения в структуре их сообществ дают информацию о трофической изменчивости среды в течение длительного времени [13].
Массив данных [14, 15 и др.] по гидрологии, морфологии, биологии озер Нарочанской группы (Нарочь, Мястро и Баторино) делает их подходящими для сравнительного изучения распределения видов олигохет в контрастных трофических условиях. На этих озерах ведется многолетний гидробиологический мониторинг, в задачи которого входит также оценка динамики количественных показателей развития макрозообентоса [15]. Первый обзор фауны олигохет озер Беларуси был проведен Н.Л. Сокольской [16] в 1947–1948 гг. Для восьми озер было указано 38 видов олигохет, из них 24 вида непосредственно в оз. Нарочь. Позднее Н.П. Финогеновой в 1972 г. и С.И. Гавриловым в 1978 г. были расширены видовые списки олигохет для озер Нарочь, Мястро и Баторино. Для ряда озер авторами отмечались особенности вертикального распределения олигохет: проникновение в глубоководные зоны большого числа видов, а по сравнению с рядом озер Среднерусской равнины – более низкие показатели биомассы червей [14].
Цель нашей работы – оценить состав, богатство и обилие олигохет как одной из доминирующих групп зообентоса в водоемах разного трофического статуса и по многолетним данным выявить закономерности пространственного распределения червей в этих водоемах.
МАТЕРИАЛ И МЕТОДЫ
Изучение бентосных сообществ Нарочанских озер началось в 1947 г., но только с 1997 г. по настоящее время наблюдение за макрозообентосом озер Нарочь (54°51′18.24″ с.ш.; 26°46′1.03″ в.д.), Мястро (54°52′0.91″ с.ш.; 26°52′49.86″ в.д.) и Баторино (54°50′47.94″ с.ш.; 26°58′3.36″ в.д.) проводится регулярно (2–4 раза в год) по единой схеме [15, 17]. В отдельные годы программа расширяется за счет отбора дополнительных проб в различных биотопах прибрежной и глубинной частей озер. Олигохет выбирали непосредственно из проб макрозообентоса. Собранный материал фиксировали 4%-ным формальдегидом. Анализ образцов проводили в лабораторных условиях с использованием стереомикроскопа Микромед МС-4 ZOOM LED и микроскопа МИКМЕД-6 в глицериновых препаратах. Видовую принадлежность олигохет определяли в соответствии с работами [18, 19]. Часть материала осталась неопределенной до видового статуса, включая таксоны сем. Enchytraeidae и ювенильные особи Tubificinae. Эти особи были учтены при расчете средней численности и биомассы олигохет, но исключались из расчета индексов разнообразия, основанных на видовом составе группы. Также различными методами (гидробиологический скребок, смывы с плотных грунтов и растений) были проведены специальные фаунистические сборы в литоральной зоне озера Нарочь в 2018 г. При этом выявленные мейобентические виды олигохет не были включены в количественный анализ.
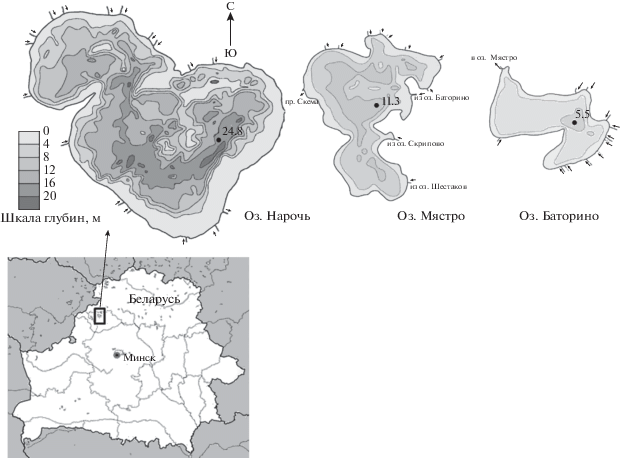
Все озера (рис. 1 ) различаются по морфологическим (глубине, площади акватории), физическим и химическим параметрам [14]. Для характеристики трофического статуса водоемов был использован индекс Карлсона (TSI) [20]. В период с 1997 г. по 2018 г. трофический статус озер не изменялся и был определен следующим образом: Нарочь – олиго-мезотрофное, Мястро – мезотрофное, Баторино – эвтрофное [20–22]. Наибольшие глубины отмечались в профундальных зонах озер (5.5–20.0 м) в отличие от литоральных, более мелководных (0.1–2.0 м) зон. Максимальные глубины (около 25.0 м) зафиксированы в оз. Нарочь. В каждом озере биотопы выделяли на основании анализа глубины и типа грунта (табл. 1).
Таблица 1.
Характеристика биотопов в озерах Нарочанской группы
| Характеристики | Литораль | Сублитораль | Профундаль | |
|---|---|---|---|---|
| Оз. Нарочь | l_N | sbl_N_1 | sbl_N_2 | pr_N |
| Глубина, м | 0.1–2.0 | 2.1–8.0 | 2.1–8.0 | 8.1–25.0 и более |
| Грунт | Песок (светлый) заилен (слабо) |
Ил (светлый) | Песок (светлый) заилен (слабо), глина (редко) |
Ил (темно-оливковый) |
| S дна, % | 13.6 | 31.6 | 54.81 | |
| Макрофиты | Харовые водоросли (редко) | Харовые водоросли (плотно), элодея, роголистник (редко) | Харовые водоросли (редко) | Нет |
| Оз. Мястро | l_M | sbl_M | pr_M | |
| Глубина, м | 0.1–2.0 | 2.1–4.0 | 4.1–11.0 и более |
|
| Грунт | Песок (светлый) заилен (средне) |
Ил (темный), ракушечник | Ил (темно-оливковый) |
|
| S дна, % | 15.02 | 15.79 | 69.18 | |
| Макрофиты | Рдесты, элодея, нитчатка, лютик, харовые водоросли (редко) | Элодея, роголистник (редко) | Нет | |
| Оз. Баторино | l_B | sbl_B | pr_B | |
| Глубина, м | 0.1–1.0 | 1.1–2.0 | 2.1–5.0 и более |
|
| Грунт | Песок (серый) заилен (сильно), детрит |
Ил (темный), детрит, торф | Ил (темно-оливковый), торф | |
| S дна, % | 14.44 | 16.41 | 69.15 | |
| Макрофиты | Харовые водоросли (редко) | Рдесты (редко) |
Нет | |
Для количественной характеристики сообщества Oligochaeta в исследованных озерах и разных биотопах рассчитывали частоту встречаемости, общую и среднюю численность в целом для группы и для каждого вида, общую и среднюю биомассу [23]; индекс доминантности по биотопам (D, %) для оценки значимости отдельных видов олигохет в биоценозе и выделения олигохетных комплексов [24, 25]; индекс приуроченности видов Fij для оценки избирательности вида при выборе им местообитаний [26, 27]. В качестве меры биологического разнообразия сообществ (альфа-разнообразия) использовали общепринятые показатели: видовую плотность, индекс разнообразия Шеннона (HN), рассчитанный на основании численности видов, индекс Cимпсона (DS), индекс видового богатства Маргалефа (d), индекс общности фаун Жаккара (IJ) и Чекановского-Съеренсена (только для количественных проб) [26]. Статистическая обработка и визуализация данных проведены с использованием программной среды R (https://www.R-project.org/) и Statistica 6.0 для Windows (StatSoft). Для выполнения кластерного анализа применяли метод Варда, в качестве меры различия между кластерами использовали Eвклидово расстояние. Дендрограммы построены на первичных показателях обилия и видового состава.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Количественные показатели развития олигохет
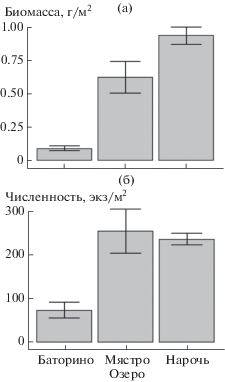
В составе донных сообществ Нарочанских озер малощетинковые черви играют заметную роль. С момента начала регулярных мониторинговых наблюдений в 1997 г. [17, 28] олигохеты встречены более чем в 50% гидробиологических проб. В общей численности бентоса их доля составляла до 35.9%, в биомассе – до 15.8%. Наибольшие средние значения численности и биомассы олигохет (рис. 2) отмечали в мезотрофном оз. Мястро и олиго-мезотрофном оз. Нарочь, наименьшие показатели количественного развития малощетинковых червей характерны для эвтрофного оз. Баторино.
Статистически значимое увеличение показателей количественного развития олигохет на фоне снижения значений индекса TSI, концентрации биогенных элементов и изменения ряда гидроэкологических показателей озер (прозрачность воды, концентрация азота, фосфора и углерода, содержание взвешенного вещества, концентрация хлорофилла, БПК5, электропроводность) было установлено [28] в ряду Баторино (эвтрофное, TSI 56.89 ± 2.71) – Мястро (мезотрофное, TSI 40.74 ± 1.24) – Нарочь (олиго-мезотрофное, TSI 32.36 ± 1.35). Выявленная нами зависимость между трофическим статусом водоема, разнообразием и биомассой олигохет подтверждается литературными данными [9], согласно которым мезотрофные водоемы указываются как наиболее благоприятные для развития червей в сравнении с эвтрофными за счет лучшего кислородного режима.
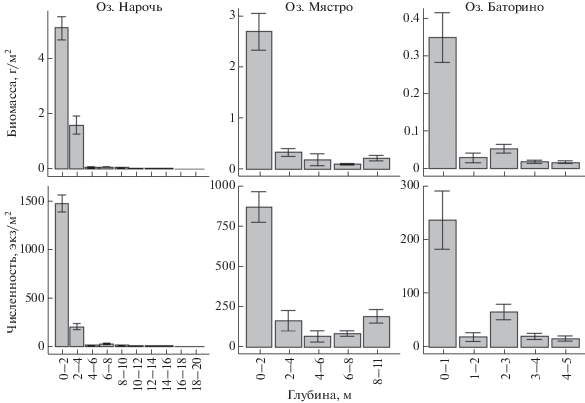
Анализ распределения количественных показателей развития червей по акватории озер показал, что наибольшие численность и биомасса олигохет отмечены в оз. Баторино на глубине до 1 м, в оз. Мястро – до 2 м и оз. Нарочь – до 4 м (рис. 3 ). С увеличением глубины количество и биомасса олигохет статистически значимо снижались. Отмечено [17], что в оз. Баторино до глубины 1.5 м высшая водная растительность покрывает 19.6% общей площади дна, в оз. Нарочь нижняя граница распространения макрофитов – 7 м (около 42.0% общей площади дна), а в оз. Мястро из-за более низкой прозрачности воды растительность распространена до глубины 4–5 м, покрывая более 30.0% дна. Условия, складывающиеся в зоне развития водной растительности, наиболее благоприятны для большинства таксонов водных беспозвоночных, включая олигохет, среди которых отмечаются виды с разнообразными экологическими предпочтениями [11, 29]. Глубина водоема также оказывает значительное влияние на биомассу беспозвоночных, в том числе олигохет [30, 31]. Относительно высокие показатели биомассы червей в профундальной зоне при относительно низкой их численности часто связывают с преобладанием на заиленных грунтах глубоководных биотопов крупных особей тубифицид [9]. Однако в наших исследованиях в составе макрозообентоса на долю подсем. Tubificinae во всех зонах приходилось от 75 до 100% численности всех олигохет, поэтому снижение общей численности червей от литоральной к профундальной зоне (см. рис. 3 ), вероятно, объясняет в целом снижение биомассы олигохет в зоне профундали всех озер независимо от их трофического статуса.
Видовой состав олигохет
Общий состав фауны Oligochaeta озер Нарочанской системы, включая литературные [14, 16] и наши данные, представлен 48 видами и формами выше видового ранга, 33 из них отмечены в современных сборах (1997–2018 гг.). Более 30% всей современной фауны приходится на долю подсем. Tubificinae. С 1997 г. только 5 видов (15.6% всей фауны червей) с разной частотой встречаемости в пробах отмечены во всех трех озерах: Limnodrilus hoffmeisteri Claparède, 1862, L. udekemianus Claparède, 1862, Potamothrix hammoniensis (Michaelsen, 1901), Psammoryctides barbatus (Grube, 1861), Lumbriculus variegatus (Müller, 1774). Ранее [14, 16] доля общих видов, включая мейобентосные, между озерами составляла 47%.
В период 1997–2018 гг. в олиго-мезотрофном оз. Нарочь по результатам количественных и качественных сборов установлено 27 видов и форм олигохет. Только здесь нами встречены Lophochaeta ignota (Štolc, 1886), Spirosperma ferox Eisen, 1879, Rhynchelmis limosella Hoffmeister, 1843, Uncinais uncinata (Ørsted, 1842). В ранних исследованиях [14, 16] для озера указывали 39 видов (сходство фаун между периодами составило около 70%).
В мезотрофном оз. Мястро в современных гидробиологических сборах бентоса отмечено 11 видов. Только здесь единично встречены Potamothrix bedoti (Piguet, 1913), Dero digitata (Müller, 1774), Tubifex newaensis (Michaelsen, 1903). Ранее [14] для озера указывали 32 вида за счет высокого разнообразия мейобентосных форм олигохет, не учитывающихся при количественных методах мониторинговых наблюдений в современных исследованиях.
В эвтрофном оз. Баторино в состав современной фауны входит 10 видов, из них L. claparedeanus Ratzel, 1868, L. profundicola (Verrill, 1871), Isochaetides michaelseni (Lastočkin, 1936) обнаружены нами только здесь. Ранее [14] для озера указывали 25 видов, более 60% из которых приходилось на долю мейобентосных видов.
Сходство современного видового состава олигохет, встреченных в пробах макрозообентоса, составило 60% между всеми тремя озерами.
Пространственное распределение видов олигохет
В олиго-мезотрофном оз. Нарочь ранее [14, 16] было описано неравномерное распределение видов по акватории озера: преобладание наидид в литоральной зоне и смена их тубифицидами с глубиной. Как преобладающие виды указывались L. udekemianus, Psammoryctides albicola (Michaelsen, 1901), L. variegatus. В период современных исследований доминирующий комплекс видов (табл. 2) составляли P. аlbicola (35% общей численности олигохет), L. variegatus (19%) и P. barbatus (17%). В целом по озеру состав доминирующих видов был сходен в зонах литорали (l_N) и сублиторали (sbl_N_1, sbl_N_2) и резко отличался от илистых грунтов профундальной зоны (pr_N). Из всех исследованных озер Нарочь характеризовалось наибольшим значением индекса видового разнообразия олигохет (НN = 0.98 ± 0.1), который уменьшался от литоральной к профундальной зоне одновременно со снижением числа видов (см. табл. 2) и видовой плотности (от 4.5 ± 0.4 в литорали до 1.3 ± 0.3 в профундали).
Таблица 2.
Число видов (n) в количественных пробах, доминирующие виды (D) и показатели разнообразия: индекс Шеннона (HN), индекс видового богатства Маргалефа (d), индекс доминирования Cимпсона (DS) для сообщества олигохет в озерах Нарочанской группы
| Оз. Нарочь | l_N | sbl_N_1 | sbl_N_2 | pr_N |
|---|---|---|---|---|
| n | 14 | 3 | 7 | 2 |
| D | L. variegatus P. albicola L. hoffmeisteri P. barbatus S. ferox |
P. albicola L. variegatus L. hoffmeisteri |
L. variegatus L. udekemianus L. hoffmeisteri P. albicola |
L. hoffmeisteri P. hammoniensis |
| HN, бит/экз. | 1.29 ± 0.1 | 0.35 ± 0.1 | 0.51 ± 0.2 | 0.25 ± 0.25 |
| d | 0.9 ± 0.1 | 0.31 ± 0.1 | 0.39 ± 0.04 | 0.36 ± 0.36 |
| DS | 0.5 ± 0.03 | 0.83 ± 0.06 | 1.0 ± 0.1 | 0.88 ± 0.1 |
| Оз. Мястро | l_M | sbl_M | pr_M | |
| n | 8 | 6 | 6 | |
| D | L. hoffmeisteri P. barbatus P. hammoniensis L. udekemianus |
L. hoffmeisteri T. tubifex |
P. hammoniensis | |
| HN, бит/экз. | 1.09 ± 0.2 | – | 0.50 ± 0.2 | |
| d | 0.69 ± 0.1 | – | 0.41 ± 0.2 | |
| DS | 0.69 ± 0.1 | 1 | 0.78 ± 0.07 | |
| Оз. Баторино | l_B | sbl_B | pr_B | |
| n | 10 | 1 | 2 | |
| D | L. hoffmeisteri | P. hammoniensis | P. hammoniensis | |
| HN, бит/экз. | 0.72 ± 0.2 | – | 0.16 ± 0.1 | |
| d | 0.59 ± 0.15 | – | 0.07 ± 0.07 | |
| DS | 0.64 ± 0.08 | 1 | 0.92 ± 0.08 | |
Оценка степени приуроченности доминирующих видов олигохет к биотопам (табл. 3), основанная на доле вида в структуре сообществ, показала высокую положительную приуроченность к биотопам литоральной зоны P. barbatus. Также только здесь был встречен S. ferox. Виды L. udekemianus и P. albicola показали связь с сублиторальной зоной озера, однако предпочитали разные типы грунта: если L. udekemianus отдавал предпочтение песчаным грунтам (sbl_N_2), то P. albicola выбирал тонкодетритные илы (sbl_N_1). Для P. hammoniensis наибольшее значение индекса приуроченности отмечено в профундали озера.
Таблица 3.
Степень приуроченности (Fij) доминирующих видов Oligochaeta к различным биотопам
| Вид | Оз. Нарочь | Оз. Мястро | Оз. Баторино | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| l_N | sbl_N_1 | sbl_N_2 | pr_N | l_M | sbl_M | pr_M | l_B | sbl_B | pr_B | |
| L. hoffmeisteri | 0.2 | –0.2 | 0.1 | 0.4 | 0.6 | 0.03 | –1.0 | –0.2 | 0.7 | –1.0 |
| L. udekemianus | 0.5 | –1.0 | 0.8 | –1.0 | 1.0 | –1.0 | –1.0 | 1.0 | –1.0 | –1.0 |
| L. variegatus | 0.01 | 0.0 | 0.3 | –1.0 | –0.6 | 0.9 | –1.0 | 1.0 | –1.0 | –1.0 |
| P. hammoniensis | –1.0 | –1.0 | 0.3 | 0.9 | –0.5 | –0.7 | 0.7 | –0.8 | –1.0 | 0.9 |
| P. albicola | 0.1 | 0.5 | –0.5 | –1.0 | – | – | – | 1.0 | –1.0 | –1.0 |
| P. barbatus | 1.0 | –1.0 | –1.0 | –1.0 | 1.0 | –1.0 | –1.0 | 1.0 | –1.0 | –1.0 |
| S. ferox | 1.0 | –1.0 | –1.0 | –1.0 | – | – | – | – | – | – |
| T. tubifex | –0.3 | –1.0 | –1.0 | 0.9 | –0.3 | 0.7 | –0.7 | – | – | – |
Примечание: Жирным шрифтом выделен высокий индекс приуроченности Fij, величина которого может изменяться от –1 (когда вид отсутствует в данном местообитании) до +1 (вид встречается только в данном местообитании); Fij = 0 – безразличие вида к данному биотопу (вид не предпочитает, но и не избегает его); Fij < 0 – вид избегает данный биотоп; Fij > 0 – вид отдает предпочтение биотопу [26, 27].
К видам, преобладающим в современный период в мезотрофном оз. Мястро (см. табл. 2), относятся L. hoffmeisteri (22% от общей численности олигохет), P. barbatus (19%) и P. hammoniensis (15%). Озеро стоит на втором месте по видовому разнообразию группы (HN = 0.77 ± 0.12), однако, несмотря на снижение индекса Шеннона к зоне профундали, число видов с глубиной изменялось здесь незначительно в отличие от видовой плотности, которая снижалась от 3.1 ± 0.3 в литорали озера до 1.5 ± 0.2 в профундали. В оз. Мястро к зарослевой зоне песчано-илистой литорали (l_M) высокую приуроченность (см. табл. 3) проявляли L. hoffmeisteri и L. udekemianus. На илистых грунтах сублиторальной зоны (sbl_M) предпочитали селиться L. variegatus и Tubifex tubifex (Müller, 1774). В профундали озера (pr_M) отмечен единственный доминант, вид с высоким индексом предпочтения – P. hammoniensis.
В эвтрофном оз. Баторино по численности в наших сборах преобладали (см. табл. 2) L. hoffmeisteri (34% от общей численности олигохет), P. hammoniensis (17%) и молодь подсем. Tubificinae (24%), предположительно P. hammoniensis. Для него отмечено наименьшее из трех озер значение индекса разнообразия (НN = 0.55 ± 0.13). Показатель видовой плотности также снижался от зоны литорали (2.1 ± 0.3) к профундали (1.2 ± 0.2). К литорали, слабо заросшей харовыми водорослями (l_B), наибольшую приуроченность (см. табл. 3) демонстрировали виды P. albicola, L. variegatus и L. udekemianus. Темные илы в зоне сублиторали (sbl_B) предпочитал L. hoffmeisteri. Вид P. hammoniensis и в этом озере проявлял высокую приуроченность к глубоководным биотопам в зоне заиленной профундали (pr_B).
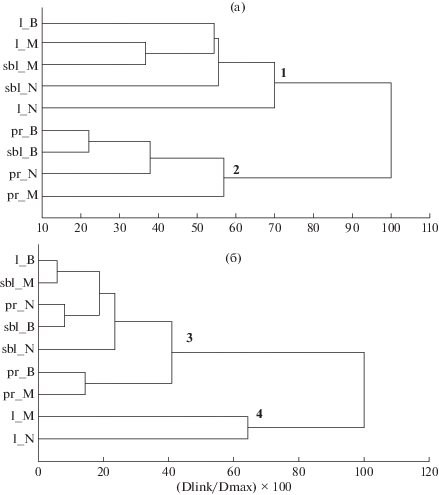
На дендрограммах сходства фауны олигохет (рис. 4 а) все биотопы разделились на два кластера: литоральную и сублиторальную зоны (кластер 1) и профундаль (кластер 2), подтверждая наши предположения о том, что зона профундали всех водоемов отличается от более мелководных участков озер фаунистической индивидуальностью. При этом внутри кластера 1 близкими оказались видовые составы литорали более мелководных озер Мястро и Баторино, вторую пару образовывали виды в биотопах зарослевой зоны более глубокого оз. Нарочь. На дендрограмме сходства, построенной на численности видов (рис. 4б), исследованные биотопы также поделились на два кластера. Сообщества олигохет заросшей литорали озер Мястро и Нарочь (кластер 4) объединились, вероятно, за счет относительно большого числа доминирующих видов в обоих сравниваемых биотопах (см. табл. 2). Модель доминирования в прибрежных зонах имела некоторое сходство: L. variegatus, P. albicola, L. hoffmeisteri, P. barbatus относятся здесь к наиболее многочисленным видам. В кластере 3 объединились сообщества биотопов с небольшим числом видов и относительно низкой их численностью: малозаросшая литораль оз. Баторино и сублитораль оз. Мястро, заиленная профундаль озер Баторино и Мястро. Количественный состав видов сублиторали оз. Баторино был близок к профундальной зоне оз. Нарочь.
Рис. 4.
Дендрограмма сходства видового состава олигохет по качественному составу (а) и численности видов (б) в разных зонах озер Нарочанской группы (характеристика и расшифровка зон даны в табл. 1).
Таким образом, литоральные зоны всех озер характеризуются относительно высоким альфа-разнообразием, выраженным видовой плотностью, наибольшими значениями индекса разнообразия и наименьшим уровнем доминирования (минимальный DS = 0.5). Профундальные зоны, отличающиеся во всех озерах большой однородностью условий, независимо от трофического статуса населяет монодоминантное сообщество олигохет (наибольшее значение DS), состоящее из P. hammoniensis. Для этого биотопа выявлены наименьшие значения индекса разнообразия. Очевидно, что специфическое разделение зон проявляется не только в большей численности и разнообразии олигохет в прибрежных биотопах, но и в отличиях моделей доминирования. Избирательность видами биотопов (табл. 4) подтверждается также и значениями индекса верности биотопу (w) [32], оценивающего биотопическую специфику на фоне общего уровня численности вида и межгодовой ее изменчивости. Биологический смысл определения верности биотопу – в постоянстве присутствия вида в конкретном местообитании, которое можно установить по многолетним данным о его встречаемости. На основании имеющихся многолетних данных для доминирующих видов олигохет были выявлены предпочитаемые условия (см. табл. 4): на песчаных биотопах литоральной зоны формируется комплекс L. variegatus–P. albicola–P. barbatus–S. ferox, при этом для них отмечен наибольший положительный индекс верности биотопу в олиго-мезотрофном озере; песчано-илистые грунты на глубинах не более 2 м, с зарослями рдестов выбирал для расселения L. hoffmeisteri; вид T. tubifex выказывал высокую избирательность к темным илам на глубинах от 2 до 4 м; на глубинах от 4 до 20 м на илах из всех отмеченных видов предпочитает селиться P. hammoniensis, при этом из трех озер вид проявлял большую избирательность к озеру с мезотрофным статусом.
Таблица 4.
Экологические характеристики доминирующих видов олигохет в озерах Нарочанской системы
| Вид | Коэффициент верности биотопу (w) в озерах |
Предпочитаемый биотоп | |||||
|---|---|---|---|---|---|---|---|
| Нарочь | Мястро | Баторино | биотоп | глубина, м | грунт | растения | |
| L. hoffmeisteri | –0.41 | –0.24 | –0.67 | l_M, sbl_B | 0.0–2.0 | п, ни, д, т | Рдесты |
| L. udekemianus | 0.07 | –0.40 | –1.94 | sbl_N_2 | 2.1–8.0 | п, ни | Харовые водоросли |
| L. variegatus | 1.41 | –0.88 | –0.80 | l_N | 0.1–2.0 | п, ни | Харовые водоросли |
| P. hammoniensis | 0.01 | 0.53 | –0.26 | pr_N, pr_M | 4.0–20.0 | ил | Нет |
| P. albicola | 2.29 | –1.54 | –1.03 | l_N | 0.1–2.0 | п, ни | Харовые водоросли |
| P. barbatus | 0.41 | –1.04 | –2.23 | l_N | 0.1–2.0 | п, ни | Харовые водоросли |
| S. ferox | 0.18 | –0.12 | –0.08 | l_N | 0.1–2.0 | п, ни | Харовые водоросли |
| T. tubifex | –0.05 | 0.18 | –0.08 | sbl_M | 2.1–4.0 | ил | Элодея (редко) |
Примечание. Жирным шрифтом выделены высокие положительные значения коэффициента w: биотопическую привязанность отражают высокие положительные значения коэффициента, а избегание биотопов — отрицательные [32]; п – песок, ни – наилок, д – детрит, т – торф.
В литературе [33, 34] оптимумы большинства доминирующих в исследованных озерах видов связывают с эвтрофными условиями. Такая несогласованность данных может определяться отсутствием многолетних рядов данных в некоторых исследованиях. Также не до конца ясно, насколько термины олиготрофное, мезотрофное и эвтрофное озера, употребляемые часто авторами, соответствуют трофическому статусу озер, установленному на основании индекса Карлсона (TSI). Такой вопрос обсуждается в работах, посвященных определению экологического оптимума видов [34].
ЗАКЛЮЧЕНИЕ
Полученные нами результаты показали, что трофический статус озер влияет на количественные показатели развития олигохет, которые снижаются в ряду олиго-мезотрофное–мезотрофное–эвтрофное и состав фауны олигохет в озерах, который наименее разнообразен в эвтрофном водоеме. Однако независимо от трофического статуса озера отмечалась сходная модель распределения количественных показателей развития олигохет: численность и биомасса червей уменьшались во всех озерах от зоны литорали к зоне профундали; в литорали разных по трофности озер состав видов был наиболее разнообразен и отличался наибольшей видовой плотностью. Проведенный анализ выявил биотопическую приуроченность и высокую избирательность ряда видов олигохет, доминирующих в озерах Нарочанской группы, к определенным биотопам в озерах различного трофического статуса.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-54-00009 Бел_а и Белорусского республиканского фонда фундаментальных исследований (грант № Б18P-056) и частично поддержано в рамках бюджетной темы № АААА-А17-117112850235-2.
Список литературы
Одум Ю. Основы экологии. М.: Мир, 1975. 740 с.
Olenin S. Benthic zonation of the Eastern Gotland Basin, Baltic Sea // Aquatic Ecology. 1997. V. 30(4). P. 265–282. https://doi.org/10.1007/BF02085871
Laine A.O. Distribution of soft-bottom macrofauna in the deep open Baltic Sea in relation to environmental variability // Estuar. Coast. Shelf Sci. 2003. V. 57. P. 87–97. https://doi.org/10.1016/S0272-7714(02)00333-5
Coleman N., Cuff W., Moverley J. et al. Depth, sediment type, biogeography and high species richness in shallow-water benthos // Marine and Freshwater Research. 2007. V. 58. P. 293–305.https://doi.org/10.1.1.959.5603
Алимов А.Ф. Морфометрия водоемов и биологическое разнообразие / Динамика биологического разнообразия и биоресурсов континентальных водоемов. Алимов А.Ф., Голубков С.М. (ред.). СПб.: Наука, 2012. С. 16–22.
Beaty S.R., Fortino K., Hershey A.E. Distribution and growth of benthic macroinvertebrates among different patch types of the littoral zones of two arctic lakes // Freshwater Biology. 2006. V. 51. P. 2347–2361. https://doi.org/10.1111/j.1365-2427.2006.01664.x
Тимм Т. Малощетинковые черви (Oligochaeta) водоемов Северо-Запада СССР. Таллин: Валгус, 1987. 299 с.
Попченко В.И. Водные малощетинковые черви (Oligochaeta liminicola) Севера Европы. Л.: Наука, 1988. 287 с.
Moretto Y., Benedito E., Higuti J. Effect of trophic status and sediment particle size on diversity and abundance of aquatic Oligochaeta (Annelida) in neotropical reservoirs // Ann. Limnol.-Int. J. Lim. 2013. V. 49(1). P. 65–78. https://doi.org/10.1051/limn/2013040
Lafont M. Production of Tubificidae in the littoral zone of Lake Léman near Thonon-les-Bains: A methodological approach // Aquatic Oligochaeta. Brinkhurst R.O., Diaz R.J. (eds.) / Developments in Hydrobiology. 1987. V. 40. P. 179–187. https://doi.org/10.1007/978-94-009-3091-9_22
Collado R., Schmelz R.M. Oligochaete distribution patterns in two German hardwater lakes of different trophic state // Limnologica, 2001. V. 1. P. 317–328. https://doi.org/10.1016/S0075-9511(01)80036-0
Verdonschot P.F.M. The role of oligochaetes in the management of waters // Aquatic Oligochaete Biology. Kaster J.L. (eds.) / Developments in Hydrobiology. 1989. V. 180(1). P. 213–227. https://doi.org/10.1007/978-94-009-2393-5_23
Lang C., Reymond O. Empirical relationships between oligochaetes, phosphorus and organic deposition during the recovery of Lake Geneva from eutrophication // Archiv für Hydrobiologie (Arch. Hydrobiol.). 1996. V. 136. P. 237–245. https://doi.org/10.1127/archiv-hydrobiol/141/1998/447
Экологическая система Нарочанских озер / Ред. Винберг Г.Г. Минск: Изд-во “Университетское”, 1985. 302 с.
Бюллетень экологического состояния озер Нарочь, Мястро, Баторино (2017 год) / Т.В. Жукова [и др.] / Под общ. ред. Михеевой Т.М. Минск БГУ, 2018. 119 с.
Сокольская Н.Л. Малощетинковые черви озер Белoрусской ССР // Ученые зап. Белорусской ГУ. Сер. Биол. 1953. Вып. 17. С. 88–95.
Makarevich O.A. Basic results of long-term makrozoobenthos studies in lakes Naroch, Myastro, and Batorino (Belarus) // J. Sib. Fed. Univ. Biol. 2019. V. 12(2). P. 180–195. https://doi.org/10.17516/1997-1389-0038
Чекановская О.В. Водные малощетинковые черви фауны СССР. М.; Л.: Наука, 1962. 412 с.
Timm T. A guide to the freshwater Oligochaeta and Polychaeta of Northern and Central Europe // Lauterbornia. 2009. V. 66. P. 1–235.
Adamovich B.V., Zhukova T.V., Mikheeva T.M. et al. Long-term variations of the trophic state index in the Narochanskie lakes and its relation with the major hydroecological parameters // Water Resources. 2016. V. 43. №. 5. P. 809–817. https://doi.org/10.1134/S009780781605002X
Zhukova T.V., Radchikova N.P., Mikheyeva T.M. et al. Long-term dynamics of suspended matter in Naroch lakes: trend or intervention // Inland Water Biology. 2017. № 3. P. 250–257. https://doi.org/10.7868/S0320965217030020
Adamovich B.V., Medvinsky A.B., Nikitina L.V. et al. Relations between variations in the lake bacterioplankton abundance and the lake trophic state: Evidence from the 20-year monitoring // Ecological Indicators. 2019. V. 97. P. 120–129. https://doi.org/10.1016/j.ecolind.2018.09.049
Методика изучения биогеоценозов внутренних водоёмов. М.: Наука, 1975. 240 с.
Kownacka M. Fauna donna potoku. Sucha Woda (Tatry Wysokie) w cyclurosznum// Acta Hydrobiologia. 1971. V. 13. № 4. P. 415–438.
Тодераш И.К. Функциональное значение хирономид в системе водоемов Молдавии. Кишинев: Штиинца, 1984. 172 с.
Песенко Ю.А. Принципы и методы количественного анализа в фаунистических исследованиях. М.: Наука, 1982. 288 с.
Наглов В., Загороднюк И. Статистический анализ приуроченности видов и структуры сообществ // Proceedings of Theriological School. 2006. Вып. 7. С. 291–300.
Baturina M.A., Makarevich O.A., Kaygorodova I.A. et al. The role of annelid worms (ANNELIDA) in the Naroch Lakes system (Belarus) // International J. of Applied and Fundamental Research. 2018. № 12. P. 56–59. https://doi.org/10.17513/mjpfi.12521
Krodkiewska M., Michalik-Kucharz A. The bottom Oligochaeta communities in sand pits of different trophic status in Upper Silesia (Southern Poland) // Aquatic Ecology. 2009. V. 43. P. 437–444. https://doi.org/10.1007/s10452-008-9199-2
Martines-Anselmi E., Prat N. Oligochaeta from profundal zones of Spanish reservoirs // Hydrobiologia. 1984. V. 115(1). P. 223–230. https://doi.org/10.1007/BF00027921
Särkkä, J. Lacustrine, profundal meiobenthic oligochaetes as indicators of trophy and organic loading // Hydrobiologia. 1994. V. 278. P. 231–241. https://doi.org/10.1007/BF00142331
Ananina T.L. Biotopic preferences of carabid beetles from Barguzinsky range (Baikal Region, Russia) by the example of Carabus odoratus barguzinicus Shil // Euroasian Entomological J. 2015. V. 14(6). P. 511–517.
Timm T. Tubifex tubifex (Muller, 1774) (Oligochaeta, Tubificidae) in profundal of Estonian lakes // Revue ges. Hydrobiol. 1996. V. 81(4). P. 589–596. https://doi.org/10.1002/iroh.19960810412
O’Toole C., Donohue L., Moe S.J., Irvine K. Nutrient optima and tolerances of benthic invertebrates, the effects of taxonomic resolution and testing of selected metrics in lakes using an extensive European data base // Aquatic Ecology. 2008. V. 42. P. 277–291. https://doi.org/10.1007/s10452-008-9185-8
Дополнительные материалы отсутствуют.