Экология, 2020, № 5, стр. 323-331
Быстрые изменения растительных сообществ природных парков вследствие рекреационного использования
Л. А. Пустовалова a, *, **, Д. В. Веселкин a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: lilium2@yandex.ru
** E-mail: veselkin_dv@ipae.uran.ru
Поступила в редакцию 20.04.2020
После доработки 27.04.2020
Принята к публикации 28.04.2020
Аннотация
Для оценки динамики состояния лесных сообществ на участках, подверженных рекреационному воздействию разной интенсивности, проверяли два предположения: 1) таксономическое богатство и разнообразие сообществ на участках с интенсивным рекреационным воздействием ниже, а богатство синантропных видов – выше; 2) при продолжающемся рекреационном воздействии богатство и доля синантропных видов продолжают увеличиваться. Исследования проведены с 2012 г. по 2019 г. на Среднем Урале (Россия) на 4 особо охраняемых территориях. На каждой территории мониторинг выполнен на двух площадях, одна из которых подвержена сильному рекреационному воздействию, а вторая – контрольная. Установлено, что рекреационно используемые сообщества содержат в среднем столько же видов, сколько и контрольные, но при интенсивной рекреации богатство и доля синантропных видов выше, а индигенных – ниже. За 7 лет доля синантропных видов значимо увеличилась в интенсивно посещаемых и, что особенно важно, в мало посещаемых сообществах. Таким образом, трансформация видового состава растительных сообществ в рекреационно используемых резерватах установлена не только на участках с интенсивным рекреационным воздействием, но и на мало посещаемых участках. Это новый эмпирический факт, свидетельствующий о возможности быстрой синантропизации лесной растительности рекреационно используемых природоохранных территорий в целом.
Охрана биологического разнообразия необходима для сохранения эволюционного потенциала биоты и устойчивости экосистемных функций [1]. Наиболее эффективный способ сохранения биоразнообразия – создание особо охраняемых природных территорий (ООПТ). Однако задачей некоторых ООПТ, например природных парков, является охрана природы одновременно с организацией рекреационной деятельности. На таких территориях актуально поддержание баланса между сохранением природных ландшафтов и сообществ и их рекреационной эксплуатацией. Рекреационное воздействие на биоту рассматривается прежде всего как механическое воздействие на почву и нижние ярусы растительных сообществ – вытаптывание, или трамплинг. Оценки прямых рекреационных эффектов для растительных сообществ ООПТ многочисленны [2–8]. Близкое направление – исследования трансформации растительности вблизи дорожно-тропиночной сети [2, 6, 9–12]. Трансформация сообществ вблизи троп и дорог часто происходит не только из-за вытаптывания, но и из-за внедрения чужеродных видов или видов, не типичных для ненарушенных местообитаний. Это отдельное направление исследований на ООПТ [7, 13–16].
Видовое богатство растительных сообществ при рекреации, как правило, снижается [3, 5, 8], хотя при промежуточных нагрузках может повышаться [8]. Нелинейность зависимости видового богатства от интенсивности рекреационных нагрузок особенно проявляется вблизи троп и дорог. При промежуточных нарушениях – на обочинах – число видов и разнообразие растений могут быть выше, чем в ненарушенных сообществах [6, 9, 10]. Однако при сильных нарушениях – собственно на дорогах и тропах – богатство ниже, чем в исходных сообществах [2, 9, 11, 12]. Обычно снижение общего видового богатства растительных сообществ под влиянием рекреации происходит из-за уменьшения числа автохтонных или редких видов [4, 8, 12, 17]. Ожидаемо увеличивается в рекреационно нарушаемых сообществах число синантропных [2, 4, 18], рудеральных [11] и чужеродных [10, 16] видов.
Чаще всего исследования последствий рекреации были единовременными, выполненными как сравнение участков с разной рекреационной нагрузкой в один момент времени [2, 6, 8–10, 12, 18]. Дизайн с повторным обследованием одних и тех же рекреационных участков встречается реже [3, 5]. Между тем только таким способом можно оценить динамические характеристики – скорость и степень обратимости рекреационной трансформации растительности.
Целью нашей работы было оценить динамику состояния лесных растительных сообществ природных парков на протяжении 7 лет на участках, подверженных рекреационному воздействию разной интенсивности. В качестве рабочих гипотез проверяли следующие предположения: 1) таксономическое богатство и разнообразие растительных сообществ на участках с интенсивным рекреационным воздействием ниже, чем на мало посещаемых, при этом на участках с интенсивным рекреационным воздействием богатство синантропных видов выше, а индигенных – ниже, чем на мало посещаемых; 2) при продолжающемся рекреационном использовании видовое разнообразие и богатство индигенных видов продолжают снижаться, а богатство и доля синантропных – увеличиваться. Таким образом, мы планировали оценить не только текущее состояние сообществ с разной посещаемостью, но прежде всего динамику их состояния на протяжении 7 лет рекреационной эксплуатации.
МАТЕРИАЛ И МЕТОДЫ
Районы. В Свердловской области (Россия, Средний Урал) функционируют четыре природных парка общей площадью 140 тыс. га. Нагрузка на их природные комплексы, в основном рекреационная, велика и постоянно увеличивается. Данные собраны в ООПТ регионального значения: в природных парках “Оленьи ручьи”, “Река Чусовая”, “Бажовские места” и в природно-минералогическом заказнике “Режевской” (рис. 1, табл. 1). Все ООПТ расположены в таежной природной зоне в подзоне южной тайги.
Рис. 1.
Расположение особо охраняемых территорий (черная заливка: 1 – “Бажовские места”; 2 – “Оленьи ручьи”; 3 – заказник “Режевской”; 4 – “Река Чусовая”) относительно населенных пунктов (серая заливка) в центральной части Свердловской области.
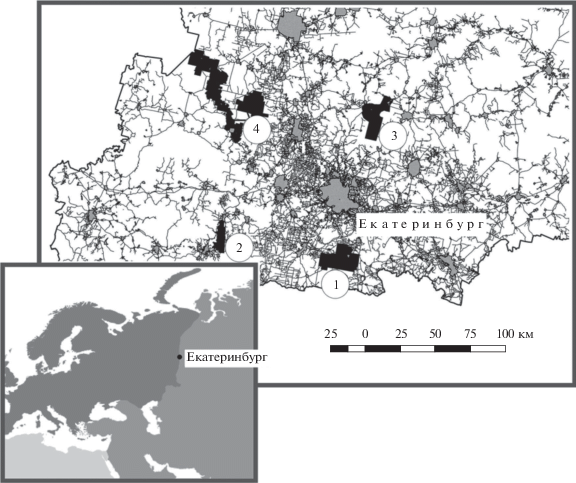
Таблица 1.
Основные характеристики ООПТ
| Характеристика | Природные парки | Заказник “Режевской” | ||
|---|---|---|---|---|
| “Оленьи ручьи” | “Река Чусовая” | “Бажовские места” | ||
| Статус ООПТ1 | Protected Landscape/Seascape | Habitat/Species Management Area | ||
| Координаты: | ||||
| широта | 56°31′24″ | 57°37′35″ | 56°30′29″ | 57°24′00″ |
| долгота | 59°13′44″ | 59°02′41″ | 60°44′11″ | 60°58′04″ |
| Ближайший город | Нижние Серги | Нижний Тагил | Сысерть | Реж |
| Год создания | 1999 | 2004 | 2007 | 1995 |
| Площадь, тыс. га | 23.2 | 77.1 | 38.4 | 32.3 |
| Число посетителей, тыс. чел/год | 802 | 72 (703) | 402 | 0.62 (1–23) |
| Температура, °C: | ||||
| июля | +18.3 | +17.9 | +18.9 | +18.7 |
| января | –15.6 | –15.5 | –14.5 | –15.0 |
| Годовая сумма осадков, мм | 583 | 607 | 504 | 501 |
| Макрорельеф | Низкогорья Среднего Урала | Восточные предгорья Среднего Урала | Зауральский пенеплен | |
| Преобладающие высоты, м над ур. м. | 400–600 | 400–600 | 180–220 | 180–220 |
| Растительность4 | Пихтово-еловые и елово-пихтовые леса травяно-кустарничковые и травяные с неморальными видами | Сосновые с лиственницей часто с липой в подлеске леса травяные | ||
| Годы наблюдений | 2012–2015, 2017–2019 |
2013–2015, 2017–2019 |
2012–2015, 2017–2019 |
2012–2015, 2017–2019 |
Пробные площади и геоботанические описания. В каждой ООПТ заложены по две связанные постоянные пробные площади (ППП): одна расположена непосредственно на интенсивно посещаемом туристическом маршруте и поэтому подвержена значительному рекреационному воздействию; другая расположена в стороне от маршрутов и мало посещается – это контрольная, мало нарушенная или условно не нарушенная ППП. В каждой ООПТ пары ППП заложены в одних и тех же элементах рельефа, в одних и тех же почвенных условиях, вблизи друг от друга – в пределах одного лесорастительного выдела. Предположительно до начала интенсивного рекреационного использования мало посещаемые и интенсивно посещаемые площади имели сравнимую растительность. По классификации EUNIS [21], обследованные местообитания в природных парках “Оленьи ручьи” и “Река Чусовая” относятся к таежным лесам из Picea мелкотравным (Т3-F3: Small-herb western Picea taiga), в природном парке “Бажовские места” и заказнике “Режевской” − к таежным лесам из Pinus sylvestris травяным (Т3-G3: Herb-rich and grassy pine taiga). Названия растений даны по [22].
Размер ППП – 20 × 20 м [23]. Обсуждаются данные, полученные в ходе мониторинга в 2012–2015 и 2017–2019 гг. на 8 ППП (52 геоботанических описания). В трех ООПТ наблюдения начаты в 2012 г., на одной – в 2013 г. Регистрировали видовой состав каждого яруса, проективное покрытие надземных органов растений травяно-кустарничкового яруса (в %). Рассчитывали значения индексов Шеннона и Бергера-Паркера для травяно-кустарничкового яруса. В качестве характеристики видового богатства использовали плотность видов – число видов на 400 м2. Анализировали группы видов: 1) по степени синантропности – индигенные и синантропные [по: 24, 25]; 2) по ценотической приуроченности – лесные и нелесные (луговые, опушечные, сорные) [по: 26, 27]; 3) по природоохранному статусу – охраняемые [по: 28]; 4) по происхождению – аборигенные и чужеродные [по: 25]; 5) разных жизненных форм [по: 26, 27]. Объемы используемых терминов взяты по [2, 29].
Анализ данных. Для сравнения характеристик богатства и состава растительных сообществ использовали подходы в рамках общих (General Linear Model – GLM) и смешанных (Linear Mixed Models – LMM) линейных моделей. В GLM факторами были “интенсивность посещения” (дискретная переменная) – мало посещаемая (контрольная) площадь или интенсивно посещаемая (рекреационная) площадь; “год наблюдения” (континуальная переменная). В LMM дополнительно к фиксированным факторам “интенсивность посещения” и “год наблюдения” в качестве случайного эффекта использовали название ООПТ, на которой размещались ППП. Связь между переменными характеризовали коэффициентом корреляции Пирсона (r). При сравнении переменных, выраженных в долях, их предварительно подвергали арксинус-преобразованию. Стандартизацию переменных для нивелирования разности средних значений характеристик сообществ на разных территориях проводили внутри оценок, полученных на каждой территории, по формуле
где x и xst – исходное и стандартизированное значения признака; xavg и σ – среднее арифметическое значение и стандартное отклонение признака на каждой территории. Расчеты выполнены в пакетах JMP 10.0.0 (SAS Institute Inc., USA, 2012) и STATISTICA 8.0 (StatSoft Inc., USA, 1984–2007). Приведенные в тексте размахи величин – размахи между значениями признаков. При усреднении значений через символ ± приведена стандартная ошибка.РЕЗУЛЬТАТЫ
Состав сообществ. В парках “Бажовские места”, “Оленьи ручьи” и заказнике “Режевской” сообщества мало посещаемых ППП представлены сосновыми лесами с Larix sibirica, Picea obovata, Betula pendula, Populus tremula разнотравными и разнотравно-вейниковыми, в парке “Река Чусовая” − елово-сосновым кустарничково-зеленомошным лесом. В их травяно-кустарничковом ярусе обычны Calamagrostis arundinacea, Rubus saxatilis, Vaccinium myrtillus, V. vitis-idaea, Fragaria vesca. Сообщества контрольных ППП имеют несколько хорошо выраженных ярусов, доминанты на них были постоянными весь период наблюдений. На интенсивно посещаемых ППП представлены синантропные сообщества, производные от лесных, древостой на них разрежен. В кустарниковом ярусе часто встречаются Chamaecytisus ruthenicus, Rosa majalis, R. acicularis, Salix caprea. Основу травянистого яруса составляют Pimpinella saxifraga, Plantago major, P. media, Taraxacum officinale, Trifolium repens, злаки Poa annua и Deschampsia cespitosa.
Всего на ППП зарегистрировано 175 видов растений, из них индигенные – 125, синантропные – 50; лесные – 32, нелесные – 143. На интенсивно посещаемых ППП охраняемые виды отсутствовали, а на контрольных их число варьировало от 0 до 3 видов на 400 м2. Выявлены 7 видов из Красной книги Свердловской области [28]: Anemone flavescens, Cypripedium guttatum, Dactylorhiza fuchsii, Digitalis grandiflora, Epipactis atrorubens, Lilium martagon, Goodyera repens. Чужеродные растения на ППП не зафиксированы.
Состояние сообществ в зависимости от интенсивности посещений. Не все характеристики сообществ изменялись в связи с факторами, которые анализировали как вероятные причины изменчивости растительности (табл. 2). Большинство характеристик различались в связи с интенсивностью рекреационной нагрузки. Однозначный индикатор интенсивного рекреационного использования – уменьшение покрытия травяно-кустарничкового яруса. Общее покрытие травяно-кустарничкового яруса на мало посещаемых площадях варьировало от 50 до 80%, на площадях с интенсивной рекреацией – от 25 до 60%.
Таблица 2.
Средние значения характеристик сообществ и значимость (P) влияния на них факторов “интенсивность посещения” и “год описания"
| Характеристики сообществ |
Средние значения на участках | Результаты LMM и GLM | |||||
|---|---|---|---|---|---|---|---|
| LMM | GLM | ||||||
| факторы | $R_{{{\text{adj}}}}^{2}$ | $R_{{{\text{adj}}}}^{2}$ | |||||
| мало посещаемых | интенсивно посещаемых | интенсивность посещения | год описания | интенсивность посещения × год | |||
| Сообщество в целом | |||||||
| Число видов на 400 м2: | |||||||
| всех | 44.7 ± 2.7 | 40.3 ± 2.1 | 0.1862 | 0.2845 | 0.6276 | 0.24 | 0.05 |
| по степени синантропности: | |||||||
| индигенных | 42.9 ± 2.5 | 25.7 ± 1.8 | <0.0001 | 0.9950 | 0.7570 | 0.50 | 0.35 |
| синантропных | 1.8 ± 0.3 | 14.6 ± 0.7 | <0.0001 | <0.0001 | <0.0001 | 0.96 | 0.93 |
| по ценотической приуроченности: | |||||||
| лесных | 14.0 ± 0.6 | 3.6 ± 0.4 | <0.0001 | 0.5906 | 0.8951 | 0.93 | 0.80 |
| нелесных | 30.7 ± 2.9 | 36.7 ± 1.8 | 0.0482 | 0.2303 | 0.6454 | 0.29 | 0.08 |
| по природоохранному статусу: | |||||||
| охраняемых | 1.7 ± 0.2 | 0 | <0.0001 | 0.1114 | 0.2103 | 0.74 | 0.59 |
| Доля синантропных видов | 0.03 ± 0.01 | 0.38 ± 0.02 | <0.0001 | 0.0004 | 0.0042 | 0.94 | 0.87 |
| Доля нелесных видов | 0.64 ± 0.03 | 0.92 ± 0.01 | <0.0001 | 0.3260 | 0.8173 | 0.90 | 0.61 |
| Доли видов разных жизненных форм: |
|||||||
| фанерофиты | 0.24 ± 0.03 | 0.11 ± 0.01 | <0.0001 | 0.2747 | 0.4538 | 0.67 | 0.36 |
| хамефиты | 0.07 ± 0.01 | 0.04 ± 0.002 | <0.0001 | 0.4209 | 0.8619 | 0.77 | 0.36 |
| гемикриптофиты | 0.54 ± 0.03 | 0.76 ± 0.01 | <0.0001 | 0.1507 | 0.2594 | 0.76 | 0.50 |
| геофиты | 0.11 ± 0.01 | 0.04 ± 0.003 | <0.0001 | 0.2021 | 0.7347 | 0.90 | 0.73 |
| терофиты | 0.004 ± 0.002 | 0.05 ± 0.01 | <0.0001 | 0.0512 | 0.3592 | 0.92 | 0.61 |
| Травяно-кустарничковый ярус | |||||||
| Число видов на 400 м2 | 35.5 ± 2.8 | 35.7 ± 1.8 | 0.8826 | 0.2392 | 0.5689 | 0.19 | 0.02 |
| Проективное покрытие, % | 65.5 ± 2.2 | 35.9 ± 1.7 | <0.0001 | 0.9398 | 0.5883 | 0.77 | 0.68 |
| Индекс Шеннона | 1.90 ± 0.04 | 2.42 ± 0.09 | <0.0001 | 0.5587 | 0.8968 | 0.45 | 0.32 |
| Индекс Бергера-Паркера | 0.34 ± 0.01 | 0.26 ± 0.02 | <0.0001 | 0.2675 | 0.6134 | 0.45 | 0.16 |
| Доля синантропных видов | 0.04 ± 0.01 | 0.41 ± 0.02 | <0.0001 | 0.0001 | 0.0843 | 0.93 | 0.87 |
Общее число видов растений на 400 м2 на мало посещаемых ППП варьировало от 20 до 63, на интенсивно посещаемых – от 19 до 56. Число видов травяно-кустарничкового яруса варьировало на контрольных ППП от 11 до 52, на рекреационных – от 17 до 48. Таким образом, плотности видов в сообществах в целом и травяно-кустарничковом ярусе в зависимости от интенсивности рекреации не различались. Разнообразие травяно-кустарничкового яруса, охарактеризованное индексом Шеннона, на контрольных ППП в среднем было ниже (1.53–2.19), чем при интенсивной рекреации (1.57–3.11). Степень доминирования, напротив, была больше на контрольных ППП (0.25–0.45), чем на рекреационных (0.14–0.42).
Составы видов на контрольных и рекреационных ППП различались. Число и доля индигенных видов при интенсивной рекреации были ниже, а синантропных – выше. Число индигенных видов на 400 м2 на контрольных площадях варьировало от 20 до 61, на рекреационных – от 10 до 40, число синантропных видов на мало посещаемых ППП варьировало 0 до 4, на рекреационных – от 9 до 21. В зависимости от интенсивности посещений доля синантропных видов различалась на порядок величин: 0–8% – на мало посещаемых площадях и 25–61% – на интенсивно посещаемых. В зависимости от интенсивности посещений ожидаемо изменялось также соотношение лесных и нелесных видов. По числу видов типично лесные растения не преобладали даже на контрольных ППП (8–18 видов на 400 м2), но при интенсивной рекреации их было значительно меньше (1–7 видов на 400 м2). Нелесные виды показали противоположные закономерности распределения, и при интенсивной рекреации их было больше: контрольные ППП – 6–55 видов на 400 м2, рекреационные – 18–51.
Ценотические перестройки, происходящие под влиянием рекреационного использования, видны по изменению среднего спектра жизненных форм: при рекреации в 2 раза меньше доли фанерофитов (Daphne mesereum, Lonicera xylosteum, Tilia cordata и др.) и хамефитов (Linnaea borealis, Orthilia secunda, Vaccinium myrtillus и др.), т.е. древесных и одревесневающих растений. На интенсивно посещаемых ППП заметно увеличение на 40% доли гемикриптофитов, устойчивых к вытаптыванию и составляющих основу сорной фракции (Plantago major, Potentilla anserina, Trifolium repens и др.). Симптоматично увеличение на рекреационных площадях доли терофитов – однолетников Poa annua и Polygonum aviculare, отсутствующих на мало посещаемых лесных участках.
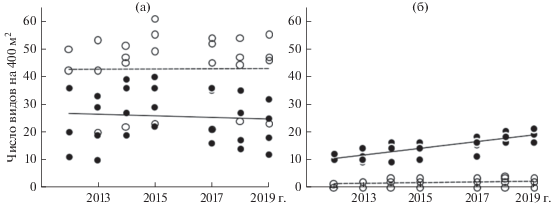
Динамика сообществ во времени. Для понимания устойчивости растительности к рекреационным воздействиям важно регистрировать изменения сообществ в ходе прямых наблюдений, не прибегая к пространственно-временным аналогиям. За 7 лет изменились только характеристики участия синантропных видов, о чем свидетельствует значимое влияние фактора “год описания” для их числа и доли (см. табл. 2), в то время как среднее число индигенных видов в описании не изменилось (рис. 2а). На рекреационных ППП число синантропных видов за 7 лет увеличилось (рис. 2б): в 2012 г. – 10–12 видов на 400 м2, в 2019 г. – 16–21.
Рис. 2.
Число индигенных (а) и синантропных (б) видов на 400 м2 в 2012–2019 гг. на интенсивно (⚫, сплошная линия) и мало (⚪, штриховая линия) посещаемых площадях.
При анализе числа и доли синантропных видов в сообществах в целом установлено значимое взаимодействие между факторами “интенсивность посещения” и “год” (см. табл. 2). Это свидетельствует о разном проявлении процесса синантропизации на слабо и интенсивно посещаемых ППП, что визуально выражено в разном угле наклона прямых на рис. 3а. Однако взаимодействие между факторами “интенсивность посещения” и “год” незначимо для доли синантропных видов в травяно-кустарничковом ярусе. Это можно интерпретировать так, что увеличение со временем уровня синантропизации травяно-кустарничкового яруса происходило не только на рекреационных, но и на контрольных площадях. Визуальный анализ графиков на рис. 3б не позволяет однозначно поддержать или отвергнуть это предположение. Поэтому мы рассчитали корреляцию между годом описания и стандартизированными значениями доли синантропных видов в травяно-кустарничковом ярусе: для мало посещаемых ППП (зависимость до стандартизации – штриховая линия на рис. 3б) – r = 0.47 (n = 25; P = 0.0170), для интенсивно посещаемых (зависимость до стандартизации – сплошная линия на рис. 3б) – r = 0.66 (n = 27; P = 0.0002).
Рис. 3.
Доля синантропных видов от общего числа видов в сообществе в целом (а) и в травяно-кустарничковом ярусе (б) в 2012–2019 гг. на интенсивно (⚫, сплошная линия) и мало (⚪, штриховая линия) посещаемых площадях.
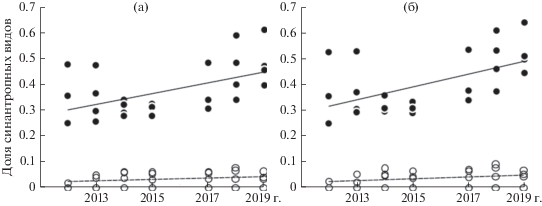
Аналогичный расчет для доли синантропных видов в сообществах в целом дал близкие результаты: для мало посещаемых ППП (зависимость до стандартизации данных – штриховая линия на рис. 3а) – r = 0.43 (n = 25; P = 0.0303), для интенсивно посещаемых (зависимость до стандартизации данных – сплошная линия на рис. 3а) – r = 0.68 (n = 27; P = 0.0001). Следовательно, значимое взаимодействие между факторами “интенсивность посещения” и “год” в целом указывает на разные скорости увеличения доли синантропных видов на мало и интенсивно посещаемых площадях, но не означает отсутствия временной динамики признака на контрольных ППП.
Таким образом, рост доли синантропных видов за 7 лет статистически подтвержден не только при отдельном анализе травяно-кустарничкового яруса, но и для сообществ в целом, и не только для интенсивно посещаемых, но и для мало посещаемых участков.
Особенности состояния сообществ разных территорий. В табл. 2 приведены оценки качества объяснений ($R_{{{\text{adj}}}}^{2}$) характеристик состояния сообществ с помощью двух подходов – LMM и GLM. Подход с использованием LMM учитывает три источника изменчивости: эффекты, сопряженные с рекреационными нарушениями; изменчивость характеристик во времени; изменчивость между разными территориями. Подход с использованием GLM учитывает два первых источника. Сопоставляя значения $R_{{{\text{adj}}}}^{2}$, полученные в LMM и GLM, можно приблизительно представить, как сильно характеристики растительных сообществ зависят от особенностей разных территорий или площадей, что в нашем случае одно и то же. В отношении большинства характеристик вклад изменчивости между территориями нерешающий. Для числа индигенных, синантропных и охраняемых видов в сообществах в целом, для долей синантропных видов, а также для проективного покрытия и разнообразия травяно-кустарничкового яруса доля изменчивости, связанная с различиями между разными территориями, не превышает 1/3 общей объяснимой изменчивости. Следовательно, эффекты, связанные со степенью рекреационной нарушенности или временной изменчивостью этих признаков, мало зависят от географических и ситуационных особенностей разных территорий.
ОБСУЖДЕНИЕ
Исследованные нами леса не являются коренными, ранее они подвергались рубкам и представляют этапы восстановительных сукцессий [30]. Рекреационная деятельность на обследованных территориях была развита задолго до создания ООПТ. Однако во флористическом и фитоценотическом отношениях исследованные леса трансформированы незначительно, сохраняя природоохранное значение и рекреационную привлекательность. Вне рекреационных участков ООПТ регулярны находки охраняемых растений [по: 28]. Чужеродные растения редки, не найдены на ППП, но Amelanchier spicata, Artemisia absinthium, Berteroa incana, Cannabis sativa, Malus baccata и Matricaria matricarioides единично зарегистрированы в лесах в ходе маршрутных обследований. На неурбанизированных территориях ООПТ региона, по-видимому, еще не подвержены интенсивному притоку чужеродных видов. Так, в парциальной флоре скальных обнажений парка “Река Чусовая” доля чужеродных видов составляет около 4% [31]. Вблизи человеческого жилья на территориях ООПТ богатство чужеродных видов может быть более высоким – до 10–22% видовых списков [2, 18]. В пригородных и городских лесах Среднего Урала чужеродные виды имеют более высокие видовое богатство (до половины общего состава видов) и покрытие (до 30%) и в подлеске, и в травяно-кустарничковом ярусе [32–34].
Наши рабочие гипотезы и полученные результаты характеризуют особенности фитоценозов, формирующиеся в разных масштабах времени. Во-первых, мы зафиксировали особенности интенсивно посещаемых и мало посещаемых сообществ, которые интерпретировали как связанные с рекреационным воздействием. Эти особенности формировались продолжительное время, вероятно, десятки лет, т.е. задолго до начала юридического и институционального оформления ООПТ. Во-вторых, мы оценили кратковременную динамику сообществ.
Первая гипотеза, относящаяся к различиям между рекреационными и контрольными участками, справедлива частично. Закономерно, что интенсивное рекреационное использование повлияло на соотношение растений с разной антропотолерантностью. Изменение соотношения ценотических групп видов и видов разных жизненных форм только детализирует эту общую закономерность, так как все оценки базируются на анализе одних и тех же списков видов. Аналогичных результатов, свидетельствующих об усилении позиций синантропных или других групп антропотолерантных видов на интенсивно посещаемых участках заповедных территорий, много [4, 8, 10–12, 16]. Тревожное следствие рекреационной эксплуатации – снижение встречаемости/обилия автохтонных и редких и исчезающих растений [4, 8, 12, 17]. Это установлено и в нашем случае: охраняемые виды отсутствовали на интенсивно посещаемых ППП, что свидетельствует об их невысокой природоохранной ценности.
Мы предполагали снижение таксономического богатства и разнообразия сообществ при рекреационных нарушениях. Однако это предположение не подтвердилось. В интенсивно посещаемых сообществах было в среднем столько же видов, сколько и в контрольных; разнообразие травяно-кустарничкового яруса в условиях рекреации в среднем было выше, чем на контрольных участках, что, вероятно, обусловлено изменением структуры доминирования. Вообще диапазон откликов характеристик растительных сообществ на рекреационные нагрузки широк – от негативных [3, 5, 8, 9, 11, 12] до позитивных [6, 8–10]. Поэтому неизменность таксономического богатства при интенсивной рекреации не является неожиданной. Например, ее можно объяснить тем, что исследованные сообщества находятся не на последних этапах деградации или совмещением двух разнонаправленных процессов, когда исчезновение индигенных лесных видов сопровождается увеличением числа синантропных видов. В целом при проверке первой гипотезы мы получили легко прогнозируемые результаты. Фактически они лишь количественно конкретизируют известные в общих чертах региональные закономерности синантропизации растительности ООПТ [2, 18, 24, 35]. К тому же эти результаты опираются на использование пространственно-временной аналогии. Несмотря на наши усилия при подборе ППП, невозможно с полной уверенностью считать интенсивно и мало посещаемые сообщества идентичными по условиям и состоянию растительности в прошлом. Однако некоторая тривиальность результатов, относящихся к проверке первой гипотезы, не бесполезна; это позволяет считать обоснованным вывод о быстрой синантропизации территорий ООПТ, полученный при проверке второй гипотезы.
По нашему мнению, результаты, относящиеся к гипотезе о краткосрочной динамике сообществ под влиянием рекреационной эксплуатации, можно считать новыми. Они позволяют оценить скорость трансформации лесных сообществ. В рекреационных сообществах в среднем за год появлялось 1.20 ± 1.18 синантропных видов на 400 м2, вследствие чего 3 из 4 сообществ на интенсивно посещаемых площадях за 7 лет перешли в следующий класс степени синантропизации по шкале П.Л. Горчаковского [35]. Наши оценки указывают также на заметные в масштабе менее 10 лет изменения состава лесных сообществ при отсутствии интенсивного вытаптывания и катастрофических воздействий: скорость трансформации сообществ в таком случае на порядок ниже и документируется менее надежно – 0.12 ± 0.11 синантропных видов на 400 м2 в год. Однако необходимо отметить, что особенности динамики синантропизации на рекреационных и контрольных участках количественные, а не качественные. Поэтому наша вторая рабочая гипотеза в основе справедлива – мы не установили изменений за 7 лет других признаков, кроме числа и доли синантропных видов. Очевидно, участие синантропных видов – это наиболее чувствительный из использованных признаков состояния растительных сообществ. Свидетельства быстрых, в масштабе немногих лет, реакций растений и растительности в связи с рекреацией относятся обычно к противоположному процессу – восстановлению сообществ, ценофлор и флор после заповедания, огораживания и т.п. [3, 36, 37]. Но закономерности и механизмы трансформации сообществ при усиливающихся и ослабляющихся нагрузках, скорее всего, различны.
Таким образом, основной эффект рекреационного воздействия на лесную растительность ООПТ Среднего Урала при текущем уровне нагрузок – изменение видового состава сообществ: α-разнообразие подверженных рекреации сообществ не снижается, но происходит замещение типичных лесных видов синантропными. Тревожная тенденция – поддающееся документированию быстрое, в масштабе нескольких лет, увеличение доли синантропных видов не только на интенсивно посещаемых участках ООПТ, но и вне них. Это свидетельствует о том, что локальные рекреационные воздействия (на маршрутах, смотровых площадках) сопровождаются трансформацией растительных сообществ, непосредственно не подверженных вытаптыванию. Следовательно, трансформации подвергаются территории природных парков и заказников в целом. Для сохранения природоохранной эффективности ООПТ необходима тщательная научно-обоснованная проработка регламентов организации их рекреационной деятельности.
Работа выполнена в рамках темы госзадания Института экологии растений и животных УрО РАН № АААА-А19-119031890084-6; обобщающий анализ выполнен в рамках выполнения проекта РФФИ № 20-44-660013. Авторы выражают благодарность к.б.н. О.В. Ерохиной и к.б.н. И.А. Кузнецовой (Институт экологии растений и животных УрО РАН) за помощь в проведении полевых работ. Авторы декларируют отсутствие конфликта интересов.
Список литературы
Jenkins M. Prospects for biodiversity // Science. 2003. V. 302. № 5648. P. 1175−1177.
Горчаковский П.Л., Козлова Е.В. Синантропизация растительного покрова в условиях заповедного режима // Экология. 1998. № 3. С. 171–177. [Gorchakovskii P.L., Kozlova E.V. Synanthropisation of plant cover under conditions of nature conservation // Rus. J. Ecol. 1998. V. 29. № 3. P. 146–151.]
Andres-Abellan M., Del Alamo J.B., Landete-Castillejos T. et al. Impacts of visitors on soil and vegetation of the recreational area “Nacimiento del Rio Mundo” (Castilla-La Mancha, Spain) // Environ. Monit. Assess. 2005. V. 101. № 1−3. P. 55−67.
Лукьянова Ю.А. Динамика растительного покрова лесных ценозов национального парка “Нижняя Кама” в условиях рекреационного воздействия // Труды Мордовского гос. природного заповедника им. П.Г. Смидовича. 2011. № 9. С. 72−82.
Ballantyne M., Pickering C.M., McDougall K.L. Sustained impacts of a hiking trail on changing Windswept Feldmark vegetation in the Australian Alps // Aust. J. Bot. 2014. V. 62. № 4. P. 263−275.
Queiroz R.E., Ventura M.A., Silva L. Plant diversity in hiking trails crossing Natura 2000 areas in the Azores: implications for tourism and nature conservation // Biodiversity Conservation. 2014. V. 23. № 6. P. 1347–1365.
Bernard-Verdier M., Hulme P.E. Alien plants can be associated with a decrease in local and regional native richness even when at low abundance // J. Ecol. 2018. V. 107. № 3. P. 1343−1354.
Pinna M.S., Bacchetta G., Cogoni D., Fenu G. Is vegetation an indicator for evaluating the impact of tourism on the conservation status of Mediterranean coastal dunes? // Sci. Total Environ. 2019. V. 674. P. 255−263.
Roovers P., Baeten S., Hermy M. Plant species variation across path ecotones in a variety of common vegetation types // Plant Ecol. 2004. V. 170. № 1. P. 107–119.
Wolf I.D., Croft D.B. Impacts of tourism hotspots on vegetation communities show a higher potential for self-propagation along roads than hiking trails // J. Environ. Manage. 2014. V. 143. P. 173–185.
Ballantyne M., Pickering C.M. The impacts of trail infrastructure on vegetation and soils: current literature and future directions // J. Environ. Manage. 2015. V. 164. P. 53−64.
Conradi T., Strobl K., Wurfer A.-L., Kollmann J. Impacts of visitor trampling on the taxonomic and functional community structure of calcareous grassland // Appl. Veg. Sci. 2015. V. 18. № 3. P. 359−367.
Морозова О.В., Царевская Н.Г. Участие чужеродных видов сосудистых растений во флорах заповедников Европейской России // Изв. РАН. Сер. геогр. 2010. № 4. С. 54–62. [Morozova O.V., Tsarevskaya N.G. Part of alien vascular plant species in floras of natural reserves of European Russia // Izv. Ross. Akad. Nauk. Ser. Geogr. 2010. № 4. P. 54–62.]
Foxcroft L.C., Pysek P., Richardson D.M. et al. Plant invasion science in protected areas; progress and priorities // Biol. Invasions. 2017. V. 19. № 5. P. 1353−1378.
Starodubtseva E.A., Grigoryevskaya A.Ya., Lepeshkina L.A., Lisova O.S. Alien species in local floras of the Voronezh region Nature reserve fund (Russia) // Nat. Conserv. Res. 2017. V. 2. № 4. P. 53−77.
Le C., Fukumori K., Hosaka T. et al. The distribution of an invasive species, Clidemia hirta along roads and trails in Endau Rompin National Park, Malaysia // Trop. Conserv. Sci. 2018. V. 11. P. 1−9. https://doi.org/10.1177/1940082917752818
Ballantyne M., Pickering C.M. Tourism and recreation: a common threat to IUCN red-listed vascular plants in Europe // Biodiversity Conservation. 2013. V. 22. № 13–14. P. 3027−3044.
Горчаковский П.Л., Телегова О.В. Сравнительная оценка уровня синантропизации растительного покрова особо охраняемых природных территорий // Экология. 2005. № 6. С. 403–408. [Gorchakovskii P.L., Telegova O.V. Comparative assessment of the level of plant cover synanthropization in specially protected areas // Rus. J. Ecol. 2005. V. 36. № 6. P. 365–370.]
Guidelines applying protected area management categories [Электронный ресурс]. URL: https://www.iucn.org/ja/content/guidelines-applying-protected-area-management-categories-2008-version (дата обращения: 31.03.2020).
Горчаковский П.Л., Никонова Н.Н., Фамелис Т.В. Растительность и ботанико-географическое деление территории // Определитель сосудистых растений Среднего Урала. М.: Наука, 1994. С. 6−13.
EUNIS – European Nature Information System [Электронный ресурс]. URL: http://eunis.eea.europa.eu/habitats.jsp (дата обращения: 31.03.2020).
The Plant List [Электронный ресурс]. URL: http://www.theplantlist.org/ (дата обращения: 31.03.2020).
Методы изучения лесных сообществ. СПб.: НИИХимии СпбГУ, 2002. 240 с.
Горчаковский П.Л. Антропогенная трансформация и восстановление продуктивности луговых фитоценозов / Отв. ред. Шиятов С.Г. Екатеринбург: “Екатеринбург”, 1999. 155 с.
Третьякова А.С. Флора Екатеринбурга. Екатеринбург: Изд-во Урал. гос. ун-та, 2011. 217 с.
Куликов П.В. Конспект флоры Челябинской области (сосудистые растения). Екатеринбург; Миасс: Геотур, 2005. 537 с.
Князев М.С., Третьякова А.С., Подгаевская Е.Н. и др. Конспект флоры Свердловской области // Фиторазнообразие Восточной Европы. 2017. Т. 11. № 3. С. 4–108.
Красная книга Свердловской области: животные, растения, грибы / Отв. ред. Корытин Н.С. Екатеринбург: ООО “Мир”, 2018. 450 с.
Баранова О.Г., Щербаков А.В., Сенатор С.А. и др. Основные термины и понятия, используемые при изучении чужеродной и синатропной флоры // Фиторазнообразие Восточной Европы. 2018. Т. 12. № 4. С. 4–22.
Горчаковский П.Л., Никонова Н.Н., Фамелис Т.В. Оценка уровня антропогенной трансформации растительного покрова горных территорий // Сибирский экологич. журн. 2009. № 4. С. 579−589.
Ерохина О.В., Пустовалова Л.А. Синантропизация растительного покрова памятников природы р. Чусовая (Средний Урал) // Поволжский экологич. журн. 2013. № 2. С. 222–225.
Веселкин Д.В., Коржиневская А.А., Подгаевская Е.Н. Состав и численность адвентивных и инвазивных кустарников и деревьев подлеска в лесопарках г. Екатеринбурга // Вестник Томского гос. ун-та. Биология. 2018. № 42. С. 102–118.
Веселкин Д.В., Коржиневская А.А. Пространственные факторы адвентизации подлеска в лесопарках крупного города // Изв. РАН. Сер. географ. 2018. № 4. С. 54–64. [Veselkin D.V., Korzhinevskaya A.A. Spatial factors of the alien understory shrubs and trees distribution in urban forests of large city // Izv. Ross. Akad. Nauk. Ser. Geogr. 2018. № 4. P. 54–64.]
Veselkin D.V., Korzhinevskaya A.A., Podaevskaya E.N. The edge effect on the grass and bush layer of urbanized southern taiga forests // Rus. J. Ecol. 2018. V. 49. № 6. P. 411–420.
Горчаковский П.Л., Золотарева Н.В., Коротеева Е.В., Подгаевская Е.Н. Фиторазнообразие Ильменского заповедника в системе охраны и мониторинга / Отв. ред. Мухин В.А. Екатеринбург: “Гощицкий”, 2005. 192 с.
Коротеева Е.В., Куянцева Н.Б., Чащина О.Е. Мониторинг состава и структуры синантропной растительности Ильменского заповедника // Изв. Самарского НЦ РАН. 2014. № 1–4. С. 1213–1217.
Исаченко Г.А., Волкова Е.А., Храмцов В.Н. Динамика лесных ландшафтов Санкт-Петербурга по данным мониторинга особо охраняемых природных территорий // Известия РГО. 2018. Т. 150. № 1. С. 19–43.
Дополнительные материалы отсутствуют.


