Экология, 2020, № 6, стр. 417-426
Разнообразие растений в зарослях инвазивного Sorbaria sorbifolia: разный эффект для травяно-кустарничкового яруса и банка семян
Д. В. Веселкин a, Н. В. Золотарева a, *, Ю. А. Липихина a, Е. Н. Подгаевская a, О. А. Киселева b
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
b Ботанический сад УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202а, Россия
* E-mail: nvp@ipae.uran.ru
Поступила в редакцию 12.05.2020
После доработки 30.05.2020
Принята к публикации 04.06.2020
Аннотация
Оценивали разнообразие вегетирующих растений травяно-кустарничкового яруса и проростков из семян почвенного банка в зарослях инвазивного кустарника Sorbaria sorbifolia в урбанизированных лесах г. Екатеринбурга (Средний Урал, Россия). Геоботанические описания и определение проростков из почвенного банка семян выполнены в разных лесных сообществах: в зарослях инвазивного S. sorbifolia, в зарослях аборигенного Rubus idaeus, в лесных сообществах без S. sorbifolia и R. idaeus. Установлено, что в присутствии S. sorbifolia обилие вегетирующих растений травяно-кустарничкового яруса было ниже в 10–20 раз и более; таксономическое богатство травяно-кустарничкового яруса в описании (α-разнообразие) – ниже в 6–8 раз, общее число видов, зарегистрированных в группе сообществ (γ-разнообразие) – ниже в 3 раза. Исчезновение видов под S. sorbifolia было избирательным. Преимущественно исчезали относительно светолюбивые и относительно сухолюбивые виды, а более тенелюбивые и влаголюбивые виды были устойчивыми. Богатство таксонов и обилие проростков из почвенного банка семян в зависимости от обилия S. sorbifolia не изменялись. Около половины числа выявленных таксонов проростков из почвенного банка семян – это типичные лесные растения, другая половина специфична только для банка семян и в вегетирующем состоянии не зарегистрирована. Сделан вывод, что влияние S. sorbifolia на растительность подчиненных ярусов обусловлено в первую очередь прямым конкурентным и средопреобразующим воздействием, создаваемым живой фитомассой S. sorbifolia.
Инвазии чужеродных организмов, или расселение растений и животных во вторичных ареалах, – характерная черта современного этапа развития биоты [1, 2]. В качестве последствий таких инвазий часто обсуждается снижение разнообразия аборигенных сообществ [3–8], вплоть до исчезновения отдельных видов [9].
Большинство исследований последствий инвазий чужеродных растений основаны на оценках состава вегетирующих растений [10], хотя они только часть общего разнообразия растительных сообществ. Хранилищем определенной доли разнообразия, отражающим прошлые экологические условия и прошлые этапы развития сообществ, являются банки семян [11]. Как правило, банки семян включают виды, которые обладают иными экологическими стратегиями по сравнению со стратегиями вегетирующих видов [12]. Семена, составляющие банк семян, могут быть толерантными и избегать условий среды, неблагоприятных для взрослых особей [13]. Поэтому растения, развивающиеся из банков семян, могут быть пионерами восстановления растительности после нарушений [14, 15].
Особенности трансформации банков семян под влиянием инвазивных растений изучены, по-видимому, хуже, чем трансформация вегетирующих растений. Например, в метаанализах о влиянии инвазий чужеродных растений на сообщества вегетирующих растений указано 216 частных исследований [4], о влиянии на банки семян – 31 [16]. По-видимому, банки семян менее чувствительны к эффектам со стороны инвазивных растений по сравнению с вегетирующей растительностью [17]. В среднем инвазии чужеродных растений приводят к снижению разнообразия и численности банков семян в аборигенных сообществах, но есть большая неопределенность, связанная с особенностями видов и местных условий [16]. Древесные инвазивные растения – деревья и кустарники – меньше преобразуют почвенный банк семян, чем травянистые чужеродные виды [18]. Для уменьшения неопределенности представлений о реакции растительных сообществ, включая банки семян, на внедрение чужеродных растений необходимы специальные сопоставления реакций банков семян и вегетирующих растений.
Цель настоящей работы – оценить разнообразие растений в зарослях инвазивного кустарника Sorbaria sorbifolia путем изучения, во-первых, вегетирующих растений травяно-кустарничкового яруса и, во-вторых, банка семян. Нас интересовало, одинаковы ли изменения состава этих частей растительных сообществ в зарослях S. sorbifolia. Проверяли следующие предположения, сделанные на основе анализа опубликованных данных: 1) разнообразие и вегетирующих растений, и банков семян в зарослях S. sorbifolia снижается; 2) разнообразие вегетирующих растений трансформируется сильнее, чем разнообразие почвенного банка семян.
МАТЕРИАЛ И МЕТОДЫ
Район. Данные собраны в южно-таежной подзоне бореальной зоны Среднего Урала (Россия) на территории г. Екатеринбурга – крупного города с населением 1.5 млн человек. Климат умеренно континентальный, средняя температура +3°C, января –12.6°C, июля +19.0°C, годовая сумма осадков 537 мм. В окрестностях города преобладают сосновые травяные, травяно-кустарничковые и зеленомошные леса [19] на дерново-подзолистых почвах и буроземах. Территория города сильно загрязнена из-за большого числа промышленных предприятий и высокой плотности автотранспортной сети.
Сообщества с S. sorbifolia описаны в лесопарках “Уктусский” и “Юго-Западный”. Преобладающая растительность на их территориях – это остатки условно-коренных относительно одновозрастных лесов из Pinus sylvestris, возникших до начала городской застройки, с деревьями основного поколения 90–120 лет. Лесопарк “Уктусский” расположен на южной окраине города, в 7–11 км от центра и частично граничит с пригородными лесами. Лесопарк расположен в северной части Уктусских гор, которые сложены основными и ультраосновными породами, местами выходящими на дневную поверхность, рельеф изрезан, почвы песчано-глинистые оподзоленные [20]. Лесопарк “Юго-Западный” расположен в 5–7 км от центра города в окружении интенсивно застроенных участков. Леса попали в зону активного освоения 40–45 лет назад [21]. Рельеф – пологие склоны, почвы средне- и слабокаменистые типичные и оподзоленные буроземы, хорошо дренированные [22].
Для Уктусского лесопарка характерны сосновые леса с проективным покрытием травяно-кустарничкового яруса 70–85% с высоким обилием типичных лесных и опушечно-лесных видов (Calamagrostis arundinacea, Vaccinium myrtillus, Brachypodium pinnatum, Carex digitata, Pteridium latiusculum, Rubus saxatilis) и кустарниковым ярусом с покрытием 1–50% с индигенными Rosa acicularis, R. majalis, Rubus idaeus и адвентивными Cotoneaster lucidus, Ribes alpinum и др. В травяном ярусе сосновых лесов Юго-Западного лесопарка, проективное покрытие которого 40–90%, доминируют опушечно-лесные и рудерально-лесные нитрофилы Glechoma hederacea, Urtica dioica, Aegopodium podagraria. Общая черта сообществ обоих лесопарков – выраженный ярус высоких кустарников и деревьев второй величины с присутствием большого числа адвентивных видов [23–25]. Моховой ярус выражен фрагментарно.
Инвазивный вид Sorbaria sorbifolia. На основе анализа онтогенеза вида [26], согласно классификации жизненных форм покрытосеменных растений [27], S. sorbifolia отнесен нами к геоксильным вегетативноподвижным кустарникам. Естественный ареал: Западная и Восточная Сибирь, Дальний Восток, Камчатка, Япония, Корея, Китай, Центральная Азия; растет по берегам, в лесах и на опушках [28]. Во вторичном ареале – инвазивный вид, колонофит, занесен в Черную книгу флоры Средней России [29], вид-трансформер в европейской части России [30]. Внедрение в естественные сообщества отмечено в Восточной Европе. Появление S. sorbifolia в лесопарках г. Екатеринбурга произошло в конце 1950-х гг. в результате искусственных посадок. Число зарегистрированных зарослей S. sorbifolia исчисляется десятками.
Сообщества. Заросли S. sorbifolia – это густые (18–30 шт/м2) скопления многолетних стволиков, которые образуются путем вегетативного латерального разрастания корневищ, соответствуя форме роста клональных растений “фаланга” [31]. Заросли неоднородны по горизонтальной структуре. Легко выделяются две зоны: центральная и периферийная (табл. 1). В сообществах центральной зоны (обозначение IV) кусты S. sorbifolia имеют больший возраст и стволики большего диаметра (5–25 мм) и высоты (1.5–2 м). На периферии зарослей (III) кусты S. sorbifolia более молодые, со стволиками меньшего диаметра (3–10 мм) и высоты (0.5–1 м). В качестве контрольных рассматривали два типа лесных сообществ – с доминированием Rubus idaeus (II) и лесные участки без S. sorbifolia и R. idaeus (I). Заросли R. idaeus изучали, приняв во внимание филогенетическую близость (сем. Rosaceae), одну и ту же жизненную форму (геоксильный вегетативноподвижный кустарник [по: 32]) и сходную ценотическую роль двух кустарников. Все сообщества – I, II, III и IV – относятся к сосновым лесам.
Таблица 1.
Число обследованных площадей и проективное покрытие ярусов растительности в сообществах разных групп
| Группы сообществ |
Число | Покрытие яруса, % (размах на площадь) | |||||
|---|---|---|---|---|---|---|---|
| описаний | площадей (проб) почвы на банк семян | древесного | кустарни-кового | травяно-кустарничкового | мохового | ||
| I ярус | II ярус | ||||||
| I – без Sorbaria sorbifolia и Rubus idaeus | 13 | 3 (9) | 40–90 | 3–70 | 1–60 | 40–95 | 1–88 |
| II – с доминированием R. idaeus | 12 | 3 (9) | 30–60 | 5–55 | 35–90 | 9–95 | 1–70 |
| III – периферия зарослей S. sorbifolia | 13 | – | 30–80 | 10–80 | 70–100 | 1–50 | 1–80 |
| IV – центр зарослей S. sorbifolia | 12 | 3 (9) | 30–70 | 3–65 | 90–100 | 0–5 | 0–40 |
Геоботанические описания. В июне–июле 2019 г. выполнили 50 описаний сообществ вегетирующих растений на площадках размером 10 × 10 м: регистрировали видовой состав и проективное покрытие (в %) растений травяно-кустарничкового яруса, рассчитывали значения индексов Шеннона и Бергера-Паркера. Характеристика видового богатства – плотность видов, т.е. число видов на 100 м2. Анализировали соотношение разных групп видов:
1. По жизненной форме: кустарнички и полукустарнички; травы (двудольные и однодольные травянистые растения с широкими листьями); граминоиды (злаки, осоки, ожики); отдельной жизненной формой считали споровые (папортники, плауны, хвощи).
2. По ценотической приуроченности: лесные, опушечные, прочие [по: 33].
3. По отношению к свету две группы выделены по верхней границе диапазона баллов шкалы освещенности [34]: 3–6 баллов – теневыносливые сциогелиофиты; 7–9 баллов – тенелюбивые сциофиты.
4. По отношению к влажности: гигромезофиты (сюда включили гигрофиты, мезогигрофиты и гигромезофиты); мезофиты; ксеромезофиты.
Названия растений даны по [35].
Банк семян. О составе и обилии банков семян судили по составу и обилию проростков после экспонирования почв в вегетационных сосудах. Почву из верхних 10 см профиля отобрали на двух участках Уктусского и на одном участке Юго-Западного лесопарков в середине июля 2019 г. в трех группах сообществ (I, II и IV) на каждом участке. В каждом сообществе отбирали 3 независимые пробы (повторности). Таким образом, всего было 27 проб: 3 участка × 3 сообщества × 3 повторности. Каждую пробу экспонировали отдельно в пластиковом вегетационном сосуде размером 20 × 15 × 10 см. Объем почвы в сосуде 2 дм3. Почву просеивали через сито 0.5–0.8 см и экспонировали в теплице с поликарбонатным покрытием, умеренно поливая. Учеты проростков выполнены в 5 туров: 18 августа, 19 сентября, 18 октября, 20 ноября, 20 декабря. В каждый тур все доступные для идентификации проростки или особи других онтогенетических состояний выпалывали, гербаризировали и определяли. Часть особей определены до рода или семейства. При анализе их учитывали как отдельный таксон.
Статистический анализ. Для сравнения средних значений признаков использовали однофакторный ANOVA с оценкой попарных различий с помощью критерия Тьюки. При анализе сообществ вегетирующих растений единицей наблюдения считали значение признака в описании, при анализе результатов учета проростков из почвенного банка семян – значение признака в одном вегетационном сосуде или значение для трех вегетационных сосудов с почвой из одного сообщества, что оговаривается отдельно. Признаки, выраженные в долях, перед проведением ANOVA подвергали арксинус-трансформации. Стандартизацию переменных для нивелирования разности средних значений видового богатства и обилия, полученных разными способами, выполнили по формуле
xst = (x – xavg)/σ,
где x и xst – исходное и стандартизированное значения признака; xavg и σ – среднее арифметическое значение и стандартное отклонение признака у вегетирующих растений и проростков из банков семян. При анализе β-разнообразия рассчитывали коэффициенты сходства Брея-Кертиса (обозначение BC) и Чекановского-Съеренсена с помощью программы EstiamateS WiN 910 (12.3.97.96, 4D SAS, 2013). С помощью этой же программы строили кривые разрежения. Расчеты ANOVA выполнены в пакете STATISTICA 8.0 (StatSoft Inc., USA, 1984–2007). При усреднении значений через символ ± при анализе α- и β-разнообразия приведена стандартная ошибка (SE), при анализе γ-разнообразия – стандартное отклонение (SD).
РЕЗУЛЬТАТЫ
Сообщества вегетирующих растений. В ряду сообществ I – II – III – IV покрытие крон кустарников закономерно увеличивалось (см. табл. 1; F(3; 46) = 81.64; P < 0.0001), при этом в центре зарослей S. sorbifolia (IV) по сравнению с сообществами I сомкнутость крон деревьев первого яруса была ниже (см. табл. 1; F(3; 46) = 2.87; P = 0.0467). И в центре зарослей S. sorbifolia (IV), и в зарослях R. idaeus (II) по сравнению с сообществами I была понижена сомкнутость крон деревьев второго яруса (см. табл. 1; F(3; 46) = 7.15; P = 0.0005). Среднее покрытие мохового яруса между группами сообществ не различалось (F(3; 46) = 1.82; P = 0.1562), что связано, по-видимому, с фрагментарной выраженностью этого яруса в урбанизированных лесах.
Наиболее контрастно в связи с доминированием S. sorbifolia различалось состояние травяно-кустарничкового яруса: его среднее проективное покрытие в центре зарослей (IV) было почти на два порядка величин ниже, чем в сообществах без S. sorbifolia и R. idaeus (табл. 2). Дальнейшие оценки приведены для травяно-кустарничкового яруса.
Таблица 2.
α-Разнообразие и групповой состав травяно-кустарничкового яруса в сообществах без Sorbaria sorbifolia и Rubus idaeus (I), с доминированием Rubus idaeus (II), на периферии (III) и в центре (IV) зарослей Sorbaria sorbifolia
| Характеристика | Группы сообществ (m ± SE) | Значимость различий | ||||
|---|---|---|---|---|---|---|
| I | II | III | IV | F | P | |
| Общее проективное покрытие, % | 75.8 ± 4.0c | 51.6 ± 8.0b | 15.4 ± 4.8a | 0.8 ± 0.4a | 45.83 | <0.0001 |
| Число видов на 100 м2 | 41.2 ± 1.95c | 38.3 ± 2.1c | 21.9 ± 1.8b | 5.3 ± 1.9a | 73.73 | <0.0001 |
| Индекс Шеннона | 1.86 ± 0.10b | 1.91 ± 0.10b | 1.75 ± 0.15b | 1.12 ± 0.28a | 4.81 | 0.0057 |
| Индекс Бергера-Паркера | 0.39 ± 0.04 | 0.36 ± 0.03 | 0.37 ± 0.06 | 0.55 ± 0.10 | 1.89 | 0.1460 |
| Доля видов: | ||||||
| по жизненной форме: | ||||||
| кустарнички и полукустарнички | 0.11 ± 0.01 | 0.11 ± 0.01 | 0.13 ± 0.02 | 0.12 ± 0.05 | 0.69 | 0.5605 |
| травы | 0.67 ± 0.01b | 0.67 ± 0.02b | 0.56 ± 0.08b | 0.35 ± 0.09a | 11.09 | <0.0001 |
| граминоиды | 0.16 ± 0.01 | 0.15 ± 0.01 | 0.23 ± 0.01 | 0.32 ± 0.11 | 1.46 | 0.2383 |
| споровые | 0.06 ± 0.01 | 0.06 ± 0.01 | 0.08 ± 0.02 | 0.21 ± 0.11 | 0.76 | 0.5230 |
| по ценотической приуроченности: | ||||||
| лесные | 0.27 ± 0.02 | 0.27 ± 0.02 | 0.32 ± 0.02 | 0.45 ± 0.12 | 1.27 | 0.2959 |
| опушечные | 0.67 ± 0.02 | 0.64 ± 0.03 | 0.59 ± 0.03 | 0.47 ± 0.13 | 1.35 | 0.2717 |
| прочие | 0.06+0.01 | 0.07 ± 0.01 | 0.08 ± 0.02 | 0.08 ± 0.05 | 0.45 | 0.7218 |
| по отношению к свету: | ||||||
| сциофиты | 0.57 ± 0.03 | 0.60 ± 0.02 | 0.69 ± 0.03 | 0.70 ± 0.11 | 1.63 | 0.1975 |
| сциогелиофиты | 0.25 ± 0.02b | 0.23 ± 0.02b | 0.18 ± 0.03b | 0.08 ± 0.04a | 9.57 | <0.0001 |
| по отношению к влажности: | ||||||
| гигромезофиты | 0.06 ± 0.01 | 0.05 ± 0.01 | 0.05 ± 0.02 | 0.08 ± 0.06 | 0.39 | 0.7608 |
| мезофиты | 0.85 ± 0.01 | 0.87 ± 0.01 | 0.87 ± 0.02 | 0.89 ± 0.05 | 2.22 | 0.0999 |
| ксеромезофиты | 0.09 ± 0.01b | 0.06 ± 0.01b | 0.08 ± 0.01b | 0.03 ± 0.02a | 6.59 | 0.0009 |
α-Разнообразие. Видовое богатство травяно-кустарничкового яруса последовательно снижалось в ряду сообществ I и II–III–IV (см. табл. 2). В центре зарослей S. sorbifolia число видов травяно-кустарничкового яруса было меньше в 4 раза, чем на периферии, в 6 раз – чем в зарослях R. idaeus и почти в 8 раз – чем в сообществах без S. sorbifolia и R. idaeus. Изменения в структуре травяно-кустарничкового яруса при доминировании S. sorbifolia видны также по снижению значений индекса Шеннона. При этом изменения уровня доминирования в травяно-кустарничковом ярусе в ряду сообществ I–II–III–IV не произошло.
Некоторые группы видов под пологом S. sorbifolia были менее устойчивы, т.е. состав видов изменялся избирательно. Из видов разных жизненных форм сильнее всего снижались богатство трав и доли сциогелиофитов (Carex montana, Galium boreale и др.) и ксеромезофитов (Pteridium latiusculum, Saussurea controversa и др.); соотношение видов с разной ценотической приуроченностью не изменялось.
β-Разнообразие. Избирательное изменение состава травяно-кустарничкового яруса в присутствии S. sorbifolia видно при анализе значений коэффициентов сходства Брея-Кертиса. Сообщества IV обладают наименьшим сходством как между собой (BC = 0.13 ± 0.03; n = 36), так и с сообществами других групп (BC от 0.08 ± 0.01 до 0.18 ± 0.02; n = 108–117). Относительно гомогенную группу представляют сообщества I и II: среднее сходство (BC) внутри них и между ними составляет от 0.34 ± 0.01 до 0.38 ± 0.02 (n = 66–156). Сообщества на периферии зарослей S. sorbifolia (III) относительно гомогенны внутри себя (BC = = 0.35 ± 0.02; n = 78), но их сходство с другими сообществами невысокое (BC от 0.18 ± 0.02 до 0.28 ± 0.01; n = 117–169).
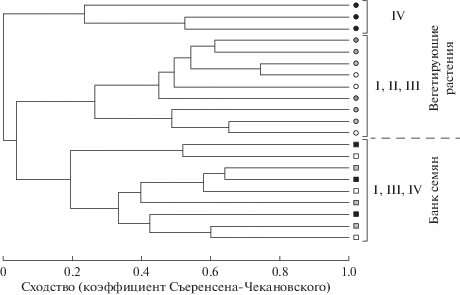
Особенности состава вегетирующих растений в присутствии S. sorbifolia показаны на рис. 1, где сообщества IV объединены в отдельный кластер. При этом невысокие значения сходства на диаграмме в целом и на этом кластере, в частности, указывают на значительный компонент случайности при формировании видового состава сообществ.
Рис. 1.
Сходство состава вегетирующих растений (круги) и банка семян (квадраты) в лесных сообществах без Sorbaria sorbifolia и Rubus idaeus (белые фигуры, I), в сообществах с доминированием Rubus idaeus (светло-серые фигуры, II), на периферии (темно-серые фигуры, III) и в центре (черные фигуры, IV) зарослей Sorbaria sorbifolia. Способ построения – среднее присоединение. Для диаграммы использованы сведения о составе вегетирующих растений только с тех пробных площадей, в которых отбирали почву для анализа банков семян. Единица наблюдения при анализе банка семян – виды, обнаруженные за 5 туров учета в 3 сосудах с одной пробной площади.
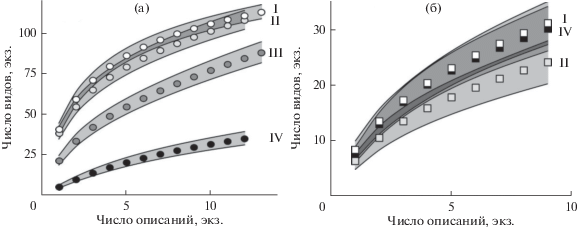
γ-Разнообразие. Из 143 зарегистрированных вегетирующих видов травяно-кустарничкового яруса в сообществах I отмечено 113 видов, II – 108, III – 88, IV – 35 (рис. 2а), т.е. γ-разнообразие травяно-кустарничкового яруса в присутствии S. sorbifolia в 3 раза ниже, чем на участках без S. sorbifolia и R. idaeus. В последних наибольшую активность имеют лесные и опушечно-лесные виды: Calamagrostis arundinacea, Brachypodium pinnatum, Pteridium latiusculum, Carex digitata, Rubus saxatilis, Glechoma hederacea, Vaccinium myrtillus, V. vitis-idaea, Maianthemum bifolium. В зарослях R. idaeus высоко активны также нитрофильные Aegopodium podagraria и Urtica dioica. В центре зарослей S. sorbifolia 2/3 видов – это обычные виды окружающих лесных сообществ. Ни одного уникального таксона, который был бы зарегистрирован только в сообществах IV, не обнаружено.
Рис. 2.
Кривые разрежения числа обнаруженных вегетирующих видов с ростом числа описаний (а, круги) и числа видов проростков из почвенного банка семян с ростом числа обследованных сосудов (б, квадраты) в лесных сообществах без Sorbaria sorbifolia и Rubus idaeus (белые фигуры, I), в сообществах с доминированием Rubus idaeus (светло-серые фигуры, II), на периферии (темно-серые фигуры, III) и в центре (черные фигуры, IV) зарослей Sorbaria sorbifolia. Полосы погрешности – SD.
При анализе полных видовых списков сообществ I–IV хорошо видно неоднородное исчезновение видов при усилении ценотической роли кустарников. В ряду сообществ I–II–III–IV соотношение числа видов гелиосциофитов и сциофитов постепенно смещается к выраженному преобладанию тенелюбивых сциофитов: 46, 51, 53 и 80% соответственно.
Банк семян. α-Разнообразие. Видовое богатство проростков из почвенного банка семян характеризовали, подсчитывая число таксонов, установленное за 5 туров наблюдения: 1) в одном сосуде; 2) в трех сосудах (повторности почвы из одного сообщества на одной пробной площади). В первом случае число таксонов в разных сообществах было следующим: I – 8.3 ± 0.8; II – 6.3 ± 1.0; IV – 7.6 ± 1.0 видов/сосуд. При подсчете числа таксонов в трех сосудах оценки видового богатства были выше: I – 15.7 ± 2.9; II – 13.0 ± 2.0; IV – 13.0 ± ± 1.0 видов/3 сосуда. Но в обоих случаях различия между сообществами I, II и IV незначимы: первый способ подсчета – F(2; 24) = 1.09 (P = 0.3537); второй способ – F(2; 6) = 0.65 (P = 0.5550). Также не удалось установить изменения числа проростков в связи с ценотической обстановкой, в которой отбирали почву: I – 34 ± 7; II – 29 ± 5; IV – 25 ± 5 проростков/сосуд (F(2; 24) = 0.72; P = 0.4953).
β-Разнообразие. В составе проростков из банка семян во всех сообществах не обнаружено каких-либо заметных особенностей. Внутри групп и между группами сообществ средние значения коэффициента сходства Брея-Кертиса варьировали в диапазоне 0.19–0.27 и группы сообществ не различались между собой. Данные рис. 1 демонстрируют, что состав проростков из почвенного банка качественно отличается от состава вегетирующих растений, но заметной кластеризации разных совокупностей проростков не наблюдается.
γ-Разнообразие. Из 49 зарегистрированных в составе банка семян видов в сообществах I отмечен 31 вид, II – 24, IV – 30. С учетом диапазонов варьирования этих оценок (рис. 2б) различия между разными сообществами отсутствуют. В целом в составе видов, проросших из банка семян, преобладают многолетники. Наиболее обычными среди видов, представленных и среди вегетирующих растений, и среди проростков из банка семян, были Betula spp., Carex pediformis var. macroura, C. montana, Epilobium angustifolium, Fragaria vesca, Glechoma hederacea, Luzula pilosa, Ranunculus monophyllus, Sambucus sibirica, Urtica dioica, Veronica chamaedrys, Viola nemoralis. В банке семян S. sorbifolia отмечен только под кронами S. sorbifolia, а Rubus idaeus встречен во всех группах сообществ – и на лесных участках без S. sorbifolia и R. idaeus, и под кронами R. idaeus, и под кронами S. sorbifolia. Почти половина таксонов, проросших из банка семян (21 вид из 49), не были зарегистрированы в составе вегетирующих растений. Наиболее обычными среди таксонов, специфичных только для банка семян, были Cirsium arvense, Epilobium sp., Melilotus sp., Plantago major, Poa pratensis, Sonchus arvensis.
ОБСУЖДЕНИЕ
Абсолютные оценки α- и γ-разнообразия вегетирующих растений и проростков из банка семян не сопоставимы между собой из-за методических особенностей их получения: например, площади обследования при полевых описаниях (100 м2) и при проращивании семян из банка почвы (площадь поверхности почвы в трех сосудах – 0.09 м2) различаются на 3 порядка. Это одна из причин меньшей выявленности состава проростков из банка семян по сравнению с вегетирующими растениями. На основе экстраполяции кривых разрежения общее ожидаемое число вегетирующих видов в травяно-кустарничковом ярусе может быть оценено в 160–180 видов, а в банке семян – около 100 видов, т.е. общее гамма-разнообразие травяно-кустарничкового яруса выявлено, по-видимому, на 80–90%, а банка семян – на 50% или менее. Ограничения выявляемости видов в банке семян, вероятно, связаны также с небольшим периодом экспозиции почвы. Однако то обстоятельство, что среди проростков зарегистрированы виды, отсутствующие среди вегетирующих растений, свидетельствует о том, что нами выявлены виды не только из активного, но и из покоящегося банка семян, отражающего давние этапы развития сообществ. Это подтверждается тем, что в банке семян представлены типичные луговые, а также раннесукцессионные рудеральные и сорные виды.
В любом случае сравнение абсолютных оценок разнообразия вегетирующих растений и проростков из банка семян не оправдано. Имеет смысл сравнивать только динамику разнообразия в ряду изученных сообществ. Поэтому сопоставление для α-разнообразия выполнено на стандартизированных данных (рис. 3). Хорошо видна качественная однонаправленность снижения видового богатства под кронами S. sorbifolia как для вегетирующих растений, так и для банка семян, а также статистически значимый характер динамики богатства между сообществами I–II и IV в первом случае и отсутствие значимости такой динамики во втором.
Рис. 3.
Стандартизированное видовое богатство вегетирующих видов (круги) и проростков из почвенного банка семян (квадраты) в лесных сообществах без Sorbaria sorbifolia и Rubus idaeus (белые фигуры, I), в сообществах с доминированием Rubus idaeus (светло-серые фигуры, II) и в центре зарослей Sorbaria sorbifolia (черные фигуры, IV). Полосы погрешности – SE. Одинаковыми буквенными индексами показаны гомогенные по критерию Тьюки значения. Для сопоставимости сообщества III опущены.
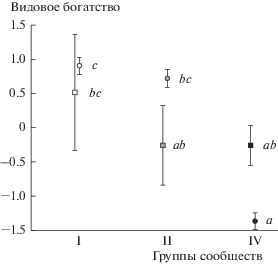
Результаты анализа разнообразия на α-, β- и γ‑уровнях хорошо согласуются между собой: α- и γ-разнообразие вегетирующих растений заметно снижается в зарослях S. sorbifolia, при этом β-разнообразие – среднее несходство описаний между собой – под кронами S. sorbifolia, по-видимому, выше, чем в окружающих лесах. Изменения характеристик α-, β- и γ-разнообразия проростков в связи с обилием S. sorbifolia не наблюдаются или не доказаны. Таким образом, наша первая рабочая гипотеза справедлива частично, а вторая – полностью: разнообразие вегетирующих растений в присутствии S. sorbifolia трансформируется сильно, но про разнообразие почвенного банка семян нельзя утверждать что-то определенное. Это заключение хорошо соответствует массиву опубликованных сведений: 1) разнообразие аборигенных сообществ в присутствии чужеродных растений снижается [3–6, 8, 9], в том числе в присутствии S. sorbifolia [7]; 2) чувствительность банков семян к эффектам со стороны инвазивных растений ниже, чем у вегетирующей растительности [17]; 3) чужеродные деревья и кустарники меньше преобразуют почвенный банк семян, чем травы [18].
В отличие от других активных на Среднем Урале чужеродных растений, например Acer negundo, Heracleum sosnowskyi или Impatiens glandulifera, природно-климатическая обстановка и видовые композиции сообществ в г. Екатеринбурге и естественном ареале S. sorbifolia сходны, так как естественный ареал S. sorbifolia локализован в той же природной зоне и его граница проходит в 1–1.5 тыс. км восточнее города. Поэтому можно ожидать, что S. sorbifolia может легко и успешно интегрировать в местные сообщества. В некотором отношении это, по-видимому, справедливо: во вторичном ареале S. sorbifolia эффективно опыляется насекомыми [36], а его семена поедают птицы [37]. Об отсутствии однозначно негативного воздействия S. sorbifolia на аборигенные сообщества свидетельствует стабильность характеристик разнообразия почвенного банка семян вне зависимости от его доминирования. Например, под североамериканским Acer negundo в г. Екатеринбурге снижается разнообразие и вегетирующих растений [8], и проростков из банка семян [38].
От большинства чужеродных растений региона S. sorbifolia отличается клональным ростом в форме фаланги и отсутствующим или слабым семенным возобновлением. Распространено представление, что во вторичном ареале вероятность размножения S. sorbifolia семенами мала [29]. Однако самосев у S. sorbifolia во вторичном ареале возможен [28]; по нашим данным, в почве под взрослыми растениями есть жизнеспособные семена. Несмотря на это, многолетнее удержание занятых участков – по экспертным оценкам до 50–60 лет – происходит с помощью вегетативного возобновления системы многолетних побегов. Это признак позднесукцессионного вида с конкурентной стратегией и чертами стресс-толерантности, так как S. sorbifolia относительно теневынослив. Сравнение степени редукции числа видов под S. sorbifolia и A. negundo [8] подтверждает еще одну глобальную закономерность – о наиболее радикальном снижении разнообразия аборигенных сообществ под влиянием инвазивных видов с клональной формой роста [4].
Густые сомкнутые заросли S. sorbifolia с высотой листового слоя до 1.5–2 м не имеют аналогов в лесных сообществах региона. Многолетние заросли с близкой густотой и морфологией побегов, но не в лесах под пологом деревьев, а на открытых участках, могут формировать R. idaeus (обычно на гарях или вырубках) и Filipendula ulmaria (в условиях переувлажнения). Возможно, чтобы надежнее оценить специфичность влияния S. sorbifolia, оправдано использование в качестве контрольных вариантов не только типичных лесных сообществ, но и сравнимых по густоте заросли аборигенных R. idaeus и F. ulmaria.
Густой полог листьев и побегов S. sorbifolia может перехватывать ресурсы, прежде всего свет: с одной стороны, есть оценки, что освещенность под пологом S. sorbifolia и R. idaeus сопоставима и трансформация светового режима не объясняет изменения видового состава травянистых растений в их зарослях [7]; с другой стороны, затенение – ключевой фактор организации растительных сообществ, который часто обсуждается как механизм влияния инвазивных растений [39, 40]. По нашим данным, затенение нельзя исключать как фактор трансформации напочвенного покрова под пологом S. sorbifolia, так как, во-первых, S. sorbifolia формирует под пологом сосны более плотные заросли, чем любой аборигенный вид подлеска, и, во-вторых, под S. sorbifolia в первую очередь исчезают относительно светолюбивые сциогелиофиты и сухолюбивые ксеромезофиты, а более тенелюбивые и влаголюбивые виды устойчивы. Еще один часто дискутируемый механизм влияния инвазивных растений на местные виды – аллелопатия [41, 42], или влияние с помощью вторичных метаболитов на почвенные организмы [43, 44]. Надземные органы S. sorbifolia содержат большое количество биологически активных веществ, в том числе и токсичные химические соединения [45, 46], поэтому их аллелопатические воздействия на аборигенные сообщества не исключены.
ЗАКЛЮЧЕНИЕ
Наши результаты свидетельствуют о том, что в присутствии S. sorbifolia состав и обилие вегетирующих растений лесных сообществ изменяются сильно, а состав почвенного банка семян не претерпевает заметных изменений. Это закономерно, учитывая изолированность банков семян от актуальных экологических воздействий и их предназначенность для длительного сохранения и переживания неблагоприятных воздействий. Влияние S. sorbifolia на растительность подчиненных ярусов обусловлено, по-видимому, прямым конкурентным и средопреобразующим воздействием, создаваемым живой фитомассой S. sorbifolia. В практическом отношении это означает, что способность к восстановлению растительного покрова из семенного банка после сильных нарушений на участках, занятых и не занятых S. sorbifolia, качественно не отличается. Возможно также, что инвазивный потенциал S. sorbifolia недооценен. Комплекс черт позднесукцессионного вида позволяет S. sorbifolia вегетативно внедряться в малонарушенные и, возможно, ненарушенные лесные сообщества, что отличает его от большинства других чужеродных видов и позволяет однозначно считать трансформером, влияющим как на режим абиотических факторов в занятых им местообитаниях, так и на состояние сообществ аборигенных растений.
Полевой этап исследований выполнен в рамках государственного задания Института экологии растений и животных УрО РАН (№ АААА-А19-119031890084-6), эксперимент по прорастанию банков семян – в рамках госзадания Ботанического сада УрО РАН, анализ данных – в рамках проекта РФФИ № 20-54-00024.
Авторы декларируют отсутствие конфликта интересов.
Список литературы
Wilcove D.S., Rothstein D., Dubow J. et al. Quantifying threats to imperiled species in the United States // Bioscience. 1998. V. 48. № 8. P. 607–615.
Kleunen van M., Dawson W., Essl F. et al. Global exchange and accumulation of non-native plants // Nature. 2015. V. 525. P. 100–103. https://doi.org/10.1038/nature14910
Vilà M., Espinar J.L., Hejda M. et al. Ecological impacts of invasive alien plants: a meta-analysis of their effects on species, communities and ecosystems // Ecol. Lett. 2011. V. 14. № 7. P. 702–708. https://doi.org/10.1111/j.1461-0248.2011.01628.x
Vilà M., Rohr R.P., Espinar J.L. et al. Explaining the variation in impacts of non-native plants on local-scale species richness: the role of phylogenetic relatedness // Global Ecol. Biogeogr. 2015. V. 24. № 2. P. 139–146. https://doi.org/10.1111/geb.12249
Maron J.L., Marler M. Effects of native species diversity and resource additions on invader impact // Am. Nat. 2008. V. 172. № 1. P. 18–33. https://doi.org/10.1086/588303
Hejda M., Pyšek P., Jarošík V. Impact of invasive plants on the species richness, diversity and composition of invaded communities // J. Ecol. 2009. V. 97. № 3. P. 393–403. https://doi.org/10.1111/j.1365-2745.2009.01480.x
Lanta V., Hyvönen T., Norrdahl K. Non-native and native shrubs have differing impacts on species diversity and composition of associated plant communities // Plant. Ecol. 2013. V. 214. № 12. P. 1517–1528. https://doi.org/10.1007/s11258-013-0272-0
Veselkin D.V., Dubrovin D.I. Diversity of the grass layer of urbanized communities dominated by invasive Acer negundo // Rus. J. Ecol. 2019. V. 50. № 5. P. 413–421. https://doi.org/10.1134/S1067413619050114
Blackburn T.M., Bellard C., Ricciardi A. Alien versus native species as drivers of recent extinctions // Front. Ecol. Environ. 2019. V. 17. № 4. P. 203–207. https://doi.org/10.1002/fee.2020
Levine J.M., Vilà M., D’Antonio C.M. et al. Mechanisms underlying the impacts of exotic plant invasions // Proc. R. Soc. Lond. B. 2003. V. 270. P. 775–781. https://doi.org/10.1098/rspb.2003.2327
Thompson J. Plant evolution in the Mediterranean. Oxford: Oxford Univ. Press, 2005. 293 p.
Pickett S.T.A., McDonnell M.J. Seed bank dynamics in temperate deciduous forest // Ecology of soil seed banks / Leck M.A., Parker V.T., Simpson R.L. Eds. San Diego, CA: Academic Press Inc. 1989. P. 123–147. https://doi.org/10.1016/B978-0-12-440405-2.50013-0
Fenner M., Thompson K. The ecology of seeds. Ed. 2. Cambridge: Cambridge Univ. Press, 2005. 260 p.
Vilà M., Gimeno I. Does invasion by an alien plant species affect the soil seed bank? // J. Veg. Sci. 2007. V. 18. № 3. P. 423–430. https://doi.org/10.1111/j.1654-1103.2007.tb02554.x
Gioria M., Pyšek P., Moravcová L. Soil seed banks in plant invasions: promoting species invasiveness and long-term impact on plant community dynamics // Preslia. 2012. V. 84. № 2. P. 327–350.
Gioria M., Jarošík V., Pyšek P. Impact of invasions by alien plants on soil seed bank communities: emerging patterns // Perspect. Plant Ecol. Evol. Syst. 2014. V. 16. № 3. P. 132–142. https://doi.org/10.1016/j.ppees.2014.03.003
Gooden B., French K. Impacts of alien grass invasion in coastal seed banks vary amongst native growth forms and dispersal strategies // Biol. Conserv. 2014. V. 171. P. 114–126. https://doi.org/10.1016/j.biocon.2014.01.005
Gioria M., Osborne B.A. Resource competition in plant invasions: emerging patterns and research needs // Front. Plant Sci. 2014. V. 5. № 501. https://doi.org/10.3389/fpls.2014.00501
Куликов П.В., Золотарева Н.В., Подгаевская Е.Н. Эндемичные растения Урала во флоре Свердловской области. Екатеринбург: “Гощицкий”, 2013. 610 с.
Сторожева М.М. Флора и растительность Уктусских гор (Средний Урал). Свердловск: УНЦ АН СССР, 1987. 67 с.
Шавнин С.А., Веселкин Д.В., Воробейчик Е.Л. и др. Факторы трансформации сосновых насаждений в районе города Екатеринбурга // Лесоведение. 2015. № 5. С. 346–355. [Shavnin S.A., Veselkin D.V., Vorobeichik E.L. et al. Factors of pine-stand transformation in the city of Yekaterinburg // Contemp. Probl. Ecol. 2016. № 7. P. 844–852. doi 10.1134/S199542551607009X]
Веселкин Д.В., Кайгородова С.Ю. Связь между агрохимическими свойствами почв урбанизированных лесов и строением эктомикориз сосны обыкновенной // Агрохимия. 2013. № 11. С. 63–71.
Золотарёва Н.В., Подгаевская Е.Н., Шавнин С.А. Изменение структуры напочвенного покрова сосновых лесов в условиях крупного промышленного города // Изв. Оренбургского гос. аграр. ун-та. 2012. № 5(37). С. 218–221.
Веселкин Д.В., Коржиневская А.А., Подгаевская Е.Н. Состав и численность адвентивных и инвазивных кустарников и деревьев подлеска в лесопарках г. Екатеринбурга // Вестник Томского гос. ун-та. Биология. 2018. № 42. С. 102–118. [Veselkin D.V., Korzhinevskaya A.A., Podgayevskaya E.N. The species composition and abundance of alien and invasive understory shrubs and trees in urban forests of Yekaterinburg. Vestnik Tomskogo gosudarstvennogo universiteta. Biologiya // Tomsk State University J. of Biology. 2018. V. 42. P. 102–118. https://doi.org/10.17223/19988591/42/5]10.17223/19988591/42/5
Веселкин Д.В., Коржиневская А.А. Пространственные факторы адвентизации подлеска в лесопарках крупного города // Изв. РАН. Сер. географич. 2018. № 4. С. 54–64. https://doi.org/10.1134/S2587556618040167
Мазуренко М.Т., Хохряков А.П. Структура и морфогенез кустарников. М.: Наука, 1977, 160 с.
Серебряков И.Г. Жизненные формы высших растений и их изучение // Полевая геоботаника. М.; Л.: Наука, 1964. Т. 3. С. 146–205.
Фирсов Г.А., Ткаченко К.Г. О качестве семян Sorbaria sorbifolia и Sorbaria Krilowii (Rosaceae), интродуцированных на северо-западе России // Бюл. Ботанического сада-института. 2016. № 16. С. 22–28.
Виноградова Ю.К., Майоров С.Р., Хорун Л.В. Черная книга флоры Средней России: чужеродные виды растений в экосистемах Средней России. М.: ГЕОС, 2010. 512 с.
Панасенко Н.Н. Растения-“трансформеры”: признаки и особенности выделения // Вестник Удмуртского ун-та. 2013. Сер. 6. Вып. 2. С. 17–22.
Ye X.H., Yu F.H., Dong M. A trade-off between guerrilla and phalanx growth forms in Leymus secalinus under different nutrient supplies // Ann Bot. 2006. V. 98. № 1. P. 187–191. https://doi.org/10.1093/aob/mcl086
Давлетшина Г.Т., Уланова Н.Г. Малина обыкновенная // Биологическая флора Московской области. М.: Изд-во МГУ, Изд-во “Аргус”, 1996. Вып. 12. С. 89–112.
Куликов П.В. Конспект флоры Челябинской области. Екатеринбург–Миасс: “Геотур”, 2005. 537 с.
Цыганов Д.Н. Фитоиндикация экологических режимов в подзоне хвойно-широколиственных лесов. М.: Наука, 1983. 196 с.
The World Checklist of Vascular Plants (WCVP) [Электронный ресурс]. URL: https://wcvp.science.kew.org/ (дата обращения: 26.05.2020).
Gosling D.C.L. Ecology of the Cerambycidae (Coleoptera) of the Huron Mountains in Northern Michigan // Great Lakes Entomol. 1986. V. 19. № 3. P. 153–162.
Москвичёв А.Н., Бородин О.В., Корепов М.В., Корольков М.А. Птицы города Ульяновска: видовой состав, распространение, лимитирующие факторы и меры охраны. Ульяновск: Изд-во “Корпорация технологий продвижения”, 2011. 280 с.
Веселкин Д.В., Киселева О.А., Екшибаров Е.Д. и др. Богатство и численность проростков из почвенного банка семян в куртинах инвазивного вида Acer negundo L. // Рос. журн. биол. инвазий. 2018. № 1. С. 18–25. [Veselkin D.V., Kiseleva O.A., Ekshibarov E.D. et al. Abundance and diversity of seedlings of the soil seed bank in the monospecific stands of the invasive species Acer negundo L. // Rus. J. Biol. Invasions. 2018. V. 9. № 2. P. 108–113. doi 10.1134/S2075111718020133]
Reinhart K.O., Gurnee J., Tirado R., Callaway R.M. Invasion through quantitative effects: intense shade drives native decline and invasive success // Ecol. Appl. 2006. V. 16. № 5. P. 1821–1831. https://doi.org/10.1890/1051-0761(2006)016[1821:itqeis ]2.0.co;2
Bravo-Monasterio P., Pauchard A., Fajardo A. Pinus contorta invasion into treeless steppe reduces species richness and alters species traits of the local community // Biol. Invasions. 2016. V. 18. P. 1883–1894. https://doi.org/10.1007/s10530-016-1131-4
Dorning M., Cipollini D. Leaf and root extracts of the invasive shrub, Lonicera maackii, inhibit seed germination of three herbs with no autotoxic effects // Plant Ecol. 2006. V. 184. № 2. P. 287–296.
Kumar A.S., Bais H.P. Allelopathy and exotic plant invasion // Plant communication from an ecological perspective. Signaling and communication in plants / Eds. Baluška F., Ninkovic V. Berlin, Heidelberg: Springer. 2010, P. 61–74.
Callaway R.M., Thelen G.C., Rodriguez A., Holben W.E. Soil biota and exotic plant invasion // Nature. 2004. V. 427. P. 731–733.
Stinson K.A., Campbell S.A., Powell J.R. et al. Invasive plant suppresses the growth of native tree seedlings by disrupting belowground mutualisms // PLoS Biol. 2006. V. 4. № 5. https://doi.org/10.1371/journal.pbio.0040140
Растительные ресурсы России: Дикорастущие цветковые растения, их компонентный состав и биологическая активность. Т. 2. Семейства Actinidiaceae — Malvaceae, Euphorbiaceae — Haloragaceae / Отв. ред. Буданцев А.Л. Спб.; М.: Тов-во науч. изд. КМК, 2009. 513 с.
Qu G.W., Wu C.J., Gong S.Z. et al. Leucine-derived cyanoglucosides from the aerial parts of Sorbaria sorbifolia (L.) A. Braun // Fitoterapia. 2016. V. 111. P. 102–108. https://doi.org/10.1016/j.fitote.2016.03.015
Дополнительные материалы отсутствуют.


