Экология, 2020, № 6, стр. 450-456
Влияние кормовых растений на жизнеспособность боярышницы Aporia crataegi L. при низкой плотности природной популяции
Е. Ю. Захарова a, b, *, А. О. Шкурихин a, И. А. Солонкин a, Т. С. Ослина a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
b Уральский федеральный университет им. Первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: zakharova@ipae.uran.ru
Поступила в редакцию 20.02.2020
После доработки 25.05.2020
Принята к публикации 29.05.2020
Аннотация
Проанализированы закономерности взаимодействия насекомого-олигофага боярышницы (Aporia crataegi L.) с кормовыми растениями в годы с низким уровнем плотности природной популяции. В годы стабильно разреженного состояния популяции боярышницы на юге Свердловской области (Сысертский район) видовой состав кормовых растений гусениц постепенно сужается от нескольких (древесные розоцветные родов Padus, Sorbus, Malus, Crataegus) до одного вида (Padus avium Mill.). Показано, что смертность гусениц V возраста, развивавшихся на рябине, выше, чем развивавшихся на черемухе. Имаго боярышницы, развивающиеся на черемухе, не только крупнее, но и растут быстрее, чем на рябине, что может являться дополнительной причиной наблюдаемой хронографической изменчивости в ходе лёта генерации боярышницы в природе.
Различные аспекты взаимодействия насекомых-фитофагов и их кормовых растений изучены весьма полно как с точки зрения представлений теоретической экологии популяций и сообществ [1–4 и др.], так и с точки зрения прикладных дисциплин (сельскохозяйственной и лесной энтомологии, защиты и карантина растений и т.д. [5–7]). Отдельное внимание в последнее время уделяется изучению влияния изменений климата на взаимодействие насекомых с растениями [8]. Насекомые-фитофаги и их взаимоотношения с кормовыми растениями – удобная модель для изучения экологической специализации и связанной с ней эволюции сообществ [9–12].
Одним из наиболее интересных остается вопрос о выборе кормового растения олигофагами и полифагами. В литературе обсуждается гипотеза о том, что самки фитофагов предпочитают откладывать яйца на то кормовое растение, при развитии на котором выживаемость и продуктивность потомства оказываются выше (preference-performance hypothesis (PPH)). В двухкомпонентной системе фитофаг–кормовое растение (т.е. без учета конкуренции, хищничества, паразитизма, мутуализма и т.д.) PPH-гипотеза подтверждается [10]. Однако в природных условиях изолированные пары фитофаг–кормовое растение не встречаются, вследствие чего в литературе существуют данные как в поддержку, так и против этой гипотезы.
Нам кажется интересным и актуальным рассмотреть некоторые аспекты экологии насекомого-фитофага при взаимодействии с разными кормовыми растениями в естественной среде. В качестве модельного объекта выбрана боярышница (Aporia crataegi L.), у которой, согласно нашим наблюдениям и литературным данным [13–16], на Среднем Урале и в соседних регионах в 2010–2013 гг. продолжалась вспышка массового размножения. В последующие годы наблюдений (2014–2019 гг.) наступила фаза разреживания, и популяция перешла в стабильно разреженное состояние. Изучение популяций насекомых на низком уровне плотности представляется не менее актуальным, чем продромальных и эруптивных состояний [17].
Цель данной работы – проанализировать закономерности взаимодействия насекомого-олигофага, характеризующегося эруптивным типом динамики численности, с кормовыми растениями в годы с низким уровнем плотности природной популяции. Для выполнения этой цели перед нами стояли задачи выявить видовой состав кормовых растений гусениц боярышницы, а также оценить жизнеспособность гусениц в зависимости от развития на разных кормовых растениях в естественных условиях.
МАТЕРИАЛ И МЕТОДЫ
Характеристика объекта исследования. Боярышница – полифаг на древесных розоцветных (Rosaceae) и вересковых (Ericaceae) с четко выраженной зональной олигофагией [18]. К настоящему моменту достаточно подробно описаны не только пищевая специализация гусениц в разных частях ареала, но и некоторые особенности физиологии [7, 19–21], поведения, миграционных способностей, расселения [22, 23] и динамики численности [24–26] вида.
На значительной части ареала (европейская часть России, Урал, Сибирь) основной кормовой породой гусениц боярышницы является черемуха (Padus avium Mill.), заросли которой представляют собой естественные резервации, откуда бабочки постоянно расселяются в садовые и парковые насаждения [25–27]. В садах, а также городских агломерациях, на луговых суходолах и вблизи населенных пунктов сельского типа предпочитаемым кормовым растением гусениц боярышницы в Уральском и сопредельных регионах является яблоня (Malus spp.) [13, 15].
Выбранная нами популяция обитает в окрестностях биостанции Уральского федерального университета (УрФУ) в Сысертском районе Свердловской области (56°36´ с.ш., 61°03´ в.д.). Данная территория расположена в Сысертском округе подзоны предлесостепных сосново-березовых лесов, преобладающие растительные сообщества которого представлены южно-таежными и предлесостепными сосновыми травяно-кустарничковыми и травяными лесами, вторичными березовыми и сосново-березовыми травяными лесами [28]. Здесь в подлеске сосняков из древесных и кустарниковых розоцветных присутствуют в основном черемуха Padus avium Mill., рябина Sorbus aucuparia L., изредка – яблоня Malus baccata (L.) Borkh. и единично – боярышник Crataegus sanguinea Pall.
Материал. Для выявления видового состава кормовых растений в 2013–2019 гг. осуществляли поиск зимующих гнезд с гусеницами младших возрастов. Количество собранных гнезд с разных кормовых растений в 2013–2018 гг. приведено в работах [16, 29], а в 2019 г. сборы гнезд продолжили ранней весной до выхода гусениц с зимовки (6 апреля) и осенью после ухода на зимовку (13 сентября).
Гусениц V возраста собирали с двух кормовых растений (черемухи и рябины) в конце мая в теплые годы (2014–2016) или в течение первой декады июня, если температура воздуха в мае была низкой и развитие гусениц протекало медленно (2013, 2017–2018 гг.). Всего было собрано 2822 гусеницы (табл. 1). Дополнительно в 2016 г. были собраны куколки (202 экз. – с черемухи, 16 – с рябины). В 2019 г. плотность гусениц на обследованной территории была настолько низкой вследствие депрессии численности, что нам не удалось собрать репрезентативную выборку (всего было найдено 6 гусениц на черемухе, 3 – на рябине).
Таблица 1.
Объем выборок и смертность гусениц в ходе выращивания боярышницы в 2013–2018 гг. (Свердловская обл., Сысертский р-н)
| Сроки сбора гусениц | Кормовое растение | Кол-во гусениц V возраста, экз. |
Смертность гусениц, % | Сроки вылета имаго* | Кол-во имаго, экз.* |
|---|---|---|---|---|---|
| 1–6.06.2013 | Черемуха | 285 | 93.0 | $\frac{{19 - 23.06}}{{20 - 26.06}}$ | $\frac{2}{{18}}$ |
| Рябина | 107 | 93.5 | $\frac{{21 - 27.06}}{{21 - 23.06}}$ | $\frac{5}{2}$ | |
| 22–24.05.2014 | Черемуха | 363 | 28.4 | $\frac{{14 - 22.06}}{{15 - 24.06}}$ | $\frac{{63}}{{184}}$ |
| Рябина | 260 | 48.8 | $\frac{{14 - 21.06}}{{18.06 - 1.07}}$ | $\frac{{52}}{{\begin{array}{*{20}{c}} {74} \end{array}}}$ | |
| 28.05–1.06.2015 | Черемуха | 310 | 23.9 | $\frac{{14 - 19.06}}{{16 - 22.06}}$ | $\frac{{104}}{{132}}$ |
| Рябина | 261 | 61.7 | $\frac{{16 - 20.06}}{{16 - 21.06}}$ | $\frac{{52}}{{52}}$ | |
| 24–26.05.2016 | Черемуха | 238 | 90.3 | $\frac{{8 - 17.06}}{{9 - 20.06}}$ | $\frac{{56}}{{66}}$ |
| Рябина | 202 | 90.6 | $\frac{{10 - 21.06}}{{12 - 21.06}}$ | $\frac{{14}}{{12}}$ | |
| 31.05–9.06.2017 | Черемуха | 330 | 59.4 | $\frac{{26.06 - 9.07}}{{27.06 - 15.07}}$ | $\frac{{44}}{{96}}$ |
| Рябина | 262 | 72.9 | $\frac{{29.06 - 13.07}}{{29.06 - 17.07}}$ | $\frac{{31}}{{39}}$ | |
| 6–11.06.2018 | Черемуха | 174 | 64.4 | $\frac{{1 - 8.07}}{{2 - 10.07}}$ | $\frac{{26}}{{36}}$ |
| Рябина | 30 | 83.3 | $\frac{{8.07}}{{8 - 10.07}}$ | $\frac{1}{4}$ |
В день сбора гусениц и куколок взвешивали на весах марки Kern 440-21N с точностью до 1 мг и нумеровали. Каждую гусеницу содержали индивидуально в пластиковом контейнере объемом 0.5 л, закрытом хлопчатобумажной тканью, выкармливали свежей листвой того кормового растения, с которого она была собрана. Контейнеры находились на открытом стеллаже под кронами деревьев при неконтролируемых условиях. Каждый контейнер проверяли ежедневно до момента вылета имаго либо гибели особи. Регистрировали дату и причину гибели гусениц или куколок, дату окукливания и вылета имаго. У всех имаго в день вылета измеряли сырую массу тела на тех же весах с точностью до 1 мг.
Уровень смертности гусениц оценивали во все годы исследования, анализ изменчивости массы тела имаго, выращенных на разных кормовых растениях, проводили только за период с 2014 г. по 2017 г. из-за отсутствия репрезентативных выборок с рябины в 2013 и 2018 гг. (см. табл. 1).
Методы статистического анализа. Изменчивость размеров (массы тела) в течение периода вылета имаго оценивали с помощью регрессионного анализа в программе PAST 2.17 [30]. Исходные результаты взвешиваний усредняли для каждого дня наблюдения. Анализ проводили независимо для каждой выборки с учетом пола и года отлова. Первым днем наблюдений считали дату вылета первого имаго. Календарные сроки вылета имаго в течение 2013–2018 гг. приведены в табл. 1. Смертность гусениц старших возрастов на разных кормовых растениях сравнивали при помощи критерия χ2.
С помощью дисперсионного анализа со смешанными эффектами оценили влияние на массу гусениц факторов “кормовое растение” и “здоровье гусеницы”. Под “здоровьем гусеницы” подразумевается один из двух вариантов: окукливание и последующий вылет имаго либо гибель от паразитоидов и инфекций. В анализе “кормовое растение” и “здоровье гусеницы” были фиксированными факторами, а год сбора материала – случайным. Влияние на массу имаго факторов “кормовое растение” и “пол” также оценили дисперсионным анализом со смешанными эффектами (“кормовое растение” и “пол” – фиксированные, а год сбора материала – случайный фактор). Расчеты проводили в среде R [31].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В течение ряда лет наблюдений за состоянием природной популяции боярышницы в окрестностях биостанции УрФУ мы обнаружили, что в последний год вспышки массового размножения (2013) и последующий (2014) гусеницы развивались на различных видах древесных розоцветных: черемухе, рябине, яблоне, боярышнике. С 2015 г. по 2018 г. зимующие гнезда с гусеницами боярышницы ранних возрастов находили в основном на черемухе, в меньшей степени – на рябине и в виде исключения – на яблоне и боярышнике. В апреле 2018 г. мы смогли найти несколько гнезд на рябине, но уже в августе–сентябре того же года, после лёта следующей генерации, а также в 2019 г. гнезда располагались исключительно на черемухе. Таким образом, по нашим наблюдениям в Сысертском районе Свердловской области, в годы стабильно разреженного состояния популяции видовой состав кормовых растений гусениц боярышницы сужается от нескольких до одного вида.
При выращивании гусениц V возраста в индивидуальных садках часть из них гибла в результате различных причин. В основном гибель гусениц была вызвана наездниками семейства Braconidae, а также вирусными и грибковыми инфекциями. Среди инфекций преобладал вирус ядерного полиэдроза (det. А.В. Ильиных).
Хорошо известно, что уровень смертности гусениц поздних возрастов и куколок боярышницы в природе может быть очень высоким. Так, в 1962 г. в Свердловской области выживаемость имаго составила всего 5.6%, что привело к резкому снижению численности и окончанию вспышки массового размножения [32]. Согласно нашим данным, смертность гусениц V возраста в последний год наблюдаемой вспышки массового размножения (2013) также была очень высока – 93%. В течение ряда лет стабильно разреженного состояния уровень смертности варьировал в широких пределах (см. табл. 1).
Как правило, смертность гусениц, развивавшихся на рябине, была выше, чем развивавшихся на черемухе. Сравнение уровня смертности гусениц на двух кормовых растениях показало наличие значимой разницы (χ2 = 15.8, d.f. = 5, p = 0.008). В целом за период с 2013 г. по 2018 г. смертность гусениц на черемухе составляла в среднем 59.9%, на рябине – 75.1%. По-видимому, достаточно высокий средний уровень смертности гусениц поздних возрастов является одной из причин низкой плотности популяции в эти годы.
Поскольку в природе рост и конечная масса тела гусениц последнего возраста перед окукливанием зависят от многих условий (сумма накопленных градусо-дней, эффективность потребления корма, биохимический, в том числе антибиозный, состав листвы и т. д.) некорректно проводить межгодовые сравнения массы гусениц, которые могут продолжать рост. Сравнение гусениц, собранных одновременно с разных кормовых растений, достаточно информативно.
По результатам дисперсионного анализа влияние обоих анализируемых факторов (“кормовое растение” и “здоровье гусеницы”) и их взаимодействие оказались значимыми (табл. 2). Естественно, что масса гусениц, зараженных паразитоидами и инфекциями, была значимо меньше, чем масса здоровых гусениц. Так, масса зараженных гусениц, собранных с черемухи за все годы исследования, составила в среднем 260.1 ± 3.8 мг, а здоровых – 393.7 ± 4.4 мг. Средние значения массы гусениц, развивавшихся на рябине, значимо меньше соответствующих показателей для гусениц, развивавшихся на черемухе, – 217.5 ± 4.1 и 377.3 ± 6.2 мг.
Таблица 2.
Результаты дисперсионного анализа массы гусениц V возраста боярышницы
| Фактор | SS | d.f. | MS | F | p |
|---|---|---|---|---|---|
| “Кормовое растение” | 1 499 925 | 1 | 1499 925 | 136.13 | <0.001 |
| “Здоровье гусеницы” | 7 847 349 | 1 | 7847349 | 741.90 | <0.001 |
| “Кормовое растение” × “здоровье гусеницы” | 99 519 | 1 | 99519 | 9.40 | <0.01 |
| “Год” | 8344 | 4 | 2086 | ||
| Остаточная дисперсия | 27 278 083 | 2579 | 10577 |
По литературным и нашим данным [14, 24, 26], для боярышницы характерен половой диморфизм размеров: в целом самки крупнее самцов. Результаты дисперсионного анализа массы тела имаго боярышницы приведены в табл. 3: факторы “пол” и “кормовое растение” статистически значимо влияют на изменчивость размеров имаго, а взаимодействие этих факторов незначимо. Влияние случайного фактора “год” обусловлено как скоростью роста и накоплением градусо-дней, что связано с погодными условиями конкретного года, так и с тем, что гусениц взвешивали в день сбора, а не перед окукливанием, и они продолжали питаться и расти в садках. Средние значения массы тела имаго самцов и самок боярышницы, выращенных на черемухе и рябине в 2013–2018 гг., приведены в табл. 4. Согласно полученным результатам, наиболее крупные имаго – самки, развивавшиеся на черемухе, наиболее мелкие – самцы, развивавшиеся на рябине. В то же время средние значения массы самцов с черемухи оказываются сопоставимы со средней массой имаго самок, выкормленных на рябине (например, в 2015 г.), и половой диморфизм размеров нивелируется.
Таблица 3.
Результаты дисперсионного анализа массы имаго боярышницы
| Фактор | SS | d.f. | MS | F | p |
|---|---|---|---|---|---|
| “Пол имаго” | 374 159 | 1 | 374 159 | 180.78 | <0.001 |
| “Кормовое растение” | 161 420 | 1 | 161 420 | 77.99 | <0.001 |
| “Пол имаго” × “кормовое растение” | 7257 | 1 | 7257 | 3.50 | 0.06 |
| “Год” | 4040 | 4 | 1010 | ||
| Остаточная дисперсия | 2 051 370 | 991 | 2070 |
Таблица 4.
Средние значения массы тела имаго боярышницы при выращивании гусениц на разных кормовых растениях в 2013–2018 гг.
| Кормовое растение | Пол | Год | |||||
|---|---|---|---|---|---|---|---|
| 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | ||
| Черемуха | Самцы | 166.0 ± 31.8 | 191.2 ± 5.6 | 159.9 ± 4.5 | 119.5 ± 31.8 | 128.3 ± 6.8 | 115.9 ± 17.3 |
| Самки | 223.2 ± 10.6 | 255.0 ± 3.3 | 187.5 ± 3.9 | 173.9 ± 10.1 | 159.9 ± 4.6 | 123.9 ± 14.1 | |
| Рябина | Самцы | 139.3 ± 26.0 | 181.9 ± 6.2 | 129.0 ± 6.2 | 97.2 ± 15.0 | 120.8 ± 8.0 | – |
| Самки | 189.0 ± 31.8 | 206.4 ± 5.2 | 158.5 ± 6.2 | 167.7 ± 14.2 | 148.3 ± 7.2 | 131.8 ± 20.6 | |
При развитии на черемухе гусеницы, по-видимому, эффективнее используют усвоенную энергию корма, чем при питании на рябине. По мнению некоторых авторов [7], экологические цены потребления корма гусеницами боярышницы и эффективность потребления корма можно сравнить с данными экспериментов по потреблению корма гусеницами непарного шелкопряда. Т.А. Вшивковой [33, 34] было показано, что рябина по сравнению с черемухой неблагоприятна для роста гусениц непарного шелкопряда, поскольку ее листья содержат вторичные соединения, влияющие на их использование и потребление. Кроме того, энергетическая ценность листьев черемухи была больше по сравнению с листьями рябины. Имаго боярышницы, развивающиеся на рябине, не только мельче, но и растут дольше, чем на черемухе. Несмотря на то, что гусениц с обоих кормовых растений всегда собирали одновременно, вылет имаго при выращивании гусениц на рябине запаздывал от одного до нескольких дней по сравнению с имаго, выращенными на черемухе (см. табл. 1 и рис. 1 ). Регрессионный анализ выявил статистически значимую зависимость размеров тела от дня вылета (за исключением выращенных на рябине имаго самцов в 2017 г. и самок в 2016 г.). Данные результаты согласуются и дополняют полученные нами ранее [14]: первоначально вылетают наиболее крупные имаго, последними появляются наиболее мелкие вне зависимости от пола и кормового растения гусениц. Показано, что чем крупнее самка боярышницы, тем более она плодовита [7, 21], что в целом характерно для многих насекомых [35–37].
Рис. 1.
Изменчивость массы тела имаго боярышницы в ходе вылета самцов и самок при выращивании на разных кормовых породах в 2014 (а), 2015 (б), 2016 (в), 2017 (г) гг.
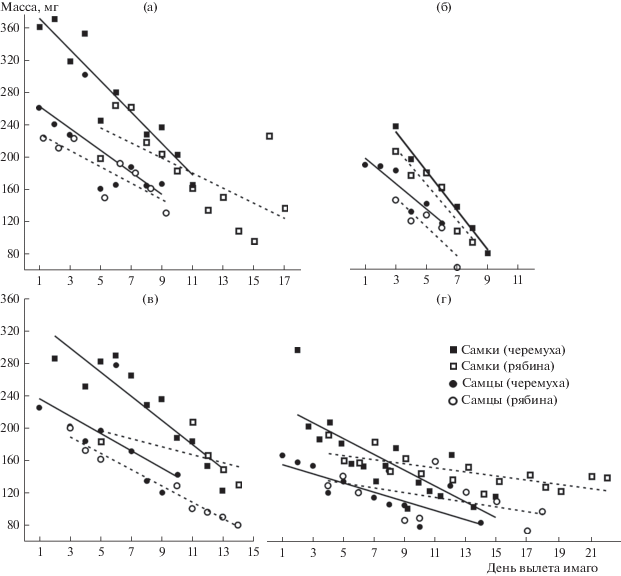
Следовательно, хронографическую изменчивость имаго боярышницы в ходе лёта ее генерации в природе можно описать следующим образом: первыми вылетают наиболее крупные самцы, развившиеся на черемухе, затем первые крупные самки с черемухи и относительно мелкие самцы с рябины, последними – самки, развившиеся на рябине. Последними из куколок появляются самые мелкие самцы и самки, развившиеся на рябине. Таким образом, дополнительной причиной наблюдаемой хронографической изменчивости в ходе лёта генерации боярышницы в природе является не только более ранний вылет крупных имаго, но и неодновременный вылет имаго, развивающихся на разных кормовых породах (крупных – с черемухи, мелких – с рябины).
В течение вспышки массового размножения боярышница в наших условиях развивалась на нескольких кормовых растениях, среди которых предпочитаемым видом была черемуха. Согласно гипотезе PPH (preference-performance hypothesis), самки насекомых предпочитают откладывать яйца на то кормовое растение, при развитии на котором выживаемость и продуктивность потомства выше [10]. Однако в условиях снижения плотности популяции и соответственно уменьшения конкуренции за пищевой ресурс не происходит мгновенного перехода от олигофагии к монофагии на наиболее предпочитаемом кормовом растении. Напротив, в течение нескольких лет при низкой плотности популяции самки боярышницы продолжают откладывать яйца на рябину, несмотря на более высокий уровень смертности гусениц старших возрастов, растянутый во времени период преимагинального развития и меньшую плодовитость имаго вследствие мелких размеров. Полученные нами результаты свидетельствуют о том, что в годы после вспышки массового размножения при снижении плотности популяции боярышница переходит от олигофагии практически к монофагии постепенно.
Многолетний сбор полевого материала, камеральная обработка, анализ и интерпретация результатов выполнены в рамках темы государственного задания Института экологии растений и животных УрО РАН № ААААА19-119031890087-7 при финансовой поддержке Комплексной программы фундаментальных исследований УрО РАН (проект № 18-4-4-28).
Авторы выражают благодарность д.б.н. А.В. Ильиных (Институт экологии и систематики животных СО РАН, Новосибирск) за определение вируса ядерного полиэдроза боярышницы. Мы также признательны сотрудникам Уральского федерального университета (г. Екатеринбург) А.В. Иванову, П.В. Рудоискателю, К.И. Фадееву за помощь при проведении экспериментальных работ на биостанции.
Список литературы
Чернышев В.Б. Экология насекомых. М.: Изд-во МГУ, 1996. 304 с.
Whitman D., Ananthakrishnan T.N. Phenotypic plasticity of insects: mechanisms and consequences. CRC Press, 2009. 904 p.
Schowalter T. Insect ecology. An Ecosystem Approach. Cambridge, MA: Academic Press, 2011. 650 p.
Sot T., Kagata H., Ando Y. et al. Species diversity and community structure. Novel patterns and processes in plants, insects, and fungi. Tokyo, Heidelberg, New York, Dordrecht, London: Springer, 2014. 70 p.
Надзор, учет и прогноз массовых размножений хвое- и листогрызущих насекомых в лесах СССР. М.: Лесная пром., 1965. 524 с.
Насекомые и клещи – вредители сельскохозяйственных культур. Т. III. Чешуекрылые. Ч. 2. СПб.: Наука, 1999. 410 с.
Исаев А.С., Пальникова Е.Н., Суховольский В.Г., Тарасова О.В. Динамика численности лесных насекомых-филлофагов: модели и прогнозы. М.: КМК, 2015. 262 с.
Уткина И.А., Рубцов В.В. Современные представления о влиянии изменений климата на взаимодействие лесных деревьев и насекомых-фитофагов // Лесной вестник / Forestry Bulletin. 2017. V. 21. № 6. С. 5–12. https://doi.org/10.18698/2542-1468-2017-6-5-12
Rundle H.D., Nosil P. Ecological speciation // Ecology Letters. 2005. V. 8. P. 336–352.
Gripenberg S., Mayhew P.J., Parnell M., Roslin T. A meta-analysis of preference-performance relationships in phytophagous insects // Ecology Letters. 2010. V. 13. P. 383–393.
Matsubayashi K.W., Ohshima I., Nosil P. Ecological speciation in phytophagous insects // Entomologia Experimentalis et Applicata. 2010. V. 134. P. 1–27.
De la Masseliere M.C., Facon B., Hafsi A., Duyck P.-F. Diet breadth modulates preference-performance relationships in a phytophagous insect community // Scientific Reports. 2017. V. 7. P. 16934. https://doi.org/10.1038/s41598-017-17231-2
Богачева И.А., Замшина Г.А., Николаева Н.В. Массовые и многочисленные насекомые-филлофаги деревьев и кустарников Екатеринбурга // Фауна Урала и Сибири. 2018. № 1. С. 46–73.
Шкурихин А.О., Захарова Е.Ю., Ослина Т.С., Солонкин И.А. Изменчивость морфофизиологических признаков самцов и самок Aporia crategi L. (Lepidoptera: Pieridae) в зависимости от времени вылета имаго // Экология. 2018. № 4. С. 325–330. [Shkurikhin, A.O., Zakharova, E.Y., Oslina, T.S., Solonkin I.A. Variation in morphophysiological traits of male and female Aporia crataegi L. (Lepidoptera: Pieridae) depending on the timing of adult emergence // Rus. J. of Ecology. 2018. V. 49. № 4. P. 356–361.https://doi.org/10.1134/S1067413618040124]https://doi.org/10.7868/S036705971804011X
Адаховский Д.А. Новые данные по внутривидовым экологическим стратегиям дневных чешуекрылых (Lepidoptera: Hesperioidea, Papilionoidea) Удмуртии // Труды Ставропольского отделения Русского энтомологического общества. Вып. 15: Мат-лы XII междун. научно-практич. интернет-конф. Ставрополь: Параграф, 2019. С. 64–67.
Захарова Е.Ю., Шкурихин А.О., Ослина Т.С., Солонкин И.А. Влияние экологических факторов на соотношение ранних возрастов гусениц боярышницы Aporia crataegi L. (Lepidoptera: Pieridae) при уходе на зимовку в условиях Среднего Урала // Евразиатский энтомол. журн. 2019. Т. 18. № 4. С. 292–300.
Исаев А.С., Овчинникова Т.М., Пальникова Е.Н. и др. Динамика численности и устойчивость популяций лесных насекомых на низком уровне плотности (на примере сосновой пяденицы Bupalus piniarius L.) // Лесоведение. 2014. № 4. С. 3–11.
Баранчиков Ю.Н. Трофическая специализация чешуекрылых. Красноярск: ИЛиД СО АН СССР, 1987. 171 с.
Баранчиков Ю.Н. Трофическая специализация и эффективность питания гусениц двух видов чешуекрылых листьями кустарниковых розоцветных // Зоол. журн. 1986. Т. 65. Вып. 3. С. 361–368.
Ли Н.Г. Физиолого-биохимические адаптации Aporia crataegi L. (Lepidoptera, Pieridae) к сухому и холодному климату Центральной Якутии // Евразиатский энтомол. журн. 2006. Т. 5. № 2. С. 173–180.
Тарасова О.В., Калашникова И.И., Кузнецова В.В. Энергетический баланс потребления корма насекомыми-филлофагами: оптимизационная модель // Сибирский лесной журн. 2015. № 3. С. 83–92.
Jugovic J., Črne M., Luźnik M. Movement, demography and behaviour of a highly mobile species: A case study of the black-veined white, Aporia crataegi (Lepidoptera: Pieridae) // Eur. J. Entomol. 2017. V. 114. P. 113–122.
Jugovic J., Kržič A. Behavior and oviposition preferences of a black-veined white, Aporia crataegi (Lepidoptera: Pieridae) // J. of Entomological and Acarological Research. 2019. V. 51. I. 2. P. 51–59.
Кузнецова В.В. Боярышница (Aporia crataegi L.) в пригородных насаждениях г. Красноярска: биология, динамика численности, взаимодействие с кормовыми растениями: Автореф. дис. … канд. биол. наук. Красноярск, 2004. 18 с.
Кузнецова В.В., Пальникова Е.Н. Анализ основных популяционных показателей боярышницы (Aporia crataegi L.) в пригородных насаждениях г. Красноярска // VII чтения памяти О.А. Катаева. Вредители и болезни древесных растений России: Мат-лы междун. конф. СПб.: СПбГЛТУ, 2013. С. 51–52.
Кузнецова В.В., Пальникова Е.Н. Факторы динамики численности боярышницы (Aporia crataegi L.) в пригородных насаждениях г. Красноярска // Изв. Санкт-Петербургской лесотехн. академии. 2014. № 34. С. 49–59.
Бабенко З.С. Насекомые-фитофаги плодовых и ягодных растений лесной зоны Приобья. Томск: Изд-во Томск. ун-та, 1982. 270 с.
Куликов П.В., Золотарева Н.В., Подгаевская Е.Н. Эндемичные растения Урала во флоре Свердловской области. Екатеринбург: “Гощицкий”, 2013. 610 с.
Захарова Е.Ю., Шкурихин А.О., Ослина Т.С., Ключерева И.Д. Успешность зимовки гусениц разных возрастов боярышницы Aporia crataegi L. (Lepidoptera: Pieridae) на Среднем Урале // Евразиатский энтомол. журн. 2015. Т. 14. № 2. С. 144–148.
Hammer O., Harper D.A.T., Ryan P.D. PAST: Paleontological Statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4. № 1. 9 p.
R Core Team. R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing, 2019. URL: https://www.R-project.org/ (дата обращения 15.02.2020).
Тураев Н.С. Паразиты и их роль в подавлении массового размножения боярышницы // Труды Свердловского сельскохозяйственного ин-та. 1964. Т. 11. С. 331–335.
Вшивкова Т.А. Энергетика питания и роста гусениц разных возрастов непарного шелкопряда // Журн. общ. биол. 1989. Т. 50. № 1. С. 108–115.
Вшивкова Т.А. Биохимические компоненты, определяющие качество кормовых растений для гусениц непарного шелкопряда (Lymantria dispar L.) начальных возрастов // Изв. Санкт-Петербургской лесотехн. академии. СПб., 2009. Вып. 187. С. 87–96.
Blanckenhorn W.U. The evolution of body size: what keeps organisms small? // Quarterly review of biology. 2000. V. 75. P. 385–407.
Tammaru T., Esperk T., Castellanos I. No evidence for costs of being large in females of Orgyia spp. (Lepidoptera, Lymantriidae): larger is always better // Oecologia. 2002. V. 133. P. 430–438.
Flatt T., Heyland A. Mechanisms of life history evolution: the genetics and physiology of life history traits and trade-offs. Oxford: Oxford Univ. Press, 2011. 512 p.
Дополнительные материалы отсутствуют.


