Экология, 2021, № 1, стр. 66-76
Многолетняя динамика сообществ мелких млекопитающих в период снижения выбросов медеплавильного завода. 1. Состав, обилие и разнообразие
С. В. Мухачева *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: msv@ipae.uran.ru
Поступила в редакцию 19.05.2020
После доработки 23.06.2020
Принята к публикации 29.06.2020
Аннотация
Анализировали многолетнюю динамику состава, суммарного обилия и разнообразия (α- и γ-) сообществ мелких млекопитающих (ММ) в зоне действия крупного медеплавильного завода в периоды высоких (1990–1997 гг.), сниженных (1998–2009 гг.) и почти прекратившихся (2010–2019 гг.) выбросов. Показано, что за 30 лет наблюдений реакция сообществ ММ на загрязнение принципиально не изменилась. В каждый из трех периодов при увеличении загрязнения регистрировали значимое снижение суммарного обилия, α-разнообразия сообществ и индекса доминирования, при этом γ‑разнообразие в фоновой (13 видов) и загрязненных (12 видов) зонах оставалось сходным. Сокращение выбросов не оказало существенного влияния на сообщество ММ фоновой (условно чистой) зоны: флуктуации видовой структуры были незначительны, структура доминирования не изменилась, а увеличение численности животных к концу наблюдений (за счет лесных полевок, но не насекомоядных) было связано с сукцессионными изменениями растительности. В окрестностях завода сокращение выбросов вызвало смену доминантов, а тренды изменения обилия не совпадали в буферной (увеличение) и импактной (отсутствие изменений) зонах. Увеличение обилия видов разных трофических групп (фитофагов, семеноядов, зоофагов) в умеренно загрязненной (буферной) зоне можно считать признаком начальных стадий восстановления вследствие улучшения качества местообитаний. В сильно загрязненной (импактной) зоне позитивные сдвиги в сообществе ММ выражены в меньшей степени – они проявляются в увеличении доли бурозубок.
Многолетняя работа металлургических предприятий приводит к формированию вокруг них техногенных геохимических аномалий – фоновые уровни загрязняющих веществ, в том числе тяжелых металлов (ТМ), превышены в десятки и сотни раз [1–3]. Промышленное загрязнение воздействует на все компоненты природных экосистем, оказывая как прямое токсическое действие, приводящее к элиминации наименее устойчивых звеньев, так и опосредованное – через изменение качества среды обитания, межвидовой конкуренции, резистентности особей к внешним факторам и др.
В последние десятилетия в большинстве стран Европы и Северной Америки техногенная эмиссия ксенобиотиков значительно снизилась в результате сокращения объемов производства и/или совершенствования технологий. Повышенное внимание исследователей обращено к процессам восстановления нарушенных территорий в окрестностях таких предприятий [1, 4–18]. При этом особый интерес представляют процессы самопроизвольной, т.е. без прямого участия человека, реабилитации территорий, позволяющие исследовать механизмы и интенсивность естественного восстановления природных экосистем.
Характер начальных стадий восстановления биоты в ответ на сокращение выбросов различается в зависимости от объектов, продолжительности и интенсивности воздействия источника загрязнения, а также его природно-географического положения. Одни исследователи ожидают быстрое восстановление экосистем до их исходного состояния [13, 15, 17], другие, напротив, полагают, что на реабилитацию потребуется значительное время даже после полного прекращения выбросов [4, 7, 11, 14, 18]. Высказано также мнение, что после снижения загрязнения экосистемы не возвращаются к исходному состоянию, а модифицируются, приобретая новые свойства [19, 20].
Сложности трактовки наблюдаемых изменений связаны с дефицитом документированных данных о динамике восстановления различных компонентов биоты. Даже при наличии информации об исходном состоянии изучаемых объектов в период интенсивного загрязнения (именно с этим аспектом зачастую связаны наибольшие проблемы) для корректных сравнений новые данные необходимо собирать на тех же участках с использованием единых методик. В противном случае пространственную вариабельность сравниваемых параметров можно ошибочно принять за их временную динамику [4]. Важно, чтобы исследования охватывали достаточно длительный интервал, поскольку кратковременные (до 10 лет) наблюдения не позволяют дифференцировать восстановление в результате сокращения выбросов от межгодовых флуктуаций. Кроме того, рассмотрение ограниченного набора видов не позволяет распространить результаты на группу в целом.
Мелких млекопитающих (ММ) часто рассматривают в качестве модельных объектов различных экологических и экотоксикологических исследований из-за их значительной роли в наземных экосистемах, широкого распространения, высокой численности, оседлости и эврибионтности [21]. Изучение реакции ММ на промышленное загрязнение обычно ограничивается анализом видового состава и численности населения [8, 22–26] либо оценками уровней накопления отдельных элементов в органах и тканях модельных видов [11, 14, 27, 28], иногда с привлечением материалов по морфологии, биохимии и генетике [16, 29–33]. В большинстве работ население ММ исследуют непродолжительно (1–3 года), получая лишь «моментальные срезы» сообществ, а длительные наблюдения единичны [8–10, 34, 35]. При сокращении промышленных выбросов в сообществах ММ отмечены позитивные сдвиги (увеличиваются видовое богатство и обилие отдельных видов), но темпы изменений невелики. Недостаток информации не позволяет пока сделать однозначные выводы о характере структурных перестроек в сообществах ММ в условиях снижающейся техногенной нагрузки. Это определяет необходимость дальнейших исследований ММ, обитающих в зоне действия точечных источников загрязнения, расположенных в разных природных зонах.
Наши работы вблизи Среднеуральского медеплавильного завода (СУМЗ) охватывают 30 лет, которые пришлись на периоды высоких (1990–1997 гг., I период), сниженных (1998–2009 гг., II) и почти прекратившихся (2010–2019 гг., III) выбросов. Полученные материалы позволяют провести анализ многолетней динамики состава и численности сообществ ММ. Долговременные исследования динамики других компонентов биоты, выполненные в окрестностях СУМЗа на одних и тех же участках в сходные сроки, показали, что даже после многократного сокращения объемов промышленных выбросов в непосредственной близости от источника эмиссии продолжается гибель древостоя, отсутствуют восстановительные процессы в травяно-кустарничковом ярусе [4, 12]. Угнетенное состояние лесных экосистем авторы [1, 36] связывают с крайне медленным очищением верхних горизонтов почвы от ТМ и сохранением мощного слоя слаборазложившейся лесной подстилки. В то же время в сообществах почвенных беспозвоночных [5] и насекомоядных млекопитающих [37] наметились определенные позитивные сдвиги, которые выражаются в увеличении обилия и сдвиге границы распространения ряда групп (дождевые черви, моллюски, крот) в сторону завода. В этих условиях интерес представляют многолетние наблюдения, касающиеся других компонентов биоты, в частности ММ.
Цель настоящей работы – анализ 30-летней динамики видовой структуры сообществ ММ, их разнообразия и обилия в зоне действия крупного медеплавильного завода в период сокращения его выбросов. Нам не известны работы, в которых на основе длительных ежегодных наблюдений сопоставлялись ключевые параметры сообществ ММ (видовой состав, обилие, α- и γ-разнообразие) до и после сокращения выбросов. Мы тестировали гипотезу о том, что снижение техногенной нагрузки в результате сокращения промышленных выбросов приведет к увеличению суммарного обилия и разнообразия сообществ ММ, а также предположили, что на сильно загрязненных участках позитивные сдвиги будут выражены в меньшей степени по сравнению с умеренно загрязненными.
МАТЕРИАЛ И МЕТОДЫ
Источник выбросов. Исследования проведены в зоне воздействия атмосферных выбросов Среднеуральского медеплавильного завода (СУМЗ), расположенного возле г. Ревды, в 50 км к западу от г. Екатеринбурга. Предприятие работает с 1940 г., основные ингредиенты выбросов – газообразные соединения S, F и N, а также пылевые частицы с сорбированными ТМ (Cu, Pb, Zn, Cd, Fe, Hg) и металлоидами (As). В 1980-е гг. валовые выбросы СУМЗа достигали 225 тыс.т/год, что делало предприятие одним из крупнейших источников промышленного загрязнения в России. В течение 1990-х гг. объем выбросов сократился в 2 раза – со 148 тыс. т в 1990 г. до 65 тыс. т в 1999 г; в последующие 10 лет снижение было еще более выраженным – с 63 тыс. т в 2000 г. до 22 тыс. т в 2009 г.; с 2010 г., после завершения реконструкции, валовые выбросы не превышают 3–5 тыс. т/год [1, 38].
Район исследований. Ключевые участки расположены в елово-пихтовых лесах на удалении 1–30 км к западу от СУМЗа (против господствующего направления ветров) и охватывали территории с разной степенью поражения экосистем. По мере приближения к заводу происходит угнетение древесного яруса, уменьшаются видовое богатство и обилие травяно-кустарничкового яруса. Выраженность этих процессов в разных зонах нагрузки неодинакова: фоновая зона (20–30 км от завода) характеризует относительно ненарушенное состояние, которое обусловлено действием только региональных выпадений поллютантов; в буферной зоне (4–10 км) отмечаются структурные перестройки экосистем, вызванные действием локального загрязнения; в импактной зоне (1–3 км) структура экосистем кардинально отличается от фонового состояния – здесь представлены крайние варианты техногенной дигрессии сообществ [1, 39]. В импактной зоне до 2012 г. не было зарегистрировано позитивных сдвигов в состоянии напочвенного покрова, тогда как на других участках разнообразие и обилие растительности увеличились [4, 12]. Впрочем эти изменения были связаны не столько с уменьшением уровня загрязнения, сколько с осветлением древесного полога после массового вывала, вызванного ураганом 1995 г. Техногенная трансформация почв проявилась в повышенной аккумуляции ТМ, увеличении кислотности, формировании мощной оторфованной лесной подстилки [36]. В настоящее время почвы возвращаются к облику исходных лесных почв, однако содержание ТМ (за исключением Cu) в подстилке и гумусовом горизонте во всех зонах остается стабильно высоким [1].
Отлов животных проводили ежегодно с 1990 г. по 2019 г. (за исключением 1999 и 2001 гг.) в три тура (с мая по сентябрь) на стационарных маркированных линиях в пределах 7 ключевых участков: 3 – в импактной зоне (1, 1.5 и 2 км от завода), 2 – в буферной (4 и 6 км), 2 – в фоновой (20 и 30 км). За прошедшие годы часть линий была утрачена в результате локальных лесных пожаров, ветровалов и рубок. Новые линии размещали на прилегающих территориях, максимально приближенных к исходным условиям (Приложение, рис. 1 ). Для отлова использовали деревянные ловушки-плашки, размещенные по 25 шт. в линию через 5–7 м друг от друга; экспозиция составляла 3–5 сут с ежедневной однократной проверкой. В течение тура животных отлавливали одновременно во всех зонах, располагая на каждом участке от 2 до 4 линий. Использование стационарных точек отлова позволило существенно снизить влияние пространственной неоднородности условий.
Принимая во внимание ограничения метода ловушко-линий и недостатки плашек в качестве орудий лова (избирательный вылов некоторых групп ММ, зависимость от погодных условий), на смежных территориях регулярно проводили дополнительные учеты животных с использованием других схем и средств (живоловок, конусов, ловушек Барбера). Это позволило уточнить видовой состав сообществ ММ в разных зонах и оценить миграционную подвижность животных. Однако массовый материал для анализа динамических изменений сообществ в градиенте загрязнения был получен при использовании метода ловушко-линий (плашек): отработано 96.8 тыс. ловушко-суток (в том числе на загрязненных участках – 66.7 тыс., на фоновых – 30.1 тыс.), отловлен 5551 экз. ММ (в том числе на загрязненных участках – 2516, на фоновых – 3008) (Приложение, табл. 1). Видовую идентификацию особей [40, 41] проводили в камеральных условиях, названия видов соответствуют сводке “Mammals species of the World” [42].
Таблица 1.
Состав населения ММ и относительное обилие отдельных видов (особей/100 лов.-сут) в окрестностях СУМЗ в периоды высоких (I), сниженных (II) и почти прекращенных (III) выбросов
| Характеристика сообщества | Зона и период | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| фоновая (20–30 км) | буферная (4–6 км) | импактная (1–2 км) | |||||||
| I | II | III | I | II | III | I | II | III | |
| Обыкновенная бурозубка (Sorex araneus) | 0.93 ± 0.10 | 0.39 ± 0.06 | 0.73 ± 0.08 | 0.20 ± 0.04 | 0.01 ± 0.02 | 0.28 ± 0.06 | 0.28 ± 0.04 | 0.03 ± 0.02 | 0.03 ± 0.01 |
| Средняя бурозубка (S. caecutiens) | 0.17 ± 0.04 | 0.17 ± 0.04 | 0.60 ± 0.08 | 0.27 ± 0.05 | 0.34 ± 0.08 | 0.87 ± 0.10 | 0.20 ± 0.04 | 0.14 ± 0.04 | 0.58 ± 0.06 |
| Равнозубая бурозубка (S. isodon) | 0.26 ± 0.05 | 0.21 ± 0.05 | 0.14 ± 0.04 | 0.02 ± 0.01 | – | 0.03 ± 0.02 | 0.01 ± 0.01 | – | – |
| Малая бурозубка (S. minutus) | 0.03 ± 0.02 | – | 0.03 ± 0.02 | 0.01 ± 0.01 | – | 0.01 ± 0.01 | 0.03 ± 0.01 | – | 0.01 ± 0.01 |
| Крот европейский (Talpa europaea) | 0.05 ± 0.02 | 0.02 ± 0.01 | 0.02 ± 0.01 | – | – | – | – | – | – |
| Малая лесная мышь (Apodemus uralensis) | 0.32 ± 0.06 | 0.42 ± 0.06 | 0.71 ± 0.08 | 0.27 ± 0.05 | 0.68 ± 0.10 | 0.93 ± 0.10 | 0.62 ± 0.06 | 0.26 ± 0.06 | 0.33 ± 0.04 |
| Полевая мышь (Ap. agrarius) | – | – | 0.01 ± 0.00 | 0.03 ± 0.02 | 0.03 ± 0.02 | – | 0.02 ± 0.01 | – | – |
| Домовая мышь (Mus musculus) | – | – | – | – | – | – | 0.01 ± 0.01 | – | – |
| Обыкновенная полевка (Microtus arvalis) | 0.13 ± 0.04 | 0.10 ± 0.03 | 0.08 ± 0.03 | 0.01 ± 0.01 | 0.07 ± 0.02 | 0.01 ± 0.01 | 0.01 ± 0.01 | 0.01 ± 0.01 | 0.01 ± 0.01 |
| Темная полевка (M. agrestis) | 0.17 ± 0.04 | 0.10 ± 0.03 | 0.03 ± 0.02 | 0.08 ± 0.03 | 0.01 ± 0.005 | 0.13 ± 0.04 | 0.05 ± 0.02 | 0.01 ± 0.01 | 0.09 ± 0.02 |
| Полевка-экономка (Alexandromys oeconomus) | 0.03 ± 0.02 | 0.01 ± 0.01 | 0.04 ± 0.02 | – | – | – | – | – | – |
| Красная полевка (Myodes rutilus) | – | 0.70 ± 0.07 | 0.67 ± 0.08 | 0.51 ± 0.07 | 0.56 ± 0.06 | 1.76 ± 0.14 | 0.34 ± 0.05 | 0.55 ± 0.09 | 1.20 ± 0.08 |
| Рыжая полевка (M. glareolus) | 6.97 ± 0.28 | 6.11 ± 0.24 | 9.25 ± 0.30 | 2.55 ± 0.15 | 2.55 ± 0.19 | 3.33 ± 0.19 | 1.87 ± 0.11 | 1.01 ± 0.12 | 0.40 ± 0.05 |
| Красно-серая полевка (M. rufocanus) | – | 0.23 ± 0.04 | 0.05 ± 0.01 | 0.05 ± 0.02 | 0.18 ± 0.06 | 0.07 ± 0.03 | – | 0.04 ± 0.02 | – |
| Отработано ловушко-суток | 8755 | 10 800 | 10 525 | 10 945 | 6790 | 8900 | 14 785 | 7150 | 16 950 |
| Отловлено особей, N | 793 | 914 | 1301 | 438 | 301 | 661 | 510 | 156 | 447 |
| Суммарное обилие, особей на 100 лов.-сут | 9.1 ± 0.3 ab (0.3 – 23.7) |
8.5 ± 0.3 ab (0.9 – 26.3) |
12.4 ± 0.4 a (0.4 –38.7) |
4.0 ± 0.2 bc (0.8 – 9.2) |
4.4 ± 0.3 bc (0.5 – 13.6) |
7.4 ± 0.4 b (1.0 – 25.8) |
3.4 ± 0.4 bc (0 – 10.7) |
2.0 ± 0.2 c (0 – 6.3) |
2.6 ± 0.2 bc (0 – 8.7) |
| Индекс доминирования Симпсона, D | 0.72 ± 0.07 a | 0.54 ± 0.05 ab | 0.59 ± 0.05 ab | 0.55 ± 0.07 ab | 0.50 ± 0.06 ab | 0.42 ± 0.05 b | 0.59 ± 0.04 ab | 0.68 ± 0.06 a | 0.42 ± 0.04 b |
| γ-Разнообразие наблюдаемое, S (наблюдаемое число видов на зону) |
10 | 11 | 13 | 11 | 9 | 10 | 11 | 8 | 8 |
| γ-Разнообразие интерполированное, S* (расчетное число видов на зону) | 9.8 [9.3–10.2] |
9.1 [8.2–9.9] |
10.2 [10.0–12.1] |
11.0 [10.8–11.2] |
7.7 [6.9–8.6] |
9.3 [8.6–10.0] |
10.8 [10.4–11.2] |
8.0 [7.9–8.1] |
8.0 [7.7–8.2] |
| α-Разнообразие (среднее число видов на ключевой участок) | 5.0 ± 0.7 ab (1 – 8) |
5.4 ± 0.5 a (2 – 9) |
5.0 ± 0.5 ab (1 – 9) |
5.3 ± 0.7 ab (2 – 9) |
3.6 ± 0.6 ab (2 – 7) |
4.2 ± 0.5 ab (1 – 8) |
3.3 ± 0.5 ab (0 – 7) |
2.6 ± 0.5 b (0 – 7) |
3.0 ± 0.4 b (0 – 6) |
Анализ данных. Для сравнения сообществ ММ в градиенте загрязнения использовали: 1) относительное обилие; 2) доли разных видов в сообществе; 3) индекс доминирования; 4) γ-разнообразие; 5) α-разнообразие. В качестве учетной единицы во всех случаях рассматривали ключевой участок, значения показателей оценивали для каждого года, объединяя три тура.
Относительное обилие (число особей на 100 ловушко-суток) рассчитывали как для отдельных видов, так и для сообщества в целом. Степень доминирования отдельных видов оценивали с помощью индекса Симпсона (D), величина которого изменяется от 0 (все виды представлены в равной степени) до 1 (только 1 вид). Доминирующими считали виды, составляющие более 10% от общей численности населения, редкими – менее 1%. Показатель γ-разнообразия характеризует общее число видов в пределах зоны. Поскольку прямое сравнение видового богатства (S) территорий было некорректным из-за неодинакового промыслового усилия в разных зонах, использовали также интерполированное число видов (S*) для численности, ближайшей к максимальному значению в одной из зон, кратное 10. Для характеристики α-разнообразия использовали среднее число видов на ключевом участке.
Для оценки различий между зонами загрязнения и периодами применяли двухфакторный ANOVA (значения предварительно логарифмировали). Множественные сравнения выполнили по критерию Тьюки. Величину эффекта относительно фоновой территории рассчитывали как логарифм отношения откликов (ln Response Ratio). В статистических тестах значимыми считали различия при p < 0.05. Расчеты выполнены в программах PAST 4.0 [43] и JMP v. 11 [44].
РЕЗУЛЬТАТЫ
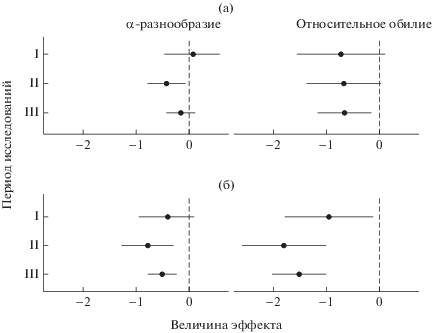
Суммарное обилие. Значимое влияние на суммарное обилие сообществ ММ оказывали как уровень загрязнения, так и период исследования. При увеличении загрязнения общая численность животных снижалась в среднем в 2–4 раза (табл. 1, 2). Динамика обилия в сравниваемых зонах была разнонаправлена: на импактных участках четкие изменения отсутствовали, тогда как на буферных сокращение выбросов (от периода I к III) сопровождалось 2-кратным ростом численности ММ в сравнении с исходными значениями, а на фоновой территории увеличение составило около 30%. Основной вклад в изменение обилия в каждой зоне вносили доминирующие виды. Тренды изменения численности животных на загрязненных территориях по отношению к фоновым в отдельные периоды были неодинаковы: в буферной зоне величина эффекта RR∆ стабильна во времени, тогда как в импактной зоне при переходе от периода I к III регистрировали сдвиг в область отрицательных значений (рис. 1 ).
Таблица 2.
Результаты ANOVA изменения ключевых показателей сообществ ММ
| Показатель | Источник изменчивости | |||||
|---|---|---|---|---|---|---|
| зона (df = 2) |
период (df = 2) |
зона × период (df = 4) |
||||
| F | p | F | p | F | p | |
| Относительное обилие | 16.04 | <0.0001 | 3.41 | 0.036 | 0.77 | 0.569 |
| Индекс доминирования | 3.37 | 0.038 | 5.91 | 0.004 | 2.54 | 0.043 |
| α-Разнообразие | 9.33 | 0.0002 | 1.11 | 0.332 | 0.94 | 0.442 |
Рис. 1.
Величины эффекта (и 95%-ный доверительный интервал) в буферной (а) и импактной (б) зонах по отношению к фоновой территории. Периоды: I – высоких выбросов, II – сниженных выбросов, III – почти прекращенных выбросов.
Состав сообществ. За 30-летний период в районе исследований было отловлено 14 видов ММ, в том числе 9 видов грызунов (Rodentia), принадлежащих к 2 семействам (Muridae, Cricetidae), и 5 видов насекомоядных (Soricomorpha), относящихся к 2 семействам (Soricidae, Talpidae). Использование дополнительных методов учета позволило выявить в фоновой зоне лесную мышовку (Sicista betulina) и кутору (Neomys fodiens), в буферной – лесную мышовку, в импактной зоне новых видов не выявлено. Однако в дальнейшем анализе эти виды не рассматривались.
В населении всех зон преобладали грызуны, на долю которых приходилось более 80% общей численности (см. табл. 1). Повсеместно доминировала рыжая полевка (Myodes glareolus). При увеличении загрязнения доля этого вида снижалась c 75% на фоновой территории до 53% в зоне умеренного загрязнения и 38% на импактных участках. Наоборот, доли малой лесной мыши (Apodemus uralensis) и красной полевки (M. rutilus) увеличивались с 5% в фоновой зоне до 15–27% вблизи завода. Доля серых полевок (Microtus spp. и Alexandromys spp.) в течение 30 лет наблюдений на большинстве участков не превышала 2.5%, за исключением территории вблизи завода (1 км), где она достигала 8%. Насекомоядные в фоновой и буферной зонах составляли 12–13%, в импактной – 17% населения. Видовой состав группы во всех зонах был сходен, за исключением крота (Тalpa europaea), отловленного только на фоновых участках.
Структура доминирования. При увеличении загрязнения структура сообществ ММ кардинально меняется: из монодоминантных они трансформируются в полидоминантные. Если на фоновых участках основу населения составлял один вид (M. glareolus, 73–77% общей численности), то на загрязненных ежегодно доминировали 2–3 вида (см. табл. 1). Доля редких видов на разных участках градиента была сопоставимой и в разные периоды наблюдений составляла от 25 до 54% от общего числа видов. Эти особенности нашли отражение в динамике индекса D, значения которого при удалении от завода значимо увеличивались (см табл. 2). Существенное влияние на величину индекса оказывал и период исследований: сокращение выбросов повсеместно приводило к снижению индекса D в 1.2 раза на фоновых участках, в 1.3–1.4 раза – на загрязненных территориях.
Гамма-разнообразие. Обобщенные за 30 лет данные показывают, что γ-разнообразие не зависело от уровня загрязнения, но в разные периоды оно было неодинаковым. В период высоких выбросов (I) максимальное число видов отмечено в буферной и импактной зонах, тогда как во II и III периоды γ-разнообразие было выше на фоновой территории (см. табл. 1). В импактной зоне наблюдаемое и интерполированное видовое богатство одинаково, тогда как на фоновой территории интерполированное число видов ниже наблюдаемого, особенно для периодов II и III.
Альфа-разнообразие. Увеличение загрязнения значимомо снижало α-разнообразие – в среднем в 1.2–1.7 раза, вне зависимости от периода (см. табл. 1, 2). На фоновых участках видовая насыщенность менялась незначительно (менее 10%), тогда как в окрестностях завода наблюдали 1.5‑кратные различия между периодами. В буферной зоне величина эффекта RR∆ была незначимой в периоды I и III, в импактной – только в период I (см. рис. 1 ).
ОБСУЖДЕНИЕ
Известно, что в ответ на антропогенные воздействия различного генезиса в сообществах ММ происходят структурные перестройки, величина и направление которых зависят от типа воздействия, его интенсивности и длительности, а также от специфики составляющих сообщества видов [8, 22, 26, 40, 45, 46]. Промышленное загрязнение, особенно цветная металлургия, оказывает на биоту очень сильное воздействие [47]. Согласно сложившимся представлениям, на прилегающих к предприятиям участках постоянное население ММ отсутствует [23, 26, 48]. При приближении к источникам эмиссии уменьшаются видовое богатство и численность ММ [8, 9, 23, 26]. Такие изменения могут быть как монотонными [9, 19, 34, 35], так и нелинейными, с максимумом в зоне умеренных нагрузок. Так, в окрестностях меде(никеле)плавильных заводов на Южном Урале [23], Кольском полуострове [26] и в Финляндии [25] различия в суммарном обилии ММ на буферных и фоновых участках составляли 1.2–5 раз, на буферных и импактных – 5–20 раз. Характер изменения суммарного обилия во многом определялся числом ключевых участков в градиенте загрязнения: при большом числе (более 10) регистрировали нелинейные изменения, при меньшем – монотонные. В качестве основной причины обеднения видового состава и снижения численности ММ вблизи предприятий авторы указывают общую пессимизацию среды обитания, в первую очередь ухудшение кормовых и защитных свойств.
В работах авторов, проводивших исследования без строгой биотопической приуроченности участков, γ-разнообразие сообществ ММ импактных зон мало отличалось от фоновых или даже превышало его, но обилие и в этом случае снижалось в 2–5 раз [22, 49]. Результаты наших исследований в районе воздействия Карабашского медеплавильного завода продемонстрировали, что учет гетерогенности среды обитания кардинально меняет выводы о реакции сообществ ММ на загрязнение. Данные, полученные при изучении ММ в одном биотопе, свидетельствовали о существенном обеднении видового состава (с 7 до 2 видов) и 10-кратном снижении суммарного обилия при увеличении техногенной нагрузки [23]. При охвате разных местообитаний γ-разнообразие сообществ фоновой и импактной зон было сходным (7 и 8 видов соответственно), а суммарное обилие животных вблизи завода было снижено лишь в 2 раза [24].
Несмотря на то, что многолетние наблюдения в окрестностях СУМЗа были выполнены по традиционной “однобиотопной” схеме, не отмечено резкого снижения γ-разнообразия при увеличении загрязнения. За 30 лет в фоновой зоне было зарегистрировано 13 видов ММ, в буферной – 11, в импактной – 12, причем регулярно (т.е. на протяжении всех 3 периодов) в отловах отмечали 9, 8 и 7 видов ММ соответственно (см. табл. 1). Вероятными причинами таких незначительных различий могут быть длительный период наблюдений в сочетании с большим объемом регулярных отловов и широким охватом территорий (особенно вблизи завода), что позволило учесть редкие виды. Поэтому ожидаемый эффект резкого обеднения видового состава сообществ под действием загрязнения оказался затушеванным. Иными словами, долговременные наблюдения в пределах одного типа биотопа аналогичны однократному обследованию широкого спектра биотопов.
Снижение α-разнообразия и суммарного обилия под действием загрязнения может быть связано как с сокращением площади пригодных местообитаний, так и уменьшением их экологической емкости (в первую очередь защитно-кормовых условий). В пользу большей важности первого фактора для обилия свидетельствуют данные, полученные для Cl. glareolus: на пригодных для обитания вида участках импактной зоны локальная плотность населения сопоставима с фоновой [25, 34]. Напротив, для α-разнообразия более важна экологическая емкость местообитаний, обеспечивающая успешное сосуществование разных видов за счет более полного использования ресурсов.
Сравниваемые сообщества существенно различались и по структуре доминирования. Если в фоновой зоне в течение 30 лет наблюдений сообщество оставалось монодоминантным, то на загрязненных территориях в населении ежегодно присутствовало 2–3 доминирующих вида, а сокращение выбросов сопровождалось их ротацией. Известно, что в природных условиях сообщества становятся полидоминантными, когда местообитания характеризуются структурным разнообразием [50]. Поскольку гетерогенность среды выше в окрестностях СУМЗа, можно ожидать, что число доминантов в населении загрязненных участков будет больше, чем в более однородных условиях фоновой зоны. Это подтверждается динамикой индекса D в градиенте загрязнения (см. табл. 1). Снижение величины D при сокращении выбросов, вероятно, связано с сукцессионными изменениями фитоценозов.
Для лучшего понимания динамики сообществ ММ в градиенте загрязнения рассмотрим ее особенности в разных зонах. В непосредственной близости от завода деградация экосистем достигала максимума (особенно в период высоких выбросов). Территория СУМЗа и прилегающие участки (до 0.5 км на запад, до 2 км на восток) представляли собой техногенную пустошь, почти полностью лишенную высшей растительности и верхних горизонтов почвы, малопригодную для обитания ММ. Ключевые участки в импактной зоне частично граничат с пустошью, и здесь видовой состав ММ, как правило, обеднен: ежегодно регистрировали от 0 до 4, лишь в отдельные годы – до 7 видов (см. табл. 1). Реакция на техногенную трансформацию среды оказалась двоякой: с одной стороны, исчезают (T. europaea) или снижают численность (M. rufocanus) стенобионтные виды, с другой – появляются синантропы (Mus musculus), а также виды открытых и/или разреженных пространств (A. agrarius и M. arvalis). В период высоких выбросов хозяйственная активность вблизи СУМЗа была максимальной, видовое богатство также достигало наивысших значений (11 видов). В периоды сниженных выбросов (II и III) γ-разнообразие снизилось на 40%, но эти изменения вряд ли связаны с сокращением выбросов, поскольку выпадение редких видов, скорее всего, не было истинным (за исключением M. musculus); вероятно, животные переместились на другие участки импактной зоны. Это предположение базируется на присутствии вблизи завода M. rufocanus, A. agrarius, S. minutus в отловах с использованием дополнительных линий большой протяженности (более 750 м), пересекавших импактные участки с разными микроместообитаниями, а также иных орудий лова – живоловок и конусов (неопубликованные собственные данные).
Суммарное обилие ММ в импактной зоне в среднем в 4 раза ниже фонового, а минимальные значения зарегистрированы весной. Это позволяет предположить отсутствие на этих участках постоянного (обитающего в течение полного жизненного цикла) населения. Так, в период высоких выбросов на протяжении всего бесснежного сезона население M. glareolus состояло лишь из транзитных особей, что косвенно подтверждает наши предположения [51]. В период почти прекратившихся выбросов транзитные особи составляли 100% населения лишь весной, а к осени их доля снижалась вдвое (неопубликованные собственные данные). Это может свидетельствовать о возможных позитивных сдвигах в качестве местообитаний вследствие постепенного восстановления травянистой растительности после снижения выбросов.
В течение 30 лет наблюдений сообщество импактной зоны оставалось полидоминантным, а снижение выбросов (от периода I к III) сопровождалось ротацией доминирующих видов: M. glareolus заместился M. rutilus, S. araneus – S. caecutiens, причем изменения были очень резкими – участие M. rutilus и S. сaecutiens увеличилось почти в 4 раза. Если в течение последних 20 лет суммарное обилие лесных полевок почти не изменилось, то численность бурозубок выросла в 3 раза. Вероятной причиной позитивных сдвигов в населении мелких насекомоядных в ответ на снижение выбросов может быть постепенное улучшение их кормовой базы в окрестностях завода. Косвенно это подтверждают результаты 25-летних исследований фауны крупных почвенных беспозвоночных в районе СУМЗа. После почти полного прекращения выбросов на импактных участках, совпадающих с местами отловов ММ, общее обилие педобионтов увеличилось в 5 раз, а некоторые группы (дождевые черви, энхитреиды, моллюски), ранее отсутствовавшие в импактной зоне, продвинулись ближе к заводу [5]. В то же время темпы восстановления растительного покрова вблизи СУМЗа были незначительны [4, 12], следовательно, существенного улучшения кормовой базы для фитофагов не произошло, что объясняет стабильность суммарного обилия лесных полевок.
В буферной зоне мозаичность среды особенно высока вследствие действия многих факторов: деградации лесных фитоценозов из-за загрязнения, локальной хозяйственной деятельности (выборочные рубки, строительство ЛЭП, лесовосстановление на гарях, выкашивание луговин), естественных нарушений (ветровалы, пожары). Все это увеличивало разнообразие и экологическую емкость местообитаний в пределах доминирующего типа биотопа, что нашло отражение в увеличении суммарного обилия и α-разнообразия по сравнению с импактной зоной и приближении значений к фоновому уровню (см. табл. 1). На протяжении всего периода наблюдений сообщество оставалось полидоминантным, а сокращение выбросов сопровождалось ротацией доминантов: почти двукратно увеличилось участие M. rutilus, A. uralensis и S. сaecutiens (при эквивалентном росте численности), а доля M. glareolus снизилась в 1.4 раза. Таким образом, с 1990 г. по 2019 г. суммарное обилие ММ в буферной зоне увеличилось почти в 2 раза, причем позитивные тренды отмечались у разных трофических групп – зоофагов, фитофагов, семеноядов. Вероятно, такие изменения могут быть следствием постепенного улучшения качества среды обитания (в частности, обилия и разнообразия кормовых ресурсов). Это согласуется с ходом восстановления на буферных территориях других компонентов биоты – растительности [4, 12] и беспозвоночных [5].
В фоновой зоне пихтово-еловые леса занимали значительно большие площади и были наиболее гомогенными в сравнении с другими ключевыми участками по микросредовым условиям для ММ [34]. Ежегодно здесь регистрировали от 1 до 9 видов, причем значительную долю населения составляли типично лесные виды. В максимальной степени условия удовлетворяли требованиям M. glareolus – супердоминанта на протяжении всех 30 лет. Наличие в пределах массивов пихто-ельников небольших по площади участков с разреженной растительностью (опушки, просеки) обусловило присутствие M. arvalis, A. oeconomus, A. agrarius. Хорошие защитно-кормовые свойства фоновых территорий в сочетании с их пригодностью для обитания разных видов ММ обусловили максимальные среди сравниваемых зон значения разнообразия и обилия (см. табл. 1). К концу периода наблюдений суммараное обилие ММ увеличилось на 1/3. Основной вклад внесли грызуны, а численность насекомоядных сохранилась на одном уровне. По нашему мнению, основной причиной таких изменений были сукцессионные процессы в растительных сообществах. В результате регулярных ветровалов в спелых пихтово-еловых лесах происходит выпадение старых деревьев, приводящее, с одной стороны, к осветлению полога леса и, как следствие, к интенсивному развитию травянистой растительности на освободившихся участках, с другой – к улучшению защитных свойств местообитаний и обогащению кормовой базы за счет семян хвойных, которые становятся легко доступны наземным видам.
Использование величин эффекта (см. рис. 1 ) нивелировало влияние межгодовых флуктуаций, а также возможных методических погрешностей, сказывающихся на полноте учета ММ. Разнонаправленные изменения численности ММ при сокращении выбросов – ее увеличение в фоновой и буферной зонах при сохранении низкого обилия в импактной – обусловили отсутствие четких восстановительных трендов суммарного обилия в буферной зоне и отрицательную динамику вблизи завода.
Таким образом, сравнение периодов высоких, сниженных и почти прекратившихся выбросов показывает, что за прошедшие 30 лет реакция сообществ на загрязнение принципиально не изменилась. При увеличении загрязнения в каждый из трех периодов регистрировали значимое снижение суммарного обилия, α-разнообразия сообществ ММ и индекса доминирования. При этом γ-разнообразие на фоновых (13 видов) и загрязненных (12 видов) территориях в течение 30 лет оставалось сходным.
ЗАКЛЮЧЕНИЕ
Нам не известны длительные исследования сообществ ММ до, во время и после сокращения промышленных выбросов, где на основе ежегодных регистраций проводили бы прямые сравнения их обилия и разнообразия на разном удалении от источника эмиссии. Проверяемая нами гипотеза о позитивных изменениях в обилии и разнообразии сообществ загрязненных участков в результате сокращения промышленных выбросов подтвердилась частично – только для умеренного загрязнения. Как и ожидалось, в импактной зоне наблюдаемые изменения были выражены в меньшей степени, чем на буферных участках.
Для всех сравниваемых зон загрязнения в течение 30 лет наблюдений γ-разнообразие сообществ ММ было сходным. Это обусловлено длительным периодом наблюдений, значительными промысловыми усилиями и большой площадью обследования, что позволило учитывать редкие виды на всех участках градиента загрязнения. В окрестностях завода α-разнообразие сообществ ММ было ниже фонового в течение всего периода наблюдений: вероятно, начальные этапы восстановления местообитаний пока не привели к ощутимому увеличению их экологической емкости.
Сравниваемые сообщества ММ кардинально отличались по структуре доминирования. В фоновой зоне сообщество оставалось монодоминантным, а флуктуации видовой структуры были незначительными. К концу периода наблюдений здесь увеличилось суммарное обилие животных (за счет лесных полевок, но не насекомоядных), что связано с сукциссионными изменениями растительности. Сообщества ММ загрязненных территорий характеризовались полидоминантностью, а суммарное обилие было в 2–4 раза ниже фонового. Сокращение выбросов вызвало смену доминантов, но тренды изменения обилия не совпадали в буферной (увеличение) и импактной (отсутствие изменений) зонах. Увеличение доли бурозубок в сообществе ММ импактной зоны можно считать признаком начальных этапов восстановления. В буферной зоне положительные сдвиги выражены еще сильнее: увеличение обилия видов разных трофических групп (фитофагов, зоофагов, семеноядов) может свидетельствовать об улучшении качества местообитаний для разных видов. Наблюдаемые изменения хорошо согласуются с началом восстановительных процессов других компонентов биоты – растительности и почвенной фауны.
Благодарю А.А. Герасимова и Т.Ю. Суркову – за участие в полевых работах, В.С. Микрюкова – за помощь в анализе данных, Е.Л. Воробейчика, В.С. Безеля и анонимного рецензента – за комментарии к тексту рукописи. Выполнение исследований в течение столь длительного времени было бы невозможным без постоянного участия в полевых сборах и камеральной обработке материала всех членов моей семьи – супруга, детей и родителей, которым я выражаю искреннюю признательность.
Анализ данных и подготовка рукописи выполнены в рамках государственного задания Института экологии растений и животных УрО РАН. Автор заявляет об отсутствии конфликта интересов и подтверждает, что в работе с животными соблюдались применимые этические нормы.
Список литературы
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. [Vorobeichik E.L., Kaigorodova S.Y. Long-term dynamics of heavy metals in the upper horizons of soils in the region of a copper smelter impacts during the period of reduced emission // Eurasian Soil Science. 2017. V. 50. № 8. P. 977–990.]
Douay F., Pruvot C., Waterlot C. et al. Contamination of woody habitat soils around a former lead smelter in the North of France // Sci. Tot. Environ. 2009. V. 407. № 21. P. 5564–5577.
Fritsch C., Coeurdassier M., Giraudoux P. et al. Spatially explicit analysis of metal transfer to biota: influence of soil contamination and landscape // PLoS ONE. 2011. V. 6. № 5. e20682
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobeichik E.L., Trubina M.R., Khantemirova E.V., Bergman I.E. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Rus. J. Ecol. 2014. V. 45. № 6. P. 498–507.]
Воробейчик Е.Л., Ермаков А.И., Гребенников М.Е. Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода // Экология. 2019. № 2. С. 133–148. [Vorobeichik E.L., Ermakov A.I., Grebennikov M.E. Initial stages of recovery of soil macrofauna communities after reduction of emissions from a copper smelter // Rus. J. Ecol. 2019. V. 50. № 2. P. 146–160. doi 10.1134/S1067413619020115]
Копцик Г.Н., Копцик С.В., Смирнова Н.Е. и др. Реакция лесных экосистем на сокращение атмосферных промышленных выбросов в Кольской Субарктике // Журн. общ. биол. 2016. Т. 77. № 2. С. 145–163.
Лянгузова И.В., Мазная Е.А. Динамические тренды популяций Vaccinium myrtillus L. в зоне воздействия медно-никелевого комбината: результаты 20-летнего мониторинга // Экология. 2012. № 4. 261–269.
Катаев Г.Д. Оценка состояния сообществ млекопитающих северо-таежных экосистем в окрестностях предприятия по производству никеля // Экология. 2005. № 6. С. 460–465. [Kataev G.D. The state of the small mammal community of boreal forest ecosystems in the vicinity of a nickel-smelting plant // Rus. J. Ecol. 2005. V. 36. № 6. P. 421–426.]
Катаев Г.Д. Мониторинг населения мелких млекопитающих северной тайги Фенноскандии // Бюл. МОИП. Отд. биол. 2015. Т. 120. Вып. 3. С. 3–10.
Катаев Г.Д. Воздействие выбросов медно-никелевого предприятия на состояние популяций и сообществ мелких млекопитающих Кольского полуострова // Заповедная наука. 2017. Т. 2. Вып. 2. С. 19–27.
Мухачева С.В. Многолетняя динамика тяжелых металлов в корме и организме особей рыжей полевки в период снижения выбросов медеплавильного завода // Экология. 2017. № 6. С. 461–471. [Mukhacheva S.V. Long-term dynamics of heavy metal concentrations in the food and liver of bank voles (Myodes glareolus) in the period of reduction of emissions from a copper smelter// Rus. J. Ecol. 2017. V. 48. № 6. P. 559–568. doi 10.1134/S1067413617060078]
Трубина М.Р., Воробейчик Е.Л., Хантемирова Е.В. и др. Динамика лесной растительности после снижения промышленных выбросов: быстрое восстановление или продолжение деградации? // Докл. РАН. 2014. Т. 458. № 6. С. 721–725.
Черненькова Т.В., Бочкарев Ю.Н. Динамика еловых насаждений Кольского Севера в условиях воздействия природно-антропогенных факторов среды // Журн. общ. биол. 2013. Т.74. № 4. С. 283–303.
Camizuli E., Scheifer R., Garnier S. et al. Trace metals from historical mining sites and past metallurgical activity remain bioavailable to wildlife today // Sci. Rep. 2018. № 8. P. 3436.
Juknys R., Vencloviene J., Stravinskiene V. et al. Scots pine (Pinus sylvestris L.) growth and condition in a polluted environment: from decline to recovery // Environ. Pollut. 2003. V. 125. № 2. P. 205–212.
Tête N., Durfort M., Rieffel D. et al. Histopathology related to cadmium and lead bioaccumulation in chronically exposed wood mice, Apodemus sylvaticus, around a former smelter // Sci. Tot. Environ. 2014. V. 481. P. 167–177.
Berglund Å.M., Rainio M.J., Eeva T. Decreased metal accumulation in passerines as a result of reduces emissions // Environ. Toxicol. Chem. 2012. V. 31. P. 1–7.
Berglund Å.M., Nyholm N. Slow improvements of metal exposure, health- and breeding conditions of pied flycatchers after decreased industrial heavy metal emissions // Sci. Tot. Environ. 2011. V. 409. № 20. P. 4326–4334.
Вольперт Я.Л., Сапожников Г.В. Реакция населения мелких млекопитающих при различных формах техногенных воздействий на арктические ландшафты // Экология. 1998. № 2. С. 133–138.
Моисеенко Т.И. Эволюция биогеохимических циклов в современных условиях антропогенных нагрузок: пределы воздействия // Геохимия. 2017. № 10. С. 841–862.
Sheffield S.R., Sawicka-Kapusta K., Cohen J.B. et al. Rodentia and Lagomorpha // Ecotoxicology of Wild Mammals / Shore R.F., Rattner B.A. Eds. Wiley: Chichester et al., 2001. P. 215–314.
Лукьянова Л.Е., Лукьянов О.А. Реакция сообществ и популяций мелких млекопитающих на техногенные воздействия. 1. Сообщества // Усп. совр. биол. 1998. Т. 118. Вып. 5. С. 613–622.
Мухачева С.В., Давыдова Ю.А., Кшнясев И.А. Реакция населения мелких млекопитающих на загрязнение среды выбросами медеплавильного производства // Экология. 2010. № 6. С. 452–458. [Mukhacheva S.V., Davydova Yu.A., Kshnyasev I.A. Responses of small mammal community to environmental pollution by emissions from a copper smelter // Rus. J. Ecol. 2010. V.41. № 6. P. 513–518. doi 10.1134/ S1067413610060081]
Мухачева С.В., Давыдова Ю.А., Воробейчик Е.Л. Роль гетерогенности среды в сохранении разнообразия мелких млекопитающих в условиях сильного промышленного загрязнения // Докл. РАН. Сер. биологич. 2012. Т. 447. № 1. С. 106–109.
Мухачева С.В. Изменение структуры и численности населения мелких млекопитающих в зоне действия предприятия “Норильский никель” (Харьявалта, Финляндия) // Междунар. журн. прикл. и фунд. исслед. 2013. № 8. С. 145–148.
Kozlov M.V., Zvereva E.L., Gilyazov A.S., Kataev G.D. Contaminated zone around a nickel-copper smelter: a death trap for birds and mammals? // Trend in biodiversity research. New York: Nova Science, 2005. P. 81–101.
Fritch C., Cosson R.P., Cocurdassier M. et al. Responses of wild small mammals to a pollution gradient: host factors influence metal and metallothionein levels // Environ. Pollut. 2010. V. 158. P.827–840.
Pankakoski E., Koivisto I., Hyvärinen H., Terhivuo J. Shrews as indicators of heavy metal pollution // Advances in the biology of Shrews. Carnegie Museum of Natural History Special Publication, 1994. P. 137–149.
Давыдова Ю.А., Мухачева С.В. Промышленное загрязнение не увеличивает частоту нефропатологий у рыжей полевки // Экология. 2014. № 4. С. 278–286. [Davydova Y.A., Mukhacheva S.V. Industrial pollution does not cause in increased incidence of nephropathies in the bank vole // Rus. J. Ecol. 2014. V. 45. № 4. P. 282–290. doi 10.1134/S1067413614040043]
Тарахтий Э.А., Мухачева С.В. Химическое и радиационное загрязнение природной среды: эффекты в клетках системы крови мелких млекопитающих // Радиобиология. 2018. Т. 58. № 3. С. 293–304.
Ялковская Л.Э., Фоминых М.А., Мухачева С.В. и др. Флуктуирующая асимметрия краниальных структур грызунов в градиенте промышленного загрязнения // Экология. 2016. № 3. С. 213–220. [Yalkovskaya L.E., Fominykh M.A., Mukhacheva S.V. et al. Fluctuating Asymmetry of Rodent Cranial Structures in an Industrial Pollution Gradient // Rus. J. Ecol. 2016. V. 47. № 3. P. 281–288. doi 10.1134/ S1067413616030176]
Gileva E.A., Rakitin S.B., Fokin M.V. et al. Microsatellite DNA variation in ural bank vole population // Rus. J. Ecol. 2008. V. 39. № 7. P. 86–89.
Sánchez-Chardi A., Marques C.C., Gabriel S.I. et al. Haematology, genotoxicity, enzymatic activity and histopathology as biomarkers of metal pollution in the shrew Crocidura russula // Environ. Pollut. 2008. V. 156. P. 1332–1339.
Мухачева С.В. Особенности пространственно-временного размещения населения рыжей полевки в градиенте техногенного загрязнения среды обитания // Экология. 2007. № 3. С. 178–184. [Mukhacheva S.V. Spatiotemporal population structure of the bank vole in a gradient of technogenic environmental pollution // Rus. J. Ecol. 2007. V. 38. № 3. P. 161–167. doi 10.1134/S1067413607030034]
Tomaskova L., Bejček V., Sedlaček F. et al. Population biology of shrews (Sorex araneus and Sorex minutus) from a polluted area in central Europe // Advances in the Biology of Shrews II. New York, 2005. P. 189–198.
Korkina I.N., Vorobeichik E.L. Humus Index as an indicator of the topsoil response to the impacts of industrial pollution // Appl. Soil Ecol. 2018. V. 123. P. 455–463.
Воробейчик Е.Л., Нестеркова Д.В. Техногенная граница распространения крота в районе воздействия медеплавильного завода: смещение в период сокращения выбросов // Экология. 2015. № 4. С. 308–312. [Vorobeichik E.L., Nesterkova D.V. Technogenic boundary of the mole distribution in the region of copper smelter impacts: Shift after reduction of emissions // Rus. J. Ecol. 2015. V. 46. № 4. P. 377–380. doi: 10.1134/S1067413615040165]
Kozlov M.V., Zvereva E.L., Zverev V.E. Impact of point polluters on terrestrial biota. Comparative analysis of 18 contaminated areas. Springer, 2009. 500 p.
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: УИФ “Наука”, 1994. 280 с.
Громов И.М., Ербаева М.А. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны. СПб.: ЗИН РАН, 1995. 320 с.
Зайцев М.В., Войта Л.Л., Шефтель Б.И. Млекопитающие фауны России и сопредельных территорий. Насекомоядные. СПб.: ЗИН РАН, 2014. 321 с.
Mammal species of the world. A taxonomic and geographic reference. 3-rd ed. / Ed. Wilson D.E., Reeder D.M. Baltimore: Johns Hopkins University Press, 2005. (2 vols.), 2142 p.
Hammer Ø., Harper D.A.T. Paleontological data analysis. Blackwell, 2020, 125 p.
Carver R. Practical data analysis with JMP. Cary, NC: SAS Institute, 2014, 232 p.
Вольперт Я.Л., Шадрина Е.Г. Трансформация населения млекопитающих при техногенном преобразовании природных ландшафтов Арктики и Субарктики // Изв. РАН. Сер. биологич. 2020. № 2. С. 213–223.
Сергазинова З.М., Дупал Т.А., Литвинов Ю.Н. и др. Воздействие выбросов алюминиевого производства в Северном Казахстане на видовую структуру и характер накопления фтора у мелких млекопитающих // Принципы экологии. 2018. № 3. С. 60–74.
Воробейчик Е.Л., Козлов М.В. Воздействие точечных источников эмиссии поллютантов на наземные экосистемы: методология исследований, экспериментальные схемы, распространенные ошибки // Экология. 2012. № 2. С. 83–91. [Vorobeichik E.L., Kozlov M.V. Impact of point polluters on terrestrial ecosystems: Methodology of research, experimental design, and typical errors // Rus. J. Ecol. 2012. V. 43. № 2. P. 89–96. doi 10.1134/S1067413612020166]
Степанов А.М., Кабиров Р.Р., Черненькова Т.В. и др. Комплексная экологическая оценка техногенного воздействия на экосистемы южной тайги. М.: ЦЕПЛ, 1992. 246 с.
Истомин А.В. Влияние нарушений на видовое разнообразие мышевидных грызунов в южной тайге // Видовое разнообразие млекопитающих в трансформированных экосистемах. Киев, 1992. С. 29–40.
Canova L., Fasola M. Communities of small mammals in six biotopes of northern Italy // Acta Theriol. 1991. V. 36. № 1–2. P. 73–86.
Мухачева С.В., Лукьянов О.А. Миграционная подвижность населения рыжей полевки в градиенте техногенных факторов // Экология. 1997. № 1. С. 34–39.
Дополнительные материалы
- скачать ESM.docx
- Рис. 1. Схема расположения ключевых участков на фоновых (а) и загрязненных (b) территориях
Таблица 1. Расположение стационарных линий отлова на ключевых участках
Таблица 2. Объем проанализированного материала


