Экология, 2021, № 1, стр. 58-65
Сообщества почвенных беспозвоночных вблизи выхода сероводородных источников Иска-Шор в заказнике “Адак” (Республика Коми)
А. А. Таскаева a, *, Т. Н. Конакова a, А. А. Колесникова a, А. А. Кудрин a, Г. Л. Накул a
a Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: taskaeva@ib.komisc.ru
Поступила в редакцию 03.03.2020
После доработки 21.05.2020
Принята к публикации 04.06.2020
Аннотация
Приведены результаты исследований сообществ почвенных беспозвоночных (нематод, коллембол и представителей мезофауны) в прибрежных экосистемах, расположенных вблизи сероводородных источников в долине руч. Иска-Шор комплексного заказника “Адак” и вдоль речных долин на северном пределе таежной зоны Республики Коми. Таксономическое богатство рассмотренных групп беспозвоночных не изменяется на исследованных участках. Отмечено сокращение общей численности, отдельных трофических групп коллембол и крупных почвенных беспозвоночных в растительных сообществах вблизи выхода сульфидных вод, но их структура между рассмотренными участками остается схожей. Структура комплексов нематод, напротив, различалась в экосистемах речных долин и вблизи сероводородных источников, для которых выявлено увеличение численности микотрофов.
Экосистемы сероводородных источников являются уникальными природными объектами для изучения адаптаций организмов к экстремальным природным факторам. Они широко распространены по всему миру, однако большинство из них в связи с бальнеологическими свойствами и легкодоступностью очень быстро осваиваются человеком и теряют свой естественный облик. Вследствие этого экосистемы, расположенные в труднодоступных районах Крайнего Севера, представляют большой интерес, так как являются уникальной территорией, где сохранился весь комплекс организмов, приуроченных к данным источникам. На севере Европы источники, как правило, приурочены к зонам разломов и трещиноватости разновозрастных, преимущественно карбонатных пород, pH которых составляет более 7.5 [1, 2]. В таких условиях ранее были исследованы лишь водорослево-бактериальные маты, основу которых образуют алкалофильные цианобактерии, бесцветные и пигментированные бактерии, адаптированные к специфическому составу минеральных вод, диатомовые водоросли [1, 3], а также гидробионты, среди которых преобладают хирономиды [4]. Наземные экосистемы вблизи выходов сероводородных источников не исследовались, в то время как там наблюдается защелачивание почв, а в местах близкого залегания известняков и доломитов развиваются карбонатные почвы, которые могут быть отнесены к редким, так как имеют небольшой по площади ареал и обладают нетипичными свойствами [1]. Кроме того, прибрежные местообитания, представляющие собой переходную зону между водными и наземными экосистемами, играют важную роль в поддержании высокого уровня экологической неоднородности и биологического разнообразия [5, 6]. В то же время такие местообитания могут рассматриваться как экстремальные из-за периодических наводнений и засух, к которым могут адаптироваться лишь определенные организмы.
Почвенные беспозвоночные – важный компонент биологического разнообразия: им принадлежит существенная роль в экосистемных функциях почвы, поскольку они вовлечены в такие процессы, как разложение органического вещества, формирование гумуса, участие в круговороте веществ [7]. Наиболее многочисленной и разнообразной группой в составе почвенных зооценозов, особенно в субарктических экосистемах, оказываются нематоды [8]. Благодаря морфологической пластичности, физиологической адаптации и экологическому разнообразию, эти круглые черви абсолютно преобладают среди многоклеточных организмов и устойчивы к различным условиям окружающей среды [9]. Не менее важными компонентами почвенной биоты являются микроартроподы, среди которых доминируют две таксономические группы: коллемболы и панцирные клещи. Если коллемболы обладают чертами, характерными для R-стратегов: быстрым размножением, высокой плодовитостью, то орибатиды, напротив, являются K-стратегами с низким уровнем метаболизма, медленным развитием и низкой плодовитостью [10]. Однако обе группы чувствительны к изменениям в окружающей среде: влажности, кислотности, температуре и ряду других факторов [11, 12].
Подобно микроартроподам, наиболее чувствительными к изменениям влажности среди представителей мезофауны являются дождевые черви, наиболее разнообразные в областях умеренных широт [13], и многоножки [5], в то время как для активно передвигающихся жуков и пауков важную роль играют видовой состав, пространственное распределение растительности, характер и мощность подстилки [14]. Следовательно, таксономические группы почвенных беспозвоночных, обладая различным уровнем разнообразия, численности, трофической структуры и мобильности, будут по-разному реагировать на изменения окружающей среды [15].
В настоящем исследовании мы попытались ответить на вопрос, изменяются ли сообщества нематод, коллембол и крупных почвенных беспозвоночных вблизи выхода сероводородных вод. Для этого были исследованы разнотравные сообщества, располагающиеся непосредственно вдоль берегов сероводородных источников, а также в речных долинах на севере таежной зоны. Нами была выдвинута гипотеза о том, что в почвах вблизи выхода сульфидных вод формируются комплексы почвенных беспозвоночных, отличающиеся низким уровнем таксономического богатства, численности, а также изменением соотношения трофических групп.
МАТЕРИАЛ И МЕТОДЫ
Характеристика района исследований. Комплексный заказник “Адак”, созданный в 1984 г. для сохранения долинного ландшафта р. Уса, находится в таежной зоне Республики Коми. На его территории имеется группа сероводородных источников, расположенных в долине руч. Иска-Шор (66°28′ с.ш., 59°34′ в.д.), который берет начало из болота в 6 км выше источников. Воды сероводородных источников формируются при проникновении высокоминерализованных пластовых вод по разломам и трещинам в зону активного водообмена. До сероводородных родников воды ручья прозрачные, а ниже по течению и до устья (около 3.5 км) молочно-белого цвета. Минерализация вод ручья изменяется в пределах 0.9–1.4 г/л.
Всего выделено пять зон разгрузки сероводородных источников. Первая (I) и вторая (II) зоны расположены в нижней заболоченной части долины по обеим сторонам ручья. Третья группа сероводородных источников (III) находится примерно в 2 км от р. Уса в ущелье, где наблюдаются восходящие газирующие струи в источнике и мочажина, которая описана В.В. Раммо (цит. по [2]) как “незамерзающее болотце, ярко выделяющееся на темном фоне скалы и зелени своей окраской”. В 100 м выше по течению руч. Иска-Шор отмечен четвертый выход сульфидных вод (IV), представленный многочисленными фонтанирующими струями. На расстоянии 3.2 км от устья ручья находится основная пятая группа сероводородных вод (V). Если в IV и V зонах разгрузки дебит вод составляет около 20 л/c, то уже в I–III зонах – менее 2 л/c. В местах выхода сульфидных вод на поверхность все (почвы, породы, мох) покрыто гелеобразной пленкой, образованной скоплениями бактерий, водорослей, грибов и налетами серы. Температура вод источников составляет 5.0–9.8°С, pH 7.4–7.8. Воздух в зонах разгрузки имеет сильный запах сероводорода, содержание которого в воде может варьировать от 39 до 92 мг/л [1, 2].
Участки исследования. В июле 2018 г. в заказнике “Адак” был осуществлен отбор почвенных проб из разнотравных сообществ, расположенных в прибрежной зоне на расстоянии 1–2 м от сероводородных источников (I, III, IV и V зоны разгрузки). В качестве контроля выбран пойменный ивняк крупнотравно-осоковый в 50 м выше по течению последней зоны разгрузки. Кроме того, в работе использованы данные, полученные ранее для пойменных лугов и ивняков крупнотравных, расположенных в долинах рек Печора и Большая Роговая в пределах северной тайги. Всего было выделено восемь площадок, четыре из которых расположены вблизи сероводородных источников и четыре – вдоль речных долин, рассмотренные в качестве контрольных. Более подробное описание исследованных площадок приведено в табл. 1.
Таблица 1.
Краткая характеристика исследуемых участков
| № уч. | Координаты | Локалитет | Растительное сообщество | Растительность |
|---|---|---|---|---|
| “Сероводородные” участки | ||||
| 1 | 66°28′ с.ш. 59°35′ в.д. | Адак (руч. Иска-Шор, I– II зоны) | Разнотравные сообщества | Filipendula ulmaria (L.), Equisetum palustre E., E. fluviatile L., Cirsium heterophyllum (L.) Hill, Archangelica officinalis (Moench) |
| 2 | 66°28′ с.ш. 59°34′ в.д. | Адак (руч. Иска-Шор, III зона) | Filipendula ulmaria (L.), Equisetum palustre E., E. fluviatile L., Angelica archangelica L., Carex cespitosa L., Caltha palustris L. и др. | |
| 3 | 66°28′ с.ш. 59°34′ в.д. | Адак (руч. Иска-Шор, IV зона) | Filipendula ulmaria (L.), Geum rivale L., Carex cespitosa L., Angelica archangelica L., Galium boreale L. и др. | |
| 4 | 66°27′ с.ш. 59°33′ в.д. | Адак (руч. Иска-Шор, V зона) | Filipendula ulmaria (L.), Carex cespitosa L., C. vaginata Tausch., Angelica archangelica L., Veratrum lobelianum Bernh. и др. | |
| “Контрольные” участки | ||||
| 5 | 66°27′ с.ш. 59°33′ в.д. | Адак (руч. Иска-Шор) | Ивняк крупнотравно-осоковый | Filipendula ulmaria (L.), Veronica longifolia L., Cirsium heterophyllum (L.) Hill, Galium boreale L., Deschampsia cespitosa (L.), Equisetum fluviatile L. и другие травянистые растения и осоки |
| 6 | 66°54′ с.ш. 52°19′ в.д. | Ермица (р. Печора) |
Ивняк злаково-разнотравный | Phalaroides arundinacea L., Deshampsia cespitosa (L.), Equisetum arvense L., Angelica archangelica L., Galium boreale L. и другие травянистые растения и осоки |
| 7 | 67°01′ с.ш. 61°38′ в.д. | р. Большая Роговая | Ивняк злаково-разнотравный | Deschampsia cespitosa (L.), Equisetum palustre E., E. fluviatile L. и другие травянистые растения и осоки |
| 8 | 64°52′ с.ш. 57°36′ в.д. |
Кедровый Шор (р. Печора) | Разнотравно-осоковое сообщество | Carex cespitosa L., Galium palustre L., Filipendula ulmaria (L.), Deschampsia cespitosa (L.), Geranium sylvaticum L. и другие травянистые растения и осоки |
Полевые методы. На каждой площадке для изучения нематод было отобрано по 5 проб размером 5 × 5 × 10 см (всего 40), для учета коллембол – по 8 проб размером 10 × 10 × 10 см (всего 64). Для учета крупных почвенных беспозвоночных на площадках в долинах рек Печора и Большая Роговая было отобрано по 8 проб размером 25 × 25 × 10 см (всего 24), что соответствует стандартной методике учета мезофауны [16]. На площадках заказника “Адак” для соблюдения условий отбора проб на определенном расстоянии от сероводородных источников изъятие проб указанного размера оказалось невозможным, поэтому в них взято по 8 проб размером 10 × 10 × 10 см (всего 40). Для приведения в соответствие данных по численности мезофауны при учете меньшего количества проб использован коэффициент 6.25, найденный путем соотношения размера большей пробы (0.0625 м2) к размеру меньшей пробы (0.01 м2). Необходимо отметить, что при проведении исследований в 2018 г. в регионе установилась сухая, жаркая погода – осадков не выпадало более 20 дней.
Физико-химические свойства почвы. Для анализа почвенных параметров на каждой площадке было отобрано по 8 проб из органогенного горизонта. Влажность почвы определяли гравиметрически высушиванием образцов при 105° в течение 12 ч, величину рН – потенциометрически в соляной вытяжке (0.01 М СаСl2), массовую долю общего азота (Nобщ) и общего углерода (Собщ) – на CHNS-элементном анализаторе EA 1110 (Carlo Erba) методом газовой хроматографии. Содержание серы в почвах не определяли, так как большая группа ее минеральных соединений – это H2S и ее соли. При рН 5.0–6.0 сероводородная кислота слабая и определить ее не представляется возможным. Аналитическую обработку образцов почв выполняли в Экоаналитической лаборатории Института биологии Коми НЦ УрО РАН.
Почвенно-зоологические параметры. Для оценки численности и структуры нематод их экстракцию осуществляли при помощи модифицированного метода Бермана с экспозицией 48 ч из навески почвы массой 50 г. Фиксацию материала проводили 4%-ным формалином. Для выявления их таксономического состава было идентифицировано не менее 100 экз. из каждой пробы. Основываясь на классификации Итса с соавт. [17], нематоды были разделены на пять трофических групп: бактериотрофы, микотрофы, политрофы, хищники и фитотрофы. При этом каждому таксону было присвоено значение на основе c–p шкалы Бонгерса [18]: от 1 (R-стратеги или колонизаторы, обладают короткими жизненными циклами, значительными флуктуациями численности, высокой плодовитостью и устойчивостью к нарушениям среды) до 5 (К-стратеги или персисторы, обладают низкой плодовитостью и высокой чувствительностью к нарушениям среды). На основе соотношения таксонов нематод с различным рангом по c–p шкале был рассчитан индекс зрелости (ΣMI), применяемый как индикатор нарушения почвенной экосистемы [18]. Для оценки численности коллембол экстракцию осуществляли с использованием эклекторов Берлезе – Тульгрена в 96%-ном спирте в течение 7–10 дней – времени, достаточного для достижения воздушно-сухого состояния почвы. Жизненные формы коллембол выделены по системе С.К. Стебаевой [19], а их трофические гильдии – согласно работе А.А. Потапова с соавт. [20]. Для оценки численности и структуры сообществ почвенной мезофауны пробы были подвержены ручной разборке с последующей экстракцией в лаборатории. Трофические группы крупных беспозвоночных разделены на три группы согласно методическому руководству [21]. Всего из почвенных проб извлечено около 3 тыс. экз. нематод, 25 тыс. – микроартропод и 740 – крупных почвенных беспозвоночных.
Статистическая обработка данных. Почвенные образцы, отобранные в пределах одного участка, рассматривали как мнимые повторности и поэтому объединяли для образования одной истинной повторности [22]. Количественные показатели физико-химических свойств почвы и параметров почвенных беспозвоночных представлены в виде средних значений ± стандартная ошибка средней. Для оценки значимости различий между выборками использовали непараметрический критерий Манна-Уитни при p < 0.05. Ординация сообществ почвенной фауны исследуемых участков была получена методом неметрического многомерного шкалирования (NMDS) с использованием индекса Брея-Кертиса на основе относительного обилия их отдельных таксонов. Статистическую обработку результатов проводили с помощью программ PAST 3.0.
РЕЗУЛЬТАТЫ
Физико-химические свойства почвы. Большинство оцениваемых параметров почвы достоверно не различалось между исследованными участками. Однако содержание общего азота оказалось значимо в два раза выше в прибрежных экосистемах речных долин (табл. 2).
Таблица 2.
Физико-химические свойства почвы и параметры населения почвенных беспозвоночных (среднее ± SE) в растительных сообществах вблизи сероводородных источников и пойм рек в Республике Коми
| Показатель | “Сероводород” (n = 4) | “Контроль” (n = 4) |
|---|---|---|
| Физико-химические свойства почвы | ||
| Влажность, % | 49.5 ± 3.0 | 54.6 ± 4.5 |
| рН | 5.6 ± 0.2 | 5.7 ± 0.2 |
| N, % | 0.7 ± 0.1a | 1.4 ± 0.2bb |
| C, % | 13.7 ± 2.2 | 17.6 ± 2.3 |
| Таксономическое богатство почвенных беспозвоночных | ||
| Нематоды (число родов) | 27.5 ± 3.0 | 27.5 ± 2.9 |
| Коллемболы (число видов) | 21.5 ± 1.0 | 21.3 ± 3.8 |
| Мезофауна (число семейств) | 10.5 ± 0.9 | 8.3 ± 1.1 |
| Численность почвенных беспозвоночных | ||
| Нематоды, экз/100 мг | 1860 ± 684 | 1429 ± 127 |
| Панцирные клещи, экз/м2 | 18 600 ± 3884 | 38 333 ± 13684 |
| Коллемболы, экз/м2 | 8094 ± 1284a | 15 828 ± 2524b |
| Мезофауна, экз/м2 | 112 ± 23a | 174 ± 26b |
| Численность нематод (экз/100 мг) разных трофических групп | ||
| Бактериотрофы | 628 ± 228 | 366 ± 50 |
| Микотрофы | 537 ± 206a | 213 ± 58b |
| Политрофы | 105 ± 28a | 328 ± 58b |
| Хищники | 71 ± 21 | 185 ± 63 |
| Паразиты растений | 523 ± 418 | 341 ± 128 |
| Индекс зрелости (ΣMI) | 2.5 ± 0.1a | 3.2 ± 0.1b |
| Численность коллембол (экз/м2) разных жизненных форм | ||
| Поверхностные | 1013 ± 210a | 5225 ± 867b |
| Гемиэдафические | 4913 ± 923a | 15 466 ± 2969b |
| Эуэдафические | 2168 ± 447 | 1478 ± 373 |
| Численность коллембол (экз/м2) разных трофических гильдий | ||
| ППРМ | 487 ± 117a | 3900 ± 935b |
| ППЖМ | 548 ± 125a | 2313 ± 413b |
| ГПМ | 5452 ± 1062a | 14 809 ± 2807b |
| ЭПМ | 1116 ± 238a | 431 ± 187b |
| Численность мезофауны (экз/м2) разных трофических групп | ||
| Сапрофаги | 77 ± 18 | 120 ± 26 |
| Зоофаги | 30 ± 8a | 52 ± 9b |
| Фитофаги | 4 ± 2 | 11 ± 5 |
Примечание: ППРМ – поверхностные потребители растений и микроорганизмов, ППЖМ – поверхностные потребители животных и микроорганизмов, ГПМ – полупочвенные потребители микроорганизмов, ЭПМ – почвенные потребители микроорганизмов. Разные буквы указывают на достоверные различия между исследованными участками на основе теста Mann-Whitney при p < 0.05.
Комплексы почвенных беспозвоночных. Видовое богатство ни одной из рассмотренных групп почвенных беспозвоночных не изменялось между рассмотренными участками. Всего вблизи выхода сероводородных вод зарегистрировано 49 родов нематод, 41 вид ногохвосток и 16 семейств крупных беспозвоночных. В растительных сообществах вблизи речных долин нематоды представлены 51 родом, коллемболы – 46 видами, а мезофауна – 14 семействами.
Средняя численность панцирных клещей и нематод также достоверно не отличалась между рассмотренными участками. Однако микотрофные и политрофные черви показали разные тенденции: если представители первой группы увеличивали свое обилие в разнотравных сообществах вблизи выхода сульфидных вод, то вторые, наоборот, ее снижали. Индекс зрелости, рассчитанный на основе данных о сообществе почвенных нематод, имел более низкие значения вблизи выхода сульфидных вод (см. табл. 2). В отличие от круглых червей в почвах вблизи сероводородных источников отмечено значимое уменьшение численности коллембол, в том числе поверхностно обитающих и полупочвенных представителей, а также трофических групп, за исключением почвенных потребителей микроорганизмов. Аналогичная тенденция снижения средней численности обнаружена у почвенной мезофауны, среди которой зоофаги оказались наиболее чувствительными (см. табл. 2).
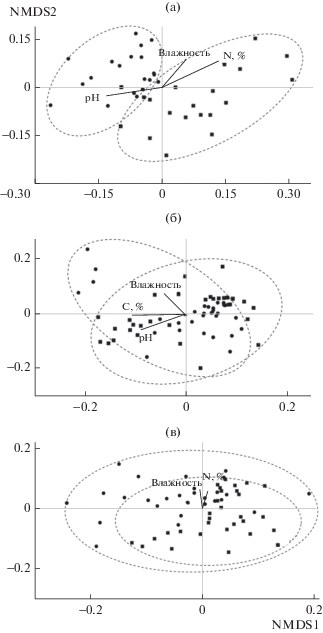
Ординация, проведенная методом многомерного шкалирования, продемонстрировала весьма четкое разделение структуры комплексов нематод рассмотренных участков. Различия связаны с изменением кислотности и влажности почвы, содержанием азота (рис. 1а). Для сообществ коллембол и крупных почвенных беспозвоночных, напротив, отмечена схожая структура во всех рассмотренных прибрежных экосистемах (рис. 1б, в).
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о том, что трофическая структура, а также численность рассмотренных групп почвенных беспозвоночных изменяются вблизи выхода сероводородных вод, в то время как таксономическое богатство, напротив, остается на том же уровне. Отсутствие значимых различий последнего показателя у всех представителей указывает на то, что исследуемые нами растительные сообщества населяют виды, относительно толерантные и экологически гибкие к прибрежным условиям. В таких биотопах виды с разными экологическими стратегиями переживают неблагоприятные гидрологические условия благодаря высокой пространственной гетерогенности пойм, обеспечивающей долговременную стабильность сообществ в целом [23]. Кроме того, физико-химические свойства почвы рассмотренных участков не показали значимых различий, за исключением содержания общего азота, значения которого оказались выше для экосистем речных долин (см. табл. 2). Согласно литературным данным [24], его высокие показатели не оказывают отрицательного эффекта на таксономическое богатство почвенной биоты.
Как и следовало ожидать, в травянистых сообществах вблизи выхода сероводородных вод отмечено сокращение численности микроартропод (см. табл. 2). С одной стороны, это может быть обусловлено влиянием растительности, а с другой – изменением соотношения грибов и бактерий. Известно, что панцирные клещи и ногохвостки имеют сильные пищевые предпочтения к определенным видам растений [11, 25]. На примере коллембол установлено, что ее снижение происходит в основном за счет поверхностно обитающих и полупочвенных видов, что подтверждается уменьшением численности соответствующих трофических групп, потребляющих остатки растительного и животного происхождения, а также микроорганизмы (см. табл. 2). Предположительно это указывает на то, что обилие поверхностных форм коллембол во многом зависит от наличия подходящих микроместобитаний (лесной подстилки). В то же время численность почвенных форм и соответствующей трофической группы ногохвосток, напротив, увеличивается, что связано не только с их обитанием в более глубоких горизонтах почвы [12], но и относительной независимостью в качестве заселяемого субстрата [26]. Считается, что представители данной группы питаются микоризными грибами [27], регулируют микробное сообщество в ризосфере и участвуют в разложении органического вещества в почве [20]. Несмотря на изменение общей численности, численности отдельных трофических групп и жизненных форм коллембол, их структура между рассмотренными участками не отличается (рис. 1б), что, по-видимому, обусловлено схожими физико-химическими свойствами почвы.
Аналогичная тенденция достоверного снижения общей численности в травянистых сообществах вблизи выхода сероводородных источников обнаружена у мезофауны (см. табл. 2), для которой “биотопический” фактор, включающий видовой состав, пространственное распределение растительности, характер и мощность подстилки, является определяющим [14]. Кроме того, в этих же экосистемах отмечено достоверное сокращение численности зоофагов. На наш взгляд, это может быть обусловлено незначительным обеспечением их водной субсидией, поступающей с амфибиотическими насекомыми, водными животными и мертвым органическим веществом, которое затем осваивается наземными сапрофагами и микробофагами [28]. Ранее для сероводородных источников ручья Иска-Шор было установлено обеднение водной фауны и ее низкое количественное развитие [4], что, возможно, и повлияло на сокращение численности панцирных клещей, коллембол и ряда других сапрофагов, являющихся потенциальной добычей зоофагов. Однако это явление мало исследовано, хотя и отмечено в литературе [28, 29]. Обращает на себя внимание преобладание сапрофагов на исследованных участках (см. табл. 2), что считается характерной чертой прибрежных экосистем [30], так как у кромки воды остаются органические остатки в виде ила, планктона, растительного детрита. Все это создает условия, благоприятные для развития сапротрофных микроорганизмов, которые составляют основной пищевой ресурс наземных сапрофагов [31]. По-видимому, именно поэтому структура сообществ крупных почвенных беспозвоночных оказалась схожей (рис. 1в).
Структура комплекса почвенных нематод, напротив, различалась между участками, расположенными вблизи выхода сероводородных источников и биотопами речных долин. Такая противоположная от артропод реакция, вероятно, может быть обусловлена различиями в среде обитания. Нематоды, являясь первичноводными животными, населяют капельки почвенной воды, в то время как для микроартропод средой обитания служат поровые пространства, а для крупных беспозвоночных, способных прокладывать ходы, вся почва [32]. Выявить ведущие факторы, отвечающие за различия в трофической и таксономической структуре сообществ почвенных нематод между рассмотренными участками, весьма проблематично. Однако полученные данные свидетельствуют о более высоком уровне стресса нематоценозов на участках вблизи выхода сульфидных вод. Здесь отмечены снижение численности политрофных и хищных нематод – K-стратегов, чувствительных к нарушениям среды [17], а также более низкий показатель индекса зрелости (ΣMI) сообщества, что указывает на значительные нарушения почвенной пищевой сети [18] и предполагает низкий уровень трофических взаимодействий в ней [33, 34]. Благодаря широкому диапазону трофических стратегий, нематоды используются как индикаторы потоков энергии и питательных веществ через бактериальный и грибной канал в почве [33, 35]. Увеличение численности микотрофов в прибрежных экосистемах вблизи выхода сероводородных вод обусловливает более высокое значение грибного компонента для функционирования почвенной пищевой сети по сравнению с долинами крупных рек.
ЗАКЛЮЧЕНИЕ
Таким образом, предложенная к рассмотрению гипотеза о том, что в почвах вблизи выхода сульфидных вод формируются комплексы почвенных беспозвоночных, отличающиеся низким уровнем таксономического богатства, численности, а также изменением соотношения трофических групп, подтвердилась частично. Установлено, что таксономическое богатство нематод, коллембол и крупных почвенных беспозвоночных не изменяется в растительных сообществах вблизи сероводородных источников по сравнению с таковыми речных долин. Однако в прибрежных экосистемах вблизи сероводородных источников отмечено снижение численности микроартропод и мезофауны, обусловленное в основном сокращением поверхностно обитающих и полупочвенных видов, а также соответствующих трофических гильдий коллембол и зоофагов среди крупных почвенных беспозвоночных. При этом структура сообществ коллембол и мезофауны между исследованными участками очень схожа в отличие от таковой нематод. Для комплексов нематод участка выхода сульфидных вод выявлено снижение численности политрофных и хищных червей, а также более низкие значения индекса зрелости (ΣMI). Увеличение численности нематод микотрофов и эуэдафических потребителей микроорганизмов среди коллембол в прибрежных экосистемах вблизи выхода сероводородных вод свидетельствует о более высоком значении грибного компонента для функционирования почвенной пищевой сети по сравнению с долинами крупных рек.
Работа выполнена при финансовой поддержке программы УрО РАН “Биоразнообразие беспозвоночных в экстремальных природно-климатических условиях Субарктики (Урала и Предуралья)” (№ АААА-А18-118011390005) и в рамках государственного задания по теме “Распространение, систематика и пространственная организация фауны и населения наземных и водных животных таежных и тундровых ландшафтов и экосистем Европейского Северо-Востока России” (№ АААА-А17-117112850235-2). Авторы признательны сотрудникам Экоаналитической лаборатории за проведение химического анализа почв и анонимному рецензенту за ценные замечания по содержанию работы.
Список литературы
Биологическое разнообразие особо охраняемых природных территорий Республики Коми. Вып. 8. Комплексный ландшафтный заказник “Адак” / Под ред. Дёгтевой С.В., Лаптевой Е.М. Сыктывкар: ИБ Коми НЦ УрО РАН, 2015. 200 с.
Митюшева Т.П. Сероводородные источники Иска-Шор (Адакские) // Изучение, сохранение и использование объектов геологического наследия северных регионов (Республика Коми): Мат-лы науч.-практич. конф. Сыктывкар: Институт геологии Коми НЦ УрО РАН, 2007. С. 94–96.
Rozanov A.S., Bryanskaya A.V., Ivanisenko T.V. et al. Biodiversity of the microbial mat of the Garga hot spring // BMC Evolutionary Biology. 2017. V. 17 (Suppl 2). P. 37−49. https://doi.org/10.1186/s12862-017-1106-9
Лоскутова О.А., Кононова О.Н., Кондратьева Т.А. и др. Сообщества беспозвоночных в сероводородных источниках Крайнего Севера (бассейн р. Уса, Россия) // Труды Карельского научного центра РАН. 2020. Вып. 1. С. 71–86. https://doi.org/10.17076/bg1130
Plum N. Terrestrial invertebrates in flooded grassland: A literature review // Wetlands. 2005. V. 25. P. 721–737.
Cantonati M., Stevens L.E., Segadelli S. et al. Ecohydrogeology: The interdisciplinary convergence needed to improve the study and stewardship of springs and other groundwater-dependent habitats, biota, and ecosystems // Ecological Indicators. 2020. https://doi.org/10.1016/j.ecolind.2019.105803
Wagg C., Bendera S.F., Widmer F., van der Heijdena M.G.A. Soil biodiversity and soil community composition determine ecosystem multifunctionality // PNAS. 2014. V. 111(14). P. 5266–5270. https://doi.org/10.1073/pnas.1320054111
van den Hoogen J., Geisen S., Routh D. et al. Soil nematode abundance and functional group composition at a global scale // Nature. 2019. V. 572. P. 194–198. https://doi.org/10.1038/s41586-019-1418-6
Tahseen Q. Nematodes in aquatic environments: adaptations and survival strategies // Biodiversity Journal. 2012. V. 3(1). P. 13–40.
Behan-Pelletier V.M. Acari and Collembola biodiversity in Canadian agricultural soils // Can. J. Soil Sci. 2002. V. 83. P. 279–288.
Nielsen U.N., Osler G.H.R., Campbell C.D. et al. The influence of vegetation type, soil properties and precipitation on the composition of soil mite and microbial communities at the landscape scale // J. Biogeogr. 2010. V. 37. P. 1317–1328. https://doi.org/10.1111/j.1365-2699.2010.02281.x
Hopkin S.P. Biology of Springtails, Insecta: Collembola. New York: Oxford University Press, 1997. 341 p.
Phillips H.R.P., Guerra C.A., Bartz M.L.C. et al. Global distribution of earthworm diversity // Science. 2019. V. 366. P. 480–485. https://doi.org/10.1126/science.aax4851
Berg M.P., Bengtsson J. Temporal and spatial variability in soil food web structure // Oikos. 2007. V. 116. P. 1789–1804.
Lehmitz R., Haase H., Otte V., Russell D. Bioindication in peatlands by means of multi-taxa indicators (Oribatida, Araneae, Carabidae, Vegetation) // Ecological Indicators. 2020. https://doi.org/10.1016/j.ecolind.2019.105837
Количественные методы в почвенной зоологии / Ю.Б. Бызова, М.С. Гиляров, В. Дунгер и др. М.: Наука, 1987. 288 с.
Yeates G.W., Bongers T., de Goede R.G.M. et al. Feeding habits in soil nematode families and genera: An outline for soil ecologists // J. Nematol. 1993. V. 25. P. 315–331.
Bongers T. The maturity index, an ecological measure of environmental disturbance based on nematode species composition // Oecologia. 1990. V. 83. P. 14–19.
Стебаева С.К. Жизненные формы ногохвосток (Collembola) // Зоол. журн. 1970. Т. 49. Вып. 10. С. 1437–1455.
Potapov A.A., Semenina E.E., Korotkevich A.Y. et al. Connecting taxonomy and ecology: Trophic niches of collembolans as related to taxonomic identity and life forms // Soil Biol. Biochem. 2016. V. 101. P. 20–31. https://doi.org/10.1016/j.soilbio.2016.07.002
Методы исследования структуры, функционирования и разнообразия детритных пищевых сетей. Методическое руководство / А.Д. Покаржевский, А.С. Зайцев, К.Б. Гонгальский и др. М.: ИПЭЭ им. А.Н. Северцова, 2003. 100 с.
Козлов М.В. Мнимые повторности (pseudoreplication) в экологических исследованиях: проблема, не замеченная российскими учеными // Журн. общ. биол. 2003. Т. 64. № 4. С. 292–307.
Kuznetsova N.A. Collembola in extreme natural and anthropogenic conditions: a case study of collembolan taxocoenoses // Species and communities in extreme environments / Golovatch S.I., Makarova O.L., Babenko A.B., Penev L.D. Eds. Sofia-Moscow: Pensoft Publishers & KMK Scientific Press, 2009. P. 441–458.
van der Wal A., Geerts R.H.E.M., Korevaar H. et al. Dissimilar response of plant and soil biota communities to long-term nutrient addition in grasslands // Biol. Fertil. Soils. 2009. V. 45. P. 663–670. https://doi.org/10.1007/s00374-009-0371-1
Sabais A.C.W., Scheu S., Eisenhauer N. Plant species richness drives the density and diversity of Collembola in temperate grassland // Acta Oecol. 2011. V. 37. P. 195–202. https://doi.org/10.1016/J.ACTAO.2011.02.002
Krab E.J., Oorsprong H., Berg M.P., Cornelissen J.H. Turning northern peatlands upside down: disentangling microclimate and substrate quality effects on vertical distribution of Collembola // Functional Ecology. 2010. V. 24. P. 1362–1369. https://doi.org/10.1111/j.1365-2435.2010.01754.x
Endlweber K., Ruess L., Scheu S. Collembola switch diet in presence of plant roots thereby functioning as herbivores // Soil Biol. Biochem. 2009. V. 41. P. 1151–1154.https://doi.org/10.1016/j.soilbio.2009.02.022
Korobushkin D.I., Korotkevich A.Y, Kolesnikova A.A. et al. Consumption of aquatic subsidies by soil invertebrates in coastal ecosystems // Contemporary Problems of Ecology. 2016. V. 9. P. 396–406.https://doi.org/10.1134/S1995425516040077
Hoekman D., Bartrons M., Gratton C. Ecosystems linkages revealed by experimental lake-derived isotope signal in heathland food webs // Oecologia. 2012. V. 71. P. 832–845. https://doi.org/10.1007/s00442-012-2329-5
Rybalov L.B., Kamaev I.O. Diversity of soil mesofauna in northern taiga biogeocenosises of the Kamennaya River basin (Karelia) // Biology Bulletin. 2011. V. 38. P. 338–347. https://doi.org/10.1134/S1062359011040169
Wardle D.A. Communities, ecosystems: linking the Aboveground, Belowground Components. Oxford: Princeton Univ. Press, 2002. 400 p.
Lavelle P., Spain A. Soil ecology. Berlin: Springer, 2001. 688 p.
Ferris H., Bongers T., de Goede R.G.M. A framework for soil food web diagnostics: extension of the nematode faunal analysis concept // Applied Soil Ecology. 2001. V. 18. P. 13–29. https://doi.org/10.1016/S0929-1393(01)00152-4
Ferris H., Matute M.M. Structural and functional succession in the nematode fauna of a soil food web // Applied Soil Ecology. 2003. V. 23. P. 93–110. https://doi.org/10.1016/S0929-1393(03)00044-1
Freckman D.W., Ettema C.H. Assessing nematode communities in agro-ecosystems of varying human intervention // Agriculture, Ecosystems and Environment. 1993. V. 45. P. 239–261.
Дополнительные материалы отсутствуют.