Экология, 2021, № 2, стр. 83-92
Факторы содержания углерода и азота в тонких корнях растений Среднего Урала
А. А. Бетехтина a, А. Ганем a, О. А. Некрасова a, Т. А. Радченко a, А. П. Учаев a, М. И. Дергачева b, Д. В. Веселкин c, *
a Уральский федеральный университет
620083 Екатеринбург, просп. Мира, 19, Россия
b Институт почвоведения и агрохимии СО РАН
630090 Новосибирск, просп. Лаврентьева, 8/2, Россия
c Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: veselkin_dv@ipae.uran.ru
Поступила в редакцию 22.05.2020
После доработки 24.08.2020
Принята к публикации 30.08.2020
Аннотация
Исследовали некоторые факторы содержания C и N в тонких корнях растений Среднего Урала. В качестве факторов анализировали: экологические (эдафические) особенности местообитаний; тип корневых симбиозов – способность к симбиотической азотфиксации и формированию разных типов микориз; экологические стратегии видов. Образцы тонких корней древесных и травянистых растений и верхнего слоя почв отбирали на двух техногенных отвалах и в естественных сообществах на Среднем Урале (Россия). На каждой территории образцы собирали в лесных и луговых местообитаниях. Единицей наблюдения было содержание C или N у вида на пробной площади. Всего проанализировано 83 оценки. Установлено, что ведущие факторы содержания C и N в тонких корнях различаются: для содержания C определяющее значение имеет тип микоризы, для N – способность к симбиотической азотфиксации; на втором месте по степени влияния на содержание C и N – экологические особенности местообитаний; на третьем – тип экологической стратегии. Закономерности накопления N в корнях растений разных экологических стратегий и с разными типами микориз не полностью повторяют аналогичные закономерности накопления N в листьях.
Тонкие корни растений имеют большое значение в циклах углерода и азота наземных экосистем [1]: они – важный источник опада, который по массе, возможно, превосходит надземный опад [2]. Содержание углерода и азота в корнях зависит от таких факторов, как таксон; функциональная группа; тип корневого симбиоза; продолжительность жизни корней; содержание химических элементов или их доступных форм в почве. Корни двудольных содержат больше N, чем корни однодольных [3–5]. Из двудольных высокое содержание N характерно для бобовых [3, 5].Содержание С и N в корнях растений связано с жизненной формой [6]. Тип микоризы определяет не только доступ к разным источникам минеральных элементов [7], но и связан с углеродным и азотным балансом живых и мертвых корней [8–15] и почвы [14, 15]. В тонких корнях эктомикоризных деревьев из-за большой массовой доли мицелия обычно много азота по сравнению с корнями арбускулярно микоризных трав [11]. Также существует связь между элементным составом корней и почв. Корни растений, адаптированных к бедным минеральными элементами почвам, как правило, характеризуются длительной жизнью и высоким содержанием С по сравнению с корнями растений богатых почв [3, 5, 16], при этом длительность жизни корней отрицательно коррелирует с содержанием N в них [17].
Содержание C и N как в корнях, так и в листьях различается в зависимости от принадлежности растений к таксономическим и функциональным группам, типов почв и гидротермических условий [18–21]. По сравнению с другими видами двудольных содержание N в листьях бобовых высокое [3]. Растения с эрикоидной микоризой и эктомикоризой, преобладающие в экосистемах с малой доступностью макроэлементов, отличаются низкими относительной скоростью роста и концентрацией N в листьях [10, 22]. Травянистые растения, среди которых преобладают арбускулярно микоризные виды, имеют более высокую интенсивность фотосинтеза, что сопряжено с более высокой концентрацией N [18, 23]. У эктомикоризных растений содержание N выше в листьях листопадных видов по сравнению с вечнозелеными [10]. В листьях растений в ряду экологических стратегий S–C–R содержание C уменьшается, а N увеличивается [24]. В глобальном и региональном масштабах содержание N в листьях положительно связано с содержанием органического вещества в почве, а также с доступностью Р и N [18, 20].
В целом закономерности изменчивости элементного состава корней изучены менее надежно, чем элементный состав листьев. Для улучшения понимания экологического своеобразия видов и групп растений, а также представлений о динамике С и N в растениях и экосистемных процессах необходимы, во-первых, дополнение существующих массивов данных о содержании С и N в тонких корнях и, во-вторых, понимание ведущих факторов депонирования С и N в корнях. Поэтому целью работы было сопоставление факторов содержания C и N в тонких корнях на примере растений Среднего Урала с разными экологическими стратегиями и типами корневых симбиозов, произрастающих в контрастных эдафических условиях. Общей идеей был поиск ответа, в какой степени совпадают закономерности накопления и распределения C и N в листьях и тонких корнях растений.
МАТЕРИАЛ И МЕТОДИКА
Район. Работы проведены на Среднем Урале (Россия; 57°00′–57°20′ с.ш., 59°56′–60°27′ в.д.) в пределах Белоярского южно-таежного ботанико-географического округа Свердловской области. Мезорельеф района холмисто-увалистый с преобладанием высот 300–350 м над ур. м. Климат умеренно-континентальный с продолжительной (5–6 мес.) холодной зимой и коротким (около 3 мес.) теплым летом. Среднегодовая температура +1.7…+2.4°С, среднегодовое количество осадков 510–580 мм. Район типично лесной, с южно-таежными сосновыми с лиственницей, реже сосново-еловыми и вторичными березовыми и смешанными лесами. Леса неоднократно подвергались рубкам и пожарам. Все луга вторичные послелесные.
Территории, местообитания и пробные площади. Работы проведены на трех разных территориях – на двух техногенных отвалах и на одной территории с естественными сообществами, которые считали вариантами, контрольными к техногенным. “Территория I” – отвал золы (золоотвал) Верхнетагильской районной электростанции (ВТГРЭС, г. Верхний Тагил), образовавшийся в 1956–1965 гг. в результате складирования золы от сжигания угля при электрогенерации. Площадь отвала 125 га, поверхность выровненная. В результате естественного зарастания поверхности золы примерно за 50 лет на отвале сформировались участки с лесной и луговой растительностью. Существование участков с луговой и лесной растительностью связано с разной скоростью сукцессии в связи с локальными особенностями увлажнения. “Территория II” – золоотвал Среднеуральской районной электростанции (СУГРЭС, г. Среднеуральск), образовавшийся в 1936–1968 гг. в результате складирования золы от сжигания угля. Площадь отвала 104 га, поверхность выровненная. В результате естественного зарастания поверхности золы за 50 лет сформировались лесные и луговые участки. Естественные сообщества, которые обозначили как “фон”, подобраны на расстоянии 3–5 км от территории I и 40–50 км от территории II.
На каждой территории сбор образцов выполнен в двух местообитаниях – лесном (обозначение “лес”) и луговом (“луг”). Территория I, лес: мелколиственный лес с Betula pendula и Populus tremula, единично встречается Pinus sylvestris; в напочвенном покрове всего 26 видов (оценки видового богатства приведены для сосудистых растений на площадь 300 м2 (луг) и 400 м2 (лес)); наиболее обильны Pyrola rotundifolia, P. minor, Orthilia secunda, Deschampsia cespitosa. Территория I, луг: разнотравно-злаковое сообщество с доминированием Calamagrostis epigeios, Poa pratensis, Pimpinella saxifraga, Silene nutans; всего 34 вида. Территория II, лес: смешанный хвойно-мелколиственный лес с B. pendula, P. tremula, P. sylvestris и подлеском из Salix caprea и Prunus padus; в напочвенном покрове всего 27 видов; преобладают Equisetum prаtense, Trifolium medium, P. rotundifolia. Территория II, луг: злаково-разнотравный луг с C. epigeios, P. pratensis, Potentilla argentea, T. medium; всего 18 видов. Фон, лес: березовый лес с Betula pubescens и B. pendula и единичными P. sylvestris и Picea obovatа; в напочвенном покрове 48 видов; преобладают Calamagrostis arundinaceae, Aegopodium podagraria, Rubus saxatilis. Фон, луг: вторичный разнотравно-мелкозлаковый луг с доминированием Agrostis tenuis, Festuca pretensis, Dactylis glomerata, Alchemilla sp.; всего 54 вида. Названия видов растений даны по [25].
В каждом местообитании территорий I и II заложили по 3 пробные площади (в луговых местообитаниях – 10 × 10 м, в лесных – 20 × 20 м); в каждом местообитании фоновой территории – по 2 пробные площади такого же размера. Таким образом, всего было 16 пробных площадей, на которых отобрали образцы растений и почв.
Отбор образцов выполнен в июле 2017 г. (фоновая территория и территория I) и 2018 г. (территория II). Образцы корней отбирали у видов, которые доминировали на пробных площадях. Образцы (корневые мочки) откапывали с глубины 0–10 см. Образцом могла быть целая корневая система (у видов с небольшой корневой системой) или ее фрагмент. Всего образцов каждого вида на пробной площади было 4–6; у видов с небольшими корневыми системами – до 10–15. Корни в лаборатории отмывали от почвы в проточной воде. Для элементного анализа и микроскопии отбирали тонкие корни по критериям [26]. К тонким относили поглощающие корни первичного строения диаметром <0.5 мм. Корневища, мертвые корни и все корни диаметром >0.5 мм отбраковывали. Из всех образцов вида на каждой пробной площади старались сформировать несколько (от 2 до 5) проб; каждая проба – около 5 г корней в свежем состоянии. Часть пробы фиксировали в 70%-ном этиловом спирте для изучения микоризообразования. Другую часть пробы сушили 48 ч при 60°С для определения элементного состава.
Образцы почв отбирали из почвенных разрезов, которые делали по одному на каждой пробной площади. Образцы отбирали из каждого морфологически выделенного горизонта верхнего корнеобитаемого слоя почвы 0–10 см. В лесных местообитаниях территорий I и II это были подстилка А0 (мощностью 2 см), горизонт АC (мощностью 5 см) и в некоторых случаях верхняя часть горизонта С (до 3 см). В фоновых лесах это были горизонты А0 и А дерново-подзолистых почв. В луговых местообитаниях территорий I и II верхние 10-см части профиля были представлены гумусовым А (2 см) и переходным АС (5 см) горизонтами и верхней частью горизонта С, на фоновых лугах – горизонт А дерново-подзолистых почв.
Анализ микоризы. У B. pendula и P. tremula с эктомикоризой (обозначение ECM) и видов рода Pyrola с арбутоидной (Arb) микоризой при увеличении ×40 регистрировали долю микоризных корневых окончаний. У некоторых корневых окончаний видов с ECM и Arb после заморозки с помощью ротационного микротома делали срезы толщиной 10–20 мкм и регистрировали наличие микоризных морфологических структур. Морфологические структуры, характерные для арбускулярной микоризы (AM), регистрировали микроскопически (×200–400) на давленых препаратах после мацерации в KOH на водяной бане и окрашивания корней анилиновым синим.
Химический и элементный анализ. Подготовку образцов почвы к анализу и определение основных химических характеристик почв проводили согласно руководствам [27, 28]. Содержание общего органического углерода определяли по Тюрину, общего азота – по Кьельдалю, доступного фосфора (P2O5) – по Кирсанову, доступного калия (К2О) – пламенно-фотометрическим методом, рН – потенциометрическим методом.
Для элементного анализа использовали образцы корней, размолотых до порошкообразного состояния. Содержание С и N определяли в микронавесках 3–5 мг с помощью CHNS-анализатора (EURO ЕА 3000 (EuroVector, Италия); точность определения <0.3%) в лаборатории микроанализа Новосибирского института органической химии им. Н.Н. Ворожцова СО РАН (Россия). Концентрации C и N в каждой пробе корней измеряли в двух аналитических повторностях. Общее число элементо-определений в корнях – 444 для C и 444 для N.
Анализировали четыре характеристики: 1) содержание C (C%) – массовая доля углерода в образце; 2) содержание N (N%) – массовая доля азота в образце; 3) соотношение C/N ( = C%/N%); 4) ΔN – разность N% в корнях и измеренного по Кьельдалю N в почве на данной площади. Последний показатель использовали, чтобы характеризовать степень обогащения азотом корней по сравнению с почвой.
Статистическую обработку данных осуществляли с помощью однофакторного и двухфакторного дисперсионного анализа (ANOVA). Единицей наблюдения в статистическом анализе было значение признака у вида на пробной площади (n = 83; исходные данные – DOI: 10.5281/zenodo.3996905). При некоторых сравнениях использовали дополнительные критерии формирования выборок и число наблюдений было меньше. Чтобы оценить, какие факторы сильнее влияли на элементный состав корней, применяли информационный критерий Акаике (AIC). Расчеты выполнены в пакете STATISTICA 8.0 (StatSoft Inc., USA, 1984–2007). При усреднении значений через символ ± приведена стандартная ошибка (SE), на рисунках дополнительно представлен 95%-ный доверительный интервал (95CI).
РЕЗУЛЬТАТЫ
Состав почвы. Верхние слои почв изученных территорий различались по химическому составу (табл. 1): на территории I величина pH верхнего горизонта была на 1.15 ед. сдвинута в щелочную область по сравнению с фоновыми условиями. Также территории различались по содержанию N и P: низкая концентрация N была у почв на территории II, а P – у почв на территории I. Это позволило считать изученные территории тремя разными вариантами эдафических условий и обоснованно использовать вместо географических привязок соответствующие обозначения: “фон”, “I (Pmin)” и “II (Nmin)” (см. табл. 1).
Таблица 1.
Средневзвешенные характеристики химического состава верхнего (0–10 см) слоя почв исследованных территорий
| Территория | n | р${{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Сорг | Nобщ | P2O5 | К2O | Обозначение |
|---|---|---|---|---|---|---|---|
| % | мг/100 г | ||||||
| Фоновые территории | 4 | 5.51 ± 0.28 | 5.25 ± 1.38 | 0.51 ± 0.16 | 4.3 ± 1.9 | 7.8 ± 2.8 | Фон |
| Отвал ВТГРЭС | 6 | 6.66 ± 0.30 | 5.09 ± 1.24 | 0.32 ± 0.06 | 0.4 ± 0.1 | 26.8 ± 6.0 | I (Pmin) |
| Отвал СУГРЭС | 6 | 5.69 ± 0.09 | 3.96 ± 1.07 | 0.15 ± 0.04 | 3.9 ± 0.2 | 10.8 ± 2.1 | II (Nmin) |
Поскольку почвы фоновых территорий и техногенных отвалов были контрастными по общей обеспеченности N и P, сравнение особенностей состава корней на них может быть продуктивно, так как позволяет разделить эффекты, связанные с биоэкологическими особенностями видов и условиями местообитаний.
Микориза. В корнях всех видов Pyrola и Orthilia микроскопически подтверждены структуры, характерные для Arb-микоризы (мицелиальные чехлы, сеть Гартига, гифальные кольца внутри клеток корней). Во всех местообитаниях у 59–95% корней Betula pendula и Populus tremula были структуры, характерные для ECM (мицелиальные чехлы и сеть Гартига). В корнях всех видов трав в фоновых сообществах и на отвалах наблюдали структуры АМ – везикулы и/или арбускулы, в том числе у видов семейств Caryophyllaceae, Polygonaceae и Equisetaceae, редко образующих микоризу. У некоторых особей видов этих семейств структур АМ не обнаружено, но у микоризных особей встречаемость АМ варьировала в диапазоне 6–48%, поэтому группу безмикоризных видов при анализе собственных данных мы не выделяли.
C и N в корнях бобовых растений. Специфику содержания N в корнях наиболее оправданно было ожидать у видов сем. Fabaceae, обычно симбиозирующих с азотфиксирующими ризобиями. Для проверки этого предположения сравнили содержание C и N в 4 образцах корней Fabaceae и 79 образцах других растений: содержание C в корнях бобовых и небобовых не различалось (F(1;81) = 0.81, P = 0.3701); содержание N ожидаемо было существенно выше у бобовых (3.16 ± 0.25%), чем у небобовых (1.32 ± 0.03%) (F(1;81) = 180.50, P < 0.0001). Корни бобовых по сравнению с почвой были обогащены N примерно в 3 раза больше, чем корни других растений: у бобовых ΔN = 3.00 ± 0.22%, у небобовых ΔN = 1.05 ± 0.03% (F(1;81) = 171.02, P < < 0.0001). Соотношение C/N у бобовых было низким (12.6 ± 0.8), у небобовых – высоким (32.4 ± 0.8) (F(1;81) = 34.21, P < 0.0001).
Учитывая статистически подтвердившуюся и большую по амплитуде специфику видов Fabaceae по содержанию N в корнях, при последующем анализе закономерностей содержания C и N в корнях эту группу исключили, соответственно объем наблюдений составил 79 измерений.
C и N в корнях растений разных экологических стратегий и с разными типами микоризы. Объемы выборок, характеризующих особенности содержания C и N у растений разных экологических стратегий, были следующими: S – 9 наблюдений, C – 36, R – 6, CSR – 28; у растений с разными типами микориз объемы выборок также были неравномерными: Arb – 7, ECM – 16, AM – 56. Группы растений, выделяемые по типам экологических стратегий и типам микориз, отчасти взаимосвязаны. В частности, в нашем массиве данных группа S-стратегов – это виды преимущественно с арбутоидной, реже – с арбускулярной микоризой; образцы двух древесных видов с ECM составляют значительную часть наблюдений C-стратегов; группы R- и CSR-стратегов представлены исключительно видами с арбускулярной микоризой. Поэтому сопоставление особенностей содержания C и N в корнях растений разных экологических стратегий и с разными типами микоризы выполнено одновременно (рис. 1).
Рис. 1.
Содержание углерода (а) и азота (б) в корнях, их соотношение (в) и разность между содержанием азота в корнях и почве (г) у растений разных экологических стратегий (S, CSR, R, C) и с разными типами микоризы (Arb, AM, ECM): среднее арифметическое, ±SE, ±95CI. В одном случае (S-стратеги с AM) SE и 95CI не приведены из-за малого (n = 2) объема наблюдений. Буквенными индексами вверху диаграмм показаны гомогенные по критерию Тьюки значения при группировке по типам экологических стратегий и типам микоризы.
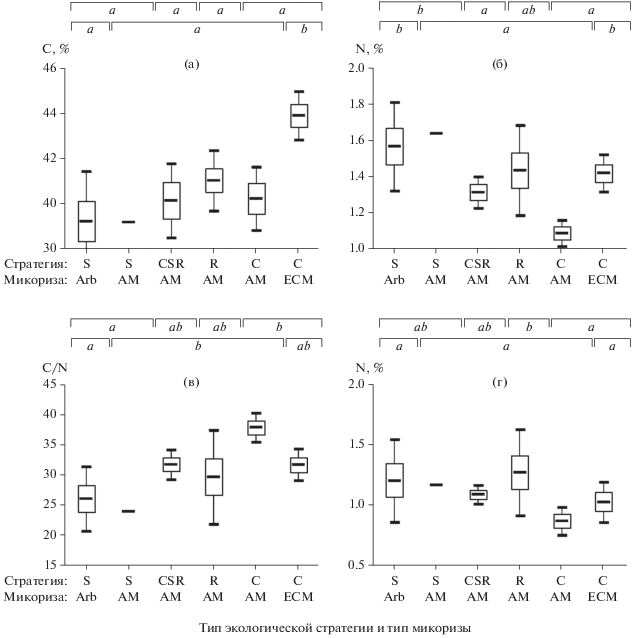
Виды разных экологических стратегий не различались по содержанию C в корнях (рис. 1а). Содержание N было значимо связано с типом стратегии (рис. 1б; F(3;75) = 5.92, P = 0.0011). Больше всего N было в корнях стресс-толерантов (1.59 ± 0.08%), а меньше всего – в корнях конкурентов (1.24 ± 0.04%). Соответственно соотношение C/N также значимо связано с типом стратегии (рис. 1в; F(3;75) = 6.68, P = 0.0005) : самое низкое – у стресс-толерантов (25.6 ± 1.7), а самое высокое – у конкурентов (35.1 ± 1.0). Относительное обогащение корней N по сравнению с почвой также значимо различалось у видов разных стратегий: значения ΔN были наименьшими у C-видов (0.94 ± 0.05%) и наибóльшими – у S- и R-видов (1.19 ± 0.11 и 1.27 ± 0.14% соответственно). Таким образом, содержание общего азота в корнях не сильно, но различалось у растений разных экологических стратегий: наиболее контрастно ‒ у конкурентов и стресс-толерантов и в меньшей степени – у конкурентов и рудералов.
Виды растений с разными типами микоризы различались по общему содержанию C в корнях (F(2;76) = 9.38, P = 0.0002): в корнях ECM-деревьев его было больше (43.94 ± 0.50%), чем в корнях видов с микоризой Arb (39.25 ± 0.91%) и АМ (40.26 ± 0.47). Содержание N было значимо (F(2;76) = 7.25, P = = 0.0012) выше в корнях видов с Arb-микоризой (1.57 ± 0.10), чем в корнях АМ-видов (1.26 ± 0.03). Соотношение C/N было низким у видов с Arb-микоризой (26.1 ± 2.2%) и более высоким (31–33%) у AM- и ECM-видов. Значения ΔN в зависимости от типа микоризы в нашем массиве измерений не различались.
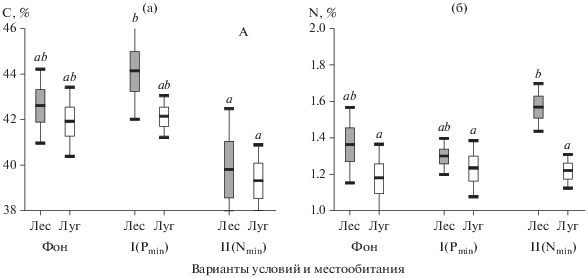
C и N в корнях растений в разных условиях. Содержание C и N в тонких корнях растений продемонстрировало экологическую изменчивость, т.е. изменчивость в зависимости от условий территорий (фон, Pmin или Nmin) и/или местообитаний (лесных и луговых). Содержание углерода изменялось только между разными территориями, возможно, в связи с их эдафическими условиями (рис. 2а). В двухфакторном ANOVA получены следующие эффекты: Fтерритория(2;73) = 7.54, P = 0.0011; Fместообитание(1;73) = 0.43, P = 0.5154. Повышенное содержание C в корнях (42.94 ± 0.48%) было на территории I на почвах с низким содержанием P, низкое (39.51 ± 0.66%) – на территории II на почвах с низким содержанием N. Содержание N изменялось только между лесными и луговыми местообитаниями. В двухфакторном ANOVA были получены следующие эффекты: Fтерритория(2;73) = 2.59, P = 0.0821; Fместообитание(1;73) = 15.15, P = 0.0002. Во всех условиях у растений, собранных в лесных местообитаниях, азота в корнях было больше, чем у растений, собранных на лугах (рис. 2б), а среднее содержание N составило: лесные растения/образцы – 1.44 ± 0.04%, луговые – 1.22 ± 0.03%.
Рис. 2.
Содержание углерода (а) и азота (б) в корнях растений на территориях с разными вариантами условий (Фон, I (Pmin) и II (Nmin)) в лесных (серые фигуры) и луговых (белые фигуры) местообитаниях: среднее арифметическое, ±SE, ±95CI. Буквенными индексами показаны гомогенные по критерию Тьюки значения.
Сопоставление факторов, влияющих на содержание C и N в корнях. В качестве причины изменчивости содержания C и N в корнях анализировали, во-первых, биоэкологические особенности растений, их групп и, во-вторых, экологические особенности местообитаний. Для соответствующих однофакторных (“способность к симбиотической азотфиксации”, “тип микоризы”; “экологическая стратегия”) и двухфакторных (“условия × местообитания”) объяснений рассчитали AIC (табл. 2; использовали полный массив оценок – n = 83). В отношении всех характеристик содержания N наибольшая объясняющая ценность установлена для способности к симбиотической азотфиксации, поскольку для этого фактора значения AIC минимальны. Вторая по значимости причина изменчивости состава N корней – изменчивость между территориями и местообитаниями. Основная причина изменчивости содержания C в корнях в нашем массиве данных – тип микоризы.
Таблица 2.
Качество объяснения (значения AIC) изменчивости характеристик содержания C и N в корнях разными факторами
| Признак | Факторы и число степеней свободы в полной модели | |||
|---|---|---|---|---|
| условия × местообитания (df = 5) | способность к симбиотической азотфиксации (df = 1) | тип микоризы (df = 2) | экологическая стратегия (df = 3) | |
| Весь массив видов с Fabaceae (n = 83) | ||||
| Содержание C | 434.26 | 443.42 | 427.64 | 440.92 |
| Содержание N | 107.08 | 18.43 | 116.74 | 110.52 |
| Отношение C/N | 559.33 | 551.02 | 578.45 | 566.69 |
| ΔN | 105.82 | 33.15 | 128.31 | 120.10 |
| Массив видов без Fabaceae (n = 79) | ||||
| Содержание C | 417.05 | Не оценивалось | 410.00 | 422.96 |
| Содержание N | –6.57 | » | –0.68 | –1.68 |
| Отношение C/N | 508.80 | » | 522.20 | 513.69 |
| ΔN | –8.70 | » | 28.18 | 19.40 |
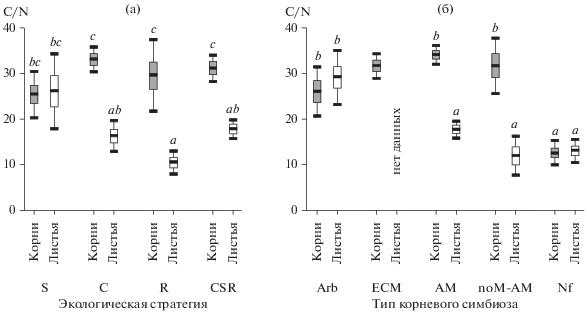
Соотношение C/N в листьях и корнях. Для оценки особенностей элементного состава листьев и корней использовали данные из работы [24], в которой приведены сведения о химическом составе листьев 73 видов растений Среднего Урала. Для сопоставления мы выбрали интегральную характеристику C/N. Публикация [24] основана на сравнении групп растений с разными экологическими стратегиями. Все неосновные стратегии (CR, CS, SR, CSR) объединили в одну группу CSR-видов. На основании литературных сведений все 73 вида классифицировали по типам корневых симбиозов, понимая под ними тип микоризы, дополненный группой растений с азотфиксирующим ризобиальным симбиозом (обозначение – Nf). При этом и виды из нашего массива оценок, и виды из работы [24], помимо типов микоризы Arb, ECM и AM, относили еще к одной группе – факультативно микоризным или безмикоризным видам (noM-AM). Сюда отнесли виды семейств, в которых часто встречаются немикоризные растения: Alismataceae, Brassicaceae, Caryophyllaceae, Chenopodiaceae, Equisetaceae, Polygonaceae. Виды с орхидными и эрикоидными микоризами в анализ не включали.
У стресс-толерантов соотношение C/N в корнях и листьях одинаковое, но у растений других стратегий в корнях оно более широкое, чем в листьях (рис. 3а): среднее соотношение C/N в корнях составляет 31.8 ± 0.9, а в листьях – 17.6 ± 0.9. На одинаковое число атомов углерода число атомов азота в листьях выше, чем в корнях, в 2.0 раза у C-видов, в 2.8 раза – у R-видов и в 1.8 раза – у CSR-видов. Аналогичная картина видна при классификации растений по способам корневого питания (рис. 3б) : одинаковое соотношение C/N в корнях и листьях установлено у Arb- и Nf-видов, а у AM- и noM-AM-видов в корнях оно в 1.9–2.6 раза больше, чем в листьях.
Рис. 3.
Соотношение C/N в корнях (серые фигуры; наши данные) и листьях (белые фигуры; по [24]) у растений Среднего Урала разных экологических стратегий (а) и с разными типами почвенного питания (б); при проведении ANOVA и расчете значений критерия Тьюки группа ECM-видов была исключена): среднее арифметическое, ±SE, ±95CI. Буквенными индексами показаны гомогенные по критерию Тьюки значения.
ОБСУЖДЕНИЕ
На фоне глобальных обобщений о закономерностях содержания углерода и азота в растениях [18–21] наши результаты имеют локальный и уточняющий характер. Они позволяют дать независимую оценку относительной важности влияния на соотношение C/N в растениях внешних условий и таких внутренних факторов, как филогенетические и функциональные особенности групп видов. Этот вопрос важен для адекватного моделирования и прогнозирования реакции растительных систем на глобальные изменения [19].
На одном из золооотвалов с ситуацией Pmin обеспеченность почвы P примерно в 3 раза меньше нижней границы естественного регионального диапазона, который составляет 1.5–12.9 мг P2O5/100 г [29, 30]. На другом отвале с ситуацией Nmin обеспеченность почвы N была меньше, чем нижняя граница естественного регионального диапазона, который составляет 0.21–0.35% Nобщ [29, 30]. Таким образом, территории, на которых мы проводили наблюдения, действительно контрастны по эдафическим условиям. Несмотря на это, основная причина варьирования N (характеристики N%, C/N и ΔN) в корнях в нашем массиве данных – это различия между видами, способными и не способными к симбиотической азотфиксации, т.е. между видами семейства Fabaceae и всеми остальными. Особенности условий в разных местообитаниях – вторая по значимости причина изменчивости содержания N. Со способностью к симбиотической азотфиксации связано 55–90% изменчивости характеристик N%, C/N и ΔN; с различиями между местообитаниями – 1–10%; суммарно с типом микоризы и экологической стратегией – 1–8%. Следовательно , таксономический/филогенетический сигнал в изменчивости содержания N в тонких корнях преобладает. Близкая амплитуда содержания N ‒ до 10 раз между разными видами ‒ установлена при сравнении изменчивости содержания C и N в других локальных местообитаниях [19]. По-видимому, экологическая компонента изменчивости содержании C и N может быть ведущей при небольшой генотипической вариабельности [31].
Изменчивость средних оценок содержания С и N между разными территориями и местообитаниями обусловлена не только условиями среды. Списки и соответственно экологические свойства изученных видов на разных территориях и в разных местообитаниях были разными. Следовательно, какая-то доля изменчивости, которую мы трактуем как экологическую, обусловлена особенностями таксонов растений.
Содержание C в первую очередь определяется типом микоризы (порядка 20% изменчивости признака) и во вторую – внешними условиями (порядка 15% изменчивости). Особенности содержания C% в корнях у растений с разными типами микоризы или у растений разных жизненных форм, что в нашем случае одно и то же, такие же, как в листьях [10]: у АМ-трав – C% относительно мало, а у ECM-деревьев – относительно много. Количество C%, как правило, связывают с конструкционной ценой органов [32], и в этом отношении распределение C% у растений с разными микоризами (= разными жизненными формами) объяснимо: много углерода и соответственно высокая конструкционная цена ‒ у долгоживущих корней деревьев, и относительно меньше C и цена – у относительно короткоживущих корней трав.
Содержание N – характеристика метаболической активности ткани или органа [33], положительно коррелирующая со скоростью роста [34]. В листьях N% возрастает от видов с эрикоидной микоризой к эктомикоризным деревьями и далее к арбускулярно микоризным деревьям и травам [10]. Виды с арбутоидной микоризой в работе [10] отсутствовали, однако структурно и функционально Arb-микориза ближе всего к ECM [35]. В корнях последовательность возрастания N% другая: АМ–ECM–Arb. Специфика содержания N в корнях по сравнению с листьями видна также при группировке видов по экологическим стратегиям: в листьях N% возрастает в ряду S–C–R, а в корнях – в ряду C–R–S. Корни стресс-толерантных растений как с арбутоидной микоризой, так и с арбускулярной богаты азотом, несмотря на низкую относительную скорость роста этих растений.
У азотфикисирующих бобовых и S-стратегов в листьях и корнях соотношение C/N одинаковое, а у C- и R-стратегов корни относительно обеднены N по сравнению с листьями. Таким образом, растения с разными экологическими стратегиями по-разному перераспределяют ресурсы между надземными и подземными органами не только в отношении общей биомассы органов [36] и не только в отношении ресурсов, выделяемых для поддержки корневых симбионтов [37], но и, по-видимому, в отношении C/N. Известно, что высокие инвестиции в подземные органы, оцениваемые по их относительной массе, характерны для S-стратегов, а низкие – для R-стратегов [36]. О больших инвестициях в корни также свидетельствует установленное равенство C/N в листьях и корнях S-стратегов. Соответственно сильная обедненность тканей корней азотом у R-стратегов подтверждает низкие инвестиции в корни у этих растений. Таким образом, не исключено, что обедненность корней арбускулярно микоризных C-стратегов и часто факультативно микоризных или безмикоризных R-стратегов азотом – это часть общего комплекса особенностей их строения. Делать подобные заключения на основании косвенных сравнений, как это сделано выше, преждевременно. Обоснованно можно лишь сформулировать предположение, требующее дальнейшей проверки. Можно также отметить, что возрастание N% в корнях в ряду C–R–S-видов соответствует общей закономерности увеличения концентрации питательных веществ с уменьшением размера растения [19].
Исследования взаимосвязи между химическими свойствами листьев и корней растений показали скоррелированное изменение содержания азота у корней и листьев [3, 16]. Важная особенность строения тонких корней по сравнению с листьями состоит в том, что их структура часто оптимизирована не для самостоятельного осуществления поглотительных функций, а для размещения симбионтов и эффективного взаимодействия с ними [38, 39]. В тонких корнях эктомикоризных деревьев грибной симбионт может занимать 20% объема и более [11, 40], а в корнях трав с арбускулярной микоризой – до 3–17% [11]. Поскольку среднее соотношение C/N в грибном мицелии 18 : 1 [41], а в растениях оно шире – от 18 : 1 [25] до 25 : 1–36 : 1 [3, 10, 42], то большое обилие грибного мицелия в корнях может приводить к снижению C/N. Высокое содержание N в корнях изученных Pyrola spp. может быть связано с особым взаимодействием симбионтов в арбутоидной микоризе, в отношении которого дискутируется микогетеротрофный характер [35], что сопровождается высокой ферментативной активностью тканей корня [33]. Другой возможной причиной особенности элементного состава корней может быть их специализация как запасающих органов.
ЗАКЛЮЧЕНИЕ
В результате сопоставления факторов содержания C и N в тонких корнях растений с разными экологическими стратегиями и типами корневых симбиозов в контрастных эдафических условиях удалось установить внутренне непротиворечивые закономерности, согласующиеся с основными современными представлениями об отношении C/N растений. Ведущие факторы содержания C и N в тонких корнях различны, но в обоих случаях они характеризуют особенности корневых симбиозов или тип почвенного питания. Для содержания C определяющее значение имеет тип микоризы, для содержания N – принадлежность вида к семейству Fabaceae или способность к симбиотической азотфиксации. На втором месте по степени влияния на содержание C и N – экологические особенности местообитаний, на третьем – тип экологической стратегии Раменского–Грайма. Хотя функциональные особенности видов, интегрально выраженные в типах экологических стратегий и типах микориз, не сильно влияли на содержание C и N, эти эффекты были значимы. По нашему мнению, они заслуживают основного внимания. Это связано с тем, что большое содержание N у бобовых – тривиальный, легко предсказуемый результат. Установленные особенности изменчивости C/N, связанные с условиями среды, имеют локальное значение и в наши задачи не входило содержательно интерпретировать эти эффекты. Но эффекты, связанные с особенностями накопления C и N в корнях видов разных экологических стратегий и с разными типами микориз, имеют относительно высокую общность. Основной результат работы можно резюмировать так: закономерности накопления N в корнях растений разных стратегий с разными типами микориз не полностью повторяют закономерности накопления N в листьях. Это открывает новые возможности для поиска общих особенностей приспособления растений к абиотическим условиям и биотическим взаимодействиям.
Работа выполнена при финансовой поддержке РФФИ (грант № 18-04-00714: полевые и аналитические работы; обобщение данных) и частично в рамках выполнения темы государственного задания Института экологии растений и животных УрО РАН (АААА-А19-119031890084-6, обобщение данных).
Авторы декларируют отсутствие конфликта интересов.
Список литературы
Ruess R.W., Van Cleve K., Yarie J. et al. Contributions of fine root production and turnover to the carbon and nitrogen cycling in taiga forests of the Alaskan interior // Can. J. For. Res. 1996. V. 26. № 8. P. 1326–1336.
Poorter H., Niklas K.J., Reich P.B. et al. Biomass allocation to leaves, stems and roots: meta-analyses of interspecific variation and environmental control // New Phytol. 2012. V. 193. P. 30–50.
Tjoelker M.G., Craine J.M., Wedin D. et al. Linking leaf and root trait syndromes among 39 grassland and savannah species // New Phytol. 2005. V. 167. P. 493–508.
Салпагарова Ф.С., ван Логтестайн Р., Онипченко В.Г. и др. Содержание азота в тонких корнях и структурно-функциональные адаптации высокогорных растений // Журн. общ. биол. 2013. Т. 74. № 3. С. 190–200.
Roumet C., Birouste M., Picon-Cochard C. et al. Root structure-function relationships in 74 species: evidence of a root economic spectrum related to carbon economy // New Phytol. 2016. V. 210. P. 815–826.
Valverde-Barrantes O.J., Freschet G.T., Roumet C. et al. A worldview of root traits: the influence of ancestry, growth form, climate and mycorrhizal association on the functional trait variation of fine-root tissues in seed plants // New Phytol. 2017. V. 215. № 4. P. 1562–1573.
Clark R.B., Zeto S.K. Mineral acquisition by arbuscular mycorrhizal plants // J. Plant Nutr. 2000. V. 23. P. 867–902.
Wright S.F., Upadhyaya A., Buyer J.S. Comparison of N‑linked oligosaccharides of glomalin from arbuscular mycorrhizal fungi and soils by capillary electrophoresis // Soil Biol. Biochem. 1998. V. 30. № 13. P. 1853–1857.
Rygiewicz P.T., Andersen C.P. Mycorrhizae alter quality and quantity of carbon allocated below ground // Nature. 1994. V. 369. № 6475. P. 58–60.
Cornelissen J.H.C., Aerts R., Cerabolini B. et al. Carbon cycling traits of plant species are linked with mycorrhizal strategy // Oecologia. 2001. V. 129. № 4. P. 611–619.
Langley J.A., Hungate B.A. Mycorrhizal controls on belowground litter quality // Ecology. 2003. V. 84. № 9. P. 2302–2312.
Langley A.J., Chapman S.K., Hungate B.A. Ectomycorrhizal colonization slows root decomposition: the post-mortem fungal legacy // Ecol. Lett. 2006. V. 9. № 8. P. 955–959.
Бетехтина А.А., Некрасова О.А., Дергачева М.И. и др. Разложение корней луговых и лесных растений в зольном субстрате отвалов электростанций: лабораторный эксперимент // Изв. РАН. Сер. биол. 2020. № 3. С. 318–324.
Wurzburger N., Brookshire E.N.J. Experimental evidence that mycorrhizal nitrogen strategies affect soil carbon // Ecology. 2017. V. 98. № 6. P. 1491–1497.
Frey S.D. Mycorrhizal fungi as mediators of soil organic matter dynamics // Annu. Rev. Ecol. Evol. Syst. 2019. V. 50. P. 237–259.
Craine J.M., Fargione J., Sugita S. Supply pre-emption, not concentration reduction, is the mechanism of competition for nutrients // New Phytol. 2005. V. 166. P. 933–942.
Reich P.B. The world-wide “fast-slow” plant economics spectrum: a traits manifesto // J. Ecol. 2014. V. 102. P. 275–301.
Wang G. Leaf trait co-variation, response and effect in a chronosequence // J. Veg. Sci. 2007. V. 18. № 4. P. 563–570.
Elser J.J., Fagan W.F., Kerkhoff A.J. et al. Biological stoichiometry of plant production: metabolism, scaling and ecological response to global change // New Phytol. 2010. V. 186. № 3. P. 593–608.
He M., Dijkstra F.A., Zhang K. et al. Leaf nitrogen and phosphorus of temperate desert plants in response to climate and soil nutrient availability // Sci. Rep. 2014. V. 4. P. 1–7.
Tang Z., Xu W., Zhou G. et al. Patterns of plant carbon, nitrogen, and phosphorus concentration in relation to productivity in China’s terrestrial ecosystems // Proc. Natl. Acad. Sci USA. 2018. V. 115. № 16. P. 4033–4038.https://doi.org/10.1073/pnas.1700295114
Read D.J. Mycorrhizas in ecosystems // Experientia. 1991. V. 47. № 4. P. 376–391.
Ахметжанова А.А., Онипченко В.Г., Эльканова М.Х. и др. Изменение эколого-морфологических параметров листьев альпийских растений при внесении элементов минерального питания // Журн. общ. биол. 2011. № 5. С. 388–400.
Пьянков В.И., Иванов Л.А., Ламберс X. Характеристика химического состава листьев растений бореальной зоны с разными типами экологических стратегий // Экология. 2001. № 4. С. 243–251. [Pyankov V.I., Ivanov L.A., Lambers H. Chemical composition of the leaves of plants with different ecological strategies from the boreal zone // Rus. J. Ecol. 2001 V. 32. № 4. P. 221–229. doi 10.1023/A:1011354019319]
The Plant List [Электронный ресурс]. URL: http://www.theplantlist.org/ (дата обращения: 30.04.2020).
McCormack M.L., Dickie I.A., Eissenstat D.M. et al. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes // New Phytol. 2015. V. 207. № 3. P. 505–518.
Аринушкина Е.В. Руководство по химическому анализу почв. М.: МГУ, 1970. 478 с.
Теория и практика химического анализа почв / Под ред. Воробьева Л.А. М.: ГЕОС, 2006. 400 с.
Фирсова В.П., Ржанникова Г.К. Почвы южной тайги Урала и Зауралья // Труды ИЭРиЖ УНЦ СССР. Свердловск, 1972. Вып. 85. С. 3–83.
Гафуров Ф.Г. Почвы Свердловской области. Екатеринбург: Изд-во Урал. ун-та, 2008. 396 с.
Agren G.I., Weih M. Plant stoichiometry at different scales: element concentration patterns reflect environment more than genotype // New Phytol. 2012. V. 194. P. 944–952.
Пьянков В.И., Иванов Л.А., Ламберс Х. Конструкционная цена растительного материала у видов бореальной зоны с разными типами экологических “стратегий” // Физиол. раст. 2001. Т. 48. № 1. С. 81–88.
Reich P.B., Tjolker M.G., Pregitzer K.S. et al. Scaling of respiration to nitrogen in leaves, stems and roots of higher land plants // Ecol. Letters. 2008. V. 11. P.793–801.
Wright L.G., Reich P.B., Westoby M. et al. The world-wide leaf economics spectrum // Nature. 2004. V. 428. P. 821–827.
Смит С.Э., Рид Д.Дж. Микоризный симбиоз. М., 2012. 776 с.
Пьянков В.И., Иванов Л.А. Структура биомассы у растений бореальной зоны с разными типами экологических стратегий // Экология. 2000. № 1. С 3–10. [Pyankov V.I., Ivanov L.A. Biomass allocation in boreal plants with different ecological strategies // Rus. J. Ecol. 2000. V. 31. № 1. P. 1–7. doi 10.1007/BF02799718]
Бетехтина А.А., Веселкин Д.В. Распространенность и интенсивность микоризообразования у травянистых растений Среднего Урала с разными типами экологических стратегий // Экология. 2011. № 3. С. 176–183. [Betekhtina A.A., Veselkin D.V. Prevalence and intensity of mycorrhiza formation in herbaceous plants with different types of ecological strategies in the Middle Urals // Rus. J. Ecol. 2011. V. 42. № 3. P. 192–198. doi 10.1134/S1067413611030040]
Проворов Н.А. Растительно-микробные симбиозы как эволюционный континуум // Журн. общ. биол. 2009. Т. 70. № 1. С. 10–34.
Betekhtina A.A., Veselkin D.V. Mycorrhizal and non-mycorrhizal dicotyledonous herbaceous plants differ in root anatomy: evidence from the Middle Urals, Russia // Symbiosis. 2019. V. 77. № 2. P. 133–140.
Веселкин Д.В. Соотношение объемов гриба и древесных тканей в эктомикоризных корнях хвойных: сравнение двух массивов измерений // Лесоведение. 2015. № 2. С. 70–76.
Zhang J., Elser J.J. Carbon: nitrogen: phosphorus stoichiometry in fungi: a meta-analysis // Front. Microbiol. 2017. V. 8. № 1281. P. 1–9.
Elser J.J., Fagan W.F., Denno R.F. et al. Nutritional constraints in terrestrial and freshwater food webs // Nature. 2000. V. 408. P. 578–580.
Дополнительные материалы отсутствуют.


