Экология, 2021, № 2, стр. 93-102
Изменение фитогормонального статуса красной японской сосны после аварии на АЭС Фукусима
С. В. Битаришвили a, *, С. А. Гераськин a, В. И. Йощенко b, А. А. Празян a, К. Нанба b, c
a Всероссийский научно-исследовательский институт радиологии и агроэкологии
249032 Обнинск, Киевское шоссе, 109-й км, Россия
b Institute of Environmental Radioactivity at Fukushima University
960-1296 Fukushima, 1 Kanayagawa, Japan
c Faculty of Symbiotic Systems Science at Fukushima University
960-1296 Fukushima, 1 Kanayagawa, Japan
* E-mail: bitarishvili.s@gmail.com
Поступила в редакцию 27.05.2020
После доработки 26.06.2020
Принята к публикации 03.07.2020
Аннотация
После аварии на АЭС Фукусима у молодых сосен была обнаружена повышенная частота нарушений апикального доминирования. Наиболее вероятно, что обнаруженные морфозы связаны с повреждением апикальных меристем хвойных растений в результате облучения и изменением их фитогормонального статуса. Для проверки этой гипотезы в популяциях красной японской сосны с территорий, загрязненных радионуклидами в результате аварии на АЭС Фукусима, была оценена частота морфозов, связанных с нарушением апикального доминирования, и содержание основных классов фитогормонов: индолилуксусной кислоты (ИУК), индолилмасляной кислоты (ИМК), зеатина, гибберелловой кислоты (ГК) и абсцизовой кислоты (АБК). Концентрации фитогормонов в хвое молодых деревьев (5–8 лет) определяли методом высокоэффективной жидкостной хроматографии. Впервые показано, что хроническое радиационное воздействие изменяет соотношение основных классов фитогормонов в хвое красной японской сосны: повышает концентрации ИУК, зеатина и АБК и снижает концентрации ГК. Полученные результаты позволили объяснить феномен повышенной частоты появления нарушений апикального доминирования в популяциях молодых хвойных деревьев из района аварии на АЭС Фукусима.
Произошедшей 11 марта 2011 г. аварии на АЭС Фукусима-1 присвоен максимальный 7-й уровень опасности по шкале INES МАГАТЭ. В результате взрывов на энергоблоках произошел выброс радиоактивных материалов, повлекший за собой загрязнение значительной территории. Основной вклад в радиоактивные выпадения вносили 129mTe, 132Te, 129I, 131I, 133I, 134Cs, 136Cs и 137Cs [1]. Из перечисленных радионуклидов в отдаленный период после аварии основную опасность представляет 137Cs, длительный период полураспада которого (30 лет) осложняет оценку экологических последствий аварии и предполагает долгосрочное воздействие на окружающую среду. Тяжелые радиационные аварии предоставляют уникальную возможность изучения механизмов адаптации природных популяций к хроническому радиационному воздействию в естественной среде их обитания.
Большая часть загрязненной территории покрыта лесами [2]. Ранее в ходе обследования загрязненных радионуклидами районов в популяциях ели [3] и сосны [4] была обнаружена повышенная частота морфозов, связанных с нарушением апикального доминирования. Преобладающая часть аномалий обнаружена у молодых деревьев на второй год после аварии, у взрослых деревьев морфозов не обнаружено. У поврежденных деревьев главная ось ствола прекращала рост, боковые побеги интенсивно развивались. У части поврежденных деревьев наблюдалось восстановление апикального доминирования: один из верхних побегов занимал лидирующее положение, рост других подавлялся.
Коррелятивные процессы у растений, а также адаптивные реакции на стресс находятся под контролем гормональной системы [5]. Наиболее вероятно, что обнаруженные морфозы связаны с повреждением в результате облучения апикальных меристем хвойных растений и изменением их фитогормонального статуса. Для проверки этой гипотезы в популяциях красной японской сосны с территорий, загрязненных радионуклидами в результате аварии на АЭС Фукусима, была оценена частота морфозов, связанных с нарушением апикального доминирования, и содержание основных классов фитогормонов в хвое хронически облучаемых деревьев.
МАТЕРИАЛ И МЕТОДЫ
Объект исследования. Красная японская сосна (Pinus densiflóra Siebold et Zucc.) широко распространена на территории Японии. Она характеризуется высокой радиочувствительностью и является одним из референтных видов, рекомендованных Международной комиссией по радиационной защите для оценки последствий облучения [6].
Характеристика участков, пробоотбор. В мае 2019 г. были заложены 4 экспериментальных участка: Akibadai (Ak), Tsushima Farm (T), Tsushima School (S), Okuma (O) на территории, подвергшейся радиоактивному загрязнению в результате аварии на АЭС Фукусима. Контрольный участок располагался на территории Фукусимского университета (F). Участки характеризовались сходными условиями произрастания и почвенными характеристиками, но различались уровнем хронического облучения (табл. 1).
Таблица 1.
Мощность амбиентной дозы в воздухе и доля деревьев с морфозами на экспериментальных участках
| Участок | Описание | Координаты | Мощность дозы, мкЗв/ч | Доля деревьев с морфозами |
|---|---|---|---|---|
| F | Университетский городок, склон холма | 37.682921 N, 140.456635 E | 0.25 ± 0.05 | 0.14 ± 0.04 |
| Aк | Заброшенное рисовое поле | 37.411508 N, 140.960887 E | 3.4 ± 0.1 | 0.52 ± 0.11* |
| T | Заброшенный сельскохозяйственный участок | 37.553270 N, 140.786833 E | 3.5 ± 0.3 | 0.42 ± 0.07* |
| S | Бывшая спортивная площадка | 37.562330 N, 140.768256 E | 3.7 ± 0.4 | 0.45 ± 0.06* |
| O | Пологий склон вдоль дороги возле заброшенного спорткомплекса | 37.411911 N, 140.994318 E | 6.4 ± 0.4 | 0.42 ± 0.06* |
Средний возраст деревьев на момент отбора проб составлял 5–8 лет. В популяциях выделяли нормальные (N), аномальные (А) – с нарушением апикального доминирования и восстановленные (R) деревья. Доля аномальных деревьев в популяции приведена в табл. 1. Мощность амбиентной дозы в воздухе измеряли на высоте 1 м с помощью дозиметра PDR-111 (Hitachi-Aloka Medical, Япония). Мощность дозы оценивали 5–7 раз под каждым деревом, с которого отбирали пробы. На каждом участке отбирали двухлетнюю хвою с деревьев на высоте 1–2 м от земли. Хвою замораживали в жидком азоте и лиофилизировали.
Анализ содержания фитогормонов. Оценивали концентрации основных классов фитогормонов: 2 представителей ауксинов (индолилуксусная кислота (ИУК) и индолилмасляная кислота (ИМК)), зеатина, абсцизовой (АБК) и гибберелловой (ГК) кислот методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Для этого была модифицирована методика выделения и определения концентраций фитогормонов методом ВЭЖХ, ранее апробированная на ячмене [7].
Пробоподготовка. Лиофилизированный материал массой 250 мг гомогенизировали в жидком азоте. К гомогенату добавляли 1.5 мл подкисленного до pH 3.5 80%-ного метанола (HPLC Gradient Grade, T.J. Baker, Нидерланды), охлажденного до 4°С. Для уменьшения окислительной деградации фитогормонов во время экстракции добавляли антиокислители: 100 мкл 0.1%-ного раствора динатриевой соли этилендиаминтетрауксусной кислоты, 100 мкл 0.1%-ного раствора 2-меркаптоэтанола. Пробирки с суспензией помещали в холодильник на мини-шейкер 3D типа “Sunflower” (Biosan, Латвия) на 30 мин. Далее суспензию центрифугировали 5 мин при 14 500 об./мин на мини-центрифуге MiniSpin (Eppendorf, Германия), надосадочную жидкость отделяли, осадок отбрасывали.
Твердофазная экстракция (ТФЭ). Для очистки экстракта проводили ТФЭ на приборе VacMaster-20 (Biotage, Норвегия) с использованием SPE колонок Biotage – ISOLUTE C18 (1 мл). Для сольватации колонки через нее пропускали 1 мл метанола, для уравновешивания – 1 мл 0.1%-ного раствора уксусной кислоты. Ультрачистая вода приобретена у компании Panreac. Твердофазную экстракцию проводили при давлении 0.35 бар. На этапах активации скорость потока через колонку, регулируемая запорным краном установки, составляла 0.5 мл/мин. Далее в колонку порционно вводили весь объем супернатанта, уменьшив скорость потока до 0.2 мл/мин. Очищенную фракцию собирали в виалы.
Условия ВЭЖХ. Качественный и количественный анализ экстрактов проводили на высокоэффективном жидкостном хроматографе Shimadzu LC-30 Nexera (Япония) с диодно-матричным детектором SPD-M20A (Shimadzu). Данные обрабатывали с помощью программного обеспечения Lab Solutions (Shimadzu). В аналитическую колонку с обращенной фазой С18 (Shim-pack XR-ODSII, 2 мкм, диаметр 3.0 мм, длина 100 мм, Shimadzu) вводили 10 мкл экстракта. Начальные условия: растворитель (А) – метанол; растворитель (B) – 0.1%-ный раствор уксусной кислоты (10 : 90). Температура термостата колонки составляла 35°С, скорость потока – 0.3 мл/мин в течение всего времени разделения. Для разделения пяти фитогормонов были подобраны оптимальные условия градиентного элюирования (табл. 2). Для устранения возможных инструментальных ошибок измерения каждый образец анализировали дважды.
Таблица 2.
Режим градиентного элюирования для анализа фитогормонов методом ВЭЖХ
| Время, мин | Растворитель A (метанол), % |
Растворитель B (0.1%-ная уксусная кислота), % |
|---|---|---|
| 0.01 | 10 | 90 |
| 7 | 20 | 80 |
| 10 | 30 | 70 |
| 25 | 35 | 65 |
| 35 | 45 | 55 |
| 50 | 95 | 5 |
| 60 | 10 | 90 |
| 65.1 | Stop | Stop |
Для идентификации и количественного анализа применяли метод внешних стандартов, основанный на соотнесении пиков проб и стандартов. Для построения калибровочных графиков использовали стандарты фитогормонов, полученные от Sigma-Aldrich (США). Стандарты разводили в метаноле в концентрациях 5–5000 мкМ. Время удерживания составило для зеатина (272 нм) – 10.82 мин; для ГК (253 нм) – 16.42 мин; для ИУК (277 нм) – 23.61 мин; для АБК (259 нм) – 35.96 мин; для ИМК (220 нм) – 40.65 мин.
Статистический анализ данных. Экспериментальные данные анализировали методами непараметрической статистики с помощью программ MS Excel и STATISTICA. Статистическую значимость различий оценивали с помощью U-теста Манна-Уитни. На рисунках представлены минимальные значения, первые квартили (Q1), медианы (М), третьи квартили (Q3) и максимальные значения.
РЕЗУЛЬТАТЫ
Из приведенных в табл. 1 данных о частоте морфозов, связанных с нарушением апикального доминирования в исследуемых популяциях, следует отсутствие связи этого показателя с мощностью амбиентной дозы на участках (r = 0.7, p > 0.05). Тем не менее частота данного типа морфозов статистически значимо превышает контрольный уровень на всех загрязненных радионуклидами участках. Следует также отметить, что в ходе обследования популяций в 2014–2016 гг. статистически значимая связь частоты встречаемости морфозов с уровнем радиационного воздействия на момент обследования также не была обнаружена [4]. Как и в нашем случае, максимальная частота морфозов отмечена на участке Akibadai, уровень радиационного воздействия на котором в момент обследования был гораздо ниже, чем на участке Okuma. При оценке последствий радиационного воздействия в популяциях Akibadai и Okuma, помимо мощности дозы, необходимо учитывать распределение деревьев по возрастам: в первой популяции большинство деревьев появилось в 2011 г., а во второй – в 2012–2013 гг. С учетом того, что в 2011 г. поглощенные деревьями дозы были гораздо больше, чем в 2012–2013 гг. [1], становится понятно, почему в популяции Akibadai частота встречаемости морфозов выше, чем в популяции Okuma. Если же радиационное воздействие на популяцию оценивать с учетом возрастной структуры составляющих ее деревьев, как это было сделано в работе [4], то корреляция между частотой морфозов и уровнем радиационного воздействия становится статистически значимой. Этот пример подчеркивает важность учета доз, полученных деревьями в первый период аварии, при оценке отдаленных последствий радиационного воздействия.
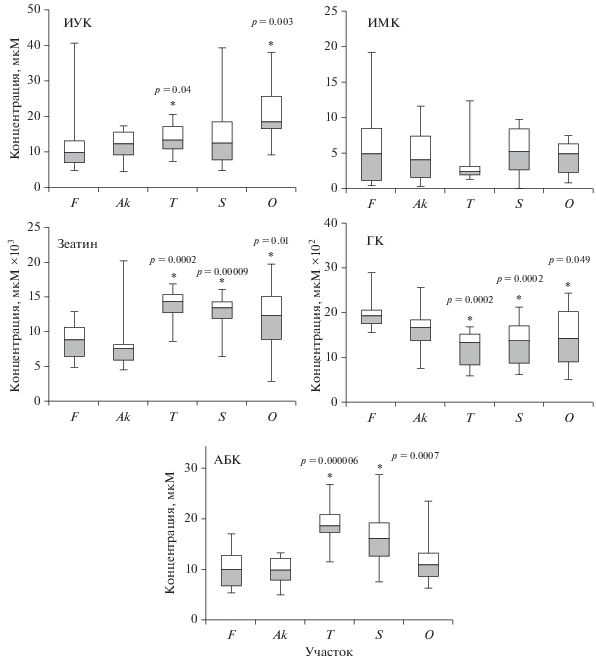
У сосен из хронически облучаемых популяций обнаружен статистически значимый (r = 0.95, p < < 0.05) рост содержания основного ауксина растений ИУК с увеличением мощности дозы (рис. 1). Содержание другого ауксина (ИМК) не изменялось. Выявлено увеличение уровней зеатина на трех самых загрязненных участках – Т (U-тест, n = 36, p = 0.0002), S (U-тест, n = 36, p = 0.00009) и О (U-тест, n = 36, p = 0.01) и снижение ГК на этих же участках – Т (U-тест, n = 36, p = 0.0002), S (U-тест, n = 36, p = 0.002), О (U-тест, n = 36, p = 0.049). Содержание основного стрессового гормона АБК в хронически облучаемых популяциях сосны было увеличено на участках Т (U-тест, n = 36, p = = 0.000006) и S (U-тест, n = 36, p = 0.0007) по сравнению с контрольным. Выявлена отрицательная связь между концентрациями зеатина и ГК (r = – 0.88, p < 0.05).
Рис. 1.
Влияние хронического облучения на концентрации фитогормонов в хвое: * – различия статистически значимы по сравнению с контрольными величинами, p < 0.05, U-тест.
Отдельно были сопоставлены концентрации фитогормонов у нормальных (N), аномальных (A) и восстановленных (R) деревьев в пределах участка. На контрольном участке с фоновым уровнем облучения аномальные деревья характеризовались пониженными концентрациями ауксинов: ИУК (U-тест, n = 12, p = 0.01) и ИМК (U-тест, n = 12, p = 0.004) (рис. 2 и 3 соответственно), у восстановленных деревьев только уровень ИУК был понижен (U-тест, n = 12, p = 0.01). На самом загрязненном участке Okuma в отличие от контрольного у аномальных и восстановленных деревьев наблюдали повышение содержания ИМК по сравнению с нормальными (для аномальных U-тест, n = 12, p = 0.04; для восстановленных U-тест, n = 12, p = 0.04). Необходимо отметить, что максимальные концентрации ИУК были зафиксированы у нормальных деревьев на контрольном участке, любые другие варианты эксперимента – повышенная мощность дозы или наличие аномалий развития, приводили к снижению ее уровня (см. рис. 2).
Рис. 2.
Влияние хронического облучения на содержание ИУК в хвое нормальных (N), аномальных (A) – с нарушением апикального доминирования и восстановленных (R) деревьев. Здесь и на рис. 3–6: * – сравнение в зависимости от участка в пределах одного типа деревьев: различия статистически значимы по сравнению с контрольными показателями (участок F), p < 0.05, U-тест; † – сравнение разных типов деревьев в пределах одного участка: различия статистически значимы по сравнению с нормальными (N) деревьями, p < 0.05, U-тест.
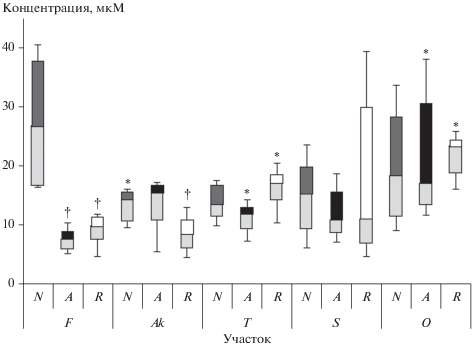
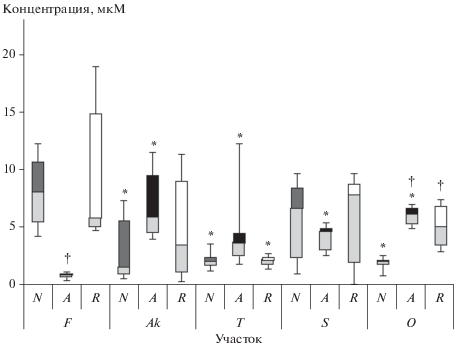
Рис. 3.
Влияние хронического облучения на содержание ИМК в хвое нормальных (N), аномальных (A) – с нарушением апикального доминирования и восстановленных (R) деревьев.
По содержанию зеатина деревья с морфозами и восстановленные не отличались от нормальных в пределах одного участка (рис. 4). Уровни гормона стресса АБК (рис. 5) были повышены на загрязненных участках Ak и S у аномальных деревьев с нарушением апикального доминирования (U-тест, n = 12, p = 0.01 и U-тест, n = 12, p = 0.02 соответственно) по сравнению с нормальными. У восстановленных деревьев на участках Т и S выявлено разнонаправленное изменение уровней гормонов-антагонистов АБК и ГК (рис. 5, 6).
Рис. 4.
Влияние хронического облучения на содержание зеатина в хвое нормальных (N), аномальных (A) – с нарушением апикального доминирования и восстановленных (R) деревьев.
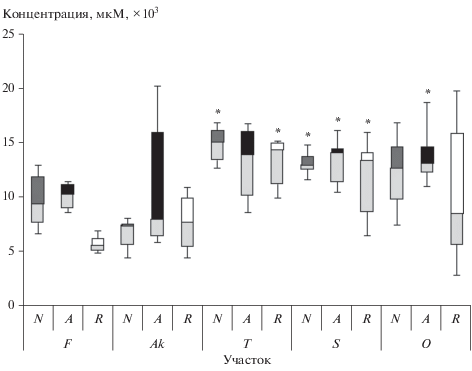
Рис. 5.
Влияние хронического облучения на содержание АБК в хвое нормальных (N), аномальных (A) – с нарушением апикального доминирования и восстановленных (R) деревьев.
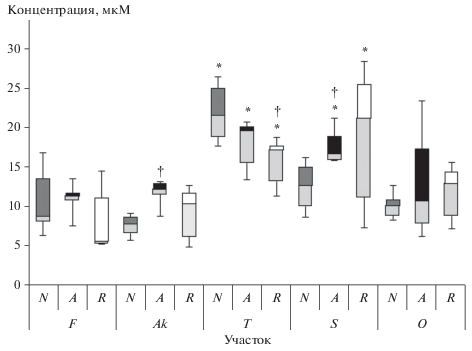
Рис. 6.
Влияние хронического облучения на содержание ГК в хвое нормальных (N), аномальных (A) – с нарушением апикального доминирования и восстановленных (R) деревьев.
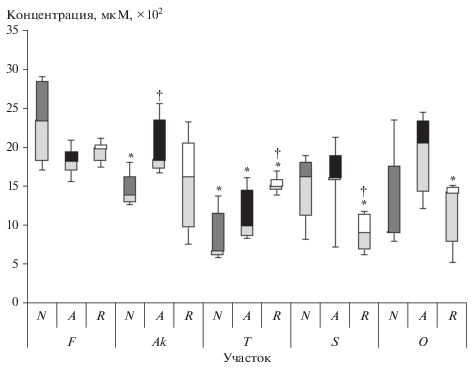
При сопоставлении содержания гормонов у деревьев одного типа на разных участках обнаружено, что у всех типов деревьев содержание АБК было выше на участке Т по сравнению с контрольным участком (для нормальных U-тест, n = 12, р = = 0.004; для аномальных U-тест, n = 12, р = 0.01; для восстановленных U-тест, n = 12, р = 0.02), на участке S – только у аномальных и восстановленных (U-тест, n = 12, p = 0.004; U-тест, n = 12, p = = 0.004 соответственно). Повышенные уровни зеатина на загрязненных участках фиксировали у всех типов деревьев (для нормальных – участки Т (U-тест, n = 12, р = 0.006) и S (U-тест, n = 12, р = = 0.04); для аномальных – участки S (U-тест, n = 12, р = 0.055) и O (U-тест, n = 12, р = 0.01); для восстановленных – участки Т (U-тест, n = 12, р = 0.004) и S (U-тест, n = 12, р = 0.006)). В отличие от зеатина содержание ГК было снижено на загрязненных участках по отношению к контрольному у нормальных деревьев на участках Аk (U-тест, n = 12, р = 0.02) и Т (U-тест, n = 12, р = 0.01); у анормальных – на участке Т (U-тест, n = 12, р = 0.01) и у восстановленных деревьев – на трех самых загрязненных участках T (U-тест, n = 12, р = 0.004), S (U-тест, n = 12, р = 0.004) и O (U-тест, n = 12, р = 0.004). Содержание ГК у нормальных деревьев имело тенденцию к снижению с мощностью дозы (r = –0.78, p > 0.05).
Концентрации ауксинов ИУК и ИМК были понижены у нормальных деревьев на загрязненных участках (см. рис. 2, 3) : ИУК – участок Аk (U-тест, n = 12, р = 0.01); ИМК – участки Аk (U-тест, n = 12, р = 0.03), T (U-тест, n = 12, р = 0.055) и O (U-тест, n = 12, р = 0.004), и увеличены у аномальных (ИУК – участки Т (U-тест, n = 12, р = 0.04) и О (U-тест, n = 12, р = 0.004); ИМК – на всех загрязненных участках (U-тест, n = 12, р = 0.004)) и восстановленных (ИУК: участок T (U-тест, n = 12, р = 0.01), О (U-тест, n = 12, р = 0.004)) деревьев. Концентрация ИМК у восстановленных деревьев на участке Т уменьшилась (U-тест, n = 12, р = = 0.004). Были выявлены корреляции между содержанием ауксинов у аномальных деревьев и мощностью дозы: ИУК – r = 0.87, p = 0.05; ИМК – r = 0.88, p < 0.05. У восстановленных деревьев была обнаружена тенденция к увеличению содержания ИУК с мощностью дозы (r = 0.75, p > 0.05).
ОБСУЖДЕНИЕ
Фитогормоны играют ключевую роль в развитии растений и их ответе на стресс, в том числе в отмене апикального доминирования [5]. Несмотря на то, что с момента аварии прошло 9 лет, исследования гормональной системы сосен с загрязненных в результате аварии на АЭС Фукусима территорий до сих пор не проводились. Более того, в научной литературе нет данных о подобных исследованиях на территориях, загрязненных радионуклидами в результате других крупных радиационных аварий. Учитывая полное отсутствие сведений о важнейшей регуляторной системе растений в хронически облучаемых популяциях, представленные в настоящей статье результаты заполняют важный пробел в наших знаниях.
В неблагоприятных условиях основной “стрессовый гормон” АБК запускает важнейшие адаптивные реакции растений – замедление роста, снижение транспирации, синтез стрессовых белков и др., приводящие к формированию неспецифической устойчивости [8]. Повышение содержания АБК в популяциях красной японской сосны на загрязненных участках соотносится с данными, полученными нами при исследовании 4 видов травянистых растений, произрастающих в зоне отчуждения ЧАЭС, у которых также были обнаружены повышенные уровни АБК [9]. Вероятно, высокие уровни АБК – один из элементов ответной реакции растений на хроническое радиационное воздействие, причем это относится ко всем рассмотренным в настоящей работе типам деревьев. Следует отметить, что в пределах одного участка у аномальных деревьев содержание АБК было выше, чем у нормальных.
Острое облучение, наряду с другими стрессовыми факторами, индуцирующими окислительный стресс, изменяет фитогормональный баланс растений. При больших дозах, ингибирующих ростовые процессы, увеличивается содержание АБК и снижается содержание ауксинов, цитокининов, ГК [7, 10]. При малых дозах, не оказывающих влияния на рост либо вызывающих его стимуляцию, наоборот снижаются концентрации АБК и увеличиваются уровни ауксинов и цитокининов [7], т.е. в ответ на острое облучение изменения в содержании АБК и гормонов-стимуляторов роста направлены противоположно. Однако нами было обнаружено, что при хроническом облучении наблюдается иной паттерн изменения концентраций фитогормонов, указывающий на общую активацию метаболических процессов.
В хвое хронически облучаемых сосен обнаружено повышение уровней основного ауксина растений ИУК, достигаемое за счет роста концентраций у аномальных и восстановленных деревьев (см. рис. 2). Статистически значимая зависимость концентраций гормона от мощности дозы (r = 0.95, p < 0.05) указывает на радиационную природу выявленного феномена. Ауксины, поддерживающие апикальное доминирование за счет стимуляции растяжения клеток в апикальной меристеме и подавления роста боковых почек, синтезируются в верхушке побега [11]. Этим объясняется резкое снижение концентраций ауксинов у деревьев с нарушением апикального доминирования (A, R) на контрольном участке по сравнению с нормальными. Однако на загрязненных участках по сравнению с контрольным выявлен рост концентраций ИУК у аномальных и восстановленных деревьев с увеличением мощности дозы (r = 0.87, p = 0.05 и r = 0.75, p > 0.05 соответственно) и снижение у нормальных деревьев, т.е. изменение соотношения фитогормонов направлено в этом случае на восстановление нормального развития деревьев.
Повышение уровней ИМК у аномальных и восстановленных деревьев относительно нормальных на самом загрязненном участке, вероятно, связано с активацией образования ИМК из ИУК, так как ИМК служит запасной формой для более подверженной окислительной деградации ИУК [12].
Цитокинины и ГК являются антагонистами в контроле развития апикальной меристемы побега (ПАМ), хотя имеют общие факторы транскрипции генов метаболизма [13]: цитокинины стимулируют пролиферацию клеток ПАМ, а ГК ингибируют их пролиферацию и стимулируют дифференцировку. Выявленная связь (r = – 0.88, p < 0.05) между повышением уровня зеатина и снижением ГК указывает на активацию развития ПАМ.
Снижение содержания ГК ведет к укорочению и утолщению побегов и хвои. Подобное явление наблюдали в популяциях сосны обыкновенной в зоне аварии на ЧАЭС: длина хвои у деревьев с загрязненных участков была статистически значимо короче по сравнению с контролем [14].
Не выявлено связи концентраций зеатина с наличием морфозов у деревьев в пределах одного участка. На загрязненных участках повышение уровней зеатина относительно контроля отмечали у всех типов деревьев, а снижение ГК – преимущественно у восстановленных и нормальных деревьев. На радиационную природу выявленных изменений указывает тенденция к снижению содержания ГК у нормальных деревьев с мощностью дозы на участках (r = – 0.78, p > 0.05).
В регуляции большинства физиологических процессов, протекающих в растениях, зеатин и АБК считаются антагонистами [15], однако в ряде случаев эти гормоны действуют однонаправленно, усиливая действие друг друга [16]. Выявленная в нашем исследовании тенденция связи между содержанием АБК и зеатина (r = 0.86, p > 0.05) указывает на возможные взаимодействия метаболических путей этих фитогормонов. В частности, АБК и зеатин участвуют в элиминации активных форм кислорода [8, 17], которые являются неотъемлемыми спутниками стресса, в том числе и радиационного.
Таким образом, хроническое радиационное воздействие изменяет соотношение основных классов фитогормонов в хвое красной японской сосны: повышает концентрации ИУК, зеатина и АБК и снижает концентрации ГК. Концентрации ИУК растут с мощностью дозы на участках в обобщенной выборке (r = 0.95, p < 0.05), у аномальных (r = 0.87, p = 0.05) и восстановленных (r = 0.75, p > 0.05) деревьев. Содержание гормонов в популяциях изменялось в зависимости от наличия морфозов, что подтверждают выявленные корреляция с мощностью дозы для ИМК у аномальных деревьев (r = 0.88, p < 0.05) и тенденция к снижению ГК у нормальных (r = –0.78, p > 0.05).
Полученные нами результаты позволяют объяснить феномен повышенной частоты появления нарушений апикального доминирования в популяциях молодых хвойных деревьев из района аварии на АЭС Фукусима. Молодые хвойные деревья гораздо чувствительнее к облучению, чем взрослые, клетки в их меристемах делятся гораздо активнее. Радиочувствительность клеток меристемы на несколько порядков выше, чем дифференцированных и специализированных, поэтому они являются критическими тканями в условиях облучения [18] и повреждаются при дозах, не оказывающих видимых эффектов на сформированные органы и ткани. Поглощенные дозы на апикальную меристему в первые годы после аварии были гораздо выше, чем в настоящее время [4], и могли привести к поражению активно делящихся клеток апикальной меристемы молодых хвойных деревьев. Повреждение апикальной меристемы запускает процессы восстановления, стимулирует пролиферативную активность спящих, более радиоустойчивых почек, из которых образуются боковые побеги.
Действительно, анализ содержания ГК и зеатина в хронически облучаемых популяциях красной японской сосны свидетельствует об усилении пролиферативной активности клеток ПАМ и активации ее развития, что связано с необходимостью компенсации сформировавшихся в первый период аварии повреждений клеток апикальной меристемы. В ряде случаев наблюдается восстановление апикального доминирования, когда один из побегов подавляет рост других и занимает лидирующее положение. В регуляции всех этих процессов ведущую роль играют фитогормоны, скоординированное изменение концентраций которых, как было показано в настоящей работе, направлено на компенсацию последствий радиационного воздействия. В целом представленные данные подтвердили нашу гипотезу об изменении фитогормонального статуса в хронически облучаемых популяциях красной японской сосны и связи фитогормонов с морфологическими изменениями у облученных молодых деревьев.
Работа выполнена при финансовой поддержке РФФИ (грант № 119-54-50003) и гранта JSPS в рамках двусторонней программы совместных проектов РФФИ-JSPS.
Список литературы
Steinhauser G., Brandl A., Johnson T.E. Comparison of the Chernobyl and Fukushima nuclear accidents: a review of the environmental impacts // Science Total Environment. 2014. V. 470–471. P. 800–817. https://doi.org/10.1016/j.scitotenv.2013.10.029
Hashimoto S., Ugawa S., Nanko K. et al. The total amounts of radioactively contaminated materials in forests in Fukushima, Japan // Scientific Reports. 2012.V.2:416. https://doi.org/10.1038/srep00416
Watanabe Y., Ichikawa S., Kubota M. et al. Morphological defects in native Japanese fir trees around the Fukushima Daiichi Nuclear Power Plant // Scientific Reports. 2015. V.5:13232. https://doi.org/10.1038/srep13232
Yoschenko V., Nanba K., Yoshida S. et al. Morphological abnormalities in Japanese red pine (Pinus densiflora) at the territories contaminated as a result of the accident at Fukushima Dai-Ichi Nuclear Power Plant // J. Environmental Radioactivity 2016. V. 165. P. 60–67. https://doi.org/10.1016/j.jenvrad.2016.09.006
Лутова Л.А., Ежова Т.А., Додуева И.Е., Осипова М.А. Генетика развития растений. СПб.: Наука, 2010. 539 с.
ICRP. The 2007 Recommendations of the International Commission on Radiological Protection // ICRP Publication 103. Annual ICR, 2007. V. 37.
Битаришвили С.В., Волкова П.Ю., Гераськин С.А. Влияние γ-облучения семян на фитогормональный статус проростков ячменя // Физиология растений. 2018. Т. 65. № 2. С. 223–231. https://doi.org/10.7868/S0015330318030065
Vishwakarma K., Upadhyay N., Kumar N. et al. Abscisic acid signaling and abiotic stress tolerance in plants: A review on current knowledge and future prospects // Frontiers Plant Science 2017. V. 8:161. https://doi.org/10.3389/fpls00161
Битаришвили С.В., Пишенин И.А., Шестерикова Е.М., Волкова П.Ю. Содержание абсцизовой кислоты в популяциях травянистых растений, обитающих в условиях хронического радиационного воздействия // Современные проблемы радиобиологии, радиоэкологии и агроэкологии. Обнинск, 2019. С. 26.
Mounir A.M., El-Yazid A.A., Orabi I.O.A. et al. Effect of sowing date, gamma irradiation and intercultivar differences on growth, pod characteristics and some endogenous plant growth regulators in snap beans // World Journal Agricultural Sciences. 2015. V. 11. P. 380–390. https://doi.org/10.5829/idosi.wjas.2015.11.6.1891
Woodward A.W., Bartel B. Auxin: Regulation, action, and interaction // Annals Botany. 2005. V. 95. P. 707–735. https://doi.org/10.1093/aob/mci083
Strader L.C., Culler A.H., Cohen J.D., Bartel B. Conversion of endogenous indole-3-butyric acid to indole-3-acetic acid drives cell expansion in Arabidopsis seedlings // Plant Physiology. 2010. V. 153. P. 1577–1586. https://doi.org/10.1104/pp.110.157461
Jasinski S., Piazza P., Craft J. et al. KNOX action in Arabidopsis is mediated by coordinate regulation of cytokinin and gibberellin activities // Current Biology. 2005. V. 15. P. 1560–1565. https://doi.org/10.1016/j.cub.2005.07.023
Козубов Г.М., Таскаев А.И. Особенности морфогенеза и ростовых процессов у хвойных растений в районе аварии на ЧАЭС // Радиационная биология. Радиоэкология. 2007. Т. 47. № 2. С. 204–223.
Ha S., Vankova R., Yamaguchi-Shinozaki K. et al. Cytokinins: metabolism and function in plant adaptation to environmental stresses // Trends Plant Science. 2012. V. 17. P. 172–179. https://doi.org/10.1016/j.tplants.2011.12.005
Nishiyama R., Watanabe Y., Fujita Y. et al. Analysis of cytokinin mutants and regulation of cytokinin metabolic genes reveals important regulatory roles of cytokinins in drought, salt and abscisic acid responses, and abscisic acid biosynthesis // Plant Cell. 2011. V. 23. P. 2169–2183. https://doi.org/10.1105/tpc.111.087395
Pavlu J., Novak J., Koukalova V. et al. Cytokinin at the crossroads of abiotic stress signaling pathways // Int. J. Molecular Science. 2018. V. 19: 2450. https://doi.org/10.3390/ijms19082450
Гудков И.Н. Основы общей и сельскохозяйственной радиобиологии. Киев: Изд-во УСХА, 1991. 328 с.
Дополнительные материалы отсутствуют.


