Экология, 2021, № 3, стр. 225-233
Изменчивость усачей комплекса Barbus intermedius в трех озерах Эфиопии: дифференциация особей генерализованной формы по признакам, связанным с разделением пищевых ресурсов. Метод корреляционных плеяд
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
b Институт биологии внутренних вод им. И.Д. Папанина РАН
152743 Ярославская обл., Некоузский р-н, п. Борок, Россия
* E-mail: adissa@mail.ru
Поступила в редакцию 11.08.2020
После доработки 22.09.2020
Принята к публикации 01.10.2020
Аннотация
У особей генерализованной формы крупных африканских усачей, обитающих в озерах Лангано и Аваса, изменчивость параметров, связанных с процессом захвата и удержания пищевых объектов, коррелирует с длиной тела. Отсутствие такой зависимости в оз. Тана показывает, что изменчивость танских усачей – это не постепенное изменение морфологии вследствие смены спектра питания по мере роста особей, а результат микроэволюции, направленной на образование форм, занимающих разные трофические ниши.
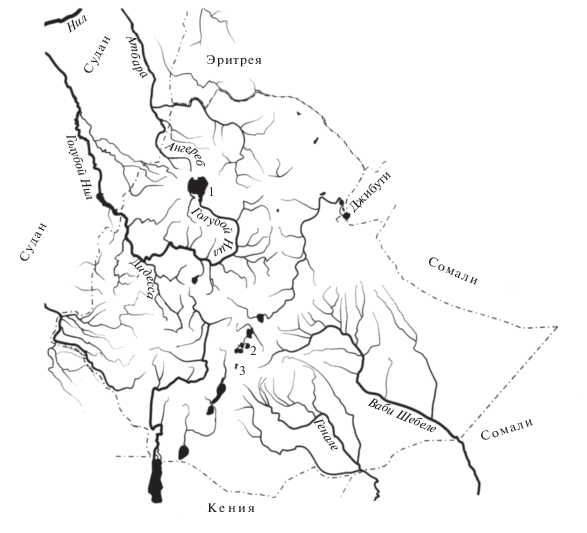
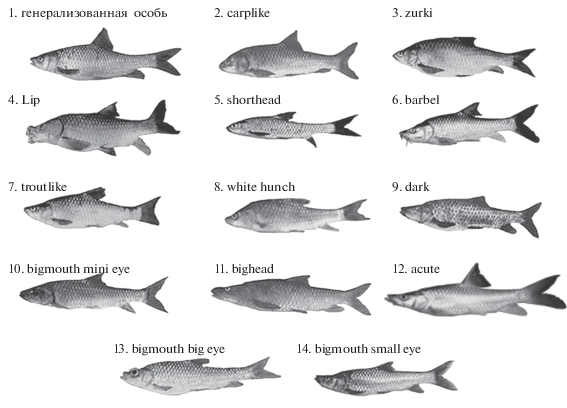
Озеро Тана, дающее начало р. Голубой Нил, находится на севере Эфиопии (рис. 1). Ихтиофауна озера привлекает внимание исследователей обилием морфоэкологических форм (или морфотипов) крупных африканских усачей комплекса Barbus intermedius sensu Banister [1]. Различия между морфотипами сопоставимы с различиями видов и родов Cyprinidae (рис. 2) [2]. Считается, что комплекс морфотипов танских усачей – это результат адаптивной радиации в процессе разделения пищевых ресурсов озера [3, 4]. Наряду с особями форм, специализированных в отношении питания, в озере обитают особи без выраженных признаков пищевой специализации. Такие особи, именуемые генерализованными, широко распространены в водоемах Эфиопии. Они слагают мономорфные популяции крупных африканских усачей и численно доминируют в популяциях полиморфных – как это наблюдается в оз. Тана.
Рис. 2.
Экологические формы крупных африканских усачей в оз. Тана: 1‒6 – нерыбоядные; 7‒14 – рыбоядные.
Генерализованную форму рассматривают как подобную предковой, которая дала начало комплексу B. intermedius [2, 5–8]. Показано [9], что диверсификация особей генерализованной и специализированных форм в оз. Тана – это разные стадии одного процесса, и начало специализированным формам (всем или некоторым) действительно могли дать генерализованные особи озера. Нельзя исключить, что процесс формообразования перманентен, и в потомстве генерализованных особей есть рыбы, подобные (или тождественные) особям специализированных форм [9, 10]. Обнаружено, что векторы диверсификации генерализованных особей в мономорфных популяциях озер Лангано и Аваса, будучи сходными между собой, отличаются от векторов диверсификации генерализованных особей в оз. Тана [9]. Отсюда следует, что в разных водоемах диверсификация особей генерализованной формы происходит по-разному.
Цель настоящего исследования – поиск ответа на вопрос: в чем заключается разница между диверсификацией генерализованных особей в оз. Тана и озерах Аваса и Лангано, которая обусловливает разный уровень формообразования? Очевидно, главный интерес в этом контексте представляет диверсификация по параметрам, связанным с разделением пищевых ресурсов.
МАТЕРИАЛ И МЕТОДЫ
С 1992 г. по 2010 г. в оз. Тана поймано 145 особей генерализованной формы (далее – GF11) стандартной длиной (SL) от 10 до 34 см. Рыб ловили жаберными и накидными сетями, брали из уловов местных рыбаков. В открытой части Бахардарского залива озера поймано 77 особей, в поросшей камышом прибрежной части залива – 68.
Для оценки морфологических отношений экологических форм озера наряду с генерализованными усачами рассматривались выборки специализированных морфотипов: carplike (далее обозначается как ca) – 12 особей; zurki (zu) – 54; Lip (Li) – 27; shorthead (sh) – 13; white hunch (wh) – 48; troutlike (tr) – 41; barbel (ba) – 17; dark (da) – 35; bigmouth mini eye (me) – 10; bighead (bh) – 11; acute (ac) – 75; bigmouth big eye (be) – 56; bigmouth small eye (se) – 51.
В сравнении с разнообразием форм оз. Тана популяции усачей озер Аваса и Лангано, расположенных в Рифтовой долине Эфиопии (см. рис. 1), можно рассматривать как практически мономорфные. Слабо выраженный полиморфизм по пропорциям черепа, обнаруженный у особей этих озер, дает основания предполагать лишь едва наметившуюся дивергенцию на две формы: эврифагов и ихтиофагов, и не сопряжен с различиями по внешним признакам [11]. Численность выборки из оз. Аваса составила 49 особей длиной 17.9–28.3 см, из оз. Лангано – 73 особи длиной 12.4–34.7 см.
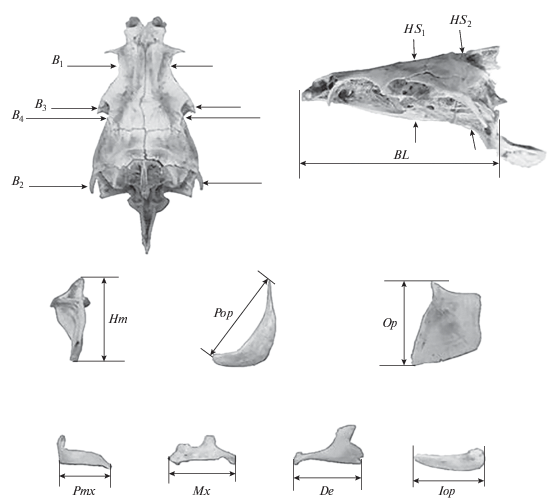
Для каждой особи выполнено 14 промеров черепа (рис. 3). Как показывает изучение изменчивости крупных африканских усачей [7, 9–11], данный набор признаков позволяет достаточно уверенно оценивать фенетические отношения большинства морфотипов. Статистическая обработка данных выполнена в пакетах NTSYS 2.02k и Статистика 6. В расчетах использованы индексы, представляющие собой отношения абсолютных значений промеров к базальной длине черепа (BL). Далее в обсуждении, упоминая тот или иной признак, мы будем иметь в виду его индекс, а не сам промер. Значения индексов преобразовывали в натуральные логарифмы для нормализации распределений. Морфологические дистанции в многомерном пространстве признаков оценивали, используя манхэттенскую метрику. Матрицы сходства анализировали методом complete linkage, результаты иллюстрированы дендрограммами. Анализ главных компонент (АГК) производили с учетом рекомендации Л.А. Животовского [12, с. 107] “не сваливать все признаки в кучу”, но, согласно тому или иному правилу, делить на группы, АГК групп проводить порознь и далее анализировать ГК1 каждой группы.
Рис. 3.
Схема промеров черепа рыб комплекса B. intermedius: BL − базальная длина черепа; B1, B2, B3 – расстояние между внешними краями соответственно frontalia, pterotica и sphenotica; B4 – ширина черепа на уровне соединения frontale и pteroticum; HS1 и HS2 – высота черепа на уровне соответственно изгиба parasphenoideum и заднего края parasphenoideum; Hm – высота hyomandibulare; Pop − длина praeoperculum; Op – высота передней части operculum; Pmx, Mx, De и Iop – длина соответственно praemaxillare, maxillare, dentale и interoperculum.
Как установлено ранее [9, 13], в процессе диверсификации экологических форм танских усачей рассматриваемые признаки образуют две корреляционные плеяды. В одну входят 6 признаков осевого черепа: B1,,B2, B3, B4, HS1, HS2 и 3 признака висцерального черепа: Hm, Pop, Op. Вторую слагают 4 параметра висцерального черепа, 3 из которых – Pmx, Mx и De – отражают морфологию челюстей, что дает основание рассматривать изменчивость этой плеяды как сопряженную с особенностями питания22. Четвертый признак второй плеяды – Iop – характеризует длину межкрышечной кости. В черепе усачей эта кость протянулась за зубной, что, видимо, определяет тесную корреляцию между нею и De. АГК проводили отдельно для “плеяды из 9 признаков” и “плеяды из 4 признаков”, затем анализировали распределение точек-объектов в координатах ГК1 первой и второй плеяд. Собственные векторы (СВ) рассчитывали по корреляционной матрице; длину вектора принимали равной 1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
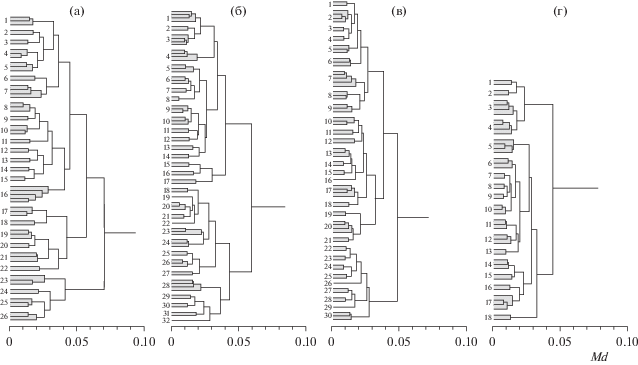
Фенетические отношения особей изучаемых выборок по совокупности 14 признаков иллюстрирует рис. 4. Усачи прибрежья Бахардарского залива слагают на дендрограмме 26 кластеров низшего уровня иерархии (рис. 4а), образованных в результате последовательного объединения особей (в отличие от кластеров следующих уровней иерархии, где между собой объединяются уже не отдельные особи, но кластеры особей, сформированные ранее). Кластеры низшего уровня иерархии можно рассматривать как элементарные феноны, т.е. первичные, предельно однородные, неподразделенные группы сходных особей. В случае выборки открытой части Бахардарского залива дендрограмму слагают 32 элементарных фенона (рис. 4б), в оз. Лангано – 30 (рис. 4в), в оз. Аваса – 18 (рис. 4г).
Рис. 4.
Дендрограммы сходства особей генерализованной формы комплекса В. intermedius в выборках: а – прибрежной зоны Бахардарского залива оз. Тана; б – открытой части Бахардарского залива оз. Тана; в – оз. Лангано; г – оз. Аваса; Md – манхэттенская дистанция.
На рис. 5 представлены результаты АГК средних оценок признаков особей, слагающих каждый фенон на каждой дендрограмме (см. рис. 4), и особей каждого из 14 морфотипов усачей оз. Тана (включая GF). Cоответствующие точки на графиках будем именовать “фенонами GF” и “реперами морфотипов”. На рис. 5 обозначены только те феноны GF, которые в силу своего положения обсуждаются в тексте. По оси X отложены значения ГК1 “плеяды 4 признаков”, по оси Y – значения ГК1 “плеяды 9 признаков”. Таким образом, ось X отражает изменчивость параметров, прямо связанных с процессом захвата и удержания пищевых объектов, т.е. сопряженную с диверсификацией особей в процессе разделения пищевых ресурсов. Слева от вертикальной штрих-линии на графиках распределены реперы нерыбоядных морфотипов, справа – рыбоядных и бентофага barbel33.
Рис. 5.
Реперы морфотипов (▼) и феноны генерализованной формы (⚫) комплекса B. intermedius. Распределение на плоскости главных компонент: а – выборка прибрежной зоны Бахардарского залива оз. Тана: 6, 12 и 15 – номера фенонов с минимальной, средней и максимальной SL особей соответственно; б – выборка открытой части Бахардарского залива оз. Тана: 2, 3 и 8 – номера фенонов с минимальной, средней и максимальной SL особей соответственно; в – выборка оз. Лангано: 1, 13 и 30 – номера фенонов с минимальной, средней и максимальной SL особей соответственно; г – выборка оз. Аваса: 1, 9 и 17 – номера фенонов с минимальной, средней и максимальной SL особей соответственно. По оси абсцисс – ГК1 признаков челюстной дуги и interoperculum (“плеяда 4 признаков”), по оси ординат – ГК1 признаков осевого черепа, подъязычной дуги и жаберной крышки (“плеяда 9 признаков”); слева от вертикальной штрих-линии ‒ нерыбоядные формы, справа – рыбоядные и морфотип barbel. Пояснения и обозначения морфотипов см. в тексте.
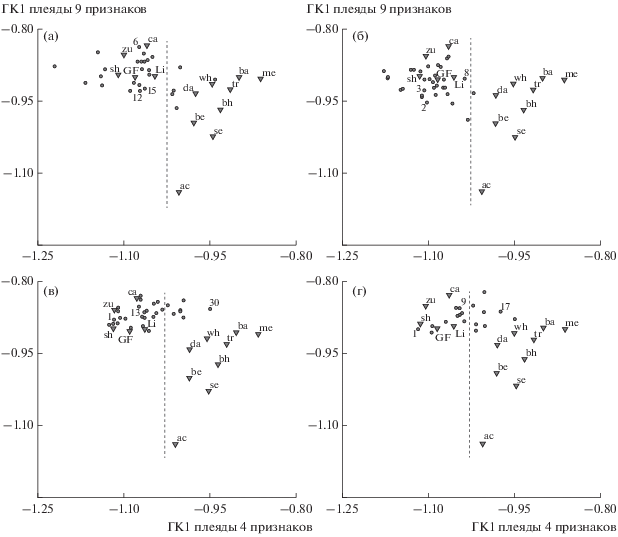
Таблица 1.
Собственные векторы и собственные значения
| Признаки | Распределение на плоскости ГК1 корреляционных плеяд на | |||||||
|---|---|---|---|---|---|---|---|---|
| рис. 5а | рис. 5б | рис. 5в | рис. 5г | |||||
| СВ1ось X | СВ1ось Y | СВ1ось X | СВ1ось Y | СВ1ось X | СВ1ось Y | СВ1ось X | СВ1ось Y | |
| B3 | 0.383 | 0.379 | 0.379 | 0.377 | ||||
| B2 | 0.344 | 0.360 | 0.353 | 0.356 | ||||
| B1 | 0.363 | 0.377 | 0.360 | 0.354 | ||||
| B4 | 0.369 | 0.373 | 0.359 | 0.370 | ||||
| HS1 | 0.298 | 0.312 | 0.321 | 0.301 | ||||
| HS2 | 0.287 | 0.281 | 0.294 | 0.263 | ||||
| Hm | 0.389 | 0.375 | 0.367 | 0.372 | ||||
| Pop | 0.206 | 0.178 | 0.170 | 0.214 | ||||
| Op | 0.318 | 0.311 | 0.346 | 0.354 | ||||
| iOp | 0.486 | 0.456 | 0.485 | 0.459 | ||||
| Pmx | 0.535 | 0.536 | 0.557 | 0.554 | ||||
| Mx | 0.474 | 0.474 | 0.424 | 0.464 | ||||
| De | 0.502 | 0.529 | 0.525 | 0.516 | ||||
| Собственные значения | 3.24 | 5.46 | 3.10 | 5.14 | 3.00 | 6.20 | 2.98 | 6.38 |
| Объясненная дисперсия, % | 81.02 | 60.67 | 77.61 | 57.15 | 75.05 | 68.90 | 74.61 | 70.96 |
Примечание. Обозначения признаков см. на рис. 2.
Как следует из табл. 1, ГК1 “плеяды 4 признаков” на разных графиках объясняет от 74.61 до 81.02% общей дисперсии, ГК1 “плеяды 9 признаков” – от 57.15 до 70.96%. Нагрузки признаков на собственные векторы каждой ГК1 одинаковы по знаку и близки по абсолютной величине, а нагрузки признаков на собственные векторы ГК1 в разных сравнениях (см. рис. 5а–г) весьма близки и в некоторых случаях полностью совпадают. Отсюда следует, что векторы дисперсии объектов в четырех рассматриваемых сравнениях практически одинаковы, а двумерные распределения на рис. 5 с большой полнотой и минимальными искажениями отражают отношения фенонов и морфотипов в многомерном пространстве исходных признаков. Об этом также свидетельствует сходство взаиморасположения реперов морфотипов усачей оз. Тана на четырех графиках – визуально паттерны их распределений неразличимы.
Наиболее разнесенными по значениям ГК1 параметров, связанных с процессом захвата и удержания пищевых объектов (ось X), оказываются реперы морфотипов sh и me (см. рис. 5), что ожидаемо: особи первого – планктофаги, особи второго – рыбоядные хищники. Вместе с тем феноны GF прибрежной зоны Бахардарского залива (рис. 5а), наиболее разнесенные по оси X, различаются между собой не меньше, чем реперы sh и me. Это дает основания полагать, что и в отношении питания эти феноны различаются не меньше означенных морфотипов. Отметим, что пять фенонов GF на рис. 5а расположены правее линии, разделяющей нерыбоядные и рыбоядные формы. В выборке открытой части Бахардарского залива (рис. 5б) различия между крайними по оси X фенонами несколько меньше, чем на рис. 5а. Тем не менее эти различия больше различий между репером нерыбоядного Lip и реперами рыбоядных ac, me и da, а один фенон GF находится правее разделительной линии (см.рис. 5б), что позволяет предположить существенные различия в спектре питания между особями разных фенонов GF.
В выборках мономорфных озер (см. рис. 5в, г) ситуация аналогична: по оси X диапазон изменчивости фенонов GF не уступает диапазону изменчивости реперов специализированных форм усачей оз. Тана и в ряде сочетаний различия между разными фенонами больше, чем между разными морфотипами. В оз. Лангано правее линии, разделяющей нерыбоядные и рыбоядные формы, находится 6 фенонов из 32, в оз. Аваса – 8 из 18.
Между распределениями фенонов мономорфных и полиморфной популяций есть существенная разница, которая становится весьма наглядной, если посчитать среднюю SL особей, вошедших в каждый фенон, и обозначить на графиках феноны, чья средняя SL находится в начале, центре и конце вариационного ряда средних SL. Из рис. 5в, г следует, что в выборках озер Лангано и Аваса феноны, центральные в ряду средних SL, находятся близко и к центру распределения по оси X, феноны с максимальной и минимальной средней SL – по краям или близко к краям распределений. Это дает основания полагать, что в мономорфных популяциях положение фенонов на графике зависит от SL слагающих их особей. Феноны, слагаемые мелкими особями, находятся в левом краю распределения по оси X – рядом с репером планктофага sh, тогда как феноны, слагаемые крупными особями, располагаются правее линии, разделяющей нерыбоядные и рыбоядные формы, и некоторые из таких фенонов расположены правее реперов некоторых рыбоядных форм. Такое распределение фенонов GF вдоль оси X не вызывает удивления – факт смены объектов питания по мере роста рыб общеизвестен [14]. Со сменой питания, очевидно, меняются параметры аппарата захвата и удержания пищевых объектов, отражаемые в ГК1 “плеяды из 4 признаков”. Необходимо отметить, что и на рис. 4в, г означенные феноны находятся по краям и в центре соответствующих дендрограмм. В выборках полиморфной популяции такой зависимости положения фенона по оси X от длины слагающих его особей не наблюдается (см. рис. 5а, б). Очевидно, в оз. Тана дифференциация фенонов по характеру питания не связана с размерами особей, слагающих феноны, и не может быть объяснена следствием закономерной смены пищевых объектов по мере роста рыб.
Достоверность предположений, основанных на визуальном анализе распределений на рис. 5, математически подтверждают результаты регрессионного анализа на рис. 6, где по оси Y отложены значения ГК1 плеяды признаков, отражающих морфологию челюстей, по оси X – средняя SL особей, слагающих феноны GF. В популяциях озер Лангано и Аваса сравниваемые параметры связаны тесной корреляцией высокого уровня достоверности (рис. 6в, г), в выборках из оз. Тана достоверной корреляции между SL особей, составивших фенон, и положением фенона на оси X нет (рис. 6а, б).
Рис. 6.
Зависимость изменчивости параметров, связанных с разделением пищевых ресурсов, от размера особей, слагающих элементарные феноны GF; а – в выборке прибрежной части Бахардарского залива; б – в выборке открытой части Бахардарского залива; в – в выборке оз. Лангано; г – в выборке оз. Аваса. По оси абсцисс – ГК1 признаков плеяды челюстной дуги и interoperculum, по оси ординат – средняя SL особей, сложивших элементарный фенон; r – коэффициент корреляции Пирсона, р – достоверность r.
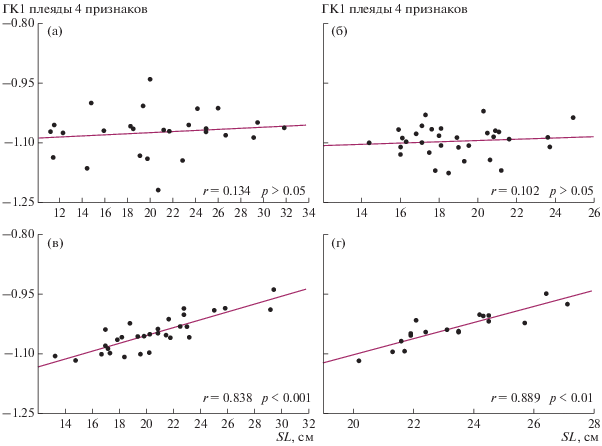
Таким образом, по параметрам, связанным с процессом захвата и удержания пищевых объектов, феноны, возникающие в процессе морфологической диверсификации особей GF, различаются между собой на уровне, соизмеримом с уровнем различий данных параметров у разных экологических форм усачей оз. Тана. Это дает основания полагать, что различия спектра питания особей разных фенонов GF сопоставимы с различиями спектра питания особей разных экологических форм. В озерах Аваса и Лангано выявлена высокая достоверная корреляция между строением челюстного аппарата особей разных фенонов и средней длиной особей каждого фенона. Это свидетельствует о том, что в мономорфных популяциях различие параметров челюстной дуги особей разных фенонов определяется сменой спектра питания по мере их роста. В полиморфной популяции оз. Тана такая зависимость не обнаружена. Поэтому можно утверждать, что диверсификация генерализованных особей в оз. Тана – это не постепенное изменение морфологических пропорций одной и той же особи вследствие смены спектра питания по мере ее роста, а результат микроэволюционных преобразований, в ходе которых формируются группы особей, занимающие разные трофические ниши, что обеспечивает более полное освоение трофических ресурсов водоема.
При сравнении фенетического разнообразия фенонов GF и специализированных морфотипов обращает на себя внимание разное соотношение остеологических и внешнеморфологических различий в том и другом случае. Специализированные морфотипы, описанные на основании внешних различий, хорошо различаются и по пропорциям черепа. Некоторые феноны GF по пропорциям черепа различаются не меньше, чем специализированные морфотипы. Вместе с тем по внешним признакам каждая из слагающих феноны особей определена в качестве генерализованной. Объяснение такому несоответствию дают представления о диверсификации генерализованных особей как о первой стадии формирования флока специализированных форм водоемов: в процессе формирования различий между формами “сперва происходит расхождение по пропорциям черепа, а уже затем – по внешнему виду…”, со временем “…различия могут увеличиваться под действием отбора, способствующего все большему развитию у специализированной формы признаков, отличающих ее от генерализованной формы” [11, с. 408].
ВЫВОДЫ
1. Анализ изменчивости параметров, связанных с процессом захвата и удержания пищевых объектов, показывает, что выявленные в настоящем исследовании различия между элементарными фенонами генерализованных особей комплекса B. intermedius сопоставимы с соответствующими различиями между специализированными в отношении питания морфотипами усачей в оз. Тана.
2. В мономорфных популяциях озер Аваса и Лангано различия между фенонами достоверно коррелируют со средней длиной слагающих их особей. Это позволяет трактовать различия фенонов как отражение постепенных изменений рассматриваемых параметров вследствие смены спектра питания одних и тех же особей по мере их роста.
3. В полиморфной популяции оз. Тана зависимость уровня различий фенонов от размера слагающих их особей не обнаружена. Это дает основания утверждать, что диверсификация генерализованных усачей в оз. Тана – не постепенное изменение морфологии особи вследствие смены спектра питания, а результат микроэволюционных процессов, направленных на образование форм, которые занимают разные трофические ниши, обеспечивая более полное освоение трофических ресурсов водоема.
Исследование выполнено в рамках государственных заданий ИПЭЭ РАН (№ 0109-2018-0076 АААА-А18-118042490059-5) и ИБВВ РАН (№ АААА-А18-118012690222-4). Материал собран на средства Долгосрочного международного проекта РАН “Совместная российско-эфиопская биологическая экспедиция”. Автор искренне благодарен участникам экспедиции, принимавшим участие в сборе материала: М.В. Мине, Ю.Ю. Дгебуадзе, А.С. Голубцову и А.А. Даркову. Особая благодарность М.В. Мине, Ф.Н. Шкилю (ИБР РАН), А.В. Кожаре (ИБВВ РАН) и Ю.Ю. Дгебуадзе (ИПЭЭ РАН) за ценные замечания по первым вариантам рукописи.
Автор подтверждает отсутствие конфликта интересов. В отношении объектов исследования соблюдались применимые этические нормы.
Список литературы
Banister K.E. A revision of the large Barbus (Pisces, Cyprinidae) of East and Central Africa. Pt. II // Bull. Brit. Mus. Nat. Hist. Zool. 1973. V. 26. P. 1–148.
Nagelkerke L.A.J., Sibbing F.A., van den Boogaart J.G.M. et al. The barbs (Barbus spp.) of Lake Tana: a forgotten species flock? // Environ. Biol. Fish. 1994. V. 39. P. 1–21.
Sibbing F.A., Nagelkerke L.A.J., Stet R.J.M., Osse J.W.M. Speciation of endemic Lake Tana barbs (Cyprinidae, Ethiopia) driven by trophic resource partitioning; a molecular and ecomorphological approach // Aquat. Ecol. 1998. V. 32. P. 217–227.
Sibbing F.A., Nagelkerke L.A.J. Resource partitioning by Lake Tana barbs predicted from fish morphometrics and prey characteristics // Rev. Fish Biol. Fish. 2001. V. 10. № 4. P. 393–437.
Лёвин Б.А. Структура локальных популяционных систем у рыб рода Barbus // Біорізноманіття та роль зооценозу в природних і антропогенних екосистемах: Мат-лы ІІ міжнар. Наук. Конф. Днепропетровск: Изд-во ДНУ, 2003. С. 53−55.
Голубцов А.С. “Пучки видов” рыб в реках и озерах: симпатрическая дивергенция в фаунистически обедненных рыбных сообществах как особый модус эволюции // Актуальные проблемы современной ихтиологии. К 100-летию Г.В. Никольского. М.: Тов-во науч. изд. КМК, 2010. С. 96–123.
Mina M.V., Mironovsky A.N., Dgebuadze Yu.Yu. Morphometry of barbell of Lake Tana, Ethiopia: multivariate ontogenetic channels // Folia Zool. 1996. V. 45. Suppl. 1. P. 109–116.
Levin B.A., Casal-López M., Simonov E. et al. Adaptive radiation of barbs of the genus Labeobarbus (Cyprinidae) in the East African river // Freshwater Biol. 2019. V. 64. Iss. 10. P. 1721–1736. https://doi.org/10.1111/fwb.13364
Мироновский А.Н. Крупные африканские усачи: векторы диверсификации особей генерализованной формы как основа морфологического разнообразия комплекса Barbus intermedius в оз. Тана, Эфиопия // Вопр. ихтиологии. 2020. Т. 60. № 3. С. 283−294. https://doi.org/10.31857/S0042875220030121
Mina M.V., Shkil F.N., Dzerzhinskii K.F. et al. Morphological diversity and age dependent transformations in progeny of the large barbs (Barbus intermedius complex sensu Banister) of several morphotypes from Lake Tana (Ethiopia). Results of a longtime experiment // J. Ichthyology. 2012. V. 52. № 11. P. 821–837. https://doi.org/10.1134/S0032945212110070
Мина М.В., Мироновский А.Н., Дгебуадзе Ю.Ю. Полиморфизм по пропорциям черепа у крупных африканских усачей Barbus intermedius sensu Banister, 1973 (Cyprinidae) из озер Аваса и Лангано (Рифтовая долина, Эфиопия) // Вопр. ихтиологии. 2016. Т. 56. № 4. С. 403−409. https://doi.org/10.7868/S0042875216040081
Животовский Л.А. Интеграция полигенных систем в популяциях: проблемы анализа комплекса признаков. М.: Наука, 1984. 183 с.
Мироновский А.Н. Место генерализованной формы в структуре фенетического разнообразия крупных африканских усачей комплекса Barbus intermedius. Метод корреляционных плеяд // Вопр. ихтиологии. 2017. Т. 57. № 4. С. 393−404. https://doi.org/10.7868/S0042875217040105
Никольский Г.В. Экология рыб. М.: Высшая школа, 1961. С. 336.
Дополнительные материалы отсутствуют.